第三章《铁金属材料》测试题(含解析)2023--2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章《铁金属材料》测试题(含解析)2023--2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 320.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
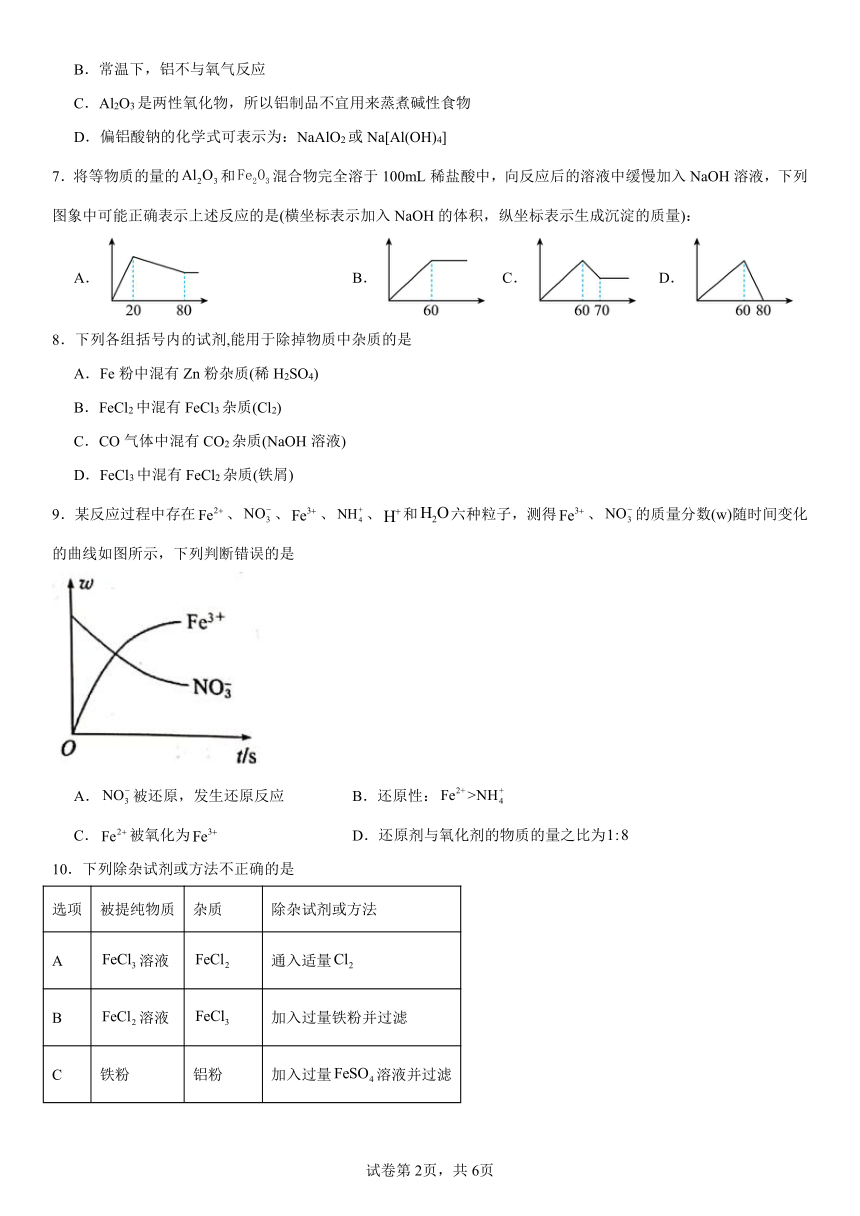
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 20:08:58 | ||
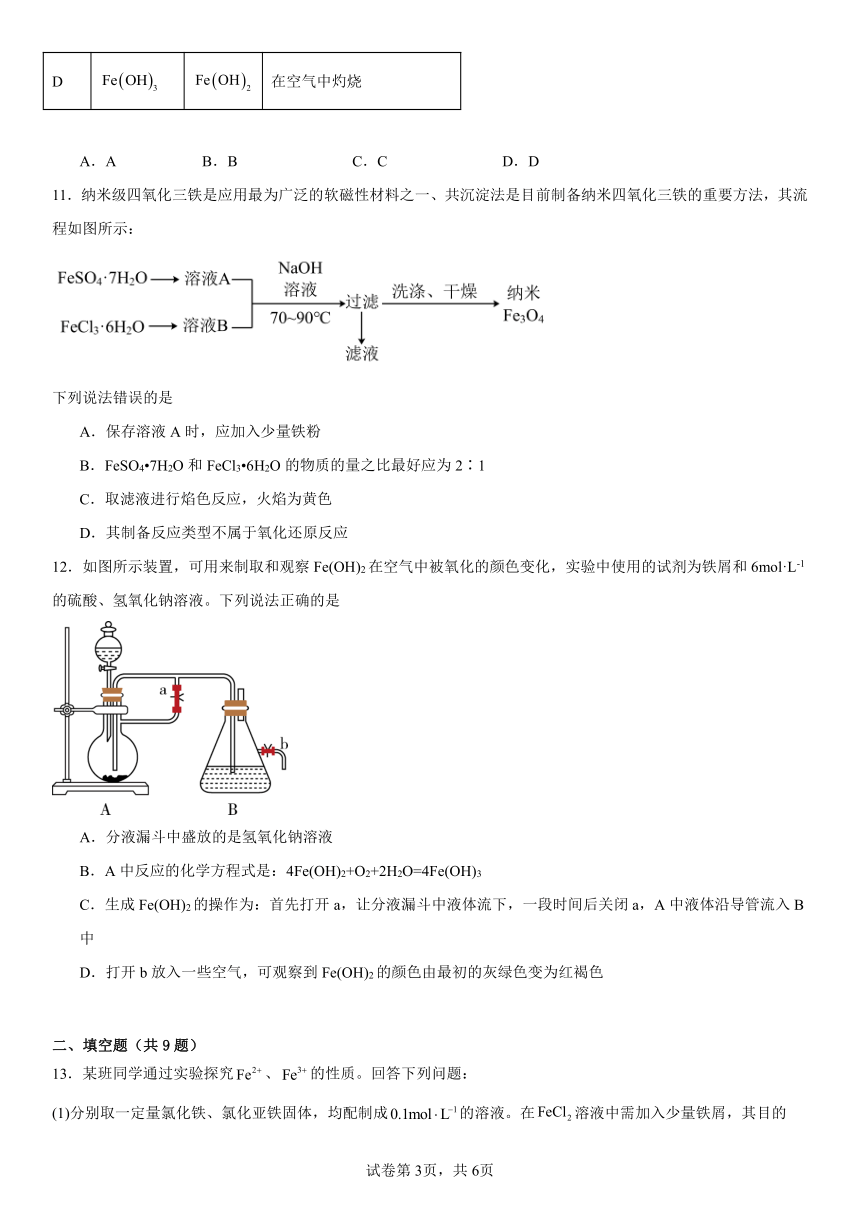
图片预览



文档简介
第三章《铁金属材料》测试题
一、单选题(共12题)
1.设NA代表阿伏加 德罗常数的值,下列说法中正确的是( )
A.一定条件下,1molFe与1molCl2充分反应,Fe失去的电子数目为3NA
B.在常温常压下,11.2L氯气含有分子数为0.5NA
C.7.8gNa2O2与水完全反应时,转移的电子数为0.1NA
D.1.2gNaHSO4晶体中所含离子数为0.03NA
2.化学与传统文化和日常生活密切相关。下列叙述错误的是
A.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”涉及置换反应
B.铝合金大量用于高铁建设
C.明矾作净水剂有杀菌作用
D.碘酒可用于皮肤外用消毒
3.下列描述中,不正确的是
A.FeSO4 可用于防止食品氧化变质,延长食品的保质期
B.Fe2O3为红棕色粉末,生活中常用作颜料
C.向Fe2(SO4)3 溶液中加入足量的铁粉,充分反应后,滴加KSCN溶液,溶液马上变成血红色
D.铁和水蒸气反应,生成紫黑色的Fe3O4
4.下列关于材料的说法不正确的是
A.钢是用量最大的合金材料,钢中加入稀土元素可改善钢的性能
B.储氢合金是一类通过物理方法吸附H2的新型合金材料
C.不锈钢的成分主要是Fe、Cr、Ni,可用作医疗器械,厨房用具和餐具
D.日常用的铝制品,其表面总是覆盖着致密的氧化铝薄膜
5.实验室药品必须按规定存放,下列对错误存放后出现现象的解释合理的是
A.石灰水敞口存放,出现白色固体:
B.浓硝酸存放于无色细口瓶中,颜色变黄:
C.酸化的硫酸亚铁溶液长时间存放,溶液变黄:
D.将氨水和浓盐酸存放在同一个药品柜中,柜壁出现白色固体:
6.铝合金是目前用途最广泛的合金之一,下列关于铝及其化合物说法错误的是
A.等质量的量Al分别与足量的盐酸、NaOH溶液反应,产生相同质量的H2
B.常温下,铝不与氧气反应
C.Al2O3是两性氧化物,所以铝制品不宜用来蒸煮碱性食物
D.偏铝酸钠的化学式可表示为:NaAlO2或Na[Al(OH)4]
7.将等物质的量的和混合物完全溶于100mL稀盐酸中,向反应后的溶液中缓慢加入NaOH溶液,下列图象中可能正确表示上述反应的是(横坐标表示加入NaOH的体积,纵坐标表示生成沉淀的质量):
A. B. C. D.
8.下列各组括号内的试剂,能用于除掉物质中杂质的是
A.Fe粉中混有Zn粉杂质(稀H2SO4)
B.FeCl2中混有FeCl3杂质(Cl2)
C.CO气体中混有CO2杂质(NaOH溶液)
D.FeCl3中混有FeCl2杂质(铁屑)
9.某反应过程中存在、、、、和六种粒子,测得、的质量分数(w)随时间变化的曲线如图所示,下列判断错误的是
A.被还原,发生还原反应 B.还原性:
C.被氧化为 D.还原剂与氧化剂的物质的量之比为
10.下列除杂试剂或方法不正确的是
选项 被提纯物质 杂质 除杂试剂或方法
A 溶液 通入适量
B 溶液 加入过量铁粉并过滤
C 铁粉 铝粉 加入过量溶液并过滤
D 在空气中灼烧
A.A B.B C.C D.D
11.纳米级四氧化三铁是应用最为广泛的软磁性材料之一、共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图所示:
下列说法错误的是
A.保存溶液A时,应加入少量铁粉
B.FeSO4 7H2O和FeCl3 6H2O的物质的量之比最好应为2∶1
C.取滤液进行焰色反应,火焰为黄色
D.其制备反应类型不属于氧化还原反应
12.如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化,实验中使用的试剂为铁屑和6mol·L-1的硫酸、氢氧化钠溶液。下列说法正确的是
A.分液漏斗中盛放的是氢氧化钠溶液
B.A中反应的化学方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.生成Fe(OH)2的操作为:首先打开a,让分液漏斗中液体流下,一段时间后关闭a,A中液体沿导管流入B中
D.打开b放入一些空气,可观察到Fe(OH)2的颜色由最初的灰绿色变为红褐色
二、填空题(共9题)
13.某班同学通过实验探究、的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成的溶液。在溶液中需加入少量铁屑,其目的是 。
(2)甲组同学取溶液,加入几滴氯水,再加入1滴溶液,溶液变红,说明可将氧化。溶液与氯水反应的离子方程式为 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在溶液中先加入煤油,再于液面下依次加入几滴氯水和1滴溶液,溶液变红。煤油的作用是 。
(4)丙组同学取溶液,加入溶液混合。分别取此溶液于3支试管中进行如下实验:
①第一支试管中加入充分振荡、静置,层显紫色;
②第二支试管中加入1滴溶液,生成蓝色沉淀;
③第三支试管中加入1滴溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在过量的情况下,溶液中仍含有 (填离子符号),由此可以证明该氧化还原反应为 。
(5)丁组同学向盛有溶液的试管中加入几滴酸化的溶液,溶液变成棕黄色,发生反应的离子方程式为 ;如果向溶液中滴加溶液,现象是 ;沉淀变色的原因是 (用化学方程式解释)。
14.铁是人类较早使用的金属之一。运用所学知识,回答下列问题:
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)电子工业用FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeC13溶液与铜反应的化学方程式;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是( )
A.有铜无铁 B.有铁有铜 C.有铁无铜 D.无铁无铜
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeC13溶液,设计如图方案:
①滤渣C的化学式为
②加过量D发生反应的离子方程式为
③通入F发生反应的化学方程式为
15.为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填入对应的空格中。
实验方法:A.加入足量铁粉,过滤 B.加热 C.加入硝酸银溶液 D.滴入酚酞试液
实验目的 实验方法
除去Na2CO3固体中少量的NaHCO3
检验自来水中是否含有Cl-
证明NaOH溶液呈碱性
除去FeCl2溶液中少量的FeCl3
16.⑴电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
②写出FeCl3溶液与金属铜发生反应的化学方程式: 。
⑵3Cl2 + 6NaOH =5NaCl + NaClO3 + 3H2O
氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
17.回答下列问题:
(1)实验室,少量的钠应保存在 中;加热铝箔的实验现象是 ,原因是 (用化学方程式表示)。
(2)在含氮的常见化合物中,常用作制冷剂的是 ,原理是 (用适当文字描述)。
(3)某工厂的燃料煤中硫的质量分数为0.4%,该工厂每天燃烧这种煤80t,试计算:
①若煤中的硫全部转化为SO2,该工厂每天产生的SO2的质量为 kg。
②如果把产生的SO2全部回收利用,理论上每年(360天)得到的98%的浓硫酸的质量为 kg。
18.请按照要求填写:
(1)除去Fe2O3粉末中的A12O3,所选试剂为 ,相关的化学方程式为 。
(2)除去FeCl2溶液中的CuCl2,所选试剂为 ,相关的离子方程式为 。
(3)除去Na2CO3固体中的NaHCO3除杂方法为 。相关的化学反应方程式为 。
(4)FeCl3溶液腐蚀铜板的离子方程式为 。
(5)为防止FeSO4溶液变质,一般在溶液中加入少量铁粉,其原因是 。
19.除去下列物质中所混有的少量杂质,指明应加入的试剂,写出有关反应的离子方程式。
加入试剂 离子方程式
(1)铁粉中混有少量铝粉
(2)NaHCO3溶液中混有少量Na2CO3
20.有以下物质①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧醋酸(CH3COOH);⑨氧化钠固体;⑩液态氯化氢。
(1)其中能导电的是 ;属于弱电解质的是 。
(2)等质量④和⑤中氢原子的数目之比为 ;若④和⑤中所含氢原子数相等,则④和⑤的质量之比为 。
(3)写出⑥和⑧在水溶液中的离子反应方程式 。
(4)室温下,某容积固定的密闭容器由可移动的活塞(忽略摩擦力)隔成A、B两室,向A室中充入H2和O2的混合气体,向B室中充入3mol空气,此时活塞的位置如图所示:
已知A室混合气体的质量为102 g,若将A室中H2与O2的混合气体点燃引爆,恢复室温后,最终活塞停留的位置在 (填数字)刻度,反应后容器内气体压强与反应前气体压强之比为 。
(5)标况下,将224 L的HCl气体溶于835 mL(ρ=1 g/cm3)的水中,所得盐酸的密度为1.2 g/cm3,该盐酸的物质的量浓度 。
21.目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答下列的问题。
(1)铁在周期表中的位置是
(2)请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
① ② ③ ④
溶液中的金属离子 Fe2+
残留固体成分 Fe、Pt Pt Pt
②当x=0.5 ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。则a = ,b = ,
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.Fe与Cl2反应方程式为:2Fe+3Cl22FeCl3,由此可知,反应过程中,Cl2不足,故反应过程中转移电子数为2NA,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,由此11.2L氯气小于0.5mol,故B错误;
C.7.8gNa2O2(即0.1mol)与水反应,过氧化钠中O元素发生歧化,过氧化钠既作氧化剂也作还原剂,转移电子数为0.1NA,故C正确;
D.1.2gNaHSO4(即0.01mol)晶体中含有Na+、,因此一共含有离子数为0.02 NA,故D错误;
故答案为:C。
【点睛】(1)铁与氯气发生反应会生成氯化铁,其反应与铁或氯气的量无关,其原因在于生成的氯化铁为分子晶体,在加热过程中会挥发,不能电离出铁离子,不能发生2Fe3++Fe=3Fe2+。
(2)Na2O2与水或二氧化碳的反应中,Na2O2既是氧化剂,又是还原剂;1molNa2O2与水或二氧化碳反应,转移电子为1mol,另外,等物质的量的Na2O2与Na2O所含的离子总数相等。
2.C
【详解】A.熬胆矾铁釜,久之亦化为铜,是发生了:Fe+CuSO4=Cu+FeSO4,硫酸铜与Fe置换反应生成Cu,属于置换反应,A正确;
B.铝合金具有密度小、质轻、硬度大、耐腐蚀等优良性能,则铝合金大量用于高铁建设,B正确;
C.明矾因具有吸附性而起到作净水作用,但没有杀菌作用,C错误;
D.碘酒具有杀菌的作用,能够使菌体蛋白质变性、死亡,D正确;
故答案为:C。
3.C
【详解】A.Fe2+具有还原性,能被其他氧化剂氧化,从而防止食品氧化变质,使食品保质期延长,故A正确;
B.Fe2O3是一种红棕色粉末,俗称铁红,常用作红色油漆和涂料,故B正确;
C.向Fe2(SO4)3溶液中加入足量铁粉,则溶液中Fe3+全部转化成Fe2+,Fe2+不与KSCN溶液反应,溶液不会变成血红色,故C错误;
D.铁和水蒸气反应的方程式为:3Fe+4H2O(g) Fe3O4+4H2,则生成紫黑色的Fe3O4,故D正确。答案选C。
【点睛】本题考查铁及其化合物,要求考生掌握常见金属及其化合物的重要性质。解题尤其需注意Fe3+和Fe2+的检验方法,Fe3+与KSCN溶液反应生成血红色的Fe(SCN)3,Fe2+不与KSCN溶液反应,溶液不会变成血红色。据此解答。
4.B
【详解】A.钢是铁的一种合金,是用量最大的合金材料,在钢中加入稀土元素可以提高钢的强度和耐腐蚀性等改善钢的性能,A项正确;
B.储氢合金储氢过程生成金属氢化物,过程中有新物质生成,是化学变化,B项错误;
C.不锈钢的成分主要是Fe、Cr、Ni,不锈钢具有很多优良性能如:抗腐蚀性强导热性好等,可用作医疗器械,厨房用具和餐具,C项正确;
D.铝的化学性质活泼,容易与空气中氧气反应生成氧化铝,因此日常用的铝制品,其表面总是覆盖着致密的氧化铝薄膜,D项正确;
答案选B。
5.D
【详解】A. 石灰水敞口存放,吸收空气中的二氧化碳,出现白色固体:,A错误;
B. 浓硝酸存放于无色细口瓶中,颜色变黄,是因为浓硝酸见光易分解产生的二氧化氮气体溶解在其中,方程式为:,B错误;
C. 酸化的硫酸亚铁溶液长时间存放,溶液变黄,是因为亚铁离子被氧化生成铁离子:,C错误;
D. 将氨水和浓盐酸存放在同一个药品柜中,氨水与浓盐酸反应生成氯化铵,出现白色固体:,D正确;
故答案为:D。
6.B
【详解】A.等质量铝与足量盐酸反应的反应式为:,与足量氢氧化钠溶液反应的反应式为:,无论与酸反应还是与碱反应,铝与氢气的关系式均为,铝质量相等,产生的氢气质量相同,A正确;
B.铝与氧气在常温下反应在铝表面生成致密氧化物薄膜,保护内部铝不受腐蚀,反应式为:,B错误;
C.氧化铝可与碱性溶液中的氢氧根反应生成偏铝酸根,大量摄入铝元素不利于人体健康,C正确;
D.偏铝酸钠在水溶液中以四羟基合铝酸钠的形式存在,可简写为,D正确;
故选B。
7.C
【详解】Al2O3和 Fe2O3分别与H2SO4反应生成Al2(SO4)3和Fe2(SO4)3,加入氢氧化钠后开始出现沉淀,发生的反应为Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,当沉淀达到最大值时再加入氢氧化钠,此时氢氧化铝开始溶解,反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少时,所得沉淀全部为Fe(OH)3,根据NaOH+Al(OH)3=NaAlO2+2H2O可知,若溶解Al(OH)3消耗的NaOH体积为10mL,设NaOH的浓度为cmol/L,说明Al3+的物质的量为0.01cmol,则Fe3+的物质的量为0.01cmol,故沉淀Al3+和Fe3+的NaOH的物质的量为(0.01cmol+0.01cmol)×3=0.06cmol,体积为=0.06L=60mL,因此C选项所对应的图象符合题意;
故选C。
8.C
【详解】A.稀硫酸既与Zn粉反应,也和Fe粉反应,A错误;
B.2FeCl2+Cl2=2FeCl3,B错误;
C.CO2杂质与NaOH溶液反应,可以用洗气的方法除去,C正确;
D.2FeCl3+Fe=3FeCl2,D错误。
故选C。
9.D
【详解】A.根据图象得出NO、H+、Fe2+反应,反应中NO所含氮元素化合价降低,被还原,发生还原反应,故A正确;
B.根据题意说明NO、H+、Fe2+反应生成Fe3+、NH和H2O,根据还原剂的还原性大于还原产物的还原性,得到还原性:Fe2+>NH,故B正确;
C.该反应中Fe2+化合价升高,失去电子, Fe2+被氧化为Fe3+,故C正确;
D.NO、H+、Fe2+反应生成Fe3+、NH和H2O,还原剂是Fe2+,化合价升高1,氧化剂是NO,氮元素化合价降低8,根据化合价升降守恒,因此在反应中参加反应的还原剂与氧化剂的物质的量之比为8:1,故D错误。
答案为D。
10.D
【详解】A.有强氧化性,可将氯化亚铁氧化成氯化铁,故在含杂质的溶液中通入适量可除去杂质,A项正确;
B.与氯化铁反应生成氯化亚铁,故在含杂质的溶液中加入过量铁粉并过滤可除去杂质,B项正确;
C.与溶液反应生成,故在含铝粉杂质的铁粉中加入过量溶液并过滤可除去铝粉杂质,C项正确;
D.在空气中灼烧时,极易被氧化成,受热分解成和,不能达到除杂效果,D项错误;
答案选D。
11.B
【分析】硫酸亚铁晶体溶解得到溶液A中溶质为FeSO4,氯化铁晶体溶解得到溶液B中溶质为FeCl3,二者混合加入氢氧化钠溶液加热发生反应Fe2++2Fe3++8OH-=Fe3O4+4H2O,过滤得到纳米级四氧化三铁,共沉淀法制备纳米级Fe3O4的关键为FeSO4 7H2O和FeCl3 6H2O的物质的量之比为1:2,以此来解答。
【详解】A.溶液A中含Fe2+,为防止亚铁离子被氧化,保存溶液A时应加入少量铁粉,故A正确;
B.Fe3O4可看成FeO Fe2O3,N(Fe2+):N(Fe3+)=1:2,则FeSO4 7H2O和FeCl3 6H2O的物质的量之比为1:2,故B错误;
C.钠的焰色反应为黄色,滤液含钠离子,则取滤液进行焰色反应,火焰为黄色,故C正确;
D.溶解后加NaOH发生Fe2++2Fe3++8OH-=Fe3O4+4H2O,无元素的化合价变化,制备反应类型不属于氧化还原反应,故D正确;
综上所述,说法错误的是B项,故答案为B。
12.C
【分析】从B装置的构造看,里面的液体不可能进入A装置内,所以B装置内应盛有NaOH溶液,A装置内反应生成FeSO4后,利用产生的气体压入B装置内。
【详解】A.由分析可知,A装置内制取FeSO4溶液,则分液漏斗中盛放的是6mol·L-1的硫酸,A不正确;
B.A中,铁屑和6mol·L-1的硫酸反应,化学方程式是:Fe+ H2SO4=FeSO4+H2↑,B不正确;
C.生成Fe(OH)2的操作为:起初需排尽装置内的空气,首先打开a,让分液漏斗中液体流下,并让反应生成的H2将两装置内的空气排出,一段时间后关闭a,利用产生的H2将A中液体沿导管压入B装置中,C正确;
D.Fe(OH)2的颜色是白色,空气进入后,可将Fe(OH)2氧化,固体颜色由白色变为灰绿色,最后变为红褐色,D不正确;
故选C。
13.(1)防止被氧化
(2)
(3)隔绝空气(排除氧气对实验的影响)
(4) 可逆反应
(5) 产生白色沉淀,迅速变为灰绿色,最终变红褐色
【详解】(1)亚铁离子具有还原性,能被空气中的氧气氧化,所以在配制的FeCl2溶液中加入少量铁属的目的是防止Fe2+被氧化;
(2)Cl2可将Fe2+氧化成铁离子,自身得电子生成氯离子,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)防止空气中的氧气将Fe2+氧化,产生干扰,所以煤油的作用是隔绝空气;
(4)根据Fe2+的检验方法,向溶液中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,一定含有亚铁离子;则实验②检验的离子是Fe2+;碘易溶于CCl4,在CCl4中呈紫色,Fe3+遇KSCN溶液显血红色,实验①和③说明,在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为可逆反应;
(5))H2O2溶液中加入几滴酸化的FeCl3溶液,溶液变成棕黄色,发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;向氯化亚铁中加入氢氧化钠水溶液,先生成氢氧化亚铁白色沉淀,后氢氧化亚铁被空气氧化生成氢氧化铁沉淀红褐色沉淀,反应的化学方程式为。
14.(1)用平行光照射两种分散系(或丁达尔现象)
(2)2FeCl3+Cu=2FeCl2+ CuCl2;C;
(3)①Fe、Cu;②Fe+2H+=Fe2++H2↑;③2FeCl2+Cl2=2FeCl3
【详解】试题分析:(1)胶体可以发生丁达尔效应,而溶液不能,故鉴别Fe(OH)3胶体和FeCl3溶液的方法是用平行光照射两种分散系,产生丁达尔现象即具有光亮的通路的是氢氧化铁胶体,没有该现象的是氯化铁溶液;(2)氯化铁具有强的氧化性,可以将Cu单质氧化为铜离子,FeC13溶液与铜反应的化学方程式是2FeCl3+Cu=2FeCl2+ CuCl2;由于还原性Fe>Cu,所以当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,若金属有剩余,则一定含有Cu,可能含有Fe,也可能不含有Fe,所以不可能出现的现象是有铁无铜,故选项C符合题意;(3)①向含有FeCl3、CuCl2的溶液中加入过量的Fe,发生反应:2FeCl3+Fe=3FeCl2,Fe+CuCl2=FeCl2+Cu,然后过滤,得到的滤渣C的化学式为Fe及Cu;滤液B是FeCl2;②向滤渣中加入过量的盐酸,发生反应:Fe+2HCl=FeCl2+H2↑,,离子方程式是Fe+2H+=Fe2++H2↑;;由于Cu的活动性比H弱,不能与酸发生反应,所以过滤得到的滤液是FeCl2;③将两次的滤液合并,向其中再通入氯气,会发生反应:2FeCl2+Cl2=2FeCl3,就转化得到FeCl3溶液。
考点:考查铁元素的单质及化合物的性质、转化、物质的鉴别、化学方程式和离子方程式的书写的知识。
15. B C D A
【详解】NaHCO3受热分解生成Na2CO3、二氧化碳和水,碳酸钠受热不分解,则实验方法选择B;检验氯离子,选择硝酸银,若生成沉淀,则含有,所以实验方法选择C;NaOH溶液显碱性,可使酚酞变红,则实验方法选择D;氯化铁与铁反应生成氯化亚铁,则实验方法选择A。
16. KSCN溶液 溶液变成血红色 2FeCl3+ Cu = 2FeCl2+ CuCl2 5:1 NaClO3
【详解】(1)①检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液于试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,故答案为KSCN溶液;溶液变红;
②铜与氯化铁反应生成氯化铜、氯化亚铁,反应方程式为:2FeCl3+Cu=2FeCl2+CuCl2,故答案为2FeCl3+Cu=2FeCl2+CuCl2;
(2)在3Cl2 + 6NaOH =5NaCl + NaClO3 + 3H2O反应中,Cl→Cl-化合价由0变为-1价,表现氧化性,Cl→ClO3-化合价由0变为+5价,表现还原性,根据得失电子守恒可知氧化剂与还原剂的物质的量之比为5: 1,氧化产物是NaClO3。所以答案:5: 1;NaClO3。
17. 煤油/石蜡油 铝箔熔化,表面变暗,但不滴落 4Al+3O22Al2O3 液氨/NH3 液氨汽化时吸收大量的热,使周围温度急剧降低 640 3.6×105
【详解】(1)钠化学性质活泼,容易和空气中的氧气以及水、二氧化碳反应,在实验室,少量的钠应保存在煤油或石蜡油中,以隔绝空气;加热铝箔时,由于铝的熔点比较低,所以能看到铝箔熔化,表面变暗,但熔化的铝不会滴落下来,因为铝箔表面的铝会被空气中的氧气氧化生成氧化铝,氧化铝熔点很高,包在铝的外面,反应的化学方程式为:4Al+3O22Al2O3。
(2)NH3易液化,液氨气化时吸收大量的热,使周围的温度急剧降低,液氨常用作制冷剂。
(3)①80t煤中含有硫的质量为80×106g×0.4%=3.2×105g,物质的量为=1×104mol。根据硫守恒,SO2的物质的量也为1×104mol,质量为1×104mol×64g/mol=6.4×105g=640kg。
②1×104molSO2理论上能生产硫酸1×104mol,则得到硫酸的质量为1×104mol×98g/mol=9.8×105g=980kg。则每年(360天)得到的98%的浓硫酸的质量为=3.6×105kg。
18.(1) 氢氧化钠溶液 Al2O3+2NaOH=2NaAlO2+H2O
(2) 铁粉 Cu2++Fe=Fe2+Cu
(3) 加热法 2NaHCO3Na2CO3+H2O+CO2↑
(4)2Fe3++Cu=2Fe2++Cu2+
(5)防止生成Fe3+(答案言之有理即可)
【解析】(1)
A12O3和氢氧化钠溶液反应,而Fe2O3和氢氧化钠溶液不反应,故除去Fe2O3粉末中的A12O3,所选试剂为NaOH溶液,离子反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O;
(2)
可以用铁粉置换出氯化铜中的铜,同时生成氯化亚铁,故所选试剂为:铁粉;相关的离子方程式为:Cu2++Fe=Fe2+Cu;
(3)
碳酸氢钠不稳定,受热容易分解,故除去Na2CO3固体中的NaHCO3除杂方法为:加热法;相关的化学反应方程式为2NaHCO3Na2CO3+H2O+CO2↑;
(4)
三价铁氧化性较强,可以和单质铜反应,相应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
(5)
硫酸亚铁中的二价铁容易被氧化为三价铁而变质,可以用铁粉将三价铁再还原为二价铁,故加入少量铁粉的原因是:防止生成Fe3+(答案言之有理即可);
19. NaOH(或KOH) 2Al+2OH-+2H2O=2AlO+3H2↑ CO2 CO+CO2+H2O=2HCO
【详解】(1)Al与强碱溶液反应,而Fe不能,因此可以加入NaOH或KOH,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应完后过滤得到Fe,反应的离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑;
(2) CO2可以与Na2CO3溶液反应生成NaHCO3,Na2CO3+H2O+CO2= 2NaHCO3,离子方程式为CO+CO2+H2O=2HCO。
20.(1) ①②⑦ ⑤⑧
(2) 3:1 1:3
(3)+CH3COOH=CH3COO- +H2O+CO2↑
(4) 2 1:2
(5)10 mol/L
【解析】(1)
石墨和钠有自由移动的电子可以导电,氢氧化钡溶液有可自由移动的阳离子和阴离子可以导电,因此能导电的是①②⑦;硫化氢和醋酸是在水溶液中不完全电离的电解质,属于弱电解质,因此弱电解质是⑤⑧;
(2)
等质量NH3和H2S物质的量之比为::=2:1,氢原子的数目之比为23:12=3:1;若NH3和H2S中所含氢原子数相等,物质的量之比为:=2:3,则NH3和H2S的质量之比为217:334=1:3;
(3)
NaHCO3与CH3COOH反应生成CH3COONa、CO2和H2O,离子方程式为+CH3COOH=CH3COO- +H2O+CO2↑;
(4)
B室2个体积,其中气体的物质的量是3 mol,A室4个体积,则其中气体的物质的量是3 mol×2=6 mol。假设其中所含H2、O2的物质的量分别是x、y,则x+y=6 mol,2x+32y=102 g,解得x=3 mol,y=3 mol,由方程式2H2+O22H2O中物质反应转化关系可知O2过量,n(O2)剩余=3mol-3mol×=1.5 mol,n(A):n(B)=1.5 mol:3 mol=1:2,则活塞停留在2刻度处;当气体温度不变时,气体的反应前后压强之比与反应前后体积成反正比,则容器内气体压强与反应前气体压强之比为1.5∶3=1 :2
(5)
224L 的 HCl的物质的量为=10mol, 835mL(ρ=1g/cm3)的水的质量为835mL×1g/mL=835g,所得盐酸的密度为 1.2g/cm3,该盐酸的物质的量浓度为=10mol/L。
21. 第四周期,第Ⅷ 族 3Fe+4H2O(g) Fe3O4+4H2↑ 2Al+Fe2O 3Al2O3 + 2Fe (答案合理即给分) Fe2+ Pt Fe2+ 、Fe3+ Fe3+ a =0.012 b = 0.02
【详解】试题分析::(1)Fe的原子序数为26,原子结构中有4个电子层,最外层电子数为2,则位于元素周期表中第四周期,第Ⅷ族,故答案为第四周期,第Ⅷ族;
(2)Fe与水蒸气反应生成四氧化三铁和氢气,反应为3Fe+4H2O(g)Fe3O4+4H2↑(3)铝和铁的氧化物反应生成氧化铝和Fe,反应为2Al+Fe2O 3Al2O3 + 2Fe.(4)①随HNO3用量的增加,硝酸不足,发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,金属离子为Fe2+,残留固体成分为Fe、Pt;若硝酸与Fe恰好发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,金属离子为Fe2+,残留固体成分为Pt;在上述反应基础上,再加硝酸,发生3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,则金属离子为Fe2+ Fe3+,残留固体成分为Pt;若亚铁离子恰好被氧化,则发生3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,则金属离子为Fe3+,残留固体成分为Pt;②x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,则物质的量均为0.25amol,由电子守恒可知,0.25a×2+0.25a×3=0.112/22.4×(5-2),解得a=0.012,由N原子守恒可知b=0.25×0.012mol×2+0.25×0.012mol×3+0.112/22.4=0.02。
考点:氧化还原反应的计算,化学方程式的计算,铁的化学性质,有关混合物的计算
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.设NA代表阿伏加 德罗常数的值,下列说法中正确的是( )
A.一定条件下,1molFe与1molCl2充分反应,Fe失去的电子数目为3NA
B.在常温常压下,11.2L氯气含有分子数为0.5NA
C.7.8gNa2O2与水完全反应时,转移的电子数为0.1NA
D.1.2gNaHSO4晶体中所含离子数为0.03NA
2.化学与传统文化和日常生活密切相关。下列叙述错误的是
A.北宋沈括《梦溪笔谈》中记载:“信州铅山有苦泉,流以为涧。挹其水熬之则成胆矾烹胆矾则成铜。熬胆矾铁釜,久之亦化为铜”涉及置换反应
B.铝合金大量用于高铁建设
C.明矾作净水剂有杀菌作用
D.碘酒可用于皮肤外用消毒
3.下列描述中,不正确的是
A.FeSO4 可用于防止食品氧化变质,延长食品的保质期
B.Fe2O3为红棕色粉末,生活中常用作颜料
C.向Fe2(SO4)3 溶液中加入足量的铁粉,充分反应后,滴加KSCN溶液,溶液马上变成血红色
D.铁和水蒸气反应,生成紫黑色的Fe3O4
4.下列关于材料的说法不正确的是
A.钢是用量最大的合金材料,钢中加入稀土元素可改善钢的性能
B.储氢合金是一类通过物理方法吸附H2的新型合金材料
C.不锈钢的成分主要是Fe、Cr、Ni,可用作医疗器械,厨房用具和餐具
D.日常用的铝制品,其表面总是覆盖着致密的氧化铝薄膜
5.实验室药品必须按规定存放,下列对错误存放后出现现象的解释合理的是
A.石灰水敞口存放,出现白色固体:
B.浓硝酸存放于无色细口瓶中,颜色变黄:
C.酸化的硫酸亚铁溶液长时间存放,溶液变黄:
D.将氨水和浓盐酸存放在同一个药品柜中,柜壁出现白色固体:
6.铝合金是目前用途最广泛的合金之一,下列关于铝及其化合物说法错误的是
A.等质量的量Al分别与足量的盐酸、NaOH溶液反应,产生相同质量的H2
B.常温下,铝不与氧气反应
C.Al2O3是两性氧化物,所以铝制品不宜用来蒸煮碱性食物
D.偏铝酸钠的化学式可表示为:NaAlO2或Na[Al(OH)4]
7.将等物质的量的和混合物完全溶于100mL稀盐酸中,向反应后的溶液中缓慢加入NaOH溶液,下列图象中可能正确表示上述反应的是(横坐标表示加入NaOH的体积,纵坐标表示生成沉淀的质量):
A. B. C. D.
8.下列各组括号内的试剂,能用于除掉物质中杂质的是
A.Fe粉中混有Zn粉杂质(稀H2SO4)
B.FeCl2中混有FeCl3杂质(Cl2)
C.CO气体中混有CO2杂质(NaOH溶液)
D.FeCl3中混有FeCl2杂质(铁屑)
9.某反应过程中存在、、、、和六种粒子,测得、的质量分数(w)随时间变化的曲线如图所示,下列判断错误的是
A.被还原,发生还原反应 B.还原性:
C.被氧化为 D.还原剂与氧化剂的物质的量之比为
10.下列除杂试剂或方法不正确的是
选项 被提纯物质 杂质 除杂试剂或方法
A 溶液 通入适量
B 溶液 加入过量铁粉并过滤
C 铁粉 铝粉 加入过量溶液并过滤
D 在空气中灼烧
A.A B.B C.C D.D
11.纳米级四氧化三铁是应用最为广泛的软磁性材料之一、共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图所示:
下列说法错误的是
A.保存溶液A时,应加入少量铁粉
B.FeSO4 7H2O和FeCl3 6H2O的物质的量之比最好应为2∶1
C.取滤液进行焰色反应,火焰为黄色
D.其制备反应类型不属于氧化还原反应
12.如图所示装置,可用来制取和观察Fe(OH)2在空气中被氧化的颜色变化,实验中使用的试剂为铁屑和6mol·L-1的硫酸、氢氧化钠溶液。下列说法正确的是
A.分液漏斗中盛放的是氢氧化钠溶液
B.A中反应的化学方程式是:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.生成Fe(OH)2的操作为:首先打开a,让分液漏斗中液体流下,一段时间后关闭a,A中液体沿导管流入B中
D.打开b放入一些空气,可观察到Fe(OH)2的颜色由最初的灰绿色变为红褐色
二、填空题(共9题)
13.某班同学通过实验探究、的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成的溶液。在溶液中需加入少量铁屑,其目的是 。
(2)甲组同学取溶液,加入几滴氯水,再加入1滴溶液,溶液变红,说明可将氧化。溶液与氯水反应的离子方程式为 。
(3)乙组同学认为甲组的实验不够严谨,该组同学在溶液中先加入煤油,再于液面下依次加入几滴氯水和1滴溶液,溶液变红。煤油的作用是 。
(4)丙组同学取溶液,加入溶液混合。分别取此溶液于3支试管中进行如下实验:
①第一支试管中加入充分振荡、静置,层显紫色;
②第二支试管中加入1滴溶液,生成蓝色沉淀;
③第三支试管中加入1滴溶液,溶液变红。
实验②检验的离子是 (填离子符号);实验①和③说明:在过量的情况下,溶液中仍含有 (填离子符号),由此可以证明该氧化还原反应为 。
(5)丁组同学向盛有溶液的试管中加入几滴酸化的溶液,溶液变成棕黄色,发生反应的离子方程式为 ;如果向溶液中滴加溶液,现象是 ;沉淀变色的原因是 (用化学方程式解释)。
14.铁是人类较早使用的金属之一。运用所学知识,回答下列问题:
(1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)电子工业用FeC13溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeC13溶液与铜反应的化学方程式;当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,烧杯底部不可能出现的是( )
A.有铜无铁 B.有铁有铜 C.有铁无铜 D.无铁无铜
(3)工程师欲从制造印刷电路板的废水中回收铜,并获得FeC13溶液,设计如图方案:
①滤渣C的化学式为
②加过量D发生反应的离子方程式为
③通入F发生反应的化学方程式为
15.为了达到下表所列的实验目的,请选择合适的实验方法,将其标号填入对应的空格中。
实验方法:A.加入足量铁粉,过滤 B.加热 C.加入硝酸银溶液 D.滴入酚酞试液
实验目的 实验方法
除去Na2CO3固体中少量的NaHCO3
检验自来水中是否含有Cl-
证明NaOH溶液呈碱性
除去FeCl2溶液中少量的FeCl3
16.⑴电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
①检验溶液中Fe3+存在的试剂是 ,证明Fe3+存在的现象是 。
②写出FeCl3溶液与金属铜发生反应的化学方程式: 。
⑵3Cl2 + 6NaOH =5NaCl + NaClO3 + 3H2O
氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
17.回答下列问题:
(1)实验室,少量的钠应保存在 中;加热铝箔的实验现象是 ,原因是 (用化学方程式表示)。
(2)在含氮的常见化合物中,常用作制冷剂的是 ,原理是 (用适当文字描述)。
(3)某工厂的燃料煤中硫的质量分数为0.4%,该工厂每天燃烧这种煤80t,试计算:
①若煤中的硫全部转化为SO2,该工厂每天产生的SO2的质量为 kg。
②如果把产生的SO2全部回收利用,理论上每年(360天)得到的98%的浓硫酸的质量为 kg。
18.请按照要求填写:
(1)除去Fe2O3粉末中的A12O3,所选试剂为 ,相关的化学方程式为 。
(2)除去FeCl2溶液中的CuCl2,所选试剂为 ,相关的离子方程式为 。
(3)除去Na2CO3固体中的NaHCO3除杂方法为 。相关的化学反应方程式为 。
(4)FeCl3溶液腐蚀铜板的离子方程式为 。
(5)为防止FeSO4溶液变质,一般在溶液中加入少量铁粉,其原因是 。
19.除去下列物质中所混有的少量杂质,指明应加入的试剂,写出有关反应的离子方程式。
加入试剂 离子方程式
(1)铁粉中混有少量铝粉
(2)NaHCO3溶液中混有少量Na2CO3
20.有以下物质①石墨;②钠;③酒精;④氨气;⑤硫化氢;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧醋酸(CH3COOH);⑨氧化钠固体;⑩液态氯化氢。
(1)其中能导电的是 ;属于弱电解质的是 。
(2)等质量④和⑤中氢原子的数目之比为 ;若④和⑤中所含氢原子数相等,则④和⑤的质量之比为 。
(3)写出⑥和⑧在水溶液中的离子反应方程式 。
(4)室温下,某容积固定的密闭容器由可移动的活塞(忽略摩擦力)隔成A、B两室,向A室中充入H2和O2的混合气体,向B室中充入3mol空气,此时活塞的位置如图所示:
已知A室混合气体的质量为102 g,若将A室中H2与O2的混合气体点燃引爆,恢复室温后,最终活塞停留的位置在 (填数字)刻度,反应后容器内气体压强与反应前气体压强之比为 。
(5)标况下,将224 L的HCl气体溶于835 mL(ρ=1 g/cm3)的水中,所得盐酸的密度为1.2 g/cm3,该盐酸的物质的量浓度 。
21.目前,铁是使用最广泛的金属之一,已知在高温下,Fe与水蒸气可发生反应。
应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
请回答下列的问题。
(1)铁在周期表中的位置是
(2)请写出该反应的化学方程式: ;
(3)曾利用铝和铁的氧化物反应原理来焊接钢轨,该反应的化学方程式为
(4)现有铁和铂组成的合金共a mol,其中Pt的物质的量分数为x,研成粉末状后全部投入含bmol HNO3的稀溶液中,使其充分反应,且HNO3的还原产物只有NO。试回答下列问题:
①随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有四种情况,请用粒子符号填写下表空白:
① ② ③ ④
溶液中的金属离子 Fe2+
残留固体成分 Fe、Pt Pt Pt
②当x=0.5 ,且溶液中Fe3+与Fe2+和物质的量相等,在标准状况下共产生112mLNO。则a = ,b = ,
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.Fe与Cl2反应方程式为:2Fe+3Cl22FeCl3,由此可知,反应过程中,Cl2不足,故反应过程中转移电子数为2NA,故A错误;
B.常温常压下,气体摩尔体积大于22.4L/mol,由此11.2L氯气小于0.5mol,故B错误;
C.7.8gNa2O2(即0.1mol)与水反应,过氧化钠中O元素发生歧化,过氧化钠既作氧化剂也作还原剂,转移电子数为0.1NA,故C正确;
D.1.2gNaHSO4(即0.01mol)晶体中含有Na+、,因此一共含有离子数为0.02 NA,故D错误;
故答案为:C。
【点睛】(1)铁与氯气发生反应会生成氯化铁,其反应与铁或氯气的量无关,其原因在于生成的氯化铁为分子晶体,在加热过程中会挥发,不能电离出铁离子,不能发生2Fe3++Fe=3Fe2+。
(2)Na2O2与水或二氧化碳的反应中,Na2O2既是氧化剂,又是还原剂;1molNa2O2与水或二氧化碳反应,转移电子为1mol,另外,等物质的量的Na2O2与Na2O所含的离子总数相等。
2.C
【详解】A.熬胆矾铁釜,久之亦化为铜,是发生了:Fe+CuSO4=Cu+FeSO4,硫酸铜与Fe置换反应生成Cu,属于置换反应,A正确;
B.铝合金具有密度小、质轻、硬度大、耐腐蚀等优良性能,则铝合金大量用于高铁建设,B正确;
C.明矾因具有吸附性而起到作净水作用,但没有杀菌作用,C错误;
D.碘酒具有杀菌的作用,能够使菌体蛋白质变性、死亡,D正确;
故答案为:C。
3.C
【详解】A.Fe2+具有还原性,能被其他氧化剂氧化,从而防止食品氧化变质,使食品保质期延长,故A正确;
B.Fe2O3是一种红棕色粉末,俗称铁红,常用作红色油漆和涂料,故B正确;
C.向Fe2(SO4)3溶液中加入足量铁粉,则溶液中Fe3+全部转化成Fe2+,Fe2+不与KSCN溶液反应,溶液不会变成血红色,故C错误;
D.铁和水蒸气反应的方程式为:3Fe+4H2O(g) Fe3O4+4H2,则生成紫黑色的Fe3O4,故D正确。答案选C。
【点睛】本题考查铁及其化合物,要求考生掌握常见金属及其化合物的重要性质。解题尤其需注意Fe3+和Fe2+的检验方法,Fe3+与KSCN溶液反应生成血红色的Fe(SCN)3,Fe2+不与KSCN溶液反应,溶液不会变成血红色。据此解答。
4.B
【详解】A.钢是铁的一种合金,是用量最大的合金材料,在钢中加入稀土元素可以提高钢的强度和耐腐蚀性等改善钢的性能,A项正确;
B.储氢合金储氢过程生成金属氢化物,过程中有新物质生成,是化学变化,B项错误;
C.不锈钢的成分主要是Fe、Cr、Ni,不锈钢具有很多优良性能如:抗腐蚀性强导热性好等,可用作医疗器械,厨房用具和餐具,C项正确;
D.铝的化学性质活泼,容易与空气中氧气反应生成氧化铝,因此日常用的铝制品,其表面总是覆盖着致密的氧化铝薄膜,D项正确;
答案选B。
5.D
【详解】A. 石灰水敞口存放,吸收空气中的二氧化碳,出现白色固体:,A错误;
B. 浓硝酸存放于无色细口瓶中,颜色变黄,是因为浓硝酸见光易分解产生的二氧化氮气体溶解在其中,方程式为:,B错误;
C. 酸化的硫酸亚铁溶液长时间存放,溶液变黄,是因为亚铁离子被氧化生成铁离子:,C错误;
D. 将氨水和浓盐酸存放在同一个药品柜中,氨水与浓盐酸反应生成氯化铵,出现白色固体:,D正确;
故答案为:D。
6.B
【详解】A.等质量铝与足量盐酸反应的反应式为:,与足量氢氧化钠溶液反应的反应式为:,无论与酸反应还是与碱反应,铝与氢气的关系式均为,铝质量相等,产生的氢气质量相同,A正确;
B.铝与氧气在常温下反应在铝表面生成致密氧化物薄膜,保护内部铝不受腐蚀,反应式为:,B错误;
C.氧化铝可与碱性溶液中的氢氧根反应生成偏铝酸根,大量摄入铝元素不利于人体健康,C正确;
D.偏铝酸钠在水溶液中以四羟基合铝酸钠的形式存在,可简写为,D正确;
故选B。
7.C
【详解】Al2O3和 Fe2O3分别与H2SO4反应生成Al2(SO4)3和Fe2(SO4)3,加入氢氧化钠后开始出现沉淀,发生的反应为Fe3++3OH-=Fe(OH)3↓、Al3++3OH-=Al(OH)3↓,当沉淀达到最大值时再加入氢氧化钠,此时氢氧化铝开始溶解,反应的方程式为NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少时,所得沉淀全部为Fe(OH)3,根据NaOH+Al(OH)3=NaAlO2+2H2O可知,若溶解Al(OH)3消耗的NaOH体积为10mL,设NaOH的浓度为cmol/L,说明Al3+的物质的量为0.01cmol,则Fe3+的物质的量为0.01cmol,故沉淀Al3+和Fe3+的NaOH的物质的量为(0.01cmol+0.01cmol)×3=0.06cmol,体积为=0.06L=60mL,因此C选项所对应的图象符合题意;
故选C。
8.C
【详解】A.稀硫酸既与Zn粉反应,也和Fe粉反应,A错误;
B.2FeCl2+Cl2=2FeCl3,B错误;
C.CO2杂质与NaOH溶液反应,可以用洗气的方法除去,C正确;
D.2FeCl3+Fe=3FeCl2,D错误。
故选C。
9.D
【详解】A.根据图象得出NO、H+、Fe2+反应,反应中NO所含氮元素化合价降低,被还原,发生还原反应,故A正确;
B.根据题意说明NO、H+、Fe2+反应生成Fe3+、NH和H2O,根据还原剂的还原性大于还原产物的还原性,得到还原性:Fe2+>NH,故B正确;
C.该反应中Fe2+化合价升高,失去电子, Fe2+被氧化为Fe3+,故C正确;
D.NO、H+、Fe2+反应生成Fe3+、NH和H2O,还原剂是Fe2+,化合价升高1,氧化剂是NO,氮元素化合价降低8,根据化合价升降守恒,因此在反应中参加反应的还原剂与氧化剂的物质的量之比为8:1,故D错误。
答案为D。
10.D
【详解】A.有强氧化性,可将氯化亚铁氧化成氯化铁,故在含杂质的溶液中通入适量可除去杂质,A项正确;
B.与氯化铁反应生成氯化亚铁,故在含杂质的溶液中加入过量铁粉并过滤可除去杂质,B项正确;
C.与溶液反应生成,故在含铝粉杂质的铁粉中加入过量溶液并过滤可除去铝粉杂质,C项正确;
D.在空气中灼烧时,极易被氧化成,受热分解成和,不能达到除杂效果,D项错误;
答案选D。
11.B
【分析】硫酸亚铁晶体溶解得到溶液A中溶质为FeSO4,氯化铁晶体溶解得到溶液B中溶质为FeCl3,二者混合加入氢氧化钠溶液加热发生反应Fe2++2Fe3++8OH-=Fe3O4+4H2O,过滤得到纳米级四氧化三铁,共沉淀法制备纳米级Fe3O4的关键为FeSO4 7H2O和FeCl3 6H2O的物质的量之比为1:2,以此来解答。
【详解】A.溶液A中含Fe2+,为防止亚铁离子被氧化,保存溶液A时应加入少量铁粉,故A正确;
B.Fe3O4可看成FeO Fe2O3,N(Fe2+):N(Fe3+)=1:2,则FeSO4 7H2O和FeCl3 6H2O的物质的量之比为1:2,故B错误;
C.钠的焰色反应为黄色,滤液含钠离子,则取滤液进行焰色反应,火焰为黄色,故C正确;
D.溶解后加NaOH发生Fe2++2Fe3++8OH-=Fe3O4+4H2O,无元素的化合价变化,制备反应类型不属于氧化还原反应,故D正确;
综上所述,说法错误的是B项,故答案为B。
12.C
【分析】从B装置的构造看,里面的液体不可能进入A装置内,所以B装置内应盛有NaOH溶液,A装置内反应生成FeSO4后,利用产生的气体压入B装置内。
【详解】A.由分析可知,A装置内制取FeSO4溶液,则分液漏斗中盛放的是6mol·L-1的硫酸,A不正确;
B.A中,铁屑和6mol·L-1的硫酸反应,化学方程式是:Fe+ H2SO4=FeSO4+H2↑,B不正确;
C.生成Fe(OH)2的操作为:起初需排尽装置内的空气,首先打开a,让分液漏斗中液体流下,并让反应生成的H2将两装置内的空气排出,一段时间后关闭a,利用产生的H2将A中液体沿导管压入B装置中,C正确;
D.Fe(OH)2的颜色是白色,空气进入后,可将Fe(OH)2氧化,固体颜色由白色变为灰绿色,最后变为红褐色,D不正确;
故选C。
13.(1)防止被氧化
(2)
(3)隔绝空气(排除氧气对实验的影响)
(4) 可逆反应
(5) 产生白色沉淀,迅速变为灰绿色,最终变红褐色
【详解】(1)亚铁离子具有还原性,能被空气中的氧气氧化,所以在配制的FeCl2溶液中加入少量铁属的目的是防止Fe2+被氧化;
(2)Cl2可将Fe2+氧化成铁离子,自身得电子生成氯离子,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)防止空气中的氧气将Fe2+氧化,产生干扰,所以煤油的作用是隔绝空气;
(4)根据Fe2+的检验方法,向溶液中加入1滴K3[Fe(CN)6]溶液,生成蓝色沉淀,一定含有亚铁离子;则实验②检验的离子是Fe2+;碘易溶于CCl4,在CCl4中呈紫色,Fe3+遇KSCN溶液显血红色,实验①和③说明,在I-过量的情况下,溶液中仍含有Fe3+,由此可以证明该氧化还原反应为可逆反应;
(5))H2O2溶液中加入几滴酸化的FeCl3溶液,溶液变成棕黄色,发生反应的离子方程式为H2O2+2Fe2++2H+=2Fe3++2H2O;向氯化亚铁中加入氢氧化钠水溶液,先生成氢氧化亚铁白色沉淀,后氢氧化亚铁被空气氧化生成氢氧化铁沉淀红褐色沉淀,反应的化学方程式为。
14.(1)用平行光照射两种分散系(或丁达尔现象)
(2)2FeCl3+Cu=2FeCl2+ CuCl2;C;
(3)①Fe、Cu;②Fe+2H+=Fe2++H2↑;③2FeCl2+Cl2=2FeCl3
【详解】试题分析:(1)胶体可以发生丁达尔效应,而溶液不能,故鉴别Fe(OH)3胶体和FeCl3溶液的方法是用平行光照射两种分散系,产生丁达尔现象即具有光亮的通路的是氢氧化铁胶体,没有该现象的是氯化铁溶液;(2)氯化铁具有强的氧化性,可以将Cu单质氧化为铜离子,FeC13溶液与铜反应的化学方程式是2FeCl3+Cu=2FeCl2+ CuCl2;由于还原性Fe>Cu,所以当向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,若金属有剩余,则一定含有Cu,可能含有Fe,也可能不含有Fe,所以不可能出现的现象是有铁无铜,故选项C符合题意;(3)①向含有FeCl3、CuCl2的溶液中加入过量的Fe,发生反应:2FeCl3+Fe=3FeCl2,Fe+CuCl2=FeCl2+Cu,然后过滤,得到的滤渣C的化学式为Fe及Cu;滤液B是FeCl2;②向滤渣中加入过量的盐酸,发生反应:Fe+2HCl=FeCl2+H2↑,,离子方程式是Fe+2H+=Fe2++H2↑;;由于Cu的活动性比H弱,不能与酸发生反应,所以过滤得到的滤液是FeCl2;③将两次的滤液合并,向其中再通入氯气,会发生反应:2FeCl2+Cl2=2FeCl3,就转化得到FeCl3溶液。
考点:考查铁元素的单质及化合物的性质、转化、物质的鉴别、化学方程式和离子方程式的书写的知识。
15. B C D A
【详解】NaHCO3受热分解生成Na2CO3、二氧化碳和水,碳酸钠受热不分解,则实验方法选择B;检验氯离子,选择硝酸银,若生成沉淀,则含有,所以实验方法选择C;NaOH溶液显碱性,可使酚酞变红,则实验方法选择D;氯化铁与铁反应生成氯化亚铁,则实验方法选择A。
16. KSCN溶液 溶液变成血红色 2FeCl3+ Cu = 2FeCl2+ CuCl2 5:1 NaClO3
【详解】(1)①检验溶液中Fe3+存在通常用KSCN溶液,取少量溶液于试管中,滴加KSCN溶液,溶液变红说明Fe3+存在,故答案为KSCN溶液;溶液变红;
②铜与氯化铁反应生成氯化铜、氯化亚铁,反应方程式为:2FeCl3+Cu=2FeCl2+CuCl2,故答案为2FeCl3+Cu=2FeCl2+CuCl2;
(2)在3Cl2 + 6NaOH =5NaCl + NaClO3 + 3H2O反应中,Cl→Cl-化合价由0变为-1价,表现氧化性,Cl→ClO3-化合价由0变为+5价,表现还原性,根据得失电子守恒可知氧化剂与还原剂的物质的量之比为5: 1,氧化产物是NaClO3。所以答案:5: 1;NaClO3。
17. 煤油/石蜡油 铝箔熔化,表面变暗,但不滴落 4Al+3O22Al2O3 液氨/NH3 液氨汽化时吸收大量的热,使周围温度急剧降低 640 3.6×105
【详解】(1)钠化学性质活泼,容易和空气中的氧气以及水、二氧化碳反应,在实验室,少量的钠应保存在煤油或石蜡油中,以隔绝空气;加热铝箔时,由于铝的熔点比较低,所以能看到铝箔熔化,表面变暗,但熔化的铝不会滴落下来,因为铝箔表面的铝会被空气中的氧气氧化生成氧化铝,氧化铝熔点很高,包在铝的外面,反应的化学方程式为:4Al+3O22Al2O3。
(2)NH3易液化,液氨气化时吸收大量的热,使周围的温度急剧降低,液氨常用作制冷剂。
(3)①80t煤中含有硫的质量为80×106g×0.4%=3.2×105g,物质的量为=1×104mol。根据硫守恒,SO2的物质的量也为1×104mol,质量为1×104mol×64g/mol=6.4×105g=640kg。
②1×104molSO2理论上能生产硫酸1×104mol,则得到硫酸的质量为1×104mol×98g/mol=9.8×105g=980kg。则每年(360天)得到的98%的浓硫酸的质量为=3.6×105kg。
18.(1) 氢氧化钠溶液 Al2O3+2NaOH=2NaAlO2+H2O
(2) 铁粉 Cu2++Fe=Fe2+Cu
(3) 加热法 2NaHCO3Na2CO3+H2O+CO2↑
(4)2Fe3++Cu=2Fe2++Cu2+
(5)防止生成Fe3+(答案言之有理即可)
【解析】(1)
A12O3和氢氧化钠溶液反应,而Fe2O3和氢氧化钠溶液不反应,故除去Fe2O3粉末中的A12O3,所选试剂为NaOH溶液,离子反应方程式为:Al2O3+2NaOH=2NaAlO2+H2O;
(2)
可以用铁粉置换出氯化铜中的铜,同时生成氯化亚铁,故所选试剂为:铁粉;相关的离子方程式为:Cu2++Fe=Fe2+Cu;
(3)
碳酸氢钠不稳定,受热容易分解,故除去Na2CO3固体中的NaHCO3除杂方法为:加热法;相关的化学反应方程式为2NaHCO3Na2CO3+H2O+CO2↑;
(4)
三价铁氧化性较强,可以和单质铜反应,相应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+;
(5)
硫酸亚铁中的二价铁容易被氧化为三价铁而变质,可以用铁粉将三价铁再还原为二价铁,故加入少量铁粉的原因是:防止生成Fe3+(答案言之有理即可);
19. NaOH(或KOH) 2Al+2OH-+2H2O=2AlO+3H2↑ CO2 CO+CO2+H2O=2HCO
【详解】(1)Al与强碱溶液反应,而Fe不能,因此可以加入NaOH或KOH,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,反应完后过滤得到Fe,反应的离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑;
(2) CO2可以与Na2CO3溶液反应生成NaHCO3,Na2CO3+H2O+CO2= 2NaHCO3,离子方程式为CO+CO2+H2O=2HCO。
20.(1) ①②⑦ ⑤⑧
(2) 3:1 1:3
(3)+CH3COOH=CH3COO- +H2O+CO2↑
(4) 2 1:2
(5)10 mol/L
【解析】(1)
石墨和钠有自由移动的电子可以导电,氢氧化钡溶液有可自由移动的阳离子和阴离子可以导电,因此能导电的是①②⑦;硫化氢和醋酸是在水溶液中不完全电离的电解质,属于弱电解质,因此弱电解质是⑤⑧;
(2)
等质量NH3和H2S物质的量之比为::=2:1,氢原子的数目之比为23:12=3:1;若NH3和H2S中所含氢原子数相等,物质的量之比为:=2:3,则NH3和H2S的质量之比为217:334=1:3;
(3)
NaHCO3与CH3COOH反应生成CH3COONa、CO2和H2O,离子方程式为+CH3COOH=CH3COO- +H2O+CO2↑;
(4)
B室2个体积,其中气体的物质的量是3 mol,A室4个体积,则其中气体的物质的量是3 mol×2=6 mol。假设其中所含H2、O2的物质的量分别是x、y,则x+y=6 mol,2x+32y=102 g,解得x=3 mol,y=3 mol,由方程式2H2+O22H2O中物质反应转化关系可知O2过量,n(O2)剩余=3mol-3mol×=1.5 mol,n(A):n(B)=1.5 mol:3 mol=1:2,则活塞停留在2刻度处;当气体温度不变时,气体的反应前后压强之比与反应前后体积成反正比,则容器内气体压强与反应前气体压强之比为1.5∶3=1 :2
(5)
224L 的 HCl的物质的量为=10mol, 835mL(ρ=1g/cm3)的水的质量为835mL×1g/mL=835g,所得盐酸的密度为 1.2g/cm3,该盐酸的物质的量浓度为=10mol/L。
21. 第四周期,第Ⅷ 族 3Fe+4H2O(g) Fe3O4+4H2↑ 2Al+Fe2O 3Al2O3 + 2Fe (答案合理即给分) Fe2+ Pt Fe2+ 、Fe3+ Fe3+ a =0.012 b = 0.02
【详解】试题分析::(1)Fe的原子序数为26,原子结构中有4个电子层,最外层电子数为2,则位于元素周期表中第四周期,第Ⅷ族,故答案为第四周期,第Ⅷ族;
(2)Fe与水蒸气反应生成四氧化三铁和氢气,反应为3Fe+4H2O(g)Fe3O4+4H2↑(3)铝和铁的氧化物反应生成氧化铝和Fe,反应为2Al+Fe2O 3Al2O3 + 2Fe.(4)①随HNO3用量的增加,硝酸不足,发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,金属离子为Fe2+,残留固体成分为Fe、Pt;若硝酸与Fe恰好发生3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O,金属离子为Fe2+,残留固体成分为Pt;在上述反应基础上,再加硝酸,发生3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,则金属离子为Fe2+ Fe3+,残留固体成分为Pt;若亚铁离子恰好被氧化,则发生3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,则金属离子为Fe3+,残留固体成分为Pt;②x=0.5,且溶液中Fe3+与Fe2+和物质的量相等,则物质的量均为0.25amol,由电子守恒可知,0.25a×2+0.25a×3=0.112/22.4×(5-2),解得a=0.012,由N原子守恒可知b=0.25×0.012mol×2+0.25×0.012mol×3+0.112/22.4=0.02。
考点:氧化还原反应的计算,化学方程式的计算,铁的化学性质,有关混合物的计算
答案第1页,共2页
答案第1页,共2页
