第3章物质在水溶液中的行为单元训练题(含解析)--2023-2024学年高二化学鲁科版选择性必修1
文档属性
| 名称 | 第3章物质在水溶液中的行为单元训练题(含解析)--2023-2024学年高二化学鲁科版选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 20:33:52 | ||
图片预览


文档简介
第3章 物质在水溶液中的行为 单元训练题
一、单选题
1.25℃时,将HCl气体缓慢通入0.1 mol/L的氨水中,溶液的pH、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比[t=)的关系如图所示。若忽略溶液体积变化,下列有关说法错误的是
A.t=0.5时,c()>c(Cl-)
B.25℃时,的水解平衡常数Kh的数量级为10-10
C.P3所示溶液:c(Cl-)>c()> c(NH3·H2O)>c(H+)>c(OH-)
D.P2所示溶液:c(Cl-)> 100c(NH3·H2O)
2.下列离子方程式表示正确的是
A.氧化酸性废水中的:
B.氢氧化钠吸收足量二氧化硫:
C.氢氧化钠溶液吸收:
D.氟气通到溴化钠溶液中:
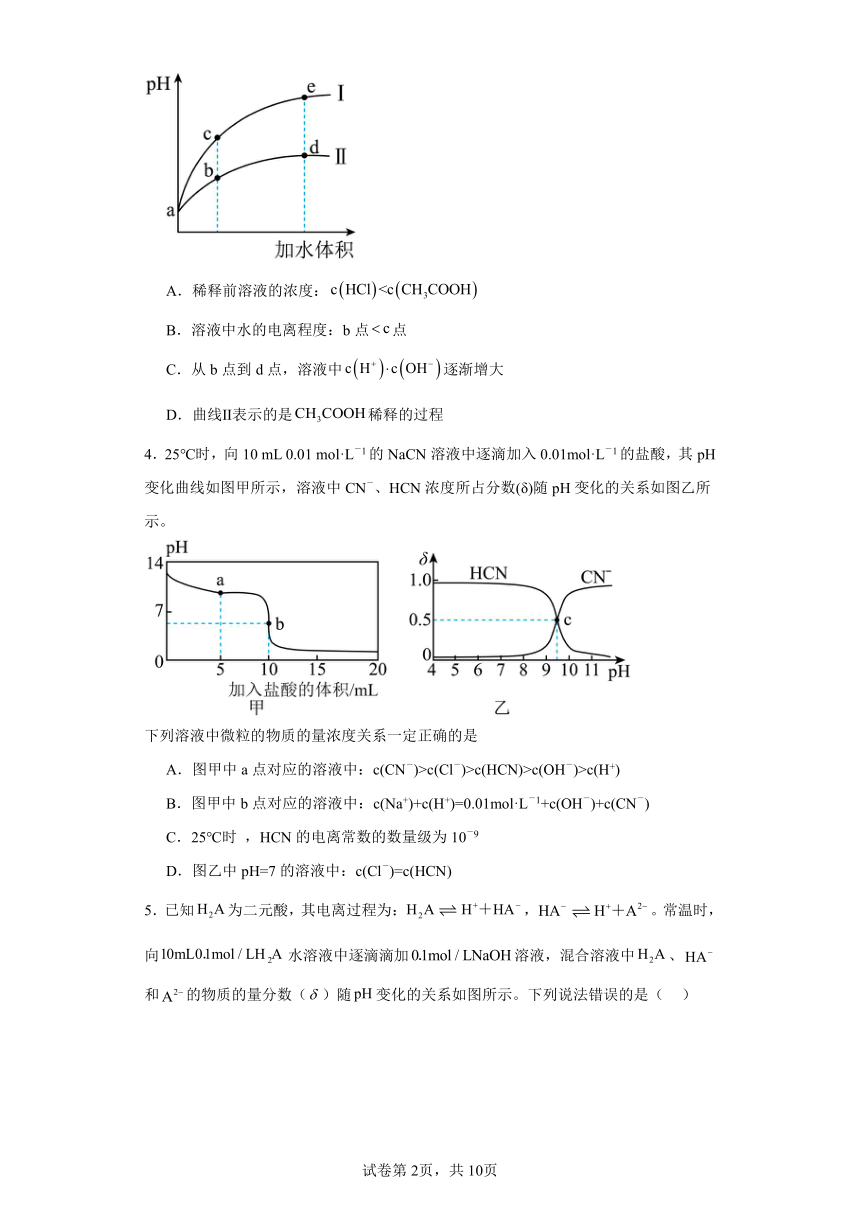
3.某温度下,将和体积均相同的和溶液分别加水稀释,其随加水体积的变化如图所示。下列叙述不正确的是
A.稀释前溶液的浓度:
B.溶液中水的电离程度:b点点
C.从b点到d点,溶液中逐渐增大
D.曲线Ⅱ表示的是稀释的过程
4.25℃时,向10 mL 0.01 mol·L-1的NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图甲所示,溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图乙所示。
下列溶液中微粒的物质的量浓度关系一定正确的是
A.图甲中a点对应的溶液中:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
B.图甲中b点对应的溶液中:c(Na+)+c(H+)=0.01mol·L-1+c(OH-)+c(CN-)
C.25℃时 ,HCN的电离常数的数量级为10-9
D.图乙中pH=7的溶液中:c(Cl-)=c(HCN)
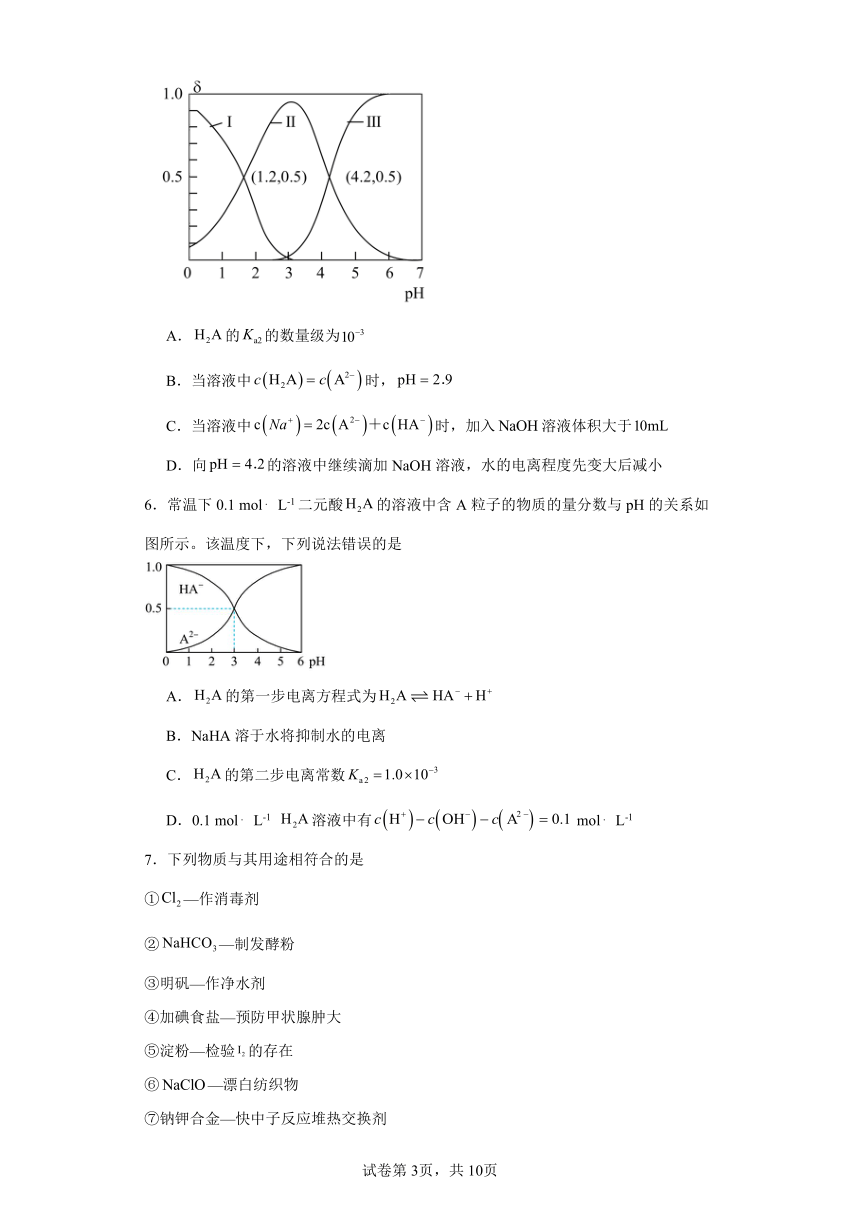
5.已知为二元酸,其电离过程为:,。常温时,向水溶液中逐滴滴加溶液,混合溶液中、和的物质的量分数()随变化的关系如图所示。下列说法错误的是( )
A.的的数量级为
B.当溶液中时,
C.当溶液中时,加入溶液体积大于
D.向的溶液中继续滴加NaOH溶液,水的电离程度先变大后减小
6.常温下0.1 mol L-1二元酸的溶液中含A粒子的物质的量分数与pH的关系如图所示。该温度下,下列说法错误的是
A.的第一步电离方程式为
B.NaHA溶于水将抑制水的电离
C.的第二步电离常数
D.0.1 mol L-1 溶液中有 mol L-1
7.下列物质与其用途相符合的是
①—作消毒剂
②—制发酵粉
③明矾—作净水剂
④加碘食盐—预防甲状腺肿大
⑤淀粉—检验的存在
⑥—漂白纺织物
⑦钠钾合金—快中子反应堆热交换剂
A.只有②③④⑤⑥ B.只有①②③④⑤ C.只有②③④⑤⑦ D.全部
8.工业上利用加入氨水生成沉淀的方法去除酸性废水中的铅元素,体系中含铅微粒的物质的量分数d与常温pH的关系如下图[难溶于水] 下列说法正确的是
A.的氨水中:
B.向的含铅酸性废水中加入氨水,反应的离子方程式为:
C.由图可知,pH越大,除铅效果越好
D.的上述溶液中始终存在:
9.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.和反应放出的溶液:
B.的溶液:
C.能使甲基橙显红色的溶液:
D.澄清透明的溶液:
10.常温下,下列各组微粒在指定溶液中一定能大量共存的是
A.的溶液中:、、、
B.由水电离产生的溶液中:、、、
C.使甲基橙变红的溶液中:、、、
D.0.1的溶液中:、、、
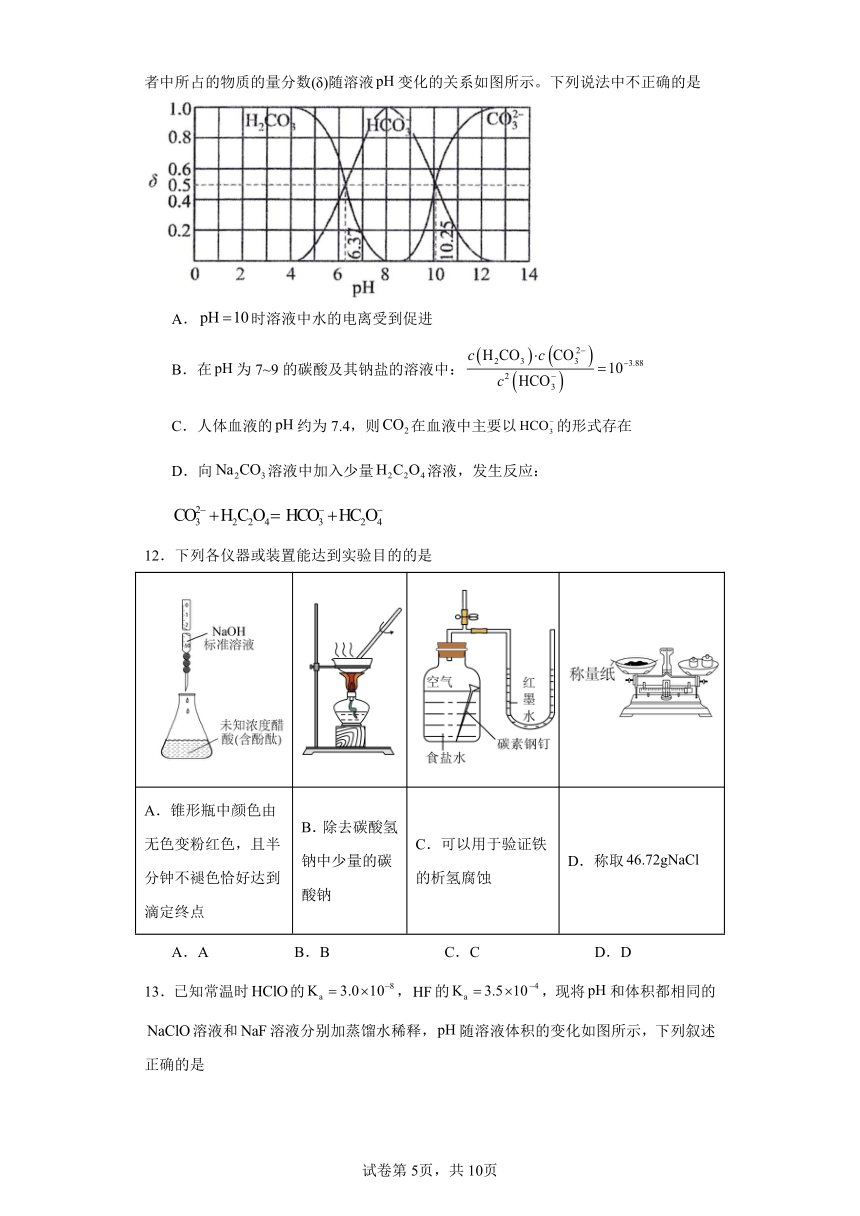
11.草酸(H2C2O4)存在于自然界的植物中,其在常温下的电离平衡常数。碳酸及其钠盐的溶液中、、分别在三者中所占的物质的量分数(δ)随溶液变化的关系如图所示。下列说法中不正确的是
A.时溶液中水的电离受到促进
B.在为7~9的碳酸及其钠盐的溶液中:
C.人体血液的约为7.4,则在血液中主要以的形式存在
D.向溶液中加入少量溶液,发生反应:
12.下列各仪器或装置能达到实验目的的是
A.锥形瓶中颜色由无色变粉红色,且半分钟不褪色恰好达到滴定终点 B.除去碳酸氢钠中少量的碳酸钠 C.可以用于验证铁的析氢腐蚀 D.称取
A.A B.B C.C D.D
13.已知常温时的,的,现将和体积都相同的溶液和溶液分别加蒸馏水稀释,随溶液体积的变化如图所示,下列叙述正确的是
A.曲线Ⅰ为溶液稀释时的变化曲线
B.与a点比,c点溶液中水的电离程度更大
C.取a点、b点溶液等体积混合,和水解程度均增大
D.与盐酸恰好完全反应时,消耗的物质的量:b点点
14.已知T ℃时两种弱酸的电离常数如下表(HA、A-分别代表相应的酸、酸根离子)。将pH和体积均相同的两种弱酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
弱酸(HA) HNO2 CH3COOH
电离平衡常数/(mol·L- 1) 5.0×10- 4 1.7×10- 5
A.曲线Ⅱ代表CH3COOH溶液
B.a点时,两溶液分别与NaOH溶液恰好中和,所需NaOH物质的量相同
C.溶液中水的电离程度:c点> b点
D.从c点到d点,溶液中持续增大
二、非选择题
15.研究电解质在水溶液中的平衡能了解它的存在形式。
I.食醋(约含的)、纯碱()和84消毒液(主要成分为)是生活中常见的化学用品,回答下列问题:
(1)醋酸()属于 电解质(填“强”“弱”或“非”),在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力,请用离子方程式表示其原因 。
(2)用离子方程式表示纯碱溶液呈碱性的原因 。
(3)将少量纯碱溶液滴入醋酸溶液中,溶液中的值变化趋势为 (填“增大”、“减小”或“不变”)。
(4)常温下,的醋酸溶液与的纯碱溶液中,水电离出的之比为 。
Ⅱ.已知时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式
电离平衡常数
(5)物质的量浓度均为的下列四种溶液:由小到大排列的顺序是 。
a. b. c. d.
(6)写出向氰化钠溶液中通入少量二氧化碳的离子方程式: 。
(7)时,将的醋酸溶液与氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数 (用含a、b的代数式表示)。
(8)标准状况下将,通入溶液中,用溶液甲微粒的浓度符号完成下列等式: 。
(9),氨水的浓度为,溶液中的 。
16.高中化学涉及的平衡理论主要包括化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,它们在工农业生产中都有广泛的应用,请回答下列问题:
(1)氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中:,其化学平衡常数K与温度t的关系如表:
t/℃ 200 300 400
K 0.5
完成下列填空:
①试比较、的大小, (填写“>”、“=”或“<”)。
②将和投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是 (填字母)。
A. B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.的体积分数不再改变
(2)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸()的结构如图:,亚磷酸可由水解而成,溶液存在电离平衡:,,回答下列问题:
①属于 (填“正盐”或“酸式盐”)。
②已知25℃时,的溶液的电离度为,的一级电离平衡常数 (用含的计算式表示,第二步电离忽略不计,忽略水的电离)。
③常温下,将溶液滴加到亚磷酸()溶液中,混合溶液的与离子浓度变化的关系如图所示,则表示的是曲线 (填“I”或“II”),亚磷酸()的 。
17.弱电解质的研究是重要课题。
(1)①25℃时,已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法不正确的是 (填字母)。
a.pH=8时,溶液中含碳元素的微粒主要是HCO
b.A点溶液中H2CO3和HCO浓度相同
c.当c(HCO)=c(CO)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是 。
(2)H2CO3以及其他部分弱酸的电离平衡常数如表:
弱酸 H2S H2CO3 HClO
电离平衡常数(25℃) Ka1=1.1×10-7 Ka2=1.3×10-13 Ka1=4.5×10-7 Ka2=4.7×10-11 Ka=4.8×10-8
①H2S、H2CO3、HClO的酸性由强到弱的顺序为 。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式: 。
(3)常温下,已知0.1mol/L一元酸HCOOH(甲酸)溶液中=1×10-8。
①0.1mol/LHCOOH溶液的pH= 。
②取10mL0.1mol/L的HCOOH溶液稀释至100倍,下列有关说法正确的是 (填字母)。
A.所有离子的浓度在稀释过程中都会减小 B.稀释后溶液的pH=5
C.稀释后甲酸的电离度会增大 D.与稀释前比较,稀释后水的电离程度增大
(4)现有0.1mol L-1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是 。
①电离程度增大 ②c(NH3 H2O)增大 ③NH数目增多 ④c(OH-)增大 ⑤导电性增强 ⑥增大 ⑦减小
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
18.是食品加工中最为快捷的食品添加剂,用于焙烤食品;在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,中 (填“等于”“大于”或“小于”)中。
(3)如图所示是电解质溶液的pH随温度变化的图像。
①其中符合的pH随温度变化的曲线是 (填Ⅰ、Ⅱ、Ⅲ、Ⅳ),导致pH随温度变化的原因是 。
②20℃时,中 。
(4)室温时,向溶液中滴加溶液,所得溶液pH与溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 点;在b点,溶液中各离子浓度由大到小的排列顺序是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.t=0.5时,溶质为等物质的量的NH3·H2O、NH4Cl,溶液呈碱性,则c()>c(Cl-),故A正确;
B.25℃时,根据图示,c()= c(NH3·H2O)时pH=9.25,的水解平衡常数Kh= ,数量级为10-10,故B正确;
C.P3所示溶液溶质为NH4Cl,溶液呈酸性,c(Cl-)>c()>c(H+)> c(NH3·H2O) >c(OH-),故C错误;
D.c()= c(NH3·H2O)时pH=9.25,Kb=10-4.75,P2所示溶液呈中性,c(Cl-)=c(),,所以c(Cl-)> 100c(NH3·H2O),故D正确;
选C。
2.C
【详解】A.氧化酸性废水中的:,A错误;
B.氢氧化钠吸收足量二氧化硫:,B错误;
C.氢氧化钠溶液吸收:,C正确;
D.氟气通到溴化钠溶液中,氟气立即水反应,得不到溴单质,D错误;
故选C。
3.C
【详解】A.a点pH相同,醋酸是弱酸水溶液中不完全电离,盐酸是强酸水溶液中完全电离,因此,故A正确;
B.b点比c点pH小,氢离子浓度大对水电离的抑制程度大,溶液中水的电离程度:b点点,故B正确;
C.温度没改变,不变,故C错误;
D.据解析A可知醋酸浓度大,稀释时pH减小相对缓慢,曲线Ⅱ表示的是稀释的过程,故D正确;
故选C。
4.D
【详解】A.滴加盐酸时,发生反应NaCN+ HCl=HCN+NaCl,a点溶液中溶质为NaCN、HCN和NaCl,三者物质的量之比为1: 1:1,此时溶液pH大于7,则NaCN的水解程度大于HCN的电离程度,故c (HCN) >c(CN-),A错误;
B..b点时,溶液中溶质为HCN和NaCl,二者物质的量之比为1: 1,溶液体积变为20 mL,二者浓度均为0.005mol/L,电荷守恒关系式为c (Na+) +c(H+) =c(Cl-) +c (CN-) +c (OH-), c (Cl-)=0.005mol/L,B错误;
C.图乙c点pH=9.5,说明,此时,则C错误;
D.在pH=7的溶液中,由电荷守恒关系式和物料守恒关系式得c (Cl-) =c(HCN),D正确;
答案选D。
5.A
【分析】为二元酸,其电离过程为:,。常温时,向水溶液中逐滴滴加溶液,混合溶液中、和的物质的量分数()随变化的关系如图所示,分析可知,Ⅰ为含量变化曲线,Ⅱ为含量变化曲线,Ⅲ为含量变化曲线。Ⅰ和Ⅱ的交点处,氢离子浓度即为此二元酸的第一级电离常数值,Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,结合溶液中的三大守恒分析即可。
【详解】A.Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,,可分析知其数量级为,A错误;
B.Ka1(H2A)=10-1.2时,同理Ka2(H2A)=10-4.2,当c(H2A)=c(A2-)时,,此时c(H+)=1×10-2.7mol/L,pH=2.7,B正确;
C.当溶液中时,由电荷守恒分析此时溶液呈现中性,向水溶液中逐滴滴加溶液,若加入溶液体积等于,此时形成NaHA溶液,其电离大于水解,溶液呈现酸性,故应再10mL的基础上多加,溶液才有可能呈现中性,C正确;
D.向的溶液中继续滴加NaOH溶液,结合图分析,含量再减小,含量增大,故水的电离程度再增大,而氢氧化钠溶液过量则会导致水的电离受到抑制,故水的电离程度先变大后减小,D正确;
故选A。
6.A
【分析】根据二元酸的溶液中含A粒子的物质的量分数与pH的关系图可知,溶液中不存在H2A分子,说明H2A的第一步完全电离,第二步部分电离,据此分析解答。
【详解】A.根据图像可知,溶液中不存在H2A分子,说明H2A的第一步完全电离,则H2A的第一步电离方程式为H2A=HA-+H+,A错误;
B.NaHA溶于水后只存在HA-的电离平衡,不存在水解平衡,所以电离产生的氢离子将抑制水的电离,B正确;
C. H2A的第二步电离常数Ka2=,根据图像可知,c(A2-)=c(HA-)时pH=3,Ka2=c(H+)=1.0×10-3,C正确;
D.0.1 mol L-1 溶液中存在电荷守恒,即,也存在物料守恒,即,两式联立可得 mol L-1,D正确;
故选A。
7.D
【详解】氯气具有强氧化性,可作为消毒剂,①正确;
碳酸氢钠受热易分解,故可作发酵粉,②正确;
明矾溶解后,铝离子水解生成氢氧化铝胶体,可吸附净水,③正确;
加碘食盐可补充碘元素,预防甲状腺肿大,④正确;
淀粉遇碘变蓝色,⑤正确;
次氯酸钠为漂白液有效成分且具有强氧化性,故可漂白织物,⑥正确;
钠钾合金导热效率高,即可作快中子反应堆热交换剂,⑦正确;
综上选D。
8.A
【详解】A.的氨水中:含氮微粒包括氨气分子,铵根离子、一水合氨分子,故,故A正确;
B.一水合氨是弱碱,离子方程式为,故B错误;
C.由图可知,pH大于10后,开始溶解,除铅效果变差,故C错误;
D.加入氨水生成沉淀的方法去除酸性废水中的铅元素,溶液中还有其他阳离子,因此不是一直存在该等式,故D错误;
故答案为:A。
9.D
【详解】A. 和反应放出的溶液,若呈酸性,不能含硝酸根,若呈碱性,铜和镁离子不能共存,故A不选;
B. 的溶液呈酸性时可以大量共存,呈碱性时,铵根离子不能大量共存,故B不选;
C. 能使甲基橙显红色的溶液呈酸性:之间会发生氧化还原反应,故C不选;
D. 澄清透明的溶液:四种离子间不发生反应,故D选;
故选D。
10.C
【详解】A.的溶液为强酸性溶液:、反应生成S、水、而不能大量存在,A不符合题意;
B.由水电离产生的,水的电离受到抑制,该溶液可能是酸性或碱性溶液,在碱性条件下不能大量共存,B不符合题意;
C.使甲基橙变红的溶液呈酸性,、、可以大量共存于酸性溶液中,C符合题意;
D.与发生水解,,不能大量共存,D不符合题意;
故选C。
11.D
【详解】A.时,溶液中溶质为,其中水解会促进水的电离,故A正确;
B.由图中曲线可知,时,,;时,,,在为7~9的碳酸及其钠盐的溶液中:,故B正确;
C.由图中曲线可以看出,当溶液的pH为7.4时,CO2主要以的形式存在,故C正确;
D.由于,因此向溶液中加入少量溶液,发生反应为,故D错误;
故选D。
12.A
【详解】A.图中标准溶液使用碱式滴定管盛装正确,滴定为止浓度的醋酸用酚酞做指示剂正确,终点现象正确,能达到实验目的,A正确;
B.除去碳酸氢钠中少量的碳酸钠不能用加热方法,加热固体物质不能用蒸发皿,B错误;
C.电解质溶液显酸性铁发生的是析氢腐蚀,在食盐水中铁发生的是吸氧腐蚀,C错误;
D.托盘天平的精确度为0.1g,不能准确称量46.72g的,D错误;
答案选A。
13.A
【详解】A.根据题中大小关系可得酸性弱于,所以水解程度小于,相同时的浓度大,加水稀释变化幅度小,A正确;
B.加水稀释c点溶液浓度比a点小,盐溶液浓度越小水的电离程度越小,B错误;
C.,,a、b两点溶液值相同即相同,等体积混合时、、、的浓度均减半,保持不变,所以平衡均不移动,C错误;
D.的浓度大,体积相同时消耗多,D错误;
故选A。
14.C
【分析】根据K可知,酸性HNO2> CH3COOH,加水稀释时HNO2的pH变化较大,则曲线I为CH3COOH,曲线Ⅱ为HNO2。
【详解】A.分析可知,曲线Ⅰ代表CH3COOH溶液,与题意不符,A错误;
B.a点时两者的pH相同,醋酸酸性更弱,故其浓度相同,故其体积相同时,醋酸需要的氢氧化钠的物质的量更多,B错误;
C.b、c两点溶液的pH越大,则溶液中水的电离程度越大,则水的电离程度:b点<c点,C正确;
D.从c点到d点,溶液的温度未变,= =,保持不变,D错误;
故选C。
15.(1) 弱
(2);
(3)减小
(4)或
(5)
(6)
(7)
(8)
(9)
【详解】(1)醋酸()是弱酸,属于弱电解质;由于醋酸的酸性比次氯酸的酸性强,故在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力是因为反应生成HClO,反应的离子方程式为;
(2)纯碱是强碱弱酸正盐,碳酸根离子会水解,使溶液显碱性,离子方程式为,;
(3)醋酸中存在电离平衡,电离平衡常数表达式为,将少量纯碱溶液滴入醋酸溶液中,醋酸的电离平衡向右移动,增大,电离平衡常数不变,故减小;
(4)常温下,的醋酸溶液中,,所以,氢氧根全部来自与水的电离;对于的纯碱溶液中,,则,溶液中氢氧根全部来自于水的电离,故两种溶液中水电离出的之比为或;
(5)由电离平衡常数可知,酸性由强到弱的顺序为;弱酸的酸性越弱,其酸根离子的水解程度越大,溶液的碱性越强,则由小到大排列的顺序为;
(6)由电离平衡常数知,酸性,强酸能和弱酸盐生成弱酸,故离子方程式为;
(7)由于反应后恰好显中性,故,由电荷守恒可知;则;
(8)标准状况下将,通入溶液中,的物质的量为0.1mol,的物质的量为0.1mol,两种恰好完全反应生成碳酸氢钠,由质子守恒可得;
(9)氨水的电离平衡常数,若氨水的浓度为,溶液中的。
16.(1) > ACD
(2) 正盐 I 10-6.5
【详解】(1)①合成氨反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,则200℃时平衡常数K1大于300℃时平衡常数K2,故答案为:>;
②A.由化学反应速率之比等于化学计量数之比可知,v正(NH3)=2v逆(N2)说明正逆反应速率相等,反应已达到平衡,故A正确;
B.由质量守恒定律可知,反应前后气体的质量相等,在恒容密闭容器中混合气体的密度始终不变,则混合气体的密度保持不变不能说明正逆反应速率相等,无法判断反应是否达到平衡,故B错误;
C.由质量守恒定律可知,反应前后气体的质量相等,合成氨反应是气体体积减小的反应,反应中混合气体的平均相对分子质量增大,则混合气体的平均相对分子质量不再改变说明正逆反应速率相等,反应已达到平衡,故C正确;
D.N2的体积分数随反应进行不断改变,当不再改变时说明正逆反应速率相等,反应已达到平衡,故D正确;故选ACD;
(2)①由电离方程式可知,H3PO3为二元弱酸,则Na2HPO3属于正盐,故答案为:正盐;②由25C时,1mol/LH3PO3溶液的电离度为α可知,在H3PO3第二步电离忽略不计,忽略水的电离的条件下,H3PO3的一级电离平衡常数Ka1== ,故答案为:;③H3PO3在溶液中分步电离,一级电离大于二级电离,一级电离常数大于二级电离常数,由电离常数公式可知溶液中=、=,则当溶液中pH相等时,>,则由图可知,表示的是曲线I,当溶液中=-1时,溶液中pH为5.5,则Ka2==10-5.5×10-1=10-6.5,故答案为:I;10-6.5。
17.(1) bc +OH =+H2O
(2) H2CO3>H2S>HClO ClO +CO2+H2O=HClO+
(3) 3 CD
(4)C
【详解】(1)①a.根据图中信息,pH═8时,溶液中含碳元素的微粒主要是,故a正确;
b.根据图中信息A点,溶液中CO2、H2CO3 的浓度和与浓度相同,故b错误;
c.当c()=c() 时,溶液显碱性,因此c(H+)<c(OH-),故c错误;
故答案为:bc;
②pH═8.4的水溶液主要是,因此向上述pH═8.4的水溶液中加入NaOH溶液时发生反应的离子方程式 +OH =+H2O;
(2)①电离常数越大说明酸性越强,根据电离常数可得酸性由强到弱的顺序为H2CO3>H2S>HClO,故答案为:H2CO3>H2S>HClO;
②根据平衡常数H2CO3>HClO>,将少量CO2气体通入NaClO溶液中反应生成碳酸氢根离子和次氯酸,该反应的离子方程式:ClO +CO2+H2O=HClO+;
(3)①0.1mol/L一元酸HCOOH(甲酸)溶液中 =1×10 8,则 =═1×10-8,c(H+)═1×10-3mol L-1,因此0.1mol/L HCOOH的pH═3;故答案为:3
②A.稀释过程中甲酸根离子浓度、氢离子浓度减少,氢氧根离子浓度增大,故A错误;
B.10mL0.1mol/L的 HCOOH溶液稀释100倍,稀释后,由于甲酸又要电离,因此氢离子浓度大于1×10-5mol L-1,因此溶液的pH小于5,故B错误;
C.稀释后,电离平衡正向移动,因此甲酸的电离度会增大,故C正确;
D.加水稀释,溶液氢离子浓度减小,抑制水的电离程度减小,因此与稀释前比较,稀释后水的电离程度增大,故D正确;
故答案为:CD;
(4)①加水稀释促进NH3 H2O电离,则NH3 H2O电离程度增大,故①正确;
②加水稀释促进NH3 H2O电离,n(NH3 H2O)减小,溶液体积增大,则c(NH3 H2O)减小,故②错误;
③加水稀释促进NH3 H2O电离,所以数目增多,故③正确;
④加水稀释促进NH3 H2O电离,但NH3 H2O电离程度小于溶液体积增大程度,导致c(OH-)减小,故④错误;
⑤加水稀释促进NH3 H2O电离,但NH3 H2O电离程度小于溶液体积增大程度,导致c(OH-)减小,离子浓度减小,则导电性减弱,故⑤错误;
⑥加水稀释过程中c(OH-)减小,温度不变,电离平衡常数不变,增大,故⑥正确;
⑦稀释过程中温度不变,电离平衡常数不变,则比值不变,故⑦错误;
故选:C。
18.(1)Al3+水解的离子方程式:Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水
(2)小于
(3) I NH4Al(SO4)2水解使溶液呈酸性,升高温度,其水解程度增大,pH减小 0.001
(4) a c(Na+)>c()>c()>c(OH-)=c(H+)
【详解】(1)Al3+水解生成的Al(OH)3胶体具有吸附性,离子方程式:Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水;
(2)NH4Al(SO4)2与NH4HSO4中的均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制水解,电离出H+同样抑制水解,因为电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中水解程度NH4Al(SO4)2中的小,则NH4Al(SO4)2中c( )小于NH4HSO4中的;
(3)①NH4Al(SO4)2为强酸弱碱盐,其溶液呈酸性,升高温度促进水解,导致溶液酸性增强,溶液的pH减小,故答案为:I;
②根据电荷守恒得2c()-c()-3c(Al3+)=c(H+)-c(OH-)=10-3 mol L-1-10-11mol L-1=10-3-10-11mol L-1≈0.001mol·L-1,故答案为:0.001;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3 H2O,(NH4)2SO4可以促进水的电离,而NH3 H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3 H2O三种成分,a点时c(Na+)=c(),b点时c(Na+)>c(),根据N元素与S元素的关系,可以得出c()>c(),故c(Na+)>c()>c()>c(OH-)=c(H+)。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.25℃时,将HCl气体缓慢通入0.1 mol/L的氨水中,溶液的pH、体系中粒子浓度的对数值(lgc)与反应物的物质的量之比[t=)的关系如图所示。若忽略溶液体积变化,下列有关说法错误的是
A.t=0.5时,c()>c(Cl-)
B.25℃时,的水解平衡常数Kh的数量级为10-10
C.P3所示溶液:c(Cl-)>c()> c(NH3·H2O)>c(H+)>c(OH-)
D.P2所示溶液:c(Cl-)> 100c(NH3·H2O)
2.下列离子方程式表示正确的是
A.氧化酸性废水中的:
B.氢氧化钠吸收足量二氧化硫:
C.氢氧化钠溶液吸收:
D.氟气通到溴化钠溶液中:
3.某温度下,将和体积均相同的和溶液分别加水稀释,其随加水体积的变化如图所示。下列叙述不正确的是
A.稀释前溶液的浓度:
B.溶液中水的电离程度:b点点
C.从b点到d点,溶液中逐渐增大
D.曲线Ⅱ表示的是稀释的过程
4.25℃时,向10 mL 0.01 mol·L-1的NaCN溶液中逐滴加入0.01mol·L-1的盐酸,其pH变化曲线如图甲所示,溶液中CN-、HCN浓度所占分数(δ)随pH变化的关系如图乙所示。
下列溶液中微粒的物质的量浓度关系一定正确的是
A.图甲中a点对应的溶液中:c(CN-)>c(Cl-)>c(HCN)>c(OH-)>c(H+)
B.图甲中b点对应的溶液中:c(Na+)+c(H+)=0.01mol·L-1+c(OH-)+c(CN-)
C.25℃时 ,HCN的电离常数的数量级为10-9
D.图乙中pH=7的溶液中:c(Cl-)=c(HCN)
5.已知为二元酸,其电离过程为:,。常温时,向水溶液中逐滴滴加溶液,混合溶液中、和的物质的量分数()随变化的关系如图所示。下列说法错误的是( )
A.的的数量级为
B.当溶液中时,
C.当溶液中时,加入溶液体积大于
D.向的溶液中继续滴加NaOH溶液,水的电离程度先变大后减小
6.常温下0.1 mol L-1二元酸的溶液中含A粒子的物质的量分数与pH的关系如图所示。该温度下,下列说法错误的是
A.的第一步电离方程式为
B.NaHA溶于水将抑制水的电离
C.的第二步电离常数
D.0.1 mol L-1 溶液中有 mol L-1
7.下列物质与其用途相符合的是
①—作消毒剂
②—制发酵粉
③明矾—作净水剂
④加碘食盐—预防甲状腺肿大
⑤淀粉—检验的存在
⑥—漂白纺织物
⑦钠钾合金—快中子反应堆热交换剂
A.只有②③④⑤⑥ B.只有①②③④⑤ C.只有②③④⑤⑦ D.全部
8.工业上利用加入氨水生成沉淀的方法去除酸性废水中的铅元素,体系中含铅微粒的物质的量分数d与常温pH的关系如下图[难溶于水] 下列说法正确的是
A.的氨水中:
B.向的含铅酸性废水中加入氨水,反应的离子方程式为:
C.由图可知,pH越大,除铅效果越好
D.的上述溶液中始终存在:
9.常温下,下列各组离子一定能在指定溶液中大量共存的是
A.和反应放出的溶液:
B.的溶液:
C.能使甲基橙显红色的溶液:
D.澄清透明的溶液:
10.常温下,下列各组微粒在指定溶液中一定能大量共存的是
A.的溶液中:、、、
B.由水电离产生的溶液中:、、、
C.使甲基橙变红的溶液中:、、、
D.0.1的溶液中:、、、
11.草酸(H2C2O4)存在于自然界的植物中,其在常温下的电离平衡常数。碳酸及其钠盐的溶液中、、分别在三者中所占的物质的量分数(δ)随溶液变化的关系如图所示。下列说法中不正确的是
A.时溶液中水的电离受到促进
B.在为7~9的碳酸及其钠盐的溶液中:
C.人体血液的约为7.4,则在血液中主要以的形式存在
D.向溶液中加入少量溶液,发生反应:
12.下列各仪器或装置能达到实验目的的是
A.锥形瓶中颜色由无色变粉红色,且半分钟不褪色恰好达到滴定终点 B.除去碳酸氢钠中少量的碳酸钠 C.可以用于验证铁的析氢腐蚀 D.称取
A.A B.B C.C D.D
13.已知常温时的,的,现将和体积都相同的溶液和溶液分别加蒸馏水稀释,随溶液体积的变化如图所示,下列叙述正确的是
A.曲线Ⅰ为溶液稀释时的变化曲线
B.与a点比,c点溶液中水的电离程度更大
C.取a点、b点溶液等体积混合,和水解程度均增大
D.与盐酸恰好完全反应时,消耗的物质的量:b点点
14.已知T ℃时两种弱酸的电离常数如下表(HA、A-分别代表相应的酸、酸根离子)。将pH和体积均相同的两种弱酸溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
弱酸(HA) HNO2 CH3COOH
电离平衡常数/(mol·L- 1) 5.0×10- 4 1.7×10- 5
A.曲线Ⅱ代表CH3COOH溶液
B.a点时,两溶液分别与NaOH溶液恰好中和,所需NaOH物质的量相同
C.溶液中水的电离程度:c点> b点
D.从c点到d点,溶液中持续增大
二、非选择题
15.研究电解质在水溶液中的平衡能了解它的存在形式。
I.食醋(约含的)、纯碱()和84消毒液(主要成分为)是生活中常见的化学用品,回答下列问题:
(1)醋酸()属于 电解质(填“强”“弱”或“非”),在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力,请用离子方程式表示其原因 。
(2)用离子方程式表示纯碱溶液呈碱性的原因 。
(3)将少量纯碱溶液滴入醋酸溶液中,溶液中的值变化趋势为 (填“增大”、“减小”或“不变”)。
(4)常温下,的醋酸溶液与的纯碱溶液中,水电离出的之比为 。
Ⅱ.已知时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式
电离平衡常数
(5)物质的量浓度均为的下列四种溶液:由小到大排列的顺序是 。
a. b. c. d.
(6)写出向氰化钠溶液中通入少量二氧化碳的离子方程式: 。
(7)时,将的醋酸溶液与氢氧化钠溶液等体积混合,反应后溶液恰好显中性,表示醋酸的电离平衡常数 (用含a、b的代数式表示)。
(8)标准状况下将,通入溶液中,用溶液甲微粒的浓度符号完成下列等式: 。
(9),氨水的浓度为,溶液中的 。
16.高中化学涉及的平衡理论主要包括化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,它们在工农业生产中都有广泛的应用,请回答下列问题:
(1)氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中:,其化学平衡常数K与温度t的关系如表:
t/℃ 200 300 400
K 0.5
完成下列填空:
①试比较、的大小, (填写“>”、“=”或“<”)。
②将和投到一个温度恒定、体积恒定的容器中进行上述反应,一段时间后可判断该可逆反应达到化学平衡状态的标志是 (填字母)。
A. B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变 D.的体积分数不再改变
(2)磷是重要的元素,能形成多种含氧酸和含氧酸盐。亚磷酸()的结构如图:,亚磷酸可由水解而成,溶液存在电离平衡:,,回答下列问题:
①属于 (填“正盐”或“酸式盐”)。
②已知25℃时,的溶液的电离度为,的一级电离平衡常数 (用含的计算式表示,第二步电离忽略不计,忽略水的电离)。
③常温下,将溶液滴加到亚磷酸()溶液中,混合溶液的与离子浓度变化的关系如图所示,则表示的是曲线 (填“I”或“II”),亚磷酸()的 。
17.弱电解质的研究是重要课题。
(1)①25℃时,已知不同pH条件下,水溶液中碳元素的存在形态如图所示。下列说法不正确的是 (填字母)。
a.pH=8时,溶液中含碳元素的微粒主要是HCO
b.A点溶液中H2CO3和HCO浓度相同
c.当c(HCO)=c(CO)时,c(H+)>c(OH-)
②向上述pH=8.4的水溶液中加入NaOH溶液时发生反应的离子方程式是 。
(2)H2CO3以及其他部分弱酸的电离平衡常数如表:
弱酸 H2S H2CO3 HClO
电离平衡常数(25℃) Ka1=1.1×10-7 Ka2=1.3×10-13 Ka1=4.5×10-7 Ka2=4.7×10-11 Ka=4.8×10-8
①H2S、H2CO3、HClO的酸性由强到弱的顺序为 。
②将少量CO2气体通入NaClO溶液中,写出该反应的离子方程式: 。
(3)常温下,已知0.1mol/L一元酸HCOOH(甲酸)溶液中=1×10-8。
①0.1mol/LHCOOH溶液的pH= 。
②取10mL0.1mol/L的HCOOH溶液稀释至100倍,下列有关说法正确的是 (填字母)。
A.所有离子的浓度在稀释过程中都会减小 B.稀释后溶液的pH=5
C.稀释后甲酸的电离度会增大 D.与稀释前比较,稀释后水的电离程度增大
(4)现有0.1mol L-1氨水10mL,加蒸馏水稀释到1L后,下列变化中正确的是 。
①电离程度增大 ②c(NH3 H2O)增大 ③NH数目增多 ④c(OH-)增大 ⑤导电性增强 ⑥增大 ⑦减小
A.①②③ B.①③⑤ C.①③⑥ D.②④⑥
18.是食品加工中最为快捷的食品添加剂,用于焙烤食品;在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)可作净水剂,其理由是 (用必要的化学用语和相关文字说明)。
(2)相同条件下,中 (填“等于”“大于”或“小于”)中。
(3)如图所示是电解质溶液的pH随温度变化的图像。
①其中符合的pH随温度变化的曲线是 (填Ⅰ、Ⅱ、Ⅲ、Ⅳ),导致pH随温度变化的原因是 。
②20℃时,中 。
(4)室温时,向溶液中滴加溶液,所得溶液pH与溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是 点;在b点,溶液中各离子浓度由大到小的排列顺序是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.t=0.5时,溶质为等物质的量的NH3·H2O、NH4Cl,溶液呈碱性,则c()>c(Cl-),故A正确;
B.25℃时,根据图示,c()= c(NH3·H2O)时pH=9.25,的水解平衡常数Kh= ,数量级为10-10,故B正确;
C.P3所示溶液溶质为NH4Cl,溶液呈酸性,c(Cl-)>c()>c(H+)> c(NH3·H2O) >c(OH-),故C错误;
D.c()= c(NH3·H2O)时pH=9.25,Kb=10-4.75,P2所示溶液呈中性,c(Cl-)=c(),,所以c(Cl-)> 100c(NH3·H2O),故D正确;
选C。
2.C
【详解】A.氧化酸性废水中的:,A错误;
B.氢氧化钠吸收足量二氧化硫:,B错误;
C.氢氧化钠溶液吸收:,C正确;
D.氟气通到溴化钠溶液中,氟气立即水反应,得不到溴单质,D错误;
故选C。
3.C
【详解】A.a点pH相同,醋酸是弱酸水溶液中不完全电离,盐酸是强酸水溶液中完全电离,因此,故A正确;
B.b点比c点pH小,氢离子浓度大对水电离的抑制程度大,溶液中水的电离程度:b点点,故B正确;
C.温度没改变,不变,故C错误;
D.据解析A可知醋酸浓度大,稀释时pH减小相对缓慢,曲线Ⅱ表示的是稀释的过程,故D正确;
故选C。
4.D
【详解】A.滴加盐酸时,发生反应NaCN+ HCl=HCN+NaCl,a点溶液中溶质为NaCN、HCN和NaCl,三者物质的量之比为1: 1:1,此时溶液pH大于7,则NaCN的水解程度大于HCN的电离程度,故c (HCN) >c(CN-),A错误;
B..b点时,溶液中溶质为HCN和NaCl,二者物质的量之比为1: 1,溶液体积变为20 mL,二者浓度均为0.005mol/L,电荷守恒关系式为c (Na+) +c(H+) =c(Cl-) +c (CN-) +c (OH-), c (Cl-)=0.005mol/L,B错误;
C.图乙c点pH=9.5,说明,此时,则C错误;
D.在pH=7的溶液中,由电荷守恒关系式和物料守恒关系式得c (Cl-) =c(HCN),D正确;
答案选D。
5.A
【分析】为二元酸,其电离过程为:,。常温时,向水溶液中逐滴滴加溶液,混合溶液中、和的物质的量分数()随变化的关系如图所示,分析可知,Ⅰ为含量变化曲线,Ⅱ为含量变化曲线,Ⅲ为含量变化曲线。Ⅰ和Ⅱ的交点处,氢离子浓度即为此二元酸的第一级电离常数值,Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,结合溶液中的三大守恒分析即可。
【详解】A.Ⅱ与Ⅲ交点处氢离子浓度即为此二元酸的第二级电离常数值,,可分析知其数量级为,A错误;
B.Ka1(H2A)=10-1.2时,同理Ka2(H2A)=10-4.2,当c(H2A)=c(A2-)时,,此时c(H+)=1×10-2.7mol/L,pH=2.7,B正确;
C.当溶液中时,由电荷守恒分析此时溶液呈现中性,向水溶液中逐滴滴加溶液,若加入溶液体积等于,此时形成NaHA溶液,其电离大于水解,溶液呈现酸性,故应再10mL的基础上多加,溶液才有可能呈现中性,C正确;
D.向的溶液中继续滴加NaOH溶液,结合图分析,含量再减小,含量增大,故水的电离程度再增大,而氢氧化钠溶液过量则会导致水的电离受到抑制,故水的电离程度先变大后减小,D正确;
故选A。
6.A
【分析】根据二元酸的溶液中含A粒子的物质的量分数与pH的关系图可知,溶液中不存在H2A分子,说明H2A的第一步完全电离,第二步部分电离,据此分析解答。
【详解】A.根据图像可知,溶液中不存在H2A分子,说明H2A的第一步完全电离,则H2A的第一步电离方程式为H2A=HA-+H+,A错误;
B.NaHA溶于水后只存在HA-的电离平衡,不存在水解平衡,所以电离产生的氢离子将抑制水的电离,B正确;
C. H2A的第二步电离常数Ka2=,根据图像可知,c(A2-)=c(HA-)时pH=3,Ka2=c(H+)=1.0×10-3,C正确;
D.0.1 mol L-1 溶液中存在电荷守恒,即,也存在物料守恒,即,两式联立可得 mol L-1,D正确;
故选A。
7.D
【详解】氯气具有强氧化性,可作为消毒剂,①正确;
碳酸氢钠受热易分解,故可作发酵粉,②正确;
明矾溶解后,铝离子水解生成氢氧化铝胶体,可吸附净水,③正确;
加碘食盐可补充碘元素,预防甲状腺肿大,④正确;
淀粉遇碘变蓝色,⑤正确;
次氯酸钠为漂白液有效成分且具有强氧化性,故可漂白织物,⑥正确;
钠钾合金导热效率高,即可作快中子反应堆热交换剂,⑦正确;
综上选D。
8.A
【详解】A.的氨水中:含氮微粒包括氨气分子,铵根离子、一水合氨分子,故,故A正确;
B.一水合氨是弱碱,离子方程式为,故B错误;
C.由图可知,pH大于10后,开始溶解,除铅效果变差,故C错误;
D.加入氨水生成沉淀的方法去除酸性废水中的铅元素,溶液中还有其他阳离子,因此不是一直存在该等式,故D错误;
故答案为:A。
9.D
【详解】A. 和反应放出的溶液,若呈酸性,不能含硝酸根,若呈碱性,铜和镁离子不能共存,故A不选;
B. 的溶液呈酸性时可以大量共存,呈碱性时,铵根离子不能大量共存,故B不选;
C. 能使甲基橙显红色的溶液呈酸性:之间会发生氧化还原反应,故C不选;
D. 澄清透明的溶液:四种离子间不发生反应,故D选;
故选D。
10.C
【详解】A.的溶液为强酸性溶液:、反应生成S、水、而不能大量存在,A不符合题意;
B.由水电离产生的,水的电离受到抑制,该溶液可能是酸性或碱性溶液,在碱性条件下不能大量共存,B不符合题意;
C.使甲基橙变红的溶液呈酸性,、、可以大量共存于酸性溶液中,C符合题意;
D.与发生水解,,不能大量共存,D不符合题意;
故选C。
11.D
【详解】A.时,溶液中溶质为,其中水解会促进水的电离,故A正确;
B.由图中曲线可知,时,,;时,,,在为7~9的碳酸及其钠盐的溶液中:,故B正确;
C.由图中曲线可以看出,当溶液的pH为7.4时,CO2主要以的形式存在,故C正确;
D.由于,因此向溶液中加入少量溶液,发生反应为,故D错误;
故选D。
12.A
【详解】A.图中标准溶液使用碱式滴定管盛装正确,滴定为止浓度的醋酸用酚酞做指示剂正确,终点现象正确,能达到实验目的,A正确;
B.除去碳酸氢钠中少量的碳酸钠不能用加热方法,加热固体物质不能用蒸发皿,B错误;
C.电解质溶液显酸性铁发生的是析氢腐蚀,在食盐水中铁发生的是吸氧腐蚀,C错误;
D.托盘天平的精确度为0.1g,不能准确称量46.72g的,D错误;
答案选A。
13.A
【详解】A.根据题中大小关系可得酸性弱于,所以水解程度小于,相同时的浓度大,加水稀释变化幅度小,A正确;
B.加水稀释c点溶液浓度比a点小,盐溶液浓度越小水的电离程度越小,B错误;
C.,,a、b两点溶液值相同即相同,等体积混合时、、、的浓度均减半,保持不变,所以平衡均不移动,C错误;
D.的浓度大,体积相同时消耗多,D错误;
故选A。
14.C
【分析】根据K可知,酸性HNO2> CH3COOH,加水稀释时HNO2的pH变化较大,则曲线I为CH3COOH,曲线Ⅱ为HNO2。
【详解】A.分析可知,曲线Ⅰ代表CH3COOH溶液,与题意不符,A错误;
B.a点时两者的pH相同,醋酸酸性更弱,故其浓度相同,故其体积相同时,醋酸需要的氢氧化钠的物质的量更多,B错误;
C.b、c两点溶液的pH越大,则溶液中水的电离程度越大,则水的电离程度:b点<c点,C正确;
D.从c点到d点,溶液的温度未变,= =,保持不变,D错误;
故选C。
15.(1) 弱
(2);
(3)减小
(4)或
(5)
(6)
(7)
(8)
(9)
【详解】(1)醋酸()是弱酸,属于弱电解质;由于醋酸的酸性比次氯酸的酸性强,故在84消毒液中加入少量食醋可以增强其杀菌、消毒的能力是因为反应生成HClO,反应的离子方程式为;
(2)纯碱是强碱弱酸正盐,碳酸根离子会水解,使溶液显碱性,离子方程式为,;
(3)醋酸中存在电离平衡,电离平衡常数表达式为,将少量纯碱溶液滴入醋酸溶液中,醋酸的电离平衡向右移动,增大,电离平衡常数不变,故减小;
(4)常温下,的醋酸溶液中,,所以,氢氧根全部来自与水的电离;对于的纯碱溶液中,,则,溶液中氢氧根全部来自于水的电离,故两种溶液中水电离出的之比为或;
(5)由电离平衡常数可知,酸性由强到弱的顺序为;弱酸的酸性越弱,其酸根离子的水解程度越大,溶液的碱性越强,则由小到大排列的顺序为;
(6)由电离平衡常数知,酸性,强酸能和弱酸盐生成弱酸,故离子方程式为;
(7)由于反应后恰好显中性,故,由电荷守恒可知;则;
(8)标准状况下将,通入溶液中,的物质的量为0.1mol,的物质的量为0.1mol,两种恰好完全反应生成碳酸氢钠,由质子守恒可得;
(9)氨水的电离平衡常数,若氨水的浓度为,溶液中的。
16.(1) > ACD
(2) 正盐 I 10-6.5
【详解】(1)①合成氨反应是放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,则200℃时平衡常数K1大于300℃时平衡常数K2,故答案为:>;
②A.由化学反应速率之比等于化学计量数之比可知,v正(NH3)=2v逆(N2)说明正逆反应速率相等,反应已达到平衡,故A正确;
B.由质量守恒定律可知,反应前后气体的质量相等,在恒容密闭容器中混合气体的密度始终不变,则混合气体的密度保持不变不能说明正逆反应速率相等,无法判断反应是否达到平衡,故B错误;
C.由质量守恒定律可知,反应前后气体的质量相等,合成氨反应是气体体积减小的反应,反应中混合气体的平均相对分子质量增大,则混合气体的平均相对分子质量不再改变说明正逆反应速率相等,反应已达到平衡,故C正确;
D.N2的体积分数随反应进行不断改变,当不再改变时说明正逆反应速率相等,反应已达到平衡,故D正确;故选ACD;
(2)①由电离方程式可知,H3PO3为二元弱酸,则Na2HPO3属于正盐,故答案为:正盐;②由25C时,1mol/LH3PO3溶液的电离度为α可知,在H3PO3第二步电离忽略不计,忽略水的电离的条件下,H3PO3的一级电离平衡常数Ka1== ,故答案为:;③H3PO3在溶液中分步电离,一级电离大于二级电离,一级电离常数大于二级电离常数,由电离常数公式可知溶液中=、=,则当溶液中pH相等时,>,则由图可知,表示的是曲线I,当溶液中=-1时,溶液中pH为5.5,则Ka2==10-5.5×10-1=10-6.5,故答案为:I;10-6.5。
17.(1) bc +OH =+H2O
(2) H2CO3>H2S>HClO ClO +CO2+H2O=HClO+
(3) 3 CD
(4)C
【详解】(1)①a.根据图中信息,pH═8时,溶液中含碳元素的微粒主要是,故a正确;
b.根据图中信息A点,溶液中CO2、H2CO3 的浓度和与浓度相同,故b错误;
c.当c()=c() 时,溶液显碱性,因此c(H+)<c(OH-),故c错误;
故答案为:bc;
②pH═8.4的水溶液主要是,因此向上述pH═8.4的水溶液中加入NaOH溶液时发生反应的离子方程式 +OH =+H2O;
(2)①电离常数越大说明酸性越强,根据电离常数可得酸性由强到弱的顺序为H2CO3>H2S>HClO,故答案为:H2CO3>H2S>HClO;
②根据平衡常数H2CO3>HClO>,将少量CO2气体通入NaClO溶液中反应生成碳酸氢根离子和次氯酸,该反应的离子方程式:ClO +CO2+H2O=HClO+;
(3)①0.1mol/L一元酸HCOOH(甲酸)溶液中 =1×10 8,则 =═1×10-8,c(H+)═1×10-3mol L-1,因此0.1mol/L HCOOH的pH═3;故答案为:3
②A.稀释过程中甲酸根离子浓度、氢离子浓度减少,氢氧根离子浓度增大,故A错误;
B.10mL0.1mol/L的 HCOOH溶液稀释100倍,稀释后,由于甲酸又要电离,因此氢离子浓度大于1×10-5mol L-1,因此溶液的pH小于5,故B错误;
C.稀释后,电离平衡正向移动,因此甲酸的电离度会增大,故C正确;
D.加水稀释,溶液氢离子浓度减小,抑制水的电离程度减小,因此与稀释前比较,稀释后水的电离程度增大,故D正确;
故答案为:CD;
(4)①加水稀释促进NH3 H2O电离,则NH3 H2O电离程度增大,故①正确;
②加水稀释促进NH3 H2O电离,n(NH3 H2O)减小,溶液体积增大,则c(NH3 H2O)减小,故②错误;
③加水稀释促进NH3 H2O电离,所以数目增多,故③正确;
④加水稀释促进NH3 H2O电离,但NH3 H2O电离程度小于溶液体积增大程度,导致c(OH-)减小,故④错误;
⑤加水稀释促进NH3 H2O电离,但NH3 H2O电离程度小于溶液体积增大程度,导致c(OH-)减小,离子浓度减小,则导电性减弱,故⑤错误;
⑥加水稀释过程中c(OH-)减小,温度不变,电离平衡常数不变,增大,故⑥正确;
⑦稀释过程中温度不变,电离平衡常数不变,则比值不变,故⑦错误;
故选:C。
18.(1)Al3+水解的离子方程式:Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水
(2)小于
(3) I NH4Al(SO4)2水解使溶液呈酸性,升高温度,其水解程度增大,pH减小 0.001
(4) a c(Na+)>c()>c()>c(OH-)=c(H+)
【详解】(1)Al3+水解生成的Al(OH)3胶体具有吸附性,离子方程式:Al3++3H2OAl(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水;
(2)NH4Al(SO4)2与NH4HSO4中的均发生水解,但是NH4Al(SO4)2中Al3+水解呈酸性抑制水解,电离出H+同样抑制水解,因为电离生成的H+浓度比Al3+水解生成的H+浓度大,所以NH4HSO4中水解程度NH4Al(SO4)2中的小,则NH4Al(SO4)2中c( )小于NH4HSO4中的;
(3)①NH4Al(SO4)2为强酸弱碱盐,其溶液呈酸性,升高温度促进水解,导致溶液酸性增强,溶液的pH减小,故答案为:I;
②根据电荷守恒得2c()-c()-3c(Al3+)=c(H+)-c(OH-)=10-3 mol L-1-10-11mol L-1=10-3-10-11mol L-1≈0.001mol·L-1,故答案为:0.001;
(4)a、b、c、d四个点,根据反应量的关系,a点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;b、c、d三点溶液均含有NH3 H2O,(NH4)2SO4可以促进水的电离,而NH3 H2O抑制水的电离.b点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3 H2O三种成分,a点时c(Na+)=c(),b点时c(Na+)>c(),根据N元素与S元素的关系,可以得出c()>c(),故c(Na+)>c()>c()>c(OH-)=c(H+)。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
