2024届高三化学专题-水溶液大题 (含解析)
文档属性
| 名称 | 2024届高三化学专题-水溶液大题 (含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 769.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 22:43:15 | ||
图片预览




文档简介
水溶液大题
一、填空题
1.实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α-Fe2O3.其主要实验流程如下:
将提纯后的FeSO4溶液与氨水NH4HCO3混合溶液反应,生成FeCO3沉淀。生成FeCO3沉淀的离子方程式为
2.实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图。
滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为 。
3.氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上以废铁为主要原料生产氧化铁黄的一种工艺流程如下:
氧化过程生成氧化铁黄的化学方程式是
4.以某工业铜渣(主要成分为Cu、Cu2Se、Cu2Te,还有少量Ag)为原料制备胆矾、硒、碲的一种工艺流程如下:
(1)“浆化、焙烧”后,铜渣中金属元素均转化为硫酸盐,碲元素转化为不溶于水的TeO2。Cu2Se与浓硫酸反应的化学方程式为
(2)“浸取Ⅱ”后,TeO2转化为TeCl,则“还原”过程反应的离子方程式为
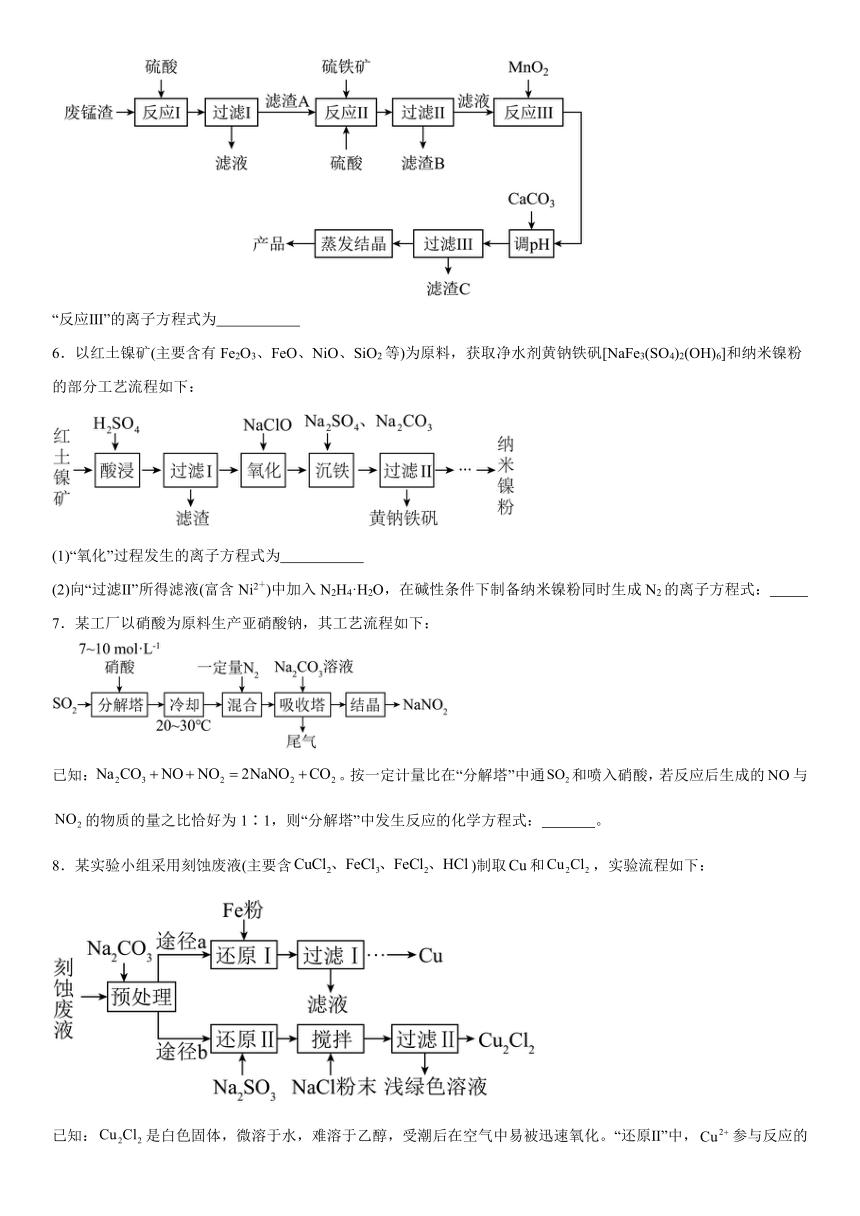
5.高锰酸钾生产过程中产生的废锰渣(主要成分为MnO2、KOH、MgO和Fe2O3)可用于制备MnSO4晶体,工艺流程如下:
“反应Ⅲ”的离子方程式为
6.以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:
(1)“氧化”过程发生的离子方程式为
(2)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在碱性条件下制备纳米镍粉同时生成N2的离子方程式:
7.某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如下:
已知:。按一定计量比在“分解塔”中通和喷入硝酸,若反应后生成的与的物质的量之比恰好为1∶1,则“分解塔”中发生反应的化学方程式: 。
8.某实验小组采用刻蚀废液(主要含)制取和,实验流程如下:
已知:是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。“还原Ⅱ”中,参与反应的离子方程式: 。
二、工业流程题
9.硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为
(2)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为
10.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl微溶于水,不溶于稀酸,可溶于Cl-浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如下:
(1)溶解步骤中Cu与NH4NO3反应的离子方程式为(N元素被还原到最低价)
(2)还原步骤发生反应的离子方程式为
11.从分金渣(主要成分为AgCl、Ag2S、PbSO4、BaSO4)中获取高纯银的流程如图所示:
已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50
(1)“预处理”时主要反应的化学方程式为
(2)“分银”时AgCl与Na2SO3反应生成Ag(SO3)的离子方程式为 ,该反应的K= 。[已知Ag++2SOAg(SO3) K′=1.0×108.68]
(3)“还原”时HCHO转化为HCOOH,其化学方程式为
12.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一、一种回收废旧磷酸亚铁锂电池正极片(主要成分为LiFePO4、炭黑和铝箔)中金属的流程如下:
(1)步骤① 中“碱溶”的化学方程式为
(2)步骤② 中反应的离子方程式为 ,若用H2O2代替HNO3,其反应的离子方程式为
(3)步骤④ 反应的离子方程式为
13.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量FeCO3、Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
已知:ZrSiO4能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+
(1)“熔融”过程中,ZrSiO4发生反应的化学方程式为
(2)滤渣Ⅲ的成分是Zr(CO3)2·nZr(OH)4.“调pH=8.0”时,所发生反应的离子方程式为
14.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图,写出“反应”步骤中生成ClO2的化学方程式 。
15.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下,回答下列问题:
(1)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O,写出此反应的离子方程式:
(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O转化为CrO,写出该反应的离子方程式
(3)写出上述流程中用SO2进行还原时发生反应的离子方程式
试卷第1页,共3页
参考答案:
1.Fe2++HCO+NH3·H2O=FeCO3↓+NH+H2O (或Fe2++HCO+NH3=FeCO3↓+NH)
【详解】将提纯后的FeSO4溶液与氨水NH4HCO3混合溶液反应生成FeCO3沉淀,生成FeCO3的化学方程式为FeSO4+NH3·H2O+NH4HCO3=FeCO3↓+(NH4)2SO4+H2O[或FeSO4+NH3+NH4HCO3=FeCO3↓+(NH4)2SO4],离子方程式为Fe2++HCO+NH3·H2O=FeCO3↓+NH+H2O(或Fe2++HCO+NH3=FeCO3↓+NH);故答案为Fe2++HCO+NH3·H2O=FeCO3↓+NH+H2O (或Fe2++HCO+NH3=FeCO3↓+NH)。
2.+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+
【详解】锌灰被稀硫酸“浸取”后,溶液中有Fe2+,KMnO4溶液氧化Fe2+生成Fe3+,自身被还原为MnO2,反应的离子方程式为MnO+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+。
3.4FeSO4+O2+8NaOH=4FeOOH↓+4Na2SO4+2H2O
【详解】过量铁与硫酸反应生成FeSO4,而空气中的O2将Fe2+氧化为FeOOH,根据质量守恒(),有Na2SO4生成,进一步推出NaOH参加反应,根据电子得失守恒配平后可知,生成物还有水。据此可写出:4FeSO4+O2+8NaOH=4FeOOH↓+4Na2SO4+2H2O。
故答案为:4FeSO4+O2+8NaOH=4FeOOH↓+4Na2SO4+2H2O。
4.(1)Cu2Se+6H2SO4(浓)2CuSO4+SeO2↑+4SO2↑+6H2O
(2)TeCl+2SO2+4H2O=Te+2SO+6Cl-+8H+
【详解】(1)根据题意,“浆化、焙烧”过程中生成物有SeO2,CuSO4,SO2,而硫酸中的H元素转化为水,反应为:Cu2Se+6H2SO4(浓)2CuSO4+SeO2↑+4SO2↑+6H2O。
故答案为:Cu2Se+6H2SO4(浓)2CuSO4+SeO2↑+4SO2↑+6H2O。
(2)“还原”时,SO2将TeCl还原为Te,本身氧化成SO,结合三大守恒(质量守恒,电子得失守恒及电荷守恒)可得反应:TeCl+2SO2+4H2O=Te+2SO+6Cl-+8H+。
故答案为:TeCl+2SO2+4H2O=Te+2SO+6Cl-+8H+。
5.2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
【分析】废锰渣主要成分为MnO2、KOH、MgO和Fe2O3,KOH、MgO和Fe2O3与硫酸反应生成硫酸钾、硫酸镁、硫酸铁,MnO2和硫酸不反应,加硫酸溶解、过滤,废渣A是MnO2,MnO2、过量FeS2在酸性条件下反应得到MnSO4、S、FeSO4,滤液中的Fe2+被加入的MnO2氧化为Fe3+,加碳酸钙调pH生成氢氧化铁沉淀除去Fe3+。
【详解】“反应Ⅲ”是溶液中的Fe2+被加入的MnO2氧化为Fe3+,MnO2被还原为Mn2+,根据得失电子守恒、电荷守恒,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
6.(1)2H++2Fe2++ClO-=2Fe3++Cl-+H2O
(2)N2H4·H2O+2Ni2++4OH-=2Ni↓+N2↑+5H2O
【详解】(1)FeO被酸溶解生成Fe2+,用NaClO氧化Fe2+,前面加入了H2SO4,故为酸性条件下,ClO-将Fe2+氧化生成Fe3+,ClO-自身被还原为Cl-,根据Cl和Fe得失电子守恒配平反应,用H+平衡电荷。故离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O。N2H4·H2O+2Ni2++4OH-=2Ni↓+N2↑+5H2O。
(2)Ni2+氧化N2H4·H2O,生成N2,自身被还原为Ni,根据N和Ni得失电子守恒配平反应,用OH-平衡电荷。故离子方程式为N2H4·H2O+2Ni2++4OH-=2Ni↓+N2↑+5H2O。
7.
【详解】“分解塔”中通和喷入硝酸,若反应后生成的与的物质的量之比恰好为1∶1,同时生成1molNO和1molNO2硝酸需得4mol电子,1mol二氧化硫被氧化呈硫酸时失2mol电子,根据得失电子守恒及元素守恒得反应方程式:,故答案为:;
8.
【详解】将Cu2+还原为Cu+,Cu+与C1-结合生成Cu2C12沉淀,反应的离子方程式为。
9.(1)NH4HCO3+NH3=(NH4)2CO3
(2)2Mg2++3CO+2H2O=Mg(OH)2·MgCO3↓+2HCO[或2Mg2++2CO+H2O=Mg(OH)2·MgCO3↓+CO2↑]
【分析】硼镁矿(含Mg2B2O3 H2O、SiO2及少量Fe2O3、Al2O3)加入硫酸铵溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3,调节溶液pH=3.5时得到H3BO3,滤液中含有MgSO4,沉镁过程发生的反应为2Mg2++3CO+2H2O=Mg(OH)2 MgCO3↓+2HCO,加热分解可以得到轻质MgO;母液中含有(NH4)2SO4,以此解答。
【详解】(1)氨气为碱性气体,能和酸式铵盐吸收生成正盐,反应方程式为NH4HCO3+NH3=(NH4)2CO3。
(2)在“沉镁”中镁离子和碳酸根离子发生水解和复分解反应生成Mg(OH)2·MgCO3沉淀,同时还生成碳酸氢根离子离子,离子方程式为2Mg2++3CO+2H2O=Mg(OH)2·MgCO3↓+2HCO[或2Mg2++2CO+H2O=Mg(OH)2·MgCO3↓+CO2↑]。
10.(1)4Cu+ 10H++NO=4Cu2++NH+3H2O
(2)2Cu2++SO+2Cl-+H2O=2CuCl↓+SO+2H+
【分析】海绵铜(主要成分是Cu和少量CuO)加入到NH4NO3、H2O和H2SO4溶解,酸性环境下硝酸根将铜单质氧化,所以得到的溶液中Cu元素的存在形式为Cu2+;之后加入氯化铵和亚硫酸铵溶液将Cu2+还原成Cu+,得到CuCl沉淀,过滤后得到的滤液主要含硫酸铵和硫酸,沉淀经酸液洗涤后经系列处理得到CuCl。
【详解】(1)“溶解” 过程中,硝酸铵中的硝酸根离子与硫酸电离出的氢离子构成硝酸,将铜氧化,离子方程式是:4Cu+ 10H++NO=4Cu2++NH+3H2O。
(2)还原过程中将Cu2+还原成Cu+,然后Cu+与Clˉ结合生成CuCl沉淀,离子方程式为2Cu2++SO+2Cl-+H2O=2CuCl↓+SO+2H+。
11.(1)2FeCl3+Ag2S=2FeCl2+S+2AgCl
(2) AgCl+2SOAg(SO3)+Cl- 1.8×10-1.32
(3)2AgCl+HCHO+H2O=2Ag+HCOOH+2HCl
【分析】分金渣中加入氯化铁进行“预处理”,氯化铁具有氧化性,能与硫化银发生氧化还原反应生成氯化亚铁、单质硫、AgCl;“分银”时,加入亚硫酸钠,AgCl与Na2SO3反应生成Ag(SO3),而PbSO4、BaSO4及“预处理”时生成的单质S不溶于水,则分银渣为PbSO4、BaSO4、单质S;“沉银”时加入盐酸,使Ag(SO3)生成氯化银沉淀;“还原”时氯化银与甲醛反应生成甲酸、单质银和氯化氢;据此分析解题。
【详解】(1)分金渣中加入氯化铁进行“预处理”,氯化铁具有氧化性,能与硫化银发生氧化还原反应生成氯化亚铁、单质硫、AgCl;“预处理”时主要反应的化学方程式为2FeCl3+Ag2S=2FeCl2+S+2AgCl;故答案为2FeCl3+Ag2S=2FeCl2+S+2AgCl。
(2)“分银”时AgCl与Na2SO3反应生成Ag(SO3)和氯离子,离子方程式为AgCl+2SOAg(SO3)+Cl-;则=K′×Ksp(AgCl)=1.0×108.68×1.8×10-10=1.8×10-1.32。故答案为AgCl+2SOAg(SO3)+Cl-;1.8×10-1.32。
(3)“还原”时氯化银与甲醛反应生成甲酸、单质银和氯化氢,化学方程式为2AgCl+HCHO+H2O=2Ag+HCOOH+2HCl;故答案为2AgCl+HCHO+H2O=2Ag+HCOOH+2HCl。
12.(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2) 3LiFePO4+NO+13H+=3Li++3Fe3++3H3PO4+NO↑+2H2O 2LiFePO4+H2O2+8H+=2Li++2Fe3++2H3PO4+2H2O
(3)2Li++CO=Li2CO3↓
【分析】步骤①中“碱溶”反应的化学方程式为2Al+2NaOH+2H2O=3H2↑+2NaAlO2,过滤分离出铝元素,步骤②滤渣中加入氧化性酸硝酸,将亚铁离子氧化为铁离子,强酸制弱酸有磷酸生成,产物为Li+、Fe3+、H3PO4、NO,加入碱液,铁离子生成Fe(OH)3沉淀,过滤分离出铁元素,滤液中加入碳酸钠,生成碳酸锂沉淀。
【详解】(1)步骤①中“碱溶”时铝与碱液发生反应生成NaAlO2:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)根据流程图知,步骤②中磷酸亚铁锂与HNO3、H2SO4发生氧化还原反应,HNO3氧化+2价的铁:3LiFePO4+NO+13H+=3Li++3Fe3++3H3PO4+NO↑+2H2O;若用H2O2代替HNO3,由于双氧水的还原产物是水,因此其优点是不产生氮氧化物大气污染物:2LiFePO4+H2O2+8H+=2Li++2Fe3++2H3PO4+2H2O;
(3)步骤④ 反应的离子方程式为2Li++CO=Li2CO3↓。
13.(1)ZrSiO4+4NaOHNa2SiO3+Na2ZrO3+2H2O
(2)(n+1)ZrO2++2nCO+(3n-1)H2O=Zr(CO3)2·nZr(OH)4↓+(2n-2)HCO
【分析】根据分析,氢氧化钠与氧化铝反应生成偏铝酸钠,与二氧化硅反应生成硅酸钠,ZrSiO4能与烧碱反应生成可溶于水的Na2ZrO3,加入过量盐酸后得到亚铁离子、铁离子、铝离子、Na2ZrO3与酸反应生成ZrO2+,加入双氧水后亚铁离子转化为铁离子,与氨水结合后得到氢氧化铝、氢氧化铁沉淀,调pH=8.0时,反应生成Zr(CO3)2·nZr(OH)4,Zr元素的化合价不变,根据原子守恒配平所发生反应的离子方程式,则得到Zr(CO3)2·nZr(OH)4,以此分析;
【详解】(1)ZrSiO4与烧碱反应生成Na2ZrO3,Zr元素的化合价均为+4,发生非氧化还原反应,另外生成产物为Na2SiO3;
故答案为:;
(2)“调pH=8.0”时,反应生成Zr(CO3)2·nZr(OH)4,Zr元素的化合价不变,根据原子守恒配平所发生反应的离子方程式;
故答案为:。
14.2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4
【分析】根据反应流程可知,氯酸钠与硫酸、二氧化硫反应生成硫酸氢钠和二氧化氯。
【详解】NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO3是氧化剂,还原产物为ClO2,SO2为还原剂,氧化产物为NaHSO4,根据得失电子守恒和原子守恒,此反应的化学方程式为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。
15.(1)2Cr3++3H2O2+H2O=Cr2O+8H+
(2)Cr2O+2OH-=2CrO+H2O
(3)2CrO+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO+2OH-
【分析】向含铬污泥中加入稀硫酸和水并调节溶液pH=1,浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,过滤,向滤液中加入双氧水,Cr3+被氧化生成Cr2O,再向溶液中加入NaOH溶液并调节溶液的pH=8,溶液中Fe3+、Al3+生成沉淀,且溶液中Cr2O转化为CrO,然后过滤,向滤液中加入钠离子交换树脂,除去Ca2+和Mg2+,最后向溶液中通入二氧化硫,还原得到Cr(OH)(H2O)5SO4,据此分析解题。
【详解】(1)H2O2具有氧化性,将Cr3+氧化成Cr2O,反应的离子方程式为2Cr3++3H2O2+H2O=Cr2O+8H+;故答案为2Cr3++3H2O2+H2O=Cr2O+8H+。
(2)Cr2O与CrO在碱性条件下的转化反应为Cr2O+2OH-=2CrO+H2O;故答案为Cr2O+2OH-=2CrO+H2O。
(3)SO2进行框图中的还原反应时,将溶液中的CrO转化成Cr(OH)(H2O)5SO4,反应的离子方程式为2CrO+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO+2OH-。故答案为2CrO+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO+2OH-
一、填空题
1.实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α-Fe2O3.其主要实验流程如下:
将提纯后的FeSO4溶液与氨水NH4HCO3混合溶液反应,生成FeCO3沉淀。生成FeCO3沉淀的离子方程式为
2.实验室以锌灰(含ZnO、PbO、CuO、FeO、Fe2O3、SiO2等)为原料制备Zn3(PO4)2·4H2O的流程如图。
滴加KMnO4溶液后有MnO2生成,该反应的离子方程式为 。
3.氧化铁黄(化学式为FeOOH)是一种黄色颜料,工业上以废铁为主要原料生产氧化铁黄的一种工艺流程如下:
氧化过程生成氧化铁黄的化学方程式是
4.以某工业铜渣(主要成分为Cu、Cu2Se、Cu2Te,还有少量Ag)为原料制备胆矾、硒、碲的一种工艺流程如下:
(1)“浆化、焙烧”后,铜渣中金属元素均转化为硫酸盐,碲元素转化为不溶于水的TeO2。Cu2Se与浓硫酸反应的化学方程式为
(2)“浸取Ⅱ”后,TeO2转化为TeCl,则“还原”过程反应的离子方程式为
5.高锰酸钾生产过程中产生的废锰渣(主要成分为MnO2、KOH、MgO和Fe2O3)可用于制备MnSO4晶体,工艺流程如下:
“反应Ⅲ”的离子方程式为
6.以红土镍矿(主要含有Fe2O3、FeO、NiO、SiO2等)为原料,获取净水剂黄钠铁矾[NaFe3(SO4)2(OH)6]和纳米镍粉的部分工艺流程如下:
(1)“氧化”过程发生的离子方程式为
(2)向“过滤Ⅱ”所得滤液(富含Ni2+)中加入N2H4·H2O,在碱性条件下制备纳米镍粉同时生成N2的离子方程式:
7.某工厂以硝酸为原料生产亚硝酸钠,其工艺流程如下:
已知:。按一定计量比在“分解塔”中通和喷入硝酸,若反应后生成的与的物质的量之比恰好为1∶1,则“分解塔”中发生反应的化学方程式: 。
8.某实验小组采用刻蚀废液(主要含)制取和,实验流程如下:
已知:是白色固体,微溶于水,难溶于乙醇,受潮后在空气中易被迅速氧化。“还原Ⅱ”中,参与反应的离子方程式: 。
二、工业流程题
9.硼酸(H3BO3)是一种重要的化工原料,广泛应用于玻璃、医药、肥料等工业。一种以硼镁矿(含Mg2B2O5·H2O、SiO2及少量Fe2O3、Al2O3)为原料生产硼酸及轻质氧化镁的工艺流程如下:
回答下列问题:
(1)在95 ℃“溶浸”硼镁矿粉,产生的气体在“吸收”中反应的化学方程式为
(2)在“沉镁”中生成Mg(OH)2·MgCO3沉淀的离子方程式为
10.氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl微溶于水,不溶于稀酸,可溶于Cl-浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺流程如下:
(1)溶解步骤中Cu与NH4NO3反应的离子方程式为(N元素被还原到最低价)
(2)还原步骤发生反应的离子方程式为
11.从分金渣(主要成分为AgCl、Ag2S、PbSO4、BaSO4)中获取高纯银的流程如图所示:
已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50
(1)“预处理”时主要反应的化学方程式为
(2)“分银”时AgCl与Na2SO3反应生成Ag(SO3)的离子方程式为 ,该反应的K= 。[已知Ag++2SOAg(SO3) K′=1.0×108.68]
(3)“还原”时HCHO转化为HCOOH,其化学方程式为
12.磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一、一种回收废旧磷酸亚铁锂电池正极片(主要成分为LiFePO4、炭黑和铝箔)中金属的流程如下:
(1)步骤① 中“碱溶”的化学方程式为
(2)步骤② 中反应的离子方程式为 ,若用H2O2代替HNO3,其反应的离子方程式为
(3)步骤④ 反应的离子方程式为
13.ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含少量FeCO3、Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取:
已知:ZrSiO4能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+
(1)“熔融”过程中,ZrSiO4发生反应的化学方程式为
(2)滤渣Ⅲ的成分是Zr(CO3)2·nZr(OH)4.“调pH=8.0”时,所发生反应的离子方程式为
14.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图,写出“反应”步骤中生成ClO2的化学方程式 。
15.利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下,回答下列问题:
(1)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O,写出此反应的离子方程式:
(2)加入NaOH溶液使溶液呈碱性,既可以除去某些杂质离子,同时又可以将Cr2O转化为CrO,写出该反应的离子方程式
(3)写出上述流程中用SO2进行还原时发生反应的离子方程式
试卷第1页,共3页
参考答案:
1.Fe2++HCO+NH3·H2O=FeCO3↓+NH+H2O (或Fe2++HCO+NH3=FeCO3↓+NH)
【详解】将提纯后的FeSO4溶液与氨水NH4HCO3混合溶液反应生成FeCO3沉淀,生成FeCO3的化学方程式为FeSO4+NH3·H2O+NH4HCO3=FeCO3↓+(NH4)2SO4+H2O[或FeSO4+NH3+NH4HCO3=FeCO3↓+(NH4)2SO4],离子方程式为Fe2++HCO+NH3·H2O=FeCO3↓+NH+H2O(或Fe2++HCO+NH3=FeCO3↓+NH);故答案为Fe2++HCO+NH3·H2O=FeCO3↓+NH+H2O (或Fe2++HCO+NH3=FeCO3↓+NH)。
2.+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+
【详解】锌灰被稀硫酸“浸取”后,溶液中有Fe2+,KMnO4溶液氧化Fe2+生成Fe3+,自身被还原为MnO2,反应的离子方程式为MnO+3Fe2++7H2O=MnO2↓+3Fe(OH)3↓+5H+。
3.4FeSO4+O2+8NaOH=4FeOOH↓+4Na2SO4+2H2O
【详解】过量铁与硫酸反应生成FeSO4,而空气中的O2将Fe2+氧化为FeOOH,根据质量守恒(),有Na2SO4生成,进一步推出NaOH参加反应,根据电子得失守恒配平后可知,生成物还有水。据此可写出:4FeSO4+O2+8NaOH=4FeOOH↓+4Na2SO4+2H2O。
故答案为:4FeSO4+O2+8NaOH=4FeOOH↓+4Na2SO4+2H2O。
4.(1)Cu2Se+6H2SO4(浓)2CuSO4+SeO2↑+4SO2↑+6H2O
(2)TeCl+2SO2+4H2O=Te+2SO+6Cl-+8H+
【详解】(1)根据题意,“浆化、焙烧”过程中生成物有SeO2,CuSO4,SO2,而硫酸中的H元素转化为水,反应为:Cu2Se+6H2SO4(浓)2CuSO4+SeO2↑+4SO2↑+6H2O。
故答案为:Cu2Se+6H2SO4(浓)2CuSO4+SeO2↑+4SO2↑+6H2O。
(2)“还原”时,SO2将TeCl还原为Te,本身氧化成SO,结合三大守恒(质量守恒,电子得失守恒及电荷守恒)可得反应:TeCl+2SO2+4H2O=Te+2SO+6Cl-+8H+。
故答案为:TeCl+2SO2+4H2O=Te+2SO+6Cl-+8H+。
5.2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O
【分析】废锰渣主要成分为MnO2、KOH、MgO和Fe2O3,KOH、MgO和Fe2O3与硫酸反应生成硫酸钾、硫酸镁、硫酸铁,MnO2和硫酸不反应,加硫酸溶解、过滤,废渣A是MnO2,MnO2、过量FeS2在酸性条件下反应得到MnSO4、S、FeSO4,滤液中的Fe2+被加入的MnO2氧化为Fe3+,加碳酸钙调pH生成氢氧化铁沉淀除去Fe3+。
【详解】“反应Ⅲ”是溶液中的Fe2+被加入的MnO2氧化为Fe3+,MnO2被还原为Mn2+,根据得失电子守恒、电荷守恒,反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。
6.(1)2H++2Fe2++ClO-=2Fe3++Cl-+H2O
(2)N2H4·H2O+2Ni2++4OH-=2Ni↓+N2↑+5H2O
【详解】(1)FeO被酸溶解生成Fe2+,用NaClO氧化Fe2+,前面加入了H2SO4,故为酸性条件下,ClO-将Fe2+氧化生成Fe3+,ClO-自身被还原为Cl-,根据Cl和Fe得失电子守恒配平反应,用H+平衡电荷。故离子方程式为2H++2Fe2++ClO-=2Fe3++Cl-+H2O。N2H4·H2O+2Ni2++4OH-=2Ni↓+N2↑+5H2O。
(2)Ni2+氧化N2H4·H2O,生成N2,自身被还原为Ni,根据N和Ni得失电子守恒配平反应,用OH-平衡电荷。故离子方程式为N2H4·H2O+2Ni2++4OH-=2Ni↓+N2↑+5H2O。
7.
【详解】“分解塔”中通和喷入硝酸,若反应后生成的与的物质的量之比恰好为1∶1,同时生成1molNO和1molNO2硝酸需得4mol电子,1mol二氧化硫被氧化呈硫酸时失2mol电子,根据得失电子守恒及元素守恒得反应方程式:,故答案为:;
8.
【详解】将Cu2+还原为Cu+,Cu+与C1-结合生成Cu2C12沉淀,反应的离子方程式为。
9.(1)NH4HCO3+NH3=(NH4)2CO3
(2)2Mg2++3CO+2H2O=Mg(OH)2·MgCO3↓+2HCO[或2Mg2++2CO+H2O=Mg(OH)2·MgCO3↓+CO2↑]
【分析】硼镁矿(含Mg2B2O3 H2O、SiO2及少量Fe2O3、Al2O3)加入硫酸铵溶液,得到气体,根据硼镁矿和硫酸铵化学式知,得到的气体为NH3,用NH4HCO3吸收NH3,发生反应NH3+NH4HCO3=(NH4)2CO3,根据过滤2及沉镁成分知,过滤1中得到的滤渣为难溶性的SiO2、Fe2O3、Al2O3,调节溶液pH=3.5时得到H3BO3,滤液中含有MgSO4,沉镁过程发生的反应为2Mg2++3CO+2H2O=Mg(OH)2 MgCO3↓+2HCO,加热分解可以得到轻质MgO;母液中含有(NH4)2SO4,以此解答。
【详解】(1)氨气为碱性气体,能和酸式铵盐吸收生成正盐,反应方程式为NH4HCO3+NH3=(NH4)2CO3。
(2)在“沉镁”中镁离子和碳酸根离子发生水解和复分解反应生成Mg(OH)2·MgCO3沉淀,同时还生成碳酸氢根离子离子,离子方程式为2Mg2++3CO+2H2O=Mg(OH)2·MgCO3↓+2HCO[或2Mg2++2CO+H2O=Mg(OH)2·MgCO3↓+CO2↑]。
10.(1)4Cu+ 10H++NO=4Cu2++NH+3H2O
(2)2Cu2++SO+2Cl-+H2O=2CuCl↓+SO+2H+
【分析】海绵铜(主要成分是Cu和少量CuO)加入到NH4NO3、H2O和H2SO4溶解,酸性环境下硝酸根将铜单质氧化,所以得到的溶液中Cu元素的存在形式为Cu2+;之后加入氯化铵和亚硫酸铵溶液将Cu2+还原成Cu+,得到CuCl沉淀,过滤后得到的滤液主要含硫酸铵和硫酸,沉淀经酸液洗涤后经系列处理得到CuCl。
【详解】(1)“溶解” 过程中,硝酸铵中的硝酸根离子与硫酸电离出的氢离子构成硝酸,将铜氧化,离子方程式是:4Cu+ 10H++NO=4Cu2++NH+3H2O。
(2)还原过程中将Cu2+还原成Cu+,然后Cu+与Clˉ结合生成CuCl沉淀,离子方程式为2Cu2++SO+2Cl-+H2O=2CuCl↓+SO+2H+。
11.(1)2FeCl3+Ag2S=2FeCl2+S+2AgCl
(2) AgCl+2SOAg(SO3)+Cl- 1.8×10-1.32
(3)2AgCl+HCHO+H2O=2Ag+HCOOH+2HCl
【分析】分金渣中加入氯化铁进行“预处理”,氯化铁具有氧化性,能与硫化银发生氧化还原反应生成氯化亚铁、单质硫、AgCl;“分银”时,加入亚硫酸钠,AgCl与Na2SO3反应生成Ag(SO3),而PbSO4、BaSO4及“预处理”时生成的单质S不溶于水,则分银渣为PbSO4、BaSO4、单质S;“沉银”时加入盐酸,使Ag(SO3)生成氯化银沉淀;“还原”时氯化银与甲醛反应生成甲酸、单质银和氯化氢;据此分析解题。
【详解】(1)分金渣中加入氯化铁进行“预处理”,氯化铁具有氧化性,能与硫化银发生氧化还原反应生成氯化亚铁、单质硫、AgCl;“预处理”时主要反应的化学方程式为2FeCl3+Ag2S=2FeCl2+S+2AgCl;故答案为2FeCl3+Ag2S=2FeCl2+S+2AgCl。
(2)“分银”时AgCl与Na2SO3反应生成Ag(SO3)和氯离子,离子方程式为AgCl+2SOAg(SO3)+Cl-;则=K′×Ksp(AgCl)=1.0×108.68×1.8×10-10=1.8×10-1.32。故答案为AgCl+2SOAg(SO3)+Cl-;1.8×10-1.32。
(3)“还原”时氯化银与甲醛反应生成甲酸、单质银和氯化氢,化学方程式为2AgCl+HCHO+H2O=2Ag+HCOOH+2HCl;故答案为2AgCl+HCHO+H2O=2Ag+HCOOH+2HCl。
12.(1)2Al+2NaOH+2H2O=2NaAlO2+3H2↑
(2) 3LiFePO4+NO+13H+=3Li++3Fe3++3H3PO4+NO↑+2H2O 2LiFePO4+H2O2+8H+=2Li++2Fe3++2H3PO4+2H2O
(3)2Li++CO=Li2CO3↓
【分析】步骤①中“碱溶”反应的化学方程式为2Al+2NaOH+2H2O=3H2↑+2NaAlO2,过滤分离出铝元素,步骤②滤渣中加入氧化性酸硝酸,将亚铁离子氧化为铁离子,强酸制弱酸有磷酸生成,产物为Li+、Fe3+、H3PO4、NO,加入碱液,铁离子生成Fe(OH)3沉淀,过滤分离出铁元素,滤液中加入碳酸钠,生成碳酸锂沉淀。
【详解】(1)步骤①中“碱溶”时铝与碱液发生反应生成NaAlO2:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(2)根据流程图知,步骤②中磷酸亚铁锂与HNO3、H2SO4发生氧化还原反应,HNO3氧化+2价的铁:3LiFePO4+NO+13H+=3Li++3Fe3++3H3PO4+NO↑+2H2O;若用H2O2代替HNO3,由于双氧水的还原产物是水,因此其优点是不产生氮氧化物大气污染物:2LiFePO4+H2O2+8H+=2Li++2Fe3++2H3PO4+2H2O;
(3)步骤④ 反应的离子方程式为2Li++CO=Li2CO3↓。
13.(1)ZrSiO4+4NaOHNa2SiO3+Na2ZrO3+2H2O
(2)(n+1)ZrO2++2nCO+(3n-1)H2O=Zr(CO3)2·nZr(OH)4↓+(2n-2)HCO
【分析】根据分析,氢氧化钠与氧化铝反应生成偏铝酸钠,与二氧化硅反应生成硅酸钠,ZrSiO4能与烧碱反应生成可溶于水的Na2ZrO3,加入过量盐酸后得到亚铁离子、铁离子、铝离子、Na2ZrO3与酸反应生成ZrO2+,加入双氧水后亚铁离子转化为铁离子,与氨水结合后得到氢氧化铝、氢氧化铁沉淀,调pH=8.0时,反应生成Zr(CO3)2·nZr(OH)4,Zr元素的化合价不变,根据原子守恒配平所发生反应的离子方程式,则得到Zr(CO3)2·nZr(OH)4,以此分析;
【详解】(1)ZrSiO4与烧碱反应生成Na2ZrO3,Zr元素的化合价均为+4,发生非氧化还原反应,另外生成产物为Na2SiO3;
故答案为:;
(2)“调pH=8.0”时,反应生成Zr(CO3)2·nZr(OH)4,Zr元素的化合价不变,根据原子守恒配平所发生反应的离子方程式;
故答案为:。
14.2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4
【分析】根据反应流程可知,氯酸钠与硫酸、二氧化硫反应生成硫酸氢钠和二氧化氯。
【详解】NaClO3和SO2在H2SO4酸化条件下生成ClO2,其中NaClO3是氧化剂,还原产物为ClO2,SO2为还原剂,氧化产物为NaHSO4,根据得失电子守恒和原子守恒,此反应的化学方程式为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。
15.(1)2Cr3++3H2O2+H2O=Cr2O+8H+
(2)Cr2O+2OH-=2CrO+H2O
(3)2CrO+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO+2OH-
【分析】向含铬污泥中加入稀硫酸和水并调节溶液pH=1,浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,过滤,向滤液中加入双氧水,Cr3+被氧化生成Cr2O,再向溶液中加入NaOH溶液并调节溶液的pH=8,溶液中Fe3+、Al3+生成沉淀,且溶液中Cr2O转化为CrO,然后过滤,向滤液中加入钠离子交换树脂,除去Ca2+和Mg2+,最后向溶液中通入二氧化硫,还原得到Cr(OH)(H2O)5SO4,据此分析解题。
【详解】(1)H2O2具有氧化性,将Cr3+氧化成Cr2O,反应的离子方程式为2Cr3++3H2O2+H2O=Cr2O+8H+;故答案为2Cr3++3H2O2+H2O=Cr2O+8H+。
(2)Cr2O与CrO在碱性条件下的转化反应为Cr2O+2OH-=2CrO+H2O;故答案为Cr2O+2OH-=2CrO+H2O。
(3)SO2进行框图中的还原反应时,将溶液中的CrO转化成Cr(OH)(H2O)5SO4,反应的离子方程式为2CrO+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO+2OH-。故答案为2CrO+3SO2+12H2O=2Cr(OH)(H2O)5SO4↓+SO+2OH-
同课章节目录
