6.4 珍惜和保护金属资源同步练习(无答案)-2022-2023学年九年级化学科粤版(2012)下册
文档属性
| 名称 | 6.4 珍惜和保护金属资源同步练习(无答案)-2022-2023学年九年级化学科粤版(2012)下册 |  | |
| 格式 | docx | ||
| 文件大小 | 153.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-28 23:04:57 | ||
图片预览


文档简介
科粤版(2012)九年级下册6.4 珍惜和保护金属资源
一、选择题
1. 下列变化属于物理变化的是
A.铁丝燃烧 B.铁丝生锈 C.铁丝弯曲 D.铁的冶炼
2. 垃圾分类是一种新时尚。废旧铁锅应投入的垃圾箱是
A.其他垃圾 B.可回收物
C.有害垃圾 D.厨余垃圾
3. 下列变化属于物理变化的是
A.燃放烟花 B.剪贴窗花 C.食物腐烂 D.钢铁生锈
4. 下列变化属于物理变化的是
A.钢铁生锈 B.食物变质 C.纸张燃烧 D.矿石粉碎
5. 厨房里发生的下列变化中,属于物理变化的是
A.燃气燃烧 B.面包发霉 C.瓷碗破裂 D.菜刀生锈
6. 下列情况下,铁钉腐蚀最慢的是
A.放在潮湿的空气中 B.部分浸入稀的食盐溶液中
C.埋在干燥、致密、不透气的土壤中 D.埋在潮湿、疏松、透气的酸性土壤中
7. 推理是化学学习中常用的思维方法。下列推理正确的是
A.将黄铜片和铜片相互刻画,铜片上有划痕,说明合金的硬度一般比各成分金属小
B.“真金不怕火炼”,说明金的熔点高
C.金属铝比金属铁更耐腐蚀,说明铁比铝活动性强
D.铁钉在潮湿的空气中生锈,不能说明是水还是氧气还是二者共同作用的结果
8. 痰盂等铁制品表面烧制搪瓷的目的是
A.增大硬度防止撞坏 B.增大厚度防止磨损
C.防止铁生锈且美观 D.美观和杀菌消毒作用
9. 用下列装置进行实验,下列有关实验的说法错误的是
A.甲实验,加热时蘸酒精的棉花燃烧了,蘸水的棉花没有燃烧,证明燃烧需要可燃物
B.甲实验,加热较长时间后蘸水的棉花燃烧了,因为水蒸发后温度达到棉花的着火点
C.乙实验,①中的铁钉生锈了,②中铁钉没有生锈;证明铁和水、氧气反应而锈蚀
D.丙实验,烧杯中的蜡烛熄灭了,证明二氧化碳的密度比空气密度大且不支持燃烧
10. 下列实验设计不能达到实验目的的是
A.探究分子在不断运动
B.探究铁生锈的条件
C.验证NaOH溶液能吸收CO2
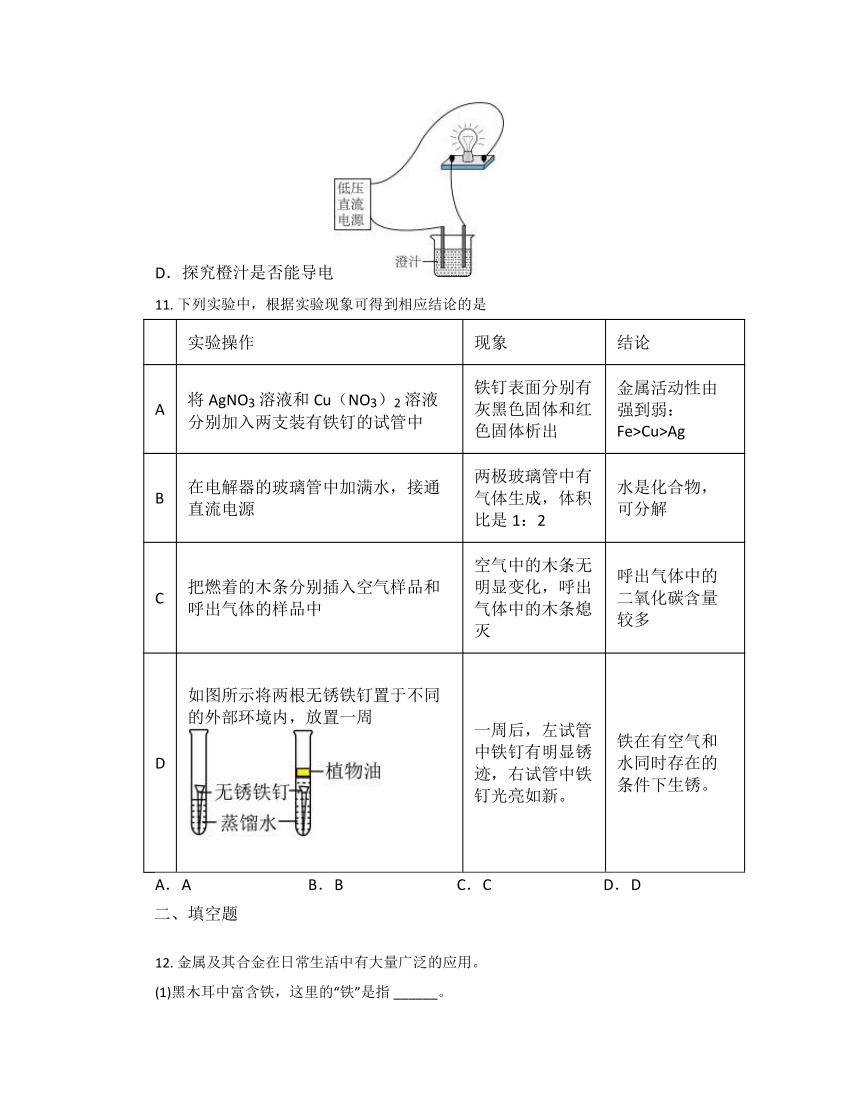
D.探究橙汁是否能导电
11. 下列实验中,根据实验现象可得到相应结论的是
实验操作 现象 结论
A 将AgNO3溶液和Cu(NO3)2溶液分别加入两支装有铁钉的试管中 铁钉表面分别有灰黑色固体和红色固体析出 金属活动性由强到弱:Fe>Cu>Ag
B 在电解器的玻璃管中加满水,接通直流电源 两极玻璃管中有气体生成,体积比是1:2 水是化合物,可分解
C 把燃着的木条分别插入空气样品和呼出气体的样品中 空气中的木条无明显变化,呼出气体中的木条熄灭 呼出气体中的二氧化碳含量较多
D 如图所示将两根无锈铁钉置于不同的外部环境内,放置一周
一周后,左试管中铁钉有明显锈迹,右试管中铁钉光亮如新。 铁在有空气和水同时存在的条件下生锈。
A.A B.B C.C D.D
二、填空题
12. 金属及其合金在日常生活中有大量广泛的应用。
(1)黑木耳中富含铁,这里的“铁”是指 ______。
(2)日常生活中钢铁容易生锈,铁生锈是因为铁与 ______(填化学式)接触而导致。
(3)铝具有很好的抗腐蚀性能,原因是(用化学方程式表示) ______。
13. 金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。
(1)2022年11月20日,卡塔尔世界杯开幕,来自世界各国的足球劲旅在绿茵场上角逐今年的“大力神杯”。“大力神杯”由18K金铸造,金可制成金箔,拉成金丝,说明金具有良好______性。
(2)《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质)。这句话说明铜锡合金比组成它的纯金属硬度______(选填“大”或“小”)。
(3)工业中,用高炉炼铁的主要反应原理是用一氧化碳还原氧化铁,反应的化学方程式为______。
(4)如图是用三根洁净无锈的铁钉探究铁生锈条件的实验。
①由实验A.c可得出的结论是铁钉锈蚀的条件之一是需要与______接触。
②铁锈的主要成分是Fe2O3·xH2O,下列措施中,能防止钢铁生锈的是______(选填字母)。
A.在钢铁表面涂油
B.在钢铁表面刷漆
C.镀耐磨和耐腐蚀的铬
D.制成耐腐蚀的合金如不锈钢
14. 金属与人类生活密切相关,回答下列问题。
(1)铯原子钟300年误差不超过5秒。铯元素在元素周期表中的信息如图所示,则铯的相对原子质量是___________。
(2)近期,三星堆遗址考古新发现6座“祭祀坑”,出土了巨青铜面具、青铜神树等重要文物。青铜属于___________。(填“合金”或“氧化物”或“化合物”)。
铜质器皿长期暴露在潮湿的空气中会长出绿色的铜锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3)。从元素守恒的角度分析,铜的锈蚀是单质铜与空气中___________共同作用的结果。
(3)铁是目前世界产量最高的金属,但容易被锈蚀。写出用稀盐酸除铁锈的化学方程式___________。通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于保护铁质船壳。该金属块的材料可以是___________(填序号)。
A.金B.银C.铜D.锌
(4)金属资源储量有限,而且不可再生。下列措施能够减缓金属消耗速度的是___________(填序号)。
A.回收利用废旧金属
B.加大对金属矿物的开采,提供金属产量
C.寻找和开发金属的替代品
D.提高金属制品的防腐能力,延长金属制品的使用寿命
三、综合题
15. 金属材料对于促进生产发展、改善人类生活发挥了巨大作用。请回答下列问题。
(1)“共享单车”方便市民出行,颇受人们的喜爱。
①如图所示,单车上标示出的部件中由金属材料制成的是______(任写一条,填字母序号)。
②铁制品表面刷漆,主要是为了防止其与______、氧气接触而锈蚀。为防止钢铁生锈可采取的措施是______(任写一条)。
③废旧单车中金属部件回收再利用的意义是______(写一条即可)。
(2)阅读下列材料
铝合金是目前用途广泛的合金之一,例如硬铝的密度小、强度高、具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。将某种铝合金放入氢氧化钠溶液中,其中铝会与氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和一种可燃性气体。
近年来,为满足某些尖端技术发展的需要,人们又设计和合成了许多新型合金。例如:钛合金与人体具有很好的“相容性”,可以用来制造人造骨;耐热合金和形状记忆合金广泛应用于航空航天等。
回答下列问题:
①用于制造飞机和宇宙飞船利用了硬铝______(多选,填标号)的性质。
A.密度小
B.强度高
C.具有较强的抗腐蚀能力
D.硬而脆
②可以用来制造人造骨的是______合金。
③铝与氢氧化钠溶液反应的化学方程式是______。
(3)将一定量的铝粉加入到Mg(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤渣和蓝色滤液。下列说法正确的是______(多选)。
A.滤渣中一定有Ag、Cu
B.滤渣中一定有Ag,可能有Cu,一定没有Mg
C.滤液中一定没有AgNO3
D.滤液中一定有Al(NO3)3、Mg(NO3)2、Cu(NO3)2
16. 大自然向人类提供了丰富的金属资源。
(1)探究铁钉锈蚀条件的实验如图所示。
①蒸馏水经过了煮沸,目的是_____;氯化钙的作用是________。
②对比试管_____(填字母,下同)和试管_____,可知铁钉锈蚀需要与水直接接触。
(2)钛铁矿(主要成分为FeTiO3)可用来提取钛,工业流程如下图所示。
①氯化过程发生反应的化学方程式为2FeTiO3+6C+7Cl22TiCl4+2X+6CO,X的化学式为_________。
②高温冶炼过程发生的反应属于基本反应类型中的_________。
③合成过程得到的产物甲醇(CH3OH)是一种重要的燃料,甲醇充分燃烧的化学方程式为____________。
(3)下列途径能有效保护金属资源的是___(填字母)。
a.防止金属腐蚀 b.回收利用废旧金属
c.合理有效地开采矿物 d.寻找金属的代用品
一、选择题
1. 下列变化属于物理变化的是
A.铁丝燃烧 B.铁丝生锈 C.铁丝弯曲 D.铁的冶炼
2. 垃圾分类是一种新时尚。废旧铁锅应投入的垃圾箱是
A.其他垃圾 B.可回收物
C.有害垃圾 D.厨余垃圾
3. 下列变化属于物理变化的是
A.燃放烟花 B.剪贴窗花 C.食物腐烂 D.钢铁生锈
4. 下列变化属于物理变化的是
A.钢铁生锈 B.食物变质 C.纸张燃烧 D.矿石粉碎
5. 厨房里发生的下列变化中,属于物理变化的是
A.燃气燃烧 B.面包发霉 C.瓷碗破裂 D.菜刀生锈
6. 下列情况下,铁钉腐蚀最慢的是
A.放在潮湿的空气中 B.部分浸入稀的食盐溶液中
C.埋在干燥、致密、不透气的土壤中 D.埋在潮湿、疏松、透气的酸性土壤中
7. 推理是化学学习中常用的思维方法。下列推理正确的是
A.将黄铜片和铜片相互刻画,铜片上有划痕,说明合金的硬度一般比各成分金属小
B.“真金不怕火炼”,说明金的熔点高
C.金属铝比金属铁更耐腐蚀,说明铁比铝活动性强
D.铁钉在潮湿的空气中生锈,不能说明是水还是氧气还是二者共同作用的结果
8. 痰盂等铁制品表面烧制搪瓷的目的是
A.增大硬度防止撞坏 B.增大厚度防止磨损
C.防止铁生锈且美观 D.美观和杀菌消毒作用
9. 用下列装置进行实验,下列有关实验的说法错误的是
A.甲实验,加热时蘸酒精的棉花燃烧了,蘸水的棉花没有燃烧,证明燃烧需要可燃物
B.甲实验,加热较长时间后蘸水的棉花燃烧了,因为水蒸发后温度达到棉花的着火点
C.乙实验,①中的铁钉生锈了,②中铁钉没有生锈;证明铁和水、氧气反应而锈蚀
D.丙实验,烧杯中的蜡烛熄灭了,证明二氧化碳的密度比空气密度大且不支持燃烧
10. 下列实验设计不能达到实验目的的是
A.探究分子在不断运动
B.探究铁生锈的条件
C.验证NaOH溶液能吸收CO2
D.探究橙汁是否能导电
11. 下列实验中,根据实验现象可得到相应结论的是
实验操作 现象 结论
A 将AgNO3溶液和Cu(NO3)2溶液分别加入两支装有铁钉的试管中 铁钉表面分别有灰黑色固体和红色固体析出 金属活动性由强到弱:Fe>Cu>Ag
B 在电解器的玻璃管中加满水,接通直流电源 两极玻璃管中有气体生成,体积比是1:2 水是化合物,可分解
C 把燃着的木条分别插入空气样品和呼出气体的样品中 空气中的木条无明显变化,呼出气体中的木条熄灭 呼出气体中的二氧化碳含量较多
D 如图所示将两根无锈铁钉置于不同的外部环境内,放置一周
一周后,左试管中铁钉有明显锈迹,右试管中铁钉光亮如新。 铁在有空气和水同时存在的条件下生锈。
A.A B.B C.C D.D
二、填空题
12. 金属及其合金在日常生活中有大量广泛的应用。
(1)黑木耳中富含铁,这里的“铁”是指 ______。
(2)日常生活中钢铁容易生锈,铁生锈是因为铁与 ______(填化学式)接触而导致。
(3)铝具有很好的抗腐蚀性能,原因是(用化学方程式表示) ______。
13. 金属材料的使用作为一个时代的标志,见证了人类文明发展的过程。
(1)2022年11月20日,卡塔尔世界杯开幕,来自世界各国的足球劲旅在绿茵场上角逐今年的“大力神杯”。“大力神杯”由18K金铸造,金可制成金箔,拉成金丝,说明金具有良好______性。
(2)《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质)。这句话说明铜锡合金比组成它的纯金属硬度______(选填“大”或“小”)。
(3)工业中,用高炉炼铁的主要反应原理是用一氧化碳还原氧化铁,反应的化学方程式为______。
(4)如图是用三根洁净无锈的铁钉探究铁生锈条件的实验。
①由实验A.c可得出的结论是铁钉锈蚀的条件之一是需要与______接触。
②铁锈的主要成分是Fe2O3·xH2O,下列措施中,能防止钢铁生锈的是______(选填字母)。
A.在钢铁表面涂油
B.在钢铁表面刷漆
C.镀耐磨和耐腐蚀的铬
D.制成耐腐蚀的合金如不锈钢
14. 金属与人类生活密切相关,回答下列问题。
(1)铯原子钟300年误差不超过5秒。铯元素在元素周期表中的信息如图所示,则铯的相对原子质量是___________。
(2)近期,三星堆遗址考古新发现6座“祭祀坑”,出土了巨青铜面具、青铜神树等重要文物。青铜属于___________。(填“合金”或“氧化物”或“化合物”)。
铜质器皿长期暴露在潮湿的空气中会长出绿色的铜锈,铜锈的主要成分是碱式碳酸铜(Cu2(OH)2CO3)。从元素守恒的角度分析,铜的锈蚀是单质铜与空气中___________共同作用的结果。
(3)铁是目前世界产量最高的金属,但容易被锈蚀。写出用稀盐酸除铁锈的化学方程式___________。通常在轮船的吃水线以下焊接比铁更活泼的金属块,用于保护铁质船壳。该金属块的材料可以是___________(填序号)。
A.金B.银C.铜D.锌
(4)金属资源储量有限,而且不可再生。下列措施能够减缓金属消耗速度的是___________(填序号)。
A.回收利用废旧金属
B.加大对金属矿物的开采,提供金属产量
C.寻找和开发金属的替代品
D.提高金属制品的防腐能力,延长金属制品的使用寿命
三、综合题
15. 金属材料对于促进生产发展、改善人类生活发挥了巨大作用。请回答下列问题。
(1)“共享单车”方便市民出行,颇受人们的喜爱。
①如图所示,单车上标示出的部件中由金属材料制成的是______(任写一条,填字母序号)。
②铁制品表面刷漆,主要是为了防止其与______、氧气接触而锈蚀。为防止钢铁生锈可采取的措施是______(任写一条)。
③废旧单车中金属部件回收再利用的意义是______(写一条即可)。
(2)阅读下列材料
铝合金是目前用途广泛的合金之一,例如硬铝的密度小、强度高、具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料。将某种铝合金放入氢氧化钠溶液中,其中铝会与氢氧化钠、水反应生成偏铝酸钠(NaAlO2)和一种可燃性气体。
近年来,为满足某些尖端技术发展的需要,人们又设计和合成了许多新型合金。例如:钛合金与人体具有很好的“相容性”,可以用来制造人造骨;耐热合金和形状记忆合金广泛应用于航空航天等。
回答下列问题:
①用于制造飞机和宇宙飞船利用了硬铝______(多选,填标号)的性质。
A.密度小
B.强度高
C.具有较强的抗腐蚀能力
D.硬而脆
②可以用来制造人造骨的是______合金。
③铝与氢氧化钠溶液反应的化学方程式是______。
(3)将一定量的铝粉加入到Mg(NO3)2、Cu(NO3)2、AgNO3三种物质的混合溶液中,充分反应后过滤,得到滤渣和蓝色滤液。下列说法正确的是______(多选)。
A.滤渣中一定有Ag、Cu
B.滤渣中一定有Ag,可能有Cu,一定没有Mg
C.滤液中一定没有AgNO3
D.滤液中一定有Al(NO3)3、Mg(NO3)2、Cu(NO3)2
16. 大自然向人类提供了丰富的金属资源。
(1)探究铁钉锈蚀条件的实验如图所示。
①蒸馏水经过了煮沸,目的是_____;氯化钙的作用是________。
②对比试管_____(填字母,下同)和试管_____,可知铁钉锈蚀需要与水直接接触。
(2)钛铁矿(主要成分为FeTiO3)可用来提取钛,工业流程如下图所示。
①氯化过程发生反应的化学方程式为2FeTiO3+6C+7Cl22TiCl4+2X+6CO,X的化学式为_________。
②高温冶炼过程发生的反应属于基本反应类型中的_________。
③合成过程得到的产物甲醇(CH3OH)是一种重要的燃料,甲醇充分燃烧的化学方程式为____________。
(3)下列途径能有效保护金属资源的是___(填字母)。
a.防止金属腐蚀 b.回收利用废旧金属
c.合理有效地开采矿物 d.寻找金属的代用品
