2024届高三化学二轮复习 选择题突破8:化学反应速率与化学平衡(含解析)
文档属性
| 名称 | 2024届高三化学二轮复习 选择题突破8:化学反应速率与化学平衡(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 357.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-29 09:13:29 | ||
图片预览




文档简介
选择题突破8 化学反应速率与化学平衡
【真题回顾】
命题角度1 化学反应速率与化学平衡的描述分析
1.(2022·海南卷)某温度下,反应CH2===CH2(g)+H2O(g) CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是( )
A.增大压强,v正>v逆,平衡常数增大
B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大
C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动
D.恒容下,充入一定量的CH2===CH2(g),CH2===CH2(g)的平衡转化率增大
2.(2022·浙江6月选考)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
命题角度2 化学反应速率与化学平衡的图像分析
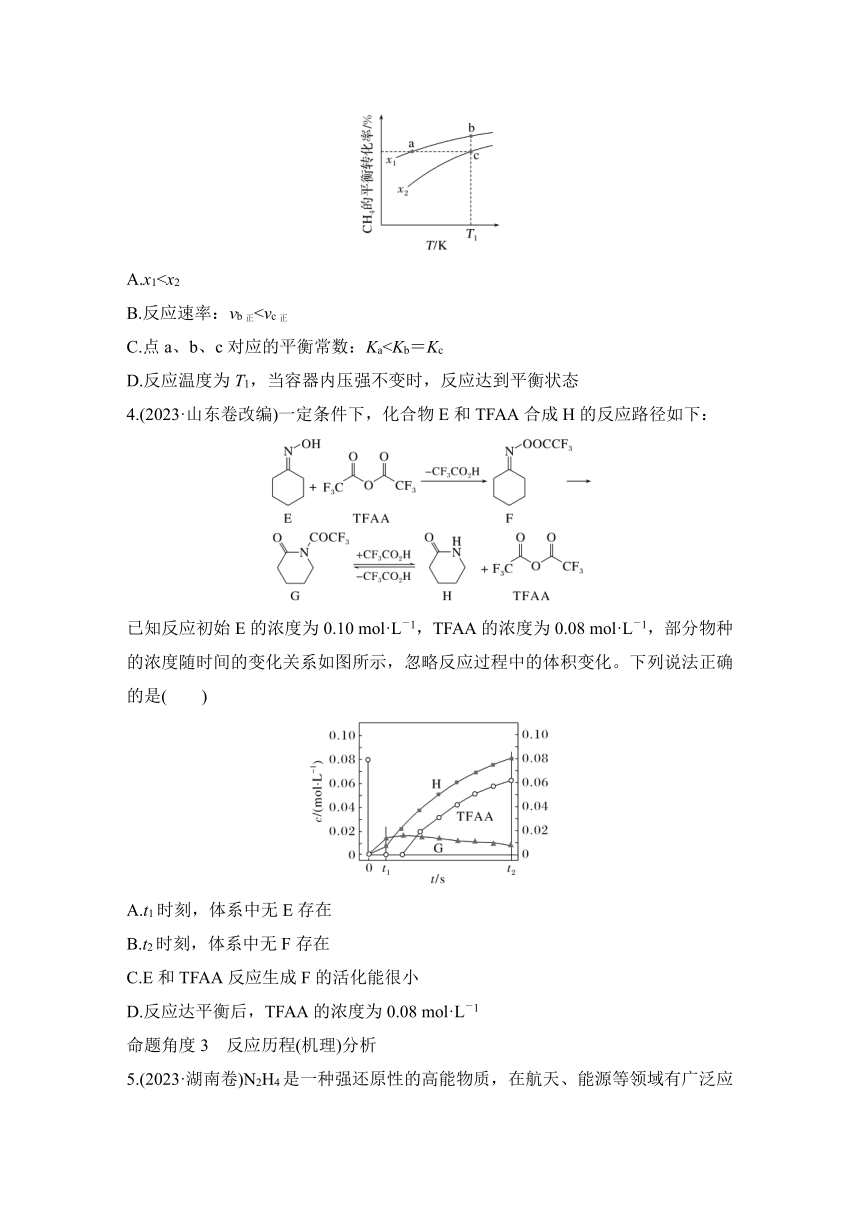
3.(2023·湖南卷)向一恒容密闭容器中加入1 mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x随温度的变化曲线如图所示。下列说法错误的是( )
A.x1B.反应速率:vb正C.点a、b、c对应的平衡常数:KaD.反应温度为T1,当容器内压强不变时,反应达到平衡状态
4.(2023·山东卷改编)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10 mol·L-1,TFAA的浓度为0.08 mol·L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是( )
A.t1时刻,体系中无E存在
B.t2时刻,体系中无F存在
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08 mol·L-1
命题角度3 反应历程(机理)分析
5.(2023·湖南卷)N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某Ru(Ⅱ)催化剂(用[L-Ru-NH3]+表示)能高效电催化氧化NH3合成N2H4,其反应机理如图所示。
下列说法错误的是( )
A.Ru(Ⅱ)被氧化至Ru(Ⅲ)后,配体NH3失去质子能力增强
B.M中Ru的化合价为+3
C.该过程有非极性键的形成
D.该过程的总反应式:4NH3-2e-===N2H4+2NH
6.(2023·浙江1月选考)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g)===O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
【考点剖析】
微点1 化学反应速率、化学平衡及影响因素
【典题精练】
1.(2023·天津红桥区一模)二氧化碳催化加氢制甲醇的反应为3H2(g)+CO2(g) H2O(g)+CH3OH(g) ΔH<0。下列说法正确的是( )
A.增大压强,平衡正向进行,该反应的平衡常数K增大
B.升高温度可使该反应的正反应速率增大,逆反应速率减小
C.温度越低越有利于该反应的进行,从而提高甲醇的生产效率
D.使用高效催化剂,可降低反应的活化能,增大活化分子百分数
2.(2023·沈阳质检)某温度下,恒容密闭容器内加入等物质的量的H2和I2发生反应H2(g)+I2(g) 2HI(g),v正=k正c(H2)c(I2),k为速率常数。反应一段时间后达到平衡。下列说法错误的是( )
A.若=8.99,则该反应ΔH<0
B.加入一定量HI,混合气体颜色变深
C.加入一定量氩气,容器内压强增大,反应速率不变
D.加入等物质的量的H2和I2,H2转化率不变
3.(2023·石家庄质检)T ℃时,向体积恒定为2 L的密闭容器中充入Q(s)发生反应:Q(s) M(g)+N(g) ΔH>0,K=0.062 5。实验测得n(Q)随时间(t)的变化关系如下表所示:
t/min 0 20 40 60 80
n(Q)/mol 1.00 0.80 0.65 0.55 0.50
下列叙述错误的是( )
A.0~20 min内,用M(g)表示的平均反应速率v(M)=0.005 mol·L-1·min-1
B.其他条件不变,升高温度,N(g)的生成速率和平衡产率均增大
C.其他条件不变,加入催化剂,80 min时Q(s)的转化率不变
D.若起始时向该容器中加入2.00 mol Q(s),达到平衡时0.25 mol·L-1【智能提升】
1.化学反应速率计算的两种方法
(1)公式法:v(B)==
(2)比值法
同一化学反应,各物质的反应速率之比等于反应方程式中的化学计量数之比。对于反应:mA(g)+nB(g)===pC(g)+qD(g)来说,则有===。
2.化学反应速率的影响因素
(1)内因——活化能
相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同,活化能小的化学反应速率快,活化能大的化学反应速率慢。
(2)外因——浓度、压强、温度、催化剂、光照、接触面积等
①浓度(c):增大(减小)反应物浓度→单位体积内活化分子数目增加(减少),活化分子百分数不变→有效碰撞频率提高(降低)→化学反应速率加快(减慢);
②压强(p):对于气相反应来说,增大(减小)压强→相当于减小(增大)容器容积→相当于增大(减小)反应物的浓度→化学反应速率加快(减慢);
③温度(T):升高(降低)温度→活化分子百分数增大(减小)→有效碰撞频率提高(降低)→化学反应速率加快(减慢);
④催化剂:使用催化剂→降低反应的活化能→活化分子百分数增大→有效碰撞频率提高→化学反应速率加快。
3.“两方法”、“三关注”判断化学平衡状态
(1)“两方法”——逆向相等、变量不变。
①“逆向相等”:反应速率必须一个是正反应的速率,一个是逆反应的速率,且经过换算后同一种物质的消耗速率和生成速率相等;
②“变量不变”:如果一个量是随反应进行而改变的,当不变时为平衡状态;一个随反应的进行保持不变的量,不能作为是否达到平衡状态的判断依据。
(2)“三关注”
①关注反应条件,是恒温恒容、恒温恒压还是绝热容器;
②关注反应特点,是等体积反应,还是非等体积反应;
③关注特殊情况,是否有固体参加或生成,或固体的分解反应。
4.“三角度”判断化学平衡移动的方向
(1)通过比较平衡破坏瞬间的正、逆反应速率的相对大小来判断平衡移动的方向。
①若外界条件改变,引起v正>v逆,则化学平衡向正反应方向移动;
②若外界条件改变,引起v正<v逆,则化学平衡向逆反应方向移动;
③若外界条件改变,虽能引起v正和v逆变化,但变化后新的v′正和v′逆仍保持相等,则化学平衡不发生移动。
(2)通过比较浓度商(Q)与平衡常数(K)的大小来判断平衡移动的方向。
①若Q>K,平衡逆向移动;
②若Q=K,平衡不移动;
③若Q<K,平衡正向移动。
(3)依据勒夏特列原理判断
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
①当增大反应物的浓度时,平衡向正反应方向移动,反之向逆反应方向移动;
②当升高反应温度时,平衡向吸热反应方向移动,反之向放热反应方向移动;
③在有气体参加或生成的可逆反应中,当增大压强时,平衡总是向气体体积缩小的方向移动,反之向气体体积增大的方向移动。
微点2 化学反应速率与化学平衡图像
【典题精练】
4.(2023·广州测试)恒容密闭容器中,在硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,S2发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g) ΔH。CH4的平衡转化率、S2的体积分数随温度的变化曲线如图所示。下列说法正确的是( )
A.ΔH>0
B.温度升高,S8分解率增大,S2体积分数增大
C.向平衡体系中充入稀有气体,平衡向右移动
D.其他条件相同,S2体积分数越大,CH4的平衡转化率越小
5.(2023·佛山一模)向1 L的恒容密闭容器中加入1 mol X和3 mol Y,发生反应X(g)+3Y(g) 2Z(g),X的转化率α随温度t的变化如图所示(不同温度下的转化率均为反应第10 min数据)。下列说法正确的是( )
A.a点的反应速率v(Z)=0.03 mol·L-1·min-1
B.a、b、c点对应的v(Y)逆大小关系为:b>c>a
C.c点时,每消耗3 mol Y的同时,消耗2 mol Z
D.若将容器体积扩大为2倍,则c点对应温度下的α(X)增大
6.(2023·大连双基测试)SCl2可用作有机合成的氯化剂。在体积为2 L的密闭容器中充入1 mol SCl2(g),发生反应:2SCl2(g) S2Cl2(g)+Cl2(g),图中所示曲线分别表示反应在10 min时和平衡时SCl2的转化率(α)与温度(T)的关系。下列说法正确的是( )
A.2SCl2(g) S2Cl2(g)+Cl2(g)的ΔH<0
B.55 ℃,0~10 min,以S2Cl2表示反应的平均速率为0.025 mol·L-1·min-1
C.当容器中混合气体的平均相对分子质量恒定不变时,反应达到平衡状态
D.82 ℃,若起始时在该密闭容器中充入SCl2、S2Cl2和Cl2各5 mol,则此时v(逆)【智能提升】
1.利用图像“断点”判断影响反应速率的外界条件
可逆反应达到平衡后,若某一时刻改变外界条件,速率-时间图像的曲线可能会出现“渐变”或“突变”。根据“断点”前后速率的大小变化,即可对外界条件的变化情况作出判断。
图像 速率变化分析 条件变化判断 平衡移动方向判断
v′正突变, v′逆渐变, 且v′正>v′逆 增大反应物浓度 平衡正向移动
v′正、v′逆都突然减小,且v′正>v′逆 ①降低温度(正反应放热); ②减小压强(正反应气体总体积增大) 平衡正向移动
v′正、v′逆都突然增大,且增大程度相同 ①使用催化剂; ②增大压强(反应前后气体总体积不变) 平衡不移动
2.两种典型的图像
(1)转化率(或百分含量)与温度变化图像
[析图关键] 表示两个外界条件同时变化时,反应物A的转化率变化情况,解决这类图像一般采用“定一议二”的方法,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。如:图1中,当压强相等(任意一条等压线)时,升高温度,A的转化率增大,说明升高温度平衡向正反应方向移动,即正反应为吸热反应。当温度相等时,在图1中作垂线,与三条等压线交于三点,这三点自下而上为增大压强,A的转化率增大,说明增大压强平衡向正反应方向移动,即正反应为气体体积减小的反应。
(2)转化率(或百分含量)与压强变化图像
[析图关键] 图3中,当温度相等(任意一条等温线)时,增大压强,A的转化率增大,说明增大压强平衡正向移动,即正反应是气体体积减小的反应。当压强相等时,在图3中作垂线,与两条等温线交于两点,这两点自下而上为降低温度,A的转化率增大,说明降低温度平衡正向移动,即正反应为放热反应。
参考答案
真题回顾
1.C [A.该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的幅度大于逆反应的,故v正>v逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;B.催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;C.恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;D.恒容下,充入一定量的CH2===CH2 (g),平衡向正反应方向移动,但是CH2===CH2 (g)的平衡转化率减小,D不正确。]
2.C [实验①中,0~20 min,v(N2)=v(NH3)=×(2.40×10-3 mol·L-1-2.00×10-3 mol·L-1)÷20 min=1.00×10-5 mol·L-1·min-1,A正确;催化剂表面积大小只影响反应速率,不影响平衡,则实验③达平衡时氨气浓度也为4.00×10-4 mol·L-1,而恒温恒容条件下,实验②相对于实验③为减小压强,平衡正向移动,因此实验②60 min时处于平衡状态,x<0.4,即x≠0.4,B正确;实验①、实验②中0~20 min、20~40 min氨气浓度变化量相同,速率相同,实验①是实验②中氨气初始浓度的两倍,相同条件下,增加氨气浓度,反应速率并没有增大,C错误;对比实验①和实验③,氨气浓度相同,实验③中催化剂表面积是实验①中催化剂表面积的2倍,实验③先达到平衡状态,实验③的反应速率大,D正确。]
3.B [A.一定条件下,增大水的浓度,能提高CH4的转化率,即x值越小,CH4的转化率越大,则x1vc正,故B错误;C.由图像可知,x一定时,温度升高CH4的平衡转化率增大,说明正反应为吸热反应,温度升高平衡正向移动,K增大;温度相同,K不变,则点a、b、c对应的平衡常数:Ka4.C [一定条件下,化合物E和TFAA合成H的反应路径中,共发生三个反应:①E+TFAA―→F ②F―→G ③G H+TFAA t1之后的某时刻,H为0.02 mol·L-1,此时TFAA的浓度仍为0,则表明0.10 mol·L-1 E、起始时的0.08 mol·L-1 TFAA、G分解生成的0.02 mol·L-1 TFAA全部参加反应,生成0.10 mol·L-1 F;在t2时刻,H为0.08 mol·L-1,TFAA为0.06 mol·L-1,G为0.01 mol·L-1,则F为0.01 mol·L-1。A.t1时刻,H的浓度小于0.02 mol·L-1,此时反应③生成TFAA的浓度小于0.02 mol·L-1,参加反应①的E的浓度小于0.1 mol·L-1,所以体系中有E存在,A错误;B.由分析可知,t2时刻,H为0.08 mol·L-1,TFAA为0.06 mol·L-1,G为0.01 mol·L-1,则F为0.01 mol·L-1,所以体系中有F存在,B不正确;C.t1之后的某时刻,H为0.02 mol·L-1,此时TFAA的浓度仍为0,表明此时E和TFAA完全反应生成F,所以E和TFAA生成F的反应速率快,反应的活化能很小,C正确;D.在t2时刻,H为0.08 mol·L-1,TFAA为0.06 mol·L-1,G为0.01 mol·L-1,F为0.01 mol·L-1,只有F、G全部转化为H和TFAA时,TFAA的浓度才能为0.08 mol·L-1,而G H+TFAA为可逆反应,所以反应达平衡后,TFAA的浓度一定小于0.08 mol·L-1,D不正确。]
5.B [A.Ru(Ⅱ)被氧化至Ru(Ⅲ)后,[L-Ru-NH3]2+中的Ru带有更多的正电荷,其与N原子成键后,Ru吸引电子的能力比Ru(Ⅱ)强,这种作用使得配体NH3中的N—H极性变强且更易断裂,因此其失去质子(H+)的能力增强,A说法正确;B.Ru(Ⅱ)中Ru的化合价为+2,当其变为Ru(Ⅲ)后,Ru的化合价变为+3,Ru(Ⅲ)失去1个质子后,N原子有1对孤电子对,Ru的化合价不变;M为[L-Ru-H2]+,当[L-Ru-NH2]+变为M时,N原子的孤电子对拆为2个电子并转移给Ru 1个电子,其中Ru的化合价变为+2,因此,B说法不正确;C.该过程M变为[L-Ru-NH2-NH2-Ru-L]2+时,有N—N形成,N—N是非极性键,C说法正确;D.从整个过程来看,4个NH3失去了2个电子后生成了1个N2H4和2个NH,Ru(Ⅱ)是催化剂,因此,该过程的总反应式为4NH3-2e-===N2H4+2NH,D说法正确。]
6.C [对比两个历程可知,历程Ⅱ中增加了催化剂,降低了反应的活化能,加快了反应速率。A项,催化剂能降低活化能,但是不能改变反应的焓变,因此E6-E3=E5-E2,A正确;B项,已知Cl2(g)的相对能量为0,对比两个历程可知,Cl(g)的相对能量为(E2-E3) kJ·mol-1,则Cl—Cl键能为2(E2-E3) kJ·mol-1,B正确;C项,催化剂不能改变反应的平衡转化率,因此相同条件下,O3的平衡转化率:历程Ⅱ=历程Ⅰ,C错误;D项,活化能越低,反应速率越快,由图像可知,历程Ⅱ中第二步反应的活化能最低,所以速率最快的一步反应的热化学方程式为:ClO(g)+O(g)===O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1,D正确;故选C。]
考点剖析
微点1
典题精练
1.D [A.该反应的正反应是气体分子数减小的反应,因此增大压强,平衡向正向进行,但平衡常数K不变,平衡常数K只与温度有关,A项错误;B.升高温度可使该反应的正、逆反应速率均增大,B项错误;C.反应的正反应是放热反应,在一定范围内,降低温度有利于平衡向正向移动,能提高甲醇的生产效率,温度过低不利于反应的进行,C项错误;D.使用高效催化剂,可降低反应的活化能,增大活化分子百分数,增加反应速率,D项正确。]
2.A [=8.99,说明温度升高,k正增大,但不能说明该反应为放热反应,A项错误;加入一定量HI,平衡逆向移动,c(I2)增大,混合气体颜色变深,B项正确;加入一定量氩气,容器内压强增大,但反应体系中各物质浓度不变,反应速率不变,C项正确;加入等物质的量的H2和I2,相当于增大压强,该反应前后气体分子数不变,加压时平衡不移动,故H2转化率不变,D项正确。]
3.D [0~20 min,Q的物质的量减少0.2 mol,生成M的物质的量为0.2 mol,v(M)=0.2 mol÷2 L÷20 min=0.005 mol·L-1·min-1,A项正确;该反应为吸热反应,其他条件不变,升高温度平衡正向移动,N(g)的生成速率和平衡产率均增大,B项正确;80 min时,Q反应0.5 mol,M的物质的量为0.5 mol,N的物质的量为0.5 mol,c(M)=c(N)=0.5 mol÷2 L=0.25 mol·L-1,Qc=c(M)·c(N)=0.25×0.25=0.062 5=K,说明80 min时反应达到平衡状态,由于催化剂不影响化学平衡,故其他条件不变,加入催化剂,80 min时Q(s)的转化率不变,C项正确;若起始时向该容器中加入2.00 mol Q(s),设达平衡时c(M)=c(N)=x mol·L-1,则K=c(M)·c(N)=x2=0.062 5,解得x=0.25,故D项错误。]
微点2
典题精练
4.B [根据图示,升高温度,CH4的平衡转化率减小,说明平衡逆向移动,则正反应为放热反应,ΔH<0,A项错误;S8(s) 4S2(g)为吸热反应,2S2(g)+CH4(g) CS2(g)+2H2S(g)为放热反应,升高温度,S8(s) 4S2(g)平衡正向移动,S8分解率增大,2S2(g)+CH4(g) CS2(g)+2H2S(g)平衡逆向移动,S2体积分数增大,B项正确;向平衡体系中充入稀有气体,体系中各物质浓度不变,平衡不移动,C项错误;其他条件相同,S2体积分数增大,相当于增大S2浓度,2S2(g)+CH4(g) CS2(g)+2H2S(g)平衡正向移动,CH4的平衡转化率增大,D项错误。]
5.C [A.由题干图像信息可知,a点X的转化率为30%,故a点X的反应速率为:v(X)==0.03 mol·L-1·min-1,根据反应速率之比等于化学计量数之比,故a点的反应速率v(Z)=2v(X)=2×0.03 mol·L-1·min-1=0.06 mol·L-1·min-1,A错误;B.由题干图像信息可知,a、b两点10 min时未达到平衡,而c点10 min时达到平衡,温度越高正、逆反应速率越快,且b、c点浓度差异较小,故a、b、c点对应的v(Y)逆大小关系为:c>b>a,B错误;C.由题干图像信息可知,c点时反应达到化学平衡,故有每消耗3 mol Y的同时消耗2 mol Z即正、逆反应速率相等,C正确;D.由反应方程式可知X(g)+3Y(g) 2Z(g)正反应是一个气体体积减小的反应,若将容器体积扩大为2倍,即减小容器压强,平衡逆向移动,则c点对应温度下的α(X)减小,D错误。]
6.D [温度升高,SCl2的平衡转化率增大,说明平衡正向移动,根据化学平衡移动原理,升温平衡向吸热方向移动,知该反应的ΔH>0,A项错误;55 ℃,0~10 min,SCl2(g)的转化率为50%,v(SCl2)==0.025 mol·L-1·min-1,则v(S2Cl2)=v(SCl2)=0.012 5 mol·L-1·min-1,B项错误;反应体系中全为气体,气体质量不变,反应前后气体分子数不变,即气体物质的量不变,则混合气体的平均相对分子质量始终不变,C项错误;由图可知,82 ℃,反应达平衡时SCl2的转化率为90%,列三段式:
则该温度下平衡常数K==20.25,若起始时在该密闭容器中充入SCl2、S2Cl2和Cl2各5 mol,则此时的浓度商Q==1
【真题回顾】
命题角度1 化学反应速率与化学平衡的描述分析
1.(2022·海南卷)某温度下,反应CH2===CH2(g)+H2O(g) CH3CH2OH(g)在密闭容器中达到平衡,下列说法正确的是( )
A.增大压强,v正>v逆,平衡常数增大
B.加入催化剂,平衡时CH3CH2OH(g)的浓度增大
C.恒容下,充入一定量的H2O(g),平衡向正反应方向移动
D.恒容下,充入一定量的CH2===CH2(g),CH2===CH2(g)的平衡转化率增大
2.(2022·浙江6月选考)恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应:2NH3(g) N2(g)+3H2(g),测得不同起始浓度和催化剂表面积下氨浓度随时间的变化,如下表所示,下列说法不正确的是( )
A.实验①,0~20 min,v(N2)=1.00×10-5 mol·L-1·min-1
B.实验②,60 min时处于平衡状态,x≠0.40
C.相同条件下,增加氨气的浓度,反应速率增大
D.相同条件下,增加催化剂的表面积,反应速率增大
命题角度2 化学反应速率与化学平衡的图像分析
3.(2023·湖南卷)向一恒容密闭容器中加入1 mol CH4和一定量的H2O,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)。CH4的平衡转化率按不同投料比x随温度的变化曲线如图所示。下列说法错误的是( )
A.x1
4.(2023·山东卷改编)一定条件下,化合物E和TFAA合成H的反应路径如下:
已知反应初始E的浓度为0.10 mol·L-1,TFAA的浓度为0.08 mol·L-1,部分物种的浓度随时间的变化关系如图所示,忽略反应过程中的体积变化。下列说法正确的是( )
A.t1时刻,体系中无E存在
B.t2时刻,体系中无F存在
C.E和TFAA反应生成F的活化能很小
D.反应达平衡后,TFAA的浓度为0.08 mol·L-1
命题角度3 反应历程(机理)分析
5.(2023·湖南卷)N2H4是一种强还原性的高能物质,在航天、能源等领域有广泛应用。我国科学家合成的某Ru(Ⅱ)催化剂(用[L-Ru-NH3]+表示)能高效电催化氧化NH3合成N2H4,其反应机理如图所示。
下列说法错误的是( )
A.Ru(Ⅱ)被氧化至Ru(Ⅲ)后,配体NH3失去质子能力增强
B.M中Ru的化合价为+3
C.该过程有非极性键的形成
D.该过程的总反应式:4NH3-2e-===N2H4+2NH
6.(2023·浙江1月选考)标准状态下,气态反应物和生成物的相对能量与反应历程示意图如下[已知O2(g)和Cl2(g)的相对能量为0],下列说法不正确的是( )
A.E6-E3=E5-E2
B.可计算Cl—Cl键能为2(E2-E3) kJ·mol-1
C.相同条件下,O3的平衡转化率:历程Ⅱ>历程Ⅰ
D.历程Ⅰ、历程Ⅱ中速率最快的一步反应的热化学方程式为:ClO(g)+O(g)===O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1
【考点剖析】
微点1 化学反应速率、化学平衡及影响因素
【典题精练】
1.(2023·天津红桥区一模)二氧化碳催化加氢制甲醇的反应为3H2(g)+CO2(g) H2O(g)+CH3OH(g) ΔH<0。下列说法正确的是( )
A.增大压强,平衡正向进行,该反应的平衡常数K增大
B.升高温度可使该反应的正反应速率增大,逆反应速率减小
C.温度越低越有利于该反应的进行,从而提高甲醇的生产效率
D.使用高效催化剂,可降低反应的活化能,增大活化分子百分数
2.(2023·沈阳质检)某温度下,恒容密闭容器内加入等物质的量的H2和I2发生反应H2(g)+I2(g) 2HI(g),v正=k正c(H2)c(I2),k为速率常数。反应一段时间后达到平衡。下列说法错误的是( )
A.若=8.99,则该反应ΔH<0
B.加入一定量HI,混合气体颜色变深
C.加入一定量氩气,容器内压强增大,反应速率不变
D.加入等物质的量的H2和I2,H2转化率不变
3.(2023·石家庄质检)T ℃时,向体积恒定为2 L的密闭容器中充入Q(s)发生反应:Q(s) M(g)+N(g) ΔH>0,K=0.062 5。实验测得n(Q)随时间(t)的变化关系如下表所示:
t/min 0 20 40 60 80
n(Q)/mol 1.00 0.80 0.65 0.55 0.50
下列叙述错误的是( )
A.0~20 min内,用M(g)表示的平均反应速率v(M)=0.005 mol·L-1·min-1
B.其他条件不变,升高温度,N(g)的生成速率和平衡产率均增大
C.其他条件不变,加入催化剂,80 min时Q(s)的转化率不变
D.若起始时向该容器中加入2.00 mol Q(s),达到平衡时0.25 mol·L-1
1.化学反应速率计算的两种方法
(1)公式法:v(B)==
(2)比值法
同一化学反应,各物质的反应速率之比等于反应方程式中的化学计量数之比。对于反应:mA(g)+nB(g)===pC(g)+qD(g)来说,则有===。
2.化学反应速率的影响因素
(1)内因——活化能
相同条件下,不同化学反应的速率不同,主要是内因——活化能大小不同,活化能小的化学反应速率快,活化能大的化学反应速率慢。
(2)外因——浓度、压强、温度、催化剂、光照、接触面积等
①浓度(c):增大(减小)反应物浓度→单位体积内活化分子数目增加(减少),活化分子百分数不变→有效碰撞频率提高(降低)→化学反应速率加快(减慢);
②压强(p):对于气相反应来说,增大(减小)压强→相当于减小(增大)容器容积→相当于增大(减小)反应物的浓度→化学反应速率加快(减慢);
③温度(T):升高(降低)温度→活化分子百分数增大(减小)→有效碰撞频率提高(降低)→化学反应速率加快(减慢);
④催化剂:使用催化剂→降低反应的活化能→活化分子百分数增大→有效碰撞频率提高→化学反应速率加快。
3.“两方法”、“三关注”判断化学平衡状态
(1)“两方法”——逆向相等、变量不变。
①“逆向相等”:反应速率必须一个是正反应的速率,一个是逆反应的速率,且经过换算后同一种物质的消耗速率和生成速率相等;
②“变量不变”:如果一个量是随反应进行而改变的,当不变时为平衡状态;一个随反应的进行保持不变的量,不能作为是否达到平衡状态的判断依据。
(2)“三关注”
①关注反应条件,是恒温恒容、恒温恒压还是绝热容器;
②关注反应特点,是等体积反应,还是非等体积反应;
③关注特殊情况,是否有固体参加或生成,或固体的分解反应。
4.“三角度”判断化学平衡移动的方向
(1)通过比较平衡破坏瞬间的正、逆反应速率的相对大小来判断平衡移动的方向。
①若外界条件改变,引起v正>v逆,则化学平衡向正反应方向移动;
②若外界条件改变,引起v正<v逆,则化学平衡向逆反应方向移动;
③若外界条件改变,虽能引起v正和v逆变化,但变化后新的v′正和v′逆仍保持相等,则化学平衡不发生移动。
(2)通过比较浓度商(Q)与平衡常数(K)的大小来判断平衡移动的方向。
①若Q>K,平衡逆向移动;
②若Q=K,平衡不移动;
③若Q<K,平衡正向移动。
(3)依据勒夏特列原理判断
如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。
①当增大反应物的浓度时,平衡向正反应方向移动,反之向逆反应方向移动;
②当升高反应温度时,平衡向吸热反应方向移动,反之向放热反应方向移动;
③在有气体参加或生成的可逆反应中,当增大压强时,平衡总是向气体体积缩小的方向移动,反之向气体体积增大的方向移动。
微点2 化学反应速率与化学平衡图像
【典题精练】
4.(2023·广州测试)恒容密闭容器中,在硫(S8)与CH4为原料制备CS2,S8受热分解成气态S2,S2发生反应2S2(g)+CH4(g) CS2(g)+2H2S(g) ΔH。CH4的平衡转化率、S2的体积分数随温度的变化曲线如图所示。下列说法正确的是( )
A.ΔH>0
B.温度升高,S8分解率增大,S2体积分数增大
C.向平衡体系中充入稀有气体,平衡向右移动
D.其他条件相同,S2体积分数越大,CH4的平衡转化率越小
5.(2023·佛山一模)向1 L的恒容密闭容器中加入1 mol X和3 mol Y,发生反应X(g)+3Y(g) 2Z(g),X的转化率α随温度t的变化如图所示(不同温度下的转化率均为反应第10 min数据)。下列说法正确的是( )
A.a点的反应速率v(Z)=0.03 mol·L-1·min-1
B.a、b、c点对应的v(Y)逆大小关系为:b>c>a
C.c点时,每消耗3 mol Y的同时,消耗2 mol Z
D.若将容器体积扩大为2倍,则c点对应温度下的α(X)增大
6.(2023·大连双基测试)SCl2可用作有机合成的氯化剂。在体积为2 L的密闭容器中充入1 mol SCl2(g),发生反应:2SCl2(g) S2Cl2(g)+Cl2(g),图中所示曲线分别表示反应在10 min时和平衡时SCl2的转化率(α)与温度(T)的关系。下列说法正确的是( )
A.2SCl2(g) S2Cl2(g)+Cl2(g)的ΔH<0
B.55 ℃,0~10 min,以S2Cl2表示反应的平均速率为0.025 mol·L-1·min-1
C.当容器中混合气体的平均相对分子质量恒定不变时,反应达到平衡状态
D.82 ℃,若起始时在该密闭容器中充入SCl2、S2Cl2和Cl2各5 mol,则此时v(逆)
1.利用图像“断点”判断影响反应速率的外界条件
可逆反应达到平衡后,若某一时刻改变外界条件,速率-时间图像的曲线可能会出现“渐变”或“突变”。根据“断点”前后速率的大小变化,即可对外界条件的变化情况作出判断。
图像 速率变化分析 条件变化判断 平衡移动方向判断
v′正突变, v′逆渐变, 且v′正>v′逆 增大反应物浓度 平衡正向移动
v′正、v′逆都突然减小,且v′正>v′逆 ①降低温度(正反应放热); ②减小压强(正反应气体总体积增大) 平衡正向移动
v′正、v′逆都突然增大,且增大程度相同 ①使用催化剂; ②增大压强(反应前后气体总体积不变) 平衡不移动
2.两种典型的图像
(1)转化率(或百分含量)与温度变化图像
[析图关键] 表示两个外界条件同时变化时,反应物A的转化率变化情况,解决这类图像一般采用“定一议二”的方法,即把自变量(温度、压强)之一设为恒量,讨论另外两个变量的关系。如:图1中,当压强相等(任意一条等压线)时,升高温度,A的转化率增大,说明升高温度平衡向正反应方向移动,即正反应为吸热反应。当温度相等时,在图1中作垂线,与三条等压线交于三点,这三点自下而上为增大压强,A的转化率增大,说明增大压强平衡向正反应方向移动,即正反应为气体体积减小的反应。
(2)转化率(或百分含量)与压强变化图像
[析图关键] 图3中,当温度相等(任意一条等温线)时,增大压强,A的转化率增大,说明增大压强平衡正向移动,即正反应是气体体积减小的反应。当压强相等时,在图3中作垂线,与两条等温线交于两点,这两点自下而上为降低温度,A的转化率增大,说明降低温度平衡正向移动,即正反应为放热反应。
参考答案
真题回顾
1.C [A.该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的幅度大于逆反应的,故v正>v逆,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;B.催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时CH3CH2OH(g)的浓度,B不正确;C.恒容下,充入一定量的H2O(g),H2O(g)的浓度增大,平衡向正反应方向移动,C正确;D.恒容下,充入一定量的CH2===CH2 (g),平衡向正反应方向移动,但是CH2===CH2 (g)的平衡转化率减小,D不正确。]
2.C [实验①中,0~20 min,v(N2)=v(NH3)=×(2.40×10-3 mol·L-1-2.00×10-3 mol·L-1)÷20 min=1.00×10-5 mol·L-1·min-1,A正确;催化剂表面积大小只影响反应速率,不影响平衡,则实验③达平衡时氨气浓度也为4.00×10-4 mol·L-1,而恒温恒容条件下,实验②相对于实验③为减小压强,平衡正向移动,因此实验②60 min时处于平衡状态,x<0.4,即x≠0.4,B正确;实验①、实验②中0~20 min、20~40 min氨气浓度变化量相同,速率相同,实验①是实验②中氨气初始浓度的两倍,相同条件下,增加氨气浓度,反应速率并没有增大,C错误;对比实验①和实验③,氨气浓度相同,实验③中催化剂表面积是实验①中催化剂表面积的2倍,实验③先达到平衡状态,实验③的反应速率大,D正确。]
3.B [A.一定条件下,增大水的浓度,能提高CH4的转化率,即x值越小,CH4的转化率越大,则x1
5.B [A.Ru(Ⅱ)被氧化至Ru(Ⅲ)后,[L-Ru-NH3]2+中的Ru带有更多的正电荷,其与N原子成键后,Ru吸引电子的能力比Ru(Ⅱ)强,这种作用使得配体NH3中的N—H极性变强且更易断裂,因此其失去质子(H+)的能力增强,A说法正确;B.Ru(Ⅱ)中Ru的化合价为+2,当其变为Ru(Ⅲ)后,Ru的化合价变为+3,Ru(Ⅲ)失去1个质子后,N原子有1对孤电子对,Ru的化合价不变;M为[L-Ru-H2]+,当[L-Ru-NH2]+变为M时,N原子的孤电子对拆为2个电子并转移给Ru 1个电子,其中Ru的化合价变为+2,因此,B说法不正确;C.该过程M变为[L-Ru-NH2-NH2-Ru-L]2+时,有N—N形成,N—N是非极性键,C说法正确;D.从整个过程来看,4个NH3失去了2个电子后生成了1个N2H4和2个NH,Ru(Ⅱ)是催化剂,因此,该过程的总反应式为4NH3-2e-===N2H4+2NH,D说法正确。]
6.C [对比两个历程可知,历程Ⅱ中增加了催化剂,降低了反应的活化能,加快了反应速率。A项,催化剂能降低活化能,但是不能改变反应的焓变,因此E6-E3=E5-E2,A正确;B项,已知Cl2(g)的相对能量为0,对比两个历程可知,Cl(g)的相对能量为(E2-E3) kJ·mol-1,则Cl—Cl键能为2(E2-E3) kJ·mol-1,B正确;C项,催化剂不能改变反应的平衡转化率,因此相同条件下,O3的平衡转化率:历程Ⅱ=历程Ⅰ,C错误;D项,活化能越低,反应速率越快,由图像可知,历程Ⅱ中第二步反应的活化能最低,所以速率最快的一步反应的热化学方程式为:ClO(g)+O(g)===O2(g)+Cl(g) ΔH=(E5-E4) kJ·mol-1,D正确;故选C。]
考点剖析
微点1
典题精练
1.D [A.该反应的正反应是气体分子数减小的反应,因此增大压强,平衡向正向进行,但平衡常数K不变,平衡常数K只与温度有关,A项错误;B.升高温度可使该反应的正、逆反应速率均增大,B项错误;C.反应的正反应是放热反应,在一定范围内,降低温度有利于平衡向正向移动,能提高甲醇的生产效率,温度过低不利于反应的进行,C项错误;D.使用高效催化剂,可降低反应的活化能,增大活化分子百分数,增加反应速率,D项正确。]
2.A [=8.99,说明温度升高,k正增大,但不能说明该反应为放热反应,A项错误;加入一定量HI,平衡逆向移动,c(I2)增大,混合气体颜色变深,B项正确;加入一定量氩气,容器内压强增大,但反应体系中各物质浓度不变,反应速率不变,C项正确;加入等物质的量的H2和I2,相当于增大压强,该反应前后气体分子数不变,加压时平衡不移动,故H2转化率不变,D项正确。]
3.D [0~20 min,Q的物质的量减少0.2 mol,生成M的物质的量为0.2 mol,v(M)=0.2 mol÷2 L÷20 min=0.005 mol·L-1·min-1,A项正确;该反应为吸热反应,其他条件不变,升高温度平衡正向移动,N(g)的生成速率和平衡产率均增大,B项正确;80 min时,Q反应0.5 mol,M的物质的量为0.5 mol,N的物质的量为0.5 mol,c(M)=c(N)=0.5 mol÷2 L=0.25 mol·L-1,Qc=c(M)·c(N)=0.25×0.25=0.062 5=K,说明80 min时反应达到平衡状态,由于催化剂不影响化学平衡,故其他条件不变,加入催化剂,80 min时Q(s)的转化率不变,C项正确;若起始时向该容器中加入2.00 mol Q(s),设达平衡时c(M)=c(N)=x mol·L-1,则K=c(M)·c(N)=x2=0.062 5,解得x=0.25,故D项错误。]
微点2
典题精练
4.B [根据图示,升高温度,CH4的平衡转化率减小,说明平衡逆向移动,则正反应为放热反应,ΔH<0,A项错误;S8(s) 4S2(g)为吸热反应,2S2(g)+CH4(g) CS2(g)+2H2S(g)为放热反应,升高温度,S8(s) 4S2(g)平衡正向移动,S8分解率增大,2S2(g)+CH4(g) CS2(g)+2H2S(g)平衡逆向移动,S2体积分数增大,B项正确;向平衡体系中充入稀有气体,体系中各物质浓度不变,平衡不移动,C项错误;其他条件相同,S2体积分数增大,相当于增大S2浓度,2S2(g)+CH4(g) CS2(g)+2H2S(g)平衡正向移动,CH4的平衡转化率增大,D项错误。]
5.C [A.由题干图像信息可知,a点X的转化率为30%,故a点X的反应速率为:v(X)==0.03 mol·L-1·min-1,根据反应速率之比等于化学计量数之比,故a点的反应速率v(Z)=2v(X)=2×0.03 mol·L-1·min-1=0.06 mol·L-1·min-1,A错误;B.由题干图像信息可知,a、b两点10 min时未达到平衡,而c点10 min时达到平衡,温度越高正、逆反应速率越快,且b、c点浓度差异较小,故a、b、c点对应的v(Y)逆大小关系为:c>b>a,B错误;C.由题干图像信息可知,c点时反应达到化学平衡,故有每消耗3 mol Y的同时消耗2 mol Z即正、逆反应速率相等,C正确;D.由反应方程式可知X(g)+3Y(g) 2Z(g)正反应是一个气体体积减小的反应,若将容器体积扩大为2倍,即减小容器压强,平衡逆向移动,则c点对应温度下的α(X)减小,D错误。]
6.D [温度升高,SCl2的平衡转化率增大,说明平衡正向移动,根据化学平衡移动原理,升温平衡向吸热方向移动,知该反应的ΔH>0,A项错误;55 ℃,0~10 min,SCl2(g)的转化率为50%,v(SCl2)==0.025 mol·L-1·min-1,则v(S2Cl2)=v(SCl2)=0.012 5 mol·L-1·min-1,B项错误;反应体系中全为气体,气体质量不变,反应前后气体分子数不变,即气体物质的量不变,则混合气体的平均相对分子质量始终不变,C项错误;由图可知,82 ℃,反应达平衡时SCl2的转化率为90%,列三段式:
则该温度下平衡常数K==20.25,若起始时在该密闭容器中充入SCl2、S2Cl2和Cl2各5 mol,则此时的浓度商Q==1
同课章节目录
