湖南省长沙市重点中学2023-2024学年高二上学期12月阶段考试化学试题(PDF版含答案)
文档属性
| 名称 | 湖南省长沙市重点中学2023-2024学年高二上学期12月阶段考试化学试题(PDF版含答案) | 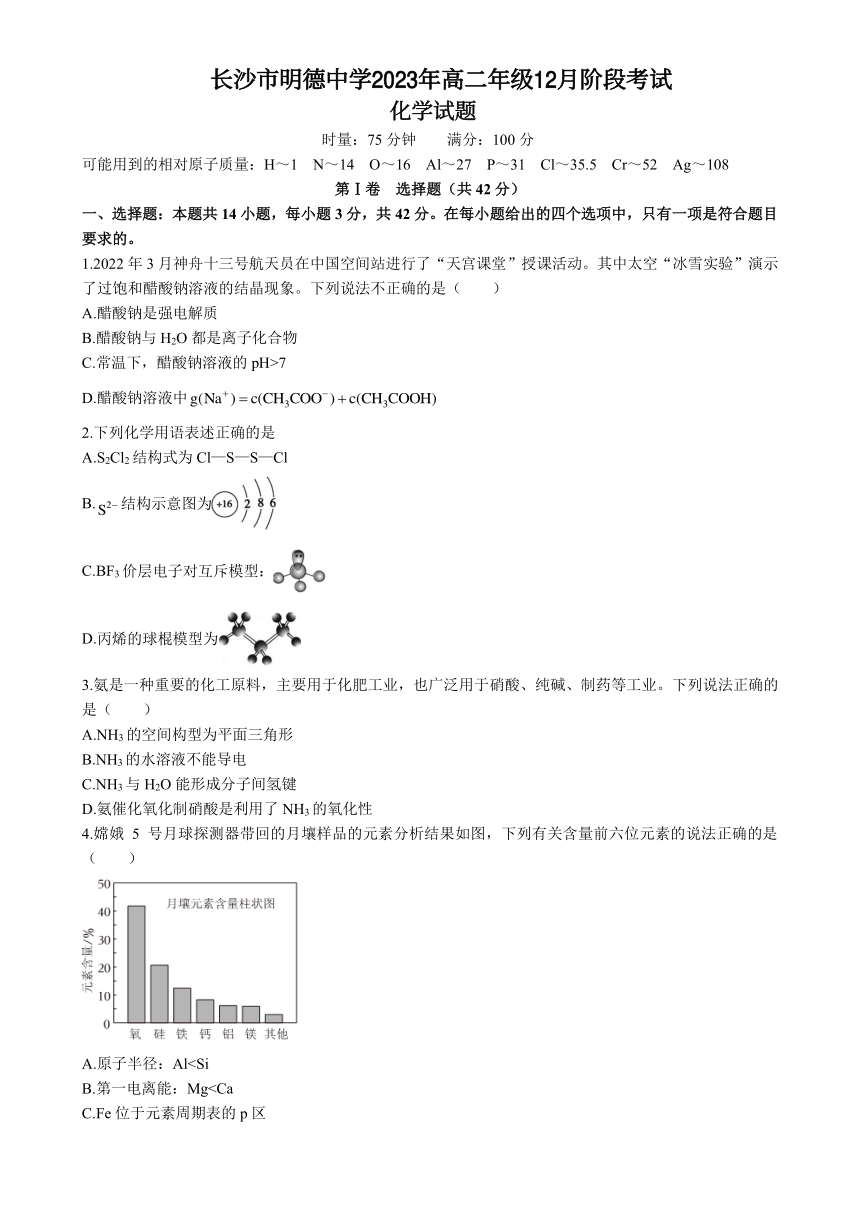 | |
| 格式 | |||
| 文件大小 | 905.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-29 11:08:40 | ||
图片预览



文档简介
长沙市明德中学2023年高二年级12月阶段考试
化学试题
时量:75 分 钟 满分:100 分
可能用到的相对原子质量:H~1 N~14 O~16 Al~27 P~31 Cl~35.5 Cr~52 Ag~108
第Ⅰ卷 选择题(共 42 分)
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.2022 年 3 月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示
了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
A.醋酸钠是强电解质
B.醋酸钠与 H2O 都是离子化合物
C.常温下,醋酸钠溶液的 pH>7
D.醋酸钠溶液中g(Na+ ) = c(CH 3COO ) + c(CH3COOH)
2.下列化学用语表述正确的是
A.S2Cl2 结构式为 Cl—S—S—Cl
B.S2 结构示意图为
C.BF3 价层电子对互斥模型:
D.丙烯的球棍模型为
3.氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业。下列说法正确的
是( )
A.NH3 的空间构型为平面三角形
B.NH3 的水溶液不能导电
C.NH3 与 H2O 能形成分子间氢键
D.氨催化氧化制硝酸是利用了 NH3 的氧化性
4.嫦娥 5 号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
( )
A.原子半径:AlB.第一电离能:MgC.Fe 位于元素周期表的 p 区
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
D.这六种元素中,电负性最大的是 O
5.已知 ICH3COOH +Cl2
2→ClCH2COOH +HCl 。下列有关说法正确的是( )
A.HCl 的电子式为
B.I-I 键的键长比 Cl-Cl 键短
C.CH3COOH 分子中只有 σ 键
D.ClCH2COOH 的酸性比 ICH2COOH 强
6.下列类比或推理合理的是( )
选项 已知 方法 结论
A 沸点:Cl2B 酸性:HClO4>HIO4 类比 酸性:HCl>HI
C 金属性:Fe>Cu 推理 氧化性:Fe3+D Ksp:Ag2CrO47.短周期元素 X、Y、Z、W、Q 原子序数依次增大。基态 X、Z 原子均有两个单电子,W 简单离子在同周
期离子中半径最小,Q 原子在同周期主族元素中原子半径最小。下列说法错误的是( )
A.X 能与多种元素形成共价键
B.YQ3 是非极性分子
C.第一电离能:Y>Z
D.熔点:W2Z3>WQ3
8.设阿伏加德罗常数为 NA,下列说法不正确的是( )
A.常温下,pH=12 的 Na2CO3溶液中OH
数目为 0.01NA
B.1mol H2S 分子中,S 原子的价层电子对数目为 4NA
C.标准状况下,32g N2H4分子中含有的 σ 键数目为 5NA
D.含1mol Cl 的 NH4Cl 溶液中加入适量氨水使溶液呈中性,此时溶液中 NH
+
4 数目为 NA
9.实验室用含锰废料(主要成分是 MnCO3)制备功能材料 MnO2的流程如图所示:
下列说法错误的是( )
A.气体 X 的中心原子为 sp 杂化
B“电解”装置中阳极电势高于阴极电势
C.电解时阳极的电极反应式为: 2H2O 4e
=O2 +4H
+
D.电解余液经处理后可返回“酸溶”工序循环利用
10.下列图示装置不能达到实验目的的是( )
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
甲 乙 丙 丁
A.装置甲用 CCl4萃取溴水中的 Br2
B.装置乙制备无水 MgCl2
C.装置丙在铁上镀铜
D.装置丁验证铁的吸氧腐蚀
11.电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,
发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2 + 6OH
= IO 3 + 5I
+ 3H2O 。下列说法不正
确的是( )
A.电解结束时,右侧溶液中含有 IO 3
B.左侧发生的电极方程式: 2H2O+ 2e
= H +2OH 2
通电
C.电解槽内发生反应的总化学方程式:KI + 3H2O=== KIO3 + 3H2
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式会改变
12.氢卤酸的能量关系如图所示,下列说法正确的是( )
A.已知 HF 气体溶于水放热,则 HF 的 H1<0
B.相同条件下,HCl 的 H2比 HBr 的小
C.相同条件下,HCl 的( H3+ H4)比 HI 的大
D.一定条件下,气态原子生成 1mol H—X 键放出 a kJ 能量,则该条件下 H2 = akJ mol
1
13.在常温下,向 10mL 浓度均为0.1mol L 1的 NaOH 和 Na2CO3 混合溶液中滴加0.1 mol L
1 的盐酸,溶液
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
pH 随盐酸加入体积的变化如图所示。下列说法正确的是( )
A.在 a 点的溶液中: c(Na+ ) c(CO2 3 ) c(Cl
) c(OH ) c(H+ )
B.在 b 点的溶液中: 2n(CO2 3 ) + n(HCO
3 ) 0.001mol
C.在 c 点的溶液 pH<7,是因为此时HCO 3 的电离能力大于其水解能力
D.若将0.1mol L 1 的盐酸换成同浓度的醋酸,当滴至溶液的 pH=7 时: c(Na+ ) = c(CH3COO
)
14.在密闭容器中发生反应: 2 A(g) +B(g) 2C(g) ,往密闭容器中以 n(A):n(B)=2:1 通入两种反应物,
15min 后 A 在四温度下的转化率如下表所示,且 T1温度 T2 T3 T4
转化率 70% 70% 60%
A.该反应是吸热反应
B.T 温度时(T2C.T3 温度下,若反应在 15min 后继续进行,则 A 的转化率变大
D.T4 温度反应 15min 后,若 c(B) = 0.5 mol L
1,则 T4温度时的平衡常数是 4.5
第Ⅱ卷 非选择题(共 58 分)
二、非选择题:此题包括 4 小题,每空 2 分,共 58 分。
15.(14 分)氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族
元素。回答下列问题:
(1)砷在元素周期表中的位置_________。
已知:P(s,白磷)=P(s,黑磷) H = 39.3 kJ mol 1;
P(s,白磷)=P(s,红磷) H = 17.6 kJ mol 1;
由此推知,其中最稳定的磷单质是________。
(2)沸点:N2H4_______P2H4(填“>”或“<”),判断依据是_________________________________。
(3)PH3和 NH3 与卤化氢的反应相似,产物的结构和性质也相似。下列对 PH3 与 HI 反应产物的推断正确
的是_________(填序号)。
a.不能与 NaOH 反应 b.含离子键、共价键 c.能与水反应
(4)SbCl3能发生较强烈的水解,生成难溶的 SbOCl,写出该反应的化学方程式_____________________,
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
因此,配制 SbCl3 溶液应注意_______________。
16.(16 分)某油脂厂废弃的油脂加氢镍催化剂主要含金属 Ni、Al、Fe 及其氧化物,还有少量其他不溶性
物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时( c = 0.01mol L 1)的 pH 7.2 3.7 2.2 7.5
沉淀完全时( c =1.0 10 5 mol L 1 )的 pH 8.7 4.7 3.2 9.0
回答下列问题:
(1)基态 S 原子的价电子中,两种自旋状态的电子数之比为_________,基态 28Ni 原子价层电子排布式
___________________________。
(2)“碱浸”中 NaOH 有两个作用:除去_________和溶解铝及其氧化物,写出 NaOH 溶液溶解 Al 的离子
方程式____________________________________________________。
(3)“转化”中可替代 H2O2 的物质是___________。若工艺流程改为先“调 pH”后“转化”,即
,“滤液③”中可能含有的杂质离子为__________。
(4)如果“转化”后的溶液中 Ni2+浓度为1.0mol L 1,则“调 pH”应控制的 pH 范围是____________。
(5)硫酸镍在强碱溶液中用 NaClO 氧化,可沉淀出能用作镍镉电池正极材料的 NiOOH。写出该反应的离
子方程式________________________________________。
17.(14 分)金属镓(31Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与
铝是同主族元素,性质相似。
(1)铝原子核外共有_______种不同能量的电子。用铝和金属氧化物反应制备金属单质是工业上较常用的
高温
方法。如: 2Al + 4BaO=== 3Ba +BaO Al2O3。常温下 Al 的金属性比 Ba 的金属性_______(选填“强”、
“弱”)。利用上述方法可制取 Ba 的主要原因是_______。
A.高温时 Al 的活泼性大于 Ba B.高温有利于 BaO 分解
C.高温时 BaO·Al2O3 比 Al2O3 稳定 D.Ba 的沸点比 Al 的低
(2)下列有关镓和镓的化合物的说法正确的是________。
A.基态 Ga 原子价层电子的轨道表示式:
B.常温下,Ga 可与水剧烈反应放出氢气
C.一定条件下,Ga2O3 可与 NaOH 反应生成盐
D.Ga2O3可由 Ga(OH)3 受热分解得到
(3)GaAs 是共价化合物,一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
①下列事实不能用元素周期律解释的是________(填字母)。
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释 As 元素显负价的原因_______________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式____
_________________________________________________________。
18.探索 CO 和 NO2 这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列
问题:
I.CO 可以与 H2反应制备合成天然气(SNG)。涉及反应如下:
CO 甲烷化:CO(g) + 3H2 (g) CH4 (g) +H2O(g) H1 = 206.2kJ mol
1
水煤气变换:CO(g) +H2O(g) CO2(g) +H2(g) H2 = 41.2kJ mol
1
(1)反应CO2 (g) + 4H2 (g) CH4 (g) + 2H2O(g)的 H=________ kJ mol
1 。分别在 V L 恒温密闭容器 A(恒
容)、B(恒压,容积可变)中,加入 1mol CO2和 4mol H2的混合气体。两容器中反应达平衡后放出或吸收
的热量较多的是_______(填“A”或“B”)。
k
II.NO2 可发生二聚反应生成 N2O4,化学方程式为 2NO (g)
正
2 N2O4 (g) 。该反应达到平衡后,升高温度k逆
可使体系颜色加深。
(2)已知该反应的正反应速率方程为 v 正=k 正 c2(NO2),逆反应速率方程为 v 逆=k 逆 c(N2O4),其中 k 正、k 逆
1
分别为正、逆反应的速率常数。如图(lg k表示速率常数的对数; 表示温度的倒数)所示①、②、③、
T
1 1
④四条斜线中,lg k 正随 变化关系的是斜线③,则 lg k 逆随 变化关系的是斜线_______。
T T
(3)图中 A、B、C、D 点的纵坐标分别为 a+0.5、a+1.5、a-0.5、a-1.5,则 T1 温度时该反应的化学平衡
常数 K=________ L mol 1。
已知 T1 温度时,某时刻恒容密闭容器中 NO
1
2、N2O4 浓度均为0.2mol L ,此时 v 正______v 逆。(填“>”、
“=”或“<”)
(4)工业上利用 NaOH 溶液吸收 NO 气体,发生反应:2NO + 2OH = NO + NO 2 2 2 3 +H2O。NO3 空间结
构为_________________,比较 NO 2 与 NO
3 的键角大小,并解释原因:_____________________________。
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
化学试题
时量:75 分 钟 满分:100 分
可能用到的相对原子质量:H~1 N~14 O~16 Al~27 P~31 Cl~35.5 Cr~52 Ag~108
第Ⅰ卷 选择题(共 42 分)
一、选择题:本题共 14 小题,每小题 3 分,共 42 分。在每小题给出的四个选项中,只有一项是符合题目
要求的。
1.2022 年 3 月神舟十三号航天员在中国空间站进行了“天宫课堂”授课活动。其中太空“冰雪实验”演示
了过饱和醋酸钠溶液的结晶现象。下列说法不正确的是( )
A.醋酸钠是强电解质
B.醋酸钠与 H2O 都是离子化合物
C.常温下,醋酸钠溶液的 pH>7
D.醋酸钠溶液中g(Na+ ) = c(CH 3COO ) + c(CH3COOH)
2.下列化学用语表述正确的是
A.S2Cl2 结构式为 Cl—S—S—Cl
B.S2 结构示意图为
C.BF3 价层电子对互斥模型:
D.丙烯的球棍模型为
3.氨是一种重要的化工原料,主要用于化肥工业,也广泛用于硝酸、纯碱、制药等工业。下列说法正确的
是( )
A.NH3 的空间构型为平面三角形
B.NH3 的水溶液不能导电
C.NH3 与 H2O 能形成分子间氢键
D.氨催化氧化制硝酸是利用了 NH3 的氧化性
4.嫦娥 5 号月球探测器带回的月壤样品的元素分析结果如图,下列有关含量前六位元素的说法正确的是
( )
A.原子半径:Al
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
D.这六种元素中,电负性最大的是 O
5.已知 ICH3COOH +Cl2
2→ClCH2COOH +HCl 。下列有关说法正确的是( )
A.HCl 的电子式为
B.I-I 键的键长比 Cl-Cl 键短
C.CH3COOH 分子中只有 σ 键
D.ClCH2COOH 的酸性比 ICH2COOH 强
6.下列类比或推理合理的是( )
选项 已知 方法 结论
A 沸点:Cl2
C 金属性:Fe>Cu 推理 氧化性:Fe3+
期离子中半径最小,Q 原子在同周期主族元素中原子半径最小。下列说法错误的是( )
A.X 能与多种元素形成共价键
B.YQ3 是非极性分子
C.第一电离能:Y>Z
D.熔点:W2Z3>WQ3
8.设阿伏加德罗常数为 NA,下列说法不正确的是( )
A.常温下,pH=12 的 Na2CO3溶液中OH
数目为 0.01NA
B.1mol H2S 分子中,S 原子的价层电子对数目为 4NA
C.标准状况下,32g N2H4分子中含有的 σ 键数目为 5NA
D.含1mol Cl 的 NH4Cl 溶液中加入适量氨水使溶液呈中性,此时溶液中 NH
+
4 数目为 NA
9.实验室用含锰废料(主要成分是 MnCO3)制备功能材料 MnO2的流程如图所示:
下列说法错误的是( )
A.气体 X 的中心原子为 sp 杂化
B“电解”装置中阳极电势高于阴极电势
C.电解时阳极的电极反应式为: 2H2O 4e
=O2 +4H
+
D.电解余液经处理后可返回“酸溶”工序循环利用
10.下列图示装置不能达到实验目的的是( )
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
甲 乙 丙 丁
A.装置甲用 CCl4萃取溴水中的 Br2
B.装置乙制备无水 MgCl2
C.装置丙在铁上镀铜
D.装置丁验证铁的吸氧腐蚀
11.电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,
发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2 + 6OH
= IO 3 + 5I
+ 3H2O 。下列说法不正
确的是( )
A.电解结束时,右侧溶液中含有 IO 3
B.左侧发生的电极方程式: 2H2O+ 2e
= H +2OH 2
通电
C.电解槽内发生反应的总化学方程式:KI + 3H2O=== KIO3 + 3H2
D.如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式会改变
12.氢卤酸的能量关系如图所示,下列说法正确的是( )
A.已知 HF 气体溶于水放热,则 HF 的 H1<0
B.相同条件下,HCl 的 H2比 HBr 的小
C.相同条件下,HCl 的( H3+ H4)比 HI 的大
D.一定条件下,气态原子生成 1mol H—X 键放出 a kJ 能量,则该条件下 H2 = akJ mol
1
13.在常温下,向 10mL 浓度均为0.1mol L 1的 NaOH 和 Na2CO3 混合溶液中滴加0.1 mol L
1 的盐酸,溶液
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
pH 随盐酸加入体积的变化如图所示。下列说法正确的是( )
A.在 a 点的溶液中: c(Na+ ) c(CO2 3 ) c(Cl
) c(OH ) c(H+ )
B.在 b 点的溶液中: 2n(CO2 3 ) + n(HCO
3 ) 0.001mol
C.在 c 点的溶液 pH<7,是因为此时HCO 3 的电离能力大于其水解能力
D.若将0.1mol L 1 的盐酸换成同浓度的醋酸,当滴至溶液的 pH=7 时: c(Na+ ) = c(CH3COO
)
14.在密闭容器中发生反应: 2 A(g) +B(g) 2C(g) ,往密闭容器中以 n(A):n(B)=2:1 通入两种反应物,
15min 后 A 在四温度下的转化率如下表所示,且 T1
转化率 70% 70% 60%
A.该反应是吸热反应
B.T 温度时(T2
D.T4 温度反应 15min 后,若 c(B) = 0.5 mol L
1,则 T4温度时的平衡常数是 4.5
第Ⅱ卷 非选择题(共 58 分)
二、非选择题:此题包括 4 小题,每空 2 分,共 58 分。
15.(14 分)氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族
元素。回答下列问题:
(1)砷在元素周期表中的位置_________。
已知:P(s,白磷)=P(s,黑磷) H = 39.3 kJ mol 1;
P(s,白磷)=P(s,红磷) H = 17.6 kJ mol 1;
由此推知,其中最稳定的磷单质是________。
(2)沸点:N2H4_______P2H4(填“>”或“<”),判断依据是_________________________________。
(3)PH3和 NH3 与卤化氢的反应相似,产物的结构和性质也相似。下列对 PH3 与 HI 反应产物的推断正确
的是_________(填序号)。
a.不能与 NaOH 反应 b.含离子键、共价键 c.能与水反应
(4)SbCl3能发生较强烈的水解,生成难溶的 SbOCl,写出该反应的化学方程式_____________________,
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
因此,配制 SbCl3 溶液应注意_______________。
16.(16 分)某油脂厂废弃的油脂加氢镍催化剂主要含金属 Ni、Al、Fe 及其氧化物,还有少量其他不溶性
物质。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):
溶液中金属离子开始沉淀和完全沉淀的 pH 如下表所示:
金属离子 Ni2+ Al3+ Fe3+ Fe2+
开始沉淀时( c = 0.01mol L 1)的 pH 7.2 3.7 2.2 7.5
沉淀完全时( c =1.0 10 5 mol L 1 )的 pH 8.7 4.7 3.2 9.0
回答下列问题:
(1)基态 S 原子的价电子中,两种自旋状态的电子数之比为_________,基态 28Ni 原子价层电子排布式
___________________________。
(2)“碱浸”中 NaOH 有两个作用:除去_________和溶解铝及其氧化物,写出 NaOH 溶液溶解 Al 的离子
方程式____________________________________________________。
(3)“转化”中可替代 H2O2 的物质是___________。若工艺流程改为先“调 pH”后“转化”,即
,“滤液③”中可能含有的杂质离子为__________。
(4)如果“转化”后的溶液中 Ni2+浓度为1.0mol L 1,则“调 pH”应控制的 pH 范围是____________。
(5)硫酸镍在强碱溶液中用 NaClO 氧化,可沉淀出能用作镍镉电池正极材料的 NiOOH。写出该反应的离
子方程式________________________________________。
17.(14 分)金属镓(31Ga)应用广泛,在半导体和光电材料、合金、磁性材料等领域都有重要应用。镓与
铝是同主族元素,性质相似。
(1)铝原子核外共有_______种不同能量的电子。用铝和金属氧化物反应制备金属单质是工业上较常用的
高温
方法。如: 2Al + 4BaO=== 3Ba +BaO Al2O3。常温下 Al 的金属性比 Ba 的金属性_______(选填“强”、
“弱”)。利用上述方法可制取 Ba 的主要原因是_______。
A.高温时 Al 的活泼性大于 Ba B.高温有利于 BaO 分解
C.高温时 BaO·Al2O3 比 Al2O3 稳定 D.Ba 的沸点比 Al 的低
(2)下列有关镓和镓的化合物的说法正确的是________。
A.基态 Ga 原子价层电子的轨道表示式:
B.常温下,Ga 可与水剧烈反应放出氢气
C.一定条件下,Ga2O3 可与 NaOH 反应生成盐
D.Ga2O3可由 Ga(OH)3 受热分解得到
(3)GaAs 是共价化合物,一种重要的半导体材料。As 与 Ga 同周期,As 与 N 同主族。
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
①下列事实不能用元素周期律解释的是________(填字母)。
a.碱性:Ga(OH)3>Al(OH)3
b.非金属性:As>Ga
c.酸性:H3AsO4>H3AsO3
②GaAs 中,As 元素化合价为-3 价,用原子结构理论解释 As 元素显负价的原因_______________________。
③废弃含 GaAs 半导体材料可以用浓硝酸溶解 GaAs,生成 H3AsO4 和 Ga3+,写出该反应的化学方程式____
_________________________________________________________。
18.探索 CO 和 NO2 这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列
问题:
I.CO 可以与 H2反应制备合成天然气(SNG)。涉及反应如下:
CO 甲烷化:CO(g) + 3H2 (g) CH4 (g) +H2O(g) H1 = 206.2kJ mol
1
水煤气变换:CO(g) +H2O(g) CO2(g) +H2(g) H2 = 41.2kJ mol
1
(1)反应CO2 (g) + 4H2 (g) CH4 (g) + 2H2O(g)的 H=________ kJ mol
1 。分别在 V L 恒温密闭容器 A(恒
容)、B(恒压,容积可变)中,加入 1mol CO2和 4mol H2的混合气体。两容器中反应达平衡后放出或吸收
的热量较多的是_______(填“A”或“B”)。
k
II.NO2 可发生二聚反应生成 N2O4,化学方程式为 2NO (g)
正
2 N2O4 (g) 。该反应达到平衡后,升高温度k逆
可使体系颜色加深。
(2)已知该反应的正反应速率方程为 v 正=k 正 c2(NO2),逆反应速率方程为 v 逆=k 逆 c(N2O4),其中 k 正、k 逆
1
分别为正、逆反应的速率常数。如图(lg k表示速率常数的对数; 表示温度的倒数)所示①、②、③、
T
1 1
④四条斜线中,lg k 正随 变化关系的是斜线③,则 lg k 逆随 变化关系的是斜线_______。
T T
(3)图中 A、B、C、D 点的纵坐标分别为 a+0.5、a+1.5、a-0.5、a-1.5,则 T1 温度时该反应的化学平衡
常数 K=________ L mol 1。
已知 T1 温度时,某时刻恒容密闭容器中 NO
1
2、N2O4 浓度均为0.2mol L ,此时 v 正______v 逆。(填“>”、
“=”或“<”)
(4)工业上利用 NaOH 溶液吸收 NO 气体,发生反应:2NO + 2OH = NO + NO 2 2 2 3 +H2O。NO3 空间结
构为_________________,比较 NO 2 与 NO
3 的键角大小,并解释原因:_____________________________。
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
{#{QQABIYyAogggQgAAABhCQQ3YCAAQkBCACAoGxAAAsAABAAFABAA=}#}
同课章节目录
