3.1 电离平衡 (含解析)课后练习 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 3.1 电离平衡 (含解析)课后练习 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 519.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-29 11:34:41 | ||
图片预览


文档简介
3.1 电离平衡 课后练习
一、单选题
1.根据下表信息,判断0.10 mol/L的下列各溶液pH最大的是( )
酸 电离常数(常温下)
CH3COOH Ka=1.8×10-5
H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11
H2S Ka1=9.1×10-8,Ka2=1.1×10-12
A.CH3COONa B.Na2CO3 C.NaHCO3 D.Na2S
2.下列物质属于弱电解质的是( )
A.CaCO3 B.CH3CH2OH C.H2O D.SO2
3.下表中物质的分类组合,完全正确的是( )
编号 A B C D
强电解质 KNO3 H2SO4 Na2SO4 HClO4
弱电解质 NH3·H2O CaCO3 HClO C2H5OH
非电解质 SO2 Al H2O CH3COOH
A.A B.B C.C D.D
4.下列属于酸,又是强电解质的是( )
A.蔗糖 B.醋酸 C.硫酸 D.稀盐酸
5.下表中物质的分类组合完全正确的是 ( )
选项 A B C D
强电解质 KNO3 H2SO4 BaSO4 HClO4
弱电解质 HF CaCO3 H2SO3 CH3COONH4
非电解质 SO3 Al H2O C2H5OH
A.A B.B C.C D.D
6.生菜无土栽培营养液的配方要求KNO3、MgSO4、NH4NO3 物质的量之比为1∶2∶1。配制该营养液,已溶解0.02 mol KNO3、0.02 mol NH4NO3,还需MgSO4的质量为( )
A.1.2 g B.2.4 g C.3.6 g D.4.8 g
7.下列过程中:①电离、②电解、③电镀、④电焊、⑤电化学腐蚀,需要通电才能进行的是( )
A.①② B.②③④ C.③④⑤ D.全部
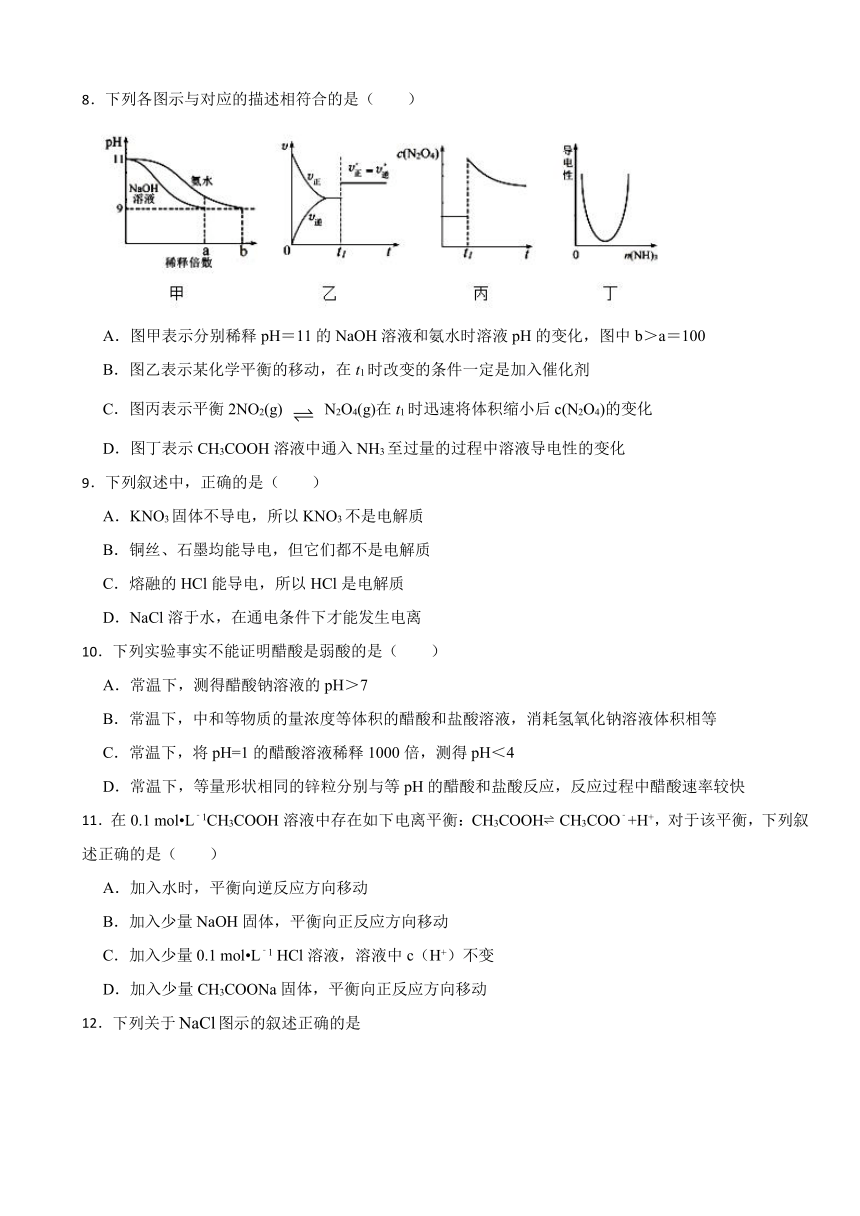
8.下列各图示与对应的描述相符合的是( )
A.图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B.图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C.图丙表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D.图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
9.下列叙述中,正确的是( )
A.KNO3固体不导电,所以KNO3不是电解质
B.铜丝、石墨均能导电,但它们都不是电解质
C.熔融的HCl能导电,所以HCl是电解质
D.NaCl溶于水,在通电条件下才能发生电离
10.下列实验事实不能证明醋酸是弱酸的是( )
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,中和等物质的量浓度等体积的醋酸和盐酸溶液,消耗氢氧化钠溶液体积相等
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快
11.在0.1 mol L﹣1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO﹣+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol L﹣1 HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正反应方向移动
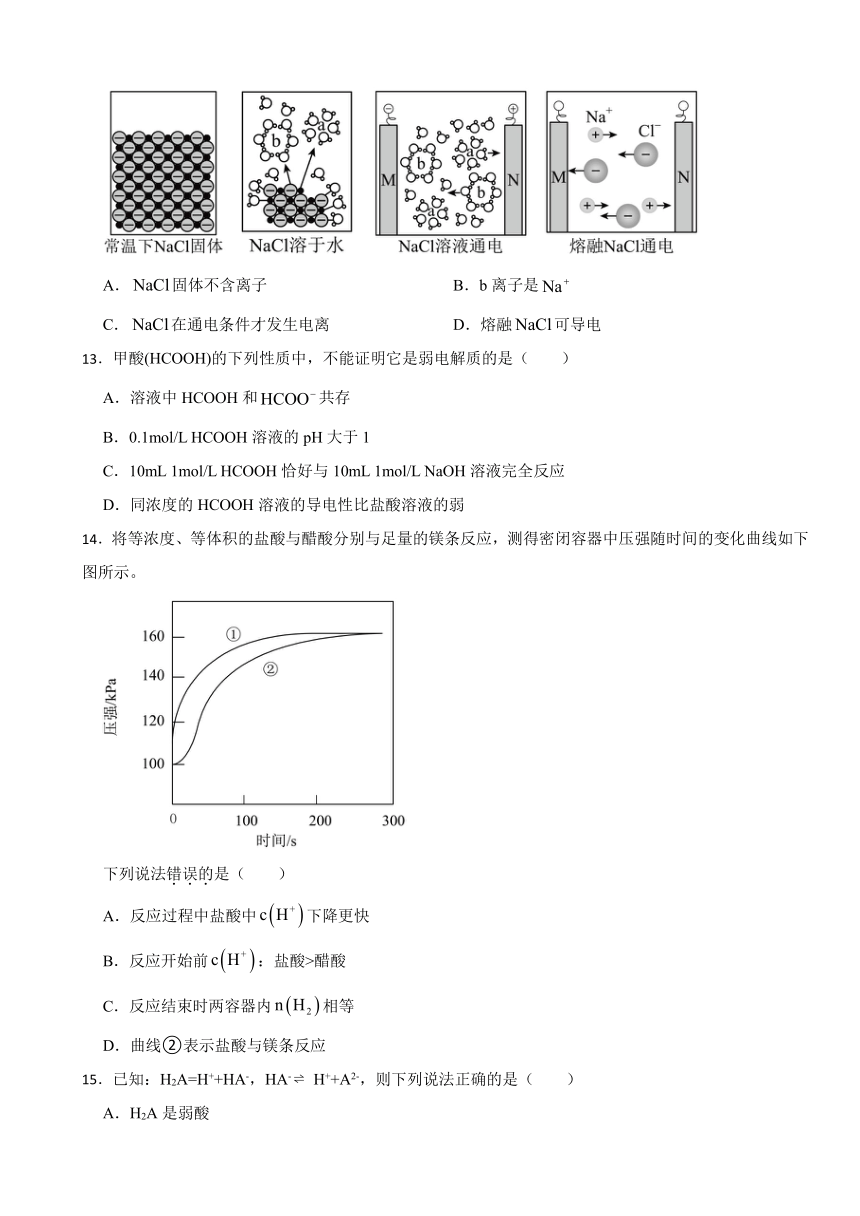
12.下列关于图示的叙述正确的是
A.固体不含离子 B.b离子是
C.在通电条件才发生电离 D.熔融可导电
13.甲酸(HCOOH)的下列性质中,不能证明它是弱电解质的是( )
A.溶液中HCOOH和共存
B.0.1mol/L HCOOH溶液的pH大于1
C.10mL 1mol/L HCOOH恰好与10mL 1mol/L NaOH溶液完全反应
D.同浓度的HCOOH溶液的导电性比盐酸溶液的弱
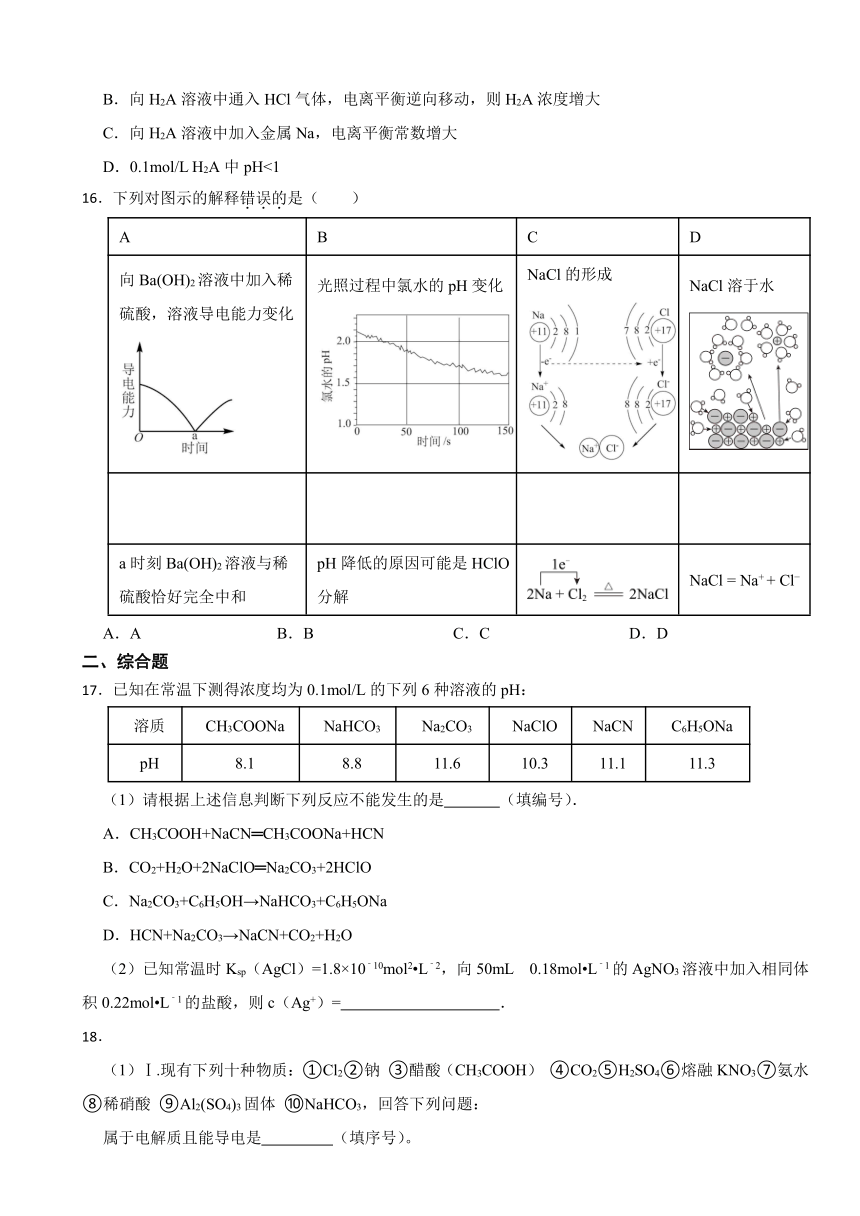
14.将等浓度、等体积的盐酸与醋酸分别与足量的镁条反应,测得密闭容器中压强随时间的变化曲线如下图所示。
下列说法错误的是( )
A.反应过程中盐酸中下降更快
B.反应开始前:盐酸>醋酸
C.反应结束时两容器内相等
D.曲线②表示盐酸与镁条反应
15.已知:H2A=H++HA-,HA- H++A2-,则下列说法正确的是( )
A.H2A是弱酸
B.向H2A溶液中通入HCl气体,电离平衡逆向移动,则H2A浓度增大
C.向H2A溶液中加入金属Na,电离平衡常数增大
D.0.1mol/L H2A中pH<1
16.下列对图示的解释错误的是( )
A B C D
向Ba(OH)2溶液中加入稀 硫酸,溶液导电能力变化 光照过程中氯水的pH变化 NaCl的形成 NaCl溶于水
a时刻Ba(OH)2溶液与稀 硫酸恰好完全中和 pH降低的原因可能是HClO分解 NaCl = Na+ + Cl
A.A B.B C.C D.D
二、综合题
17.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN C6H5ONa
pH 8.1 8.8 11.6 10.3 11.1 11.3
(1)请根据上述信息判断下列反应不能发生的是 (填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
D.HCN+Na2CO3→NaCN+CO2+H2O
(2)已知常温时Ksp(AgCl)=1.8×10﹣10mol2 L﹣2,向50mL 0.18mol L﹣1的AgNO3溶液中加入相同体积0.22mol L﹣1的盐酸,则c(Ag+)= .
18.
(1)Ⅰ.现有下列十种物质:①Cl2②钠 ③醋酸(CH3COOH) ④CO2⑤H2SO4⑥熔融KNO3⑦氨水 ⑧稀硝酸 ⑨Al2(SO4)3固体 ⑩NaHCO3,回答下列问题:
属于电解质且能导电是 (填序号)。
(2)写出①与水反应的化学方程式 。
(3)写出⑩溶于水时的电离方程式 。
(4)Ⅱ. 按要求回答下列问题:
画 出 Cl-结构示意图 : 。
(5)请用 的形式,写出质子数为8,中子数为10 的微粒符号 。
(6)某金属氯化物 MCl2 40.5g 中含有 0.6mol Cl-,则M的摩尔质量为 。
(7)相同温度和体积的 A 和 B 两容器,A容器中充满CO2,B容器中充满 O3,若密度相同,则二氧化碳和臭氧的物质的量之比为: 。
(8)将24.5g H2SO4溶于水配成500mL溶液,其中SO42-的物质的量浓度为 。
19.在抗击新型冠状病毒疫情期间,酸性KMnO4、NaClO、H2O2等被广泛用于此次抗疫行动中。
(1)向浸泡铜片的稀硫酸中加入H2O2后,铜片溶解,该反应的离子方程式为 。
(2)取300mL0.3mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量为 mol。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
①简要说明K2FeO4作为水处理剂时所起的作用 。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是 。
(4)NaClO是“84”消毒液的有效成分,含氯消毒剂中HClO的消毒效果远高于ClO-。
①“84”消毒液必须避光密封保存,目的是防止与空气中的CO2反应而变质,该反应的离子方程式为 (HClOKa=2.0×10-8H2CO3Ka1=4.3×10-7Ka2=5.6×10-11)。
②过量NaClO溶液可使酸性废水中NH4+完全转化为N2,该反应的离子方程式为 ,若处理废水产生了0.336LN2(标准状况),则需消耗有效氯为5%的“84”消毒液的质量为 g。(“有效氯”指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,常以百分数表示)。
20.有以下物质:①FeCl3;②稀NaOH溶液;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦稀盐酸;⑧纯醋酸;⑨Na2CO3;
(1)其中能导电的是 ;属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式 。
(4)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是
(5)现取0.1mol样品⑨,逐滴加入⑦,现象为 ,其所发生的离子方程式为 。完全反应时生成气体的物质的量为 。
21.25℃时,两种常见酸的电离平衡常数如表所示。
Ka1 Ka2
H2SO3 1.3×10-2 6.3×10-8
H2CO3 4.2×10-7 5.6×10-11
(1)①HCO 的电离平衡常数表达式K= 。
②SO 、HSO 、CO 、HCO 结合H+的能力由强到弱的顺序为 ;向Na2SO3溶液中通入CO2反应的离子方程式为 。
(2)已知HnA为n元弱酸。
①写出HnA与足量NaOH反应的离子方程式: 。
②HnA的电离方程式为 (写第一步电离)。
答案解析部分
1.【答案】D
【解析】【解答】根据题干表格中的酸的电离平衡常数可知,酸性的强弱顺序为:CH3COOH>H2CO3>H2S> >HS-,根据越弱越水解的规律可知,水解能力强弱顺序为:S2-> >HS-> >CH3COO-,故0.10 mol/L的下列各溶液pH最大的是Na2S,
故答案为:D。
【分析】电离常数越低产生的氢离子越少,pH值越低
2.【答案】C
【解析】【解答】A.CaCO3是难溶性物质,但溶于水部分是完全电离的,属于强电解质,A不符合题意;
B.CH3CH2OH是由分子构成的物质,易溶于水的物质,在水中和熔融状态下都不能发生电离而导电,属于非电解质,B不符合题意;
C.H2O能够极微弱的电离产生H+、OH-,存在电离平衡,因此H2O是弱电解质,C符合题意;
D.SO2是由分子构成的物质,在水中和熔融状态下都不能因自身发生电离而导电,因此属于非电解质,D不符合题意;
故答案为:C。
【分析】电解质是指在水溶液中或熔融状态下能导电的化合物,弱电解质是不完全电离的电解质。
3.【答案】A
【解析】【解答】A.硝酸钾为强电解质,一水合氨为弱电解质,二氧化硫为非电解质,故A符合题意;
B.碳酸钙为强电解质,故B不符合题意;
C.水为弱电解质,故C不符合题意;
D.乙醇为非电解质,醋酸为弱电解质,故D不符合题意;
故答案为:A。
【分析】掌握常见物质的分类:强酸和强碱和大多数盐为强电解质,弱酸或弱碱为弱电解质,其余化合物为非电解质。
4.【答案】C
【解析】【解答】A.蔗糖水溶液中不导电,是化合物,属于非电解质,A不符合题意;
B.醋酸水溶液中能导电,是化合物,为电解质,水溶液中只能部分电离,属于弱电解质,B不符合题意;
C.硫酸水溶液中完全电离,是化合物,为强电解质,电离产生阳离子都是氢离子,为酸,C符合题意;
D.稀盐酸为混合物,不是电解质,D不符合题意;
故答案为:A
【分析】电离产生的阳离子都是氢离子的化合物为酸;水溶液中能完全电离的电解质为强电解质,只能部分电离的电解质为弱电解质,单质和混合物既不是电解质也不是非电解质,据此判断。
5.【答案】A
【解析】【解答】A、KNO3是强电解质,HF是弱电解质,SO2是非电解质,所以A符合题意;
B、CaCO3是强电解质,电解质和非电解质都是化合物,所以金属铝既不是电解质又不是非电解质,B不符合题意;
C、因为H2O自身部分电离,所以水是弱电解质,而不是非电解质,C不符合题意;
D、CH3COONH4它在水溶液中完全电离,所以是强电解质,不是弱电解质,D不符合题意。
故答案为:A。
【分析】本题考查电解质、非电解质等相关概念。电解质:在水溶液或熔融状态下能够导电的化合物称为电解质,酸、碱、盐、活泼金属的氧化物都是电解质;非电解质:在水溶液和熔融状态下都不能够导电的化合物称为电解质,大多数有机物、非金属氧化物、气态氢化物都是非电解质;据此分析解答。
6.【答案】D
【解析】【解答】已溶解0.02 mol KNO3、0.02 mol NH4NO3,根据KNO3、MgSO4、NH4NO3物质的量之比为1∶2∶1可知还需MgSO4的物质的量是0.04mol,质量为0.04mol×120g/mol=4.8g,
故答案为:D。
【分析】以物质的量为中心计算,需熟记公式。
7.【答案】B
【解析】【解答】解:①电离是电解质在水溶液中离解出自由移动离子的过程,不需要通电,故①错误;②电解是外加电源强迫下的氧化还原反应,必须加外加电源,需要通电,故②正确;③电镀实质是一个电解池,必须加外加电源,需要通电,故③正确;④电焊利用焊条通过电弧高温融化金属部件需要连接的地方而实现的一种焊接操作,需要通电,故④正确;⑤电化学腐蚀原理是原电池原理,原电池中不含电源,故⑤错误;故选B.
【分析】①电离是电解质在水溶液中离解出自由移动离子的过程;②电解是外加电源强迫下的氧化还原反应;③电镀实质是一个电解池;④电焊需电能融化焊条和钢铁;⑤电化学腐蚀原理是原电池原理.
8.【答案】A
【解析】【解答】A 、NaOH为强碱完全电离,稀释100倍,pH从11变到9,氨水为弱碱部分电离,稀释100倍时,在稀释过程中,氨水会继续电离出OH-,导致溶液中的OH-浓度大于NaOH溶液中的OH-,要使稀释后两者的OH-浓度仍相等,则氨水稀释的倍数要大于100倍,所以b>a=100,A正确;
B、在t1时改变某个条件,反应速率增大,但是平衡不移动,可能是使用了催化剂,也可能是增大了压强,改变压强平衡不一定会移动,B错误;
C、压缩体积,NO2和N2O4的浓度瞬间增大,同时平衡向气体体积缩小的方向移动,即往正方向移动,所以N2O4的浓度继续增大,而丙图中N2O4的浓度在减小,C错误;
D、CH3COOH为弱电解质,导电能力弱,通入氨气后生成强电解质CH3COONH4,导电性增强,继续通入氨气,导电性仍然增强,D错误。正确答案为A。
【分析】B、催化剂不能使化学平衡移动
C、溶液的导电性:取决于可自由移动带电粒子的浓度
9.【答案】B
【解析】【解答】A.KNO3固体中离子受到离子键的作用,不能自由移动,所以不导电,但KNO3固体溶于水或熔融状态下能够发生电离,可以导电,所以KNO3属于电解质,A项不符合题意;
B.铜丝、石墨虽能导电,但均是单质,不是化合物,因此既不是电解质也不是非电解质,B项符合题意;
C.熔融状态下,HCl仍是分子,不会电离成离子,是一种共价化合物,所以不能导电。HCl水溶液状态下可以电离出离子,从而可以导电,所以HCl是电解质,C项不符合题意;
D.NaCl溶于水可电离生成钠离子与氯离子,无需外接电源,D项不符合题意;
故答案为:B。
【分析】 A.电解质是在水溶液中或熔融状态下能导电的化合物;
B.电解质必须是化合物;
C.熔融的HCl为分子,不能导电;
D.电离不需要通电。
10.【答案】B
【解析】【解答】解:A.常温下,测得醋酸钠溶液的pH>7,说明醋酸钠为强碱弱酸盐,水解呈碱性,可证明醋酸为弱酸,故A不选;
B.醋酸为一元酸,氢氧化钠为一元碱,二者恰好反应,不能证明醋酸为弱酸,故B选;
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4,说明加水稀释促进电离,如为强酸,稀释后pH=4,可证明为弱酸,故C不选;
D.常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快,可说明醋酸在反应可进一步电离,说明存在电离平衡,为弱酸,故D不选.
故选B.
【分析】要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
11.【答案】B
【解析】【解答】解:A.加水促进弱电解质的电离,则电离平衡正向移动,故A错误;
B.加入少量NaOH固体,与CH3COOH电离生成的H+结合,使电离平衡正向移动,故B正确;
C.加入少量0.1mol L﹣1HCl溶液,c(H+)增大,pH减小,故C错误;
D.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO﹣)增大,则电离平衡逆向移动,故D错误;
故选B.
【分析】因加入水、加热促进弱电解质的电离,加酸抑制弱酸的电离,加碱能够中和氢离子,促进醋酸电离,加入与弱电解质电离出相同离子的电解质抑制电离,以此来解答.
12.【答案】D
【解析】【解答】A.NaCl固体中含Na+、Cl-,但要溶于水或熔融态离子才可以自由移动,才能导电,A项不符合题意;
B.b离子周围结合的水分子,水分子中的氢原子朝向b离子,说明b离子是阴离子,故b离子为Cl-,B不符合题意;
C.NaCl在溶于水或熔融态发生电离,C项不符合题意;
D.熔融NaCl存在自由移动的离子,可导电,D项符合题意;
故答案为:D。
【分析】A.NaCl是离子化合物;
B.电解池中,与电源正极相连的电极是阳极,与电源负极相连的电极是阴极,内电路中阴离子移向阳极、阳离子移向阴极;
C.NaCl在溶于水或熔融态发生电离,电离不需要通电;
D.熔融NaCl存在自由移动的离子,可导电。
13.【答案】C
【解析】【解答】A.溶液中和共存说明甲酸存在电离平衡,即甲酸为弱电解质,故A不符合题意;
B.0.1mol/L HCOOH溶液的pH大于1,说明溶液中浓度小于0.1mol/L,即甲酸不完全电离,为弱电解质,故B不符合题意;
C.10mL 1mol/L HCOOH恰好与10mL 1mol/L NaOH溶液完全反应,是酸碱中和反应,不能说明甲酸为弱电解质,故C符合题意;
D.同浓度的HCOOH溶液的导电性比盐酸溶液的弱,说明甲酸溶液中自由离子浓度小于盐酸,即甲酸不完全电离,故D不符合题意;
故答案为:C。
【分析】依据弱酸溶液存在电离平衡,不完全电离分析。
14.【答案】D
【解析】【解答】A.HCl完全电离,醋酸存在电离平衡,反应过程中醋酸继续电离,所以反应过程中盐酸中c(H+)下降更快,A不符合题意;
B.相同浓度的一元酸,c(H+):强酸>弱酸,盐酸是强酸、醋酸是弱酸,则相同浓度的盐酸和醋酸反应开始前c(H+):盐酸>醋酸,B不符合题意;
C.反应结束时生成n(H2)与n(酸)成正比,二者都是一元酸且体积和物质的量浓度相等,所以两种酸的物质的量相等,则反应结束时两容器内n(H2)相等,C不符合题意;
D.密闭容器中气体物质的量越大,气体压强越大,开始一段时间内c(H+):盐酸>醋酸,则开始一段时间内生成气体体积:盐酸>醋酸,则曲线①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线,D符合题意;
故答案为:D。
【分析】A.弱酸中存在电离平衡,会减弱这种改变;
B.依据相同浓度的一元酸,c(H+):强酸>弱酸分析;
C.依据一元酸体积和物质的量浓度相等分析;
D.密闭容器中气体物质的量越大,气体压强越大。
15.【答案】D
【解析】【解答】A. H2A完全电离生成H+和HA-,属于强电解质,因此H2A是弱酸不是弱酸,A项不符合题意;
B. 向H2A溶液中通入HCl气体,c(H+)增大,使电离平衡HA- H++A2-逆向移动,但H2A浓度并未增大,B项不符合题意;
C. 电离平衡常数只与温度有关,向H2A溶液中加入金属Na,电离平衡常数不发生变化,C项不符合题意;
D. H2A第一步完全电离,第二步为部分电离,0.1mol/L H2A中H+并未完全电离,因此pH<1,D项符合题意;
故答案为:D。
【分析】A. H2A完全电离生成H+和HA-,属于强电解质;
B. 向H2A溶液中通入HCl气体,使电离平衡HA- H++A2-逆向移动;
C. 电离平衡常数只与温度有关;
D. H2A第一步完全电离,第二步为部分电离,据此分析判断。
16.【答案】C
【解析】【解答】A.向Ba(OH)2溶液中加入稀硫酸,二者反应生成硫酸钡沉淀和水,导电性降低,a时刻导电能力几乎为0,这说明a时刻Ba(OH)2溶液与稀 硫酸恰好完全中和,A不符合题意;
B.光照过程中氯水中的次氯酸分解生成氯化氢和氧气,溶液酸性增强,所以pH减小,B不符合题意;
C.用单线桥表示应该为,C符合题意;
D.氯化钠是电解质,溶于水电离出钠离子和氯离子,D不符合题意;
故答案为:C。
【分析】A、氢氧化钡滴加硫酸导电性想减弱后增强;
B、氯水光照后,酸性增强;
C、电子计算错误;
D、氯化钠在水中电离为钠离子和氯离子。
17.【答案】(1)B;D
(2)9.0×10﹣8mol/L
【解析】【解答】解:(1)六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,
A.CH3COOH酸性大于HCN,反应CH3COOH+NaCN═CH3COONa+HCN能发生,故A正确;
B.酸性H2CO3>HClO>HCO3﹣,应生成NaHCO3,反应CO2+H2O+2NaClO═Na2CO3+2HClO不能发生,故B错误;
C.酸性C6H5OH>HCO3﹣,反应Na2CO3+C6H5OH→NaHCO3+C6H5ONa能发生,故C正确;
D.酸性H2CO3>C6H5OH>HCO3﹣,反应生成碳酸氢钠,正确反应为CO2+H2O+C6H5ONa→NaHCO3+C6H5OH反,故D错误,
故答案为:BD;(2)向50mL 0.018mol L﹣1的AgNO3溶液中加入相同体积0.020mol L﹣1的盐酸,盐酸过量,反应后的c(Cl﹣)= =0.002mol/L,
则:c(Ag+)= mol/L=9×10﹣8mol/L,
故答案为:9.0×10﹣8 mol/L.
【分析】(1)六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,根据强酸生成弱酸的特点判断反应能否进行;(2)先判断过量,然后计算出混合液中氯离子的浓度,最后根据氯化银溶度积常数进行计算c(Ag+).
18.【答案】(1)⑥
(2)Cl2+H2O HCl+HClO
(3)NaHCO3=Na++HCO3-
(4)
(5) O
(6)64g/mol
(7)12:11
(8)0.5mol/L
【解析】【解答】Ⅰ.(1)①Cl2、②钠是单质,⑦氨水、⑧稀硝酸是混合物,所以①②⑦⑧既不是电解质也不是非电解质; ④CO2是非电解质;③醋酸(CH3COOH)、⑤H2SO4、⑥熔融KNO3、⑨Al2(SO4)3固体、⑩NaHCO3是电解质,但能导电的只有⑥熔融KNO3,故答案为:⑥;
(2)Cl2与水反应生成盐酸和次氯酸,是可逆反应,方程式为 Cl2+H2O HCl+HClO ;
(3)碳酸氢钠为强电解质,全电离,但碳酸是弱酸,碳酸氢根离子不拆,电离方程式为NaHCO3=Na++HCO3- ;
Ⅱ. (4)氯为17号元素,氯离子最外层为8个电子,Cl-结构示意图 : 。
(5)质子数为8,中子数为10 的微粒,质量数为18,符号为 O。
(6)某金属氯化物 MCl240.5g中含有 0.6mol Cl-,则n(MCl2)=n(Cl-)/2=0.6mol×1/2=0.3mol,M(MCl2)=40.5g/0.3mol=135g·mol-1,则M的相对原子量为:135-35.5×2=64,M的摩尔质量为64g·mol-1;
(7)相同温度和体积的A和B两容器,A容器中充满CO2,B 容器中充满O3,若密度相同,根据m=ρV可知二氧化碳和臭氧的质量相等,则二氧化碳和臭氧的物质的量之比为m/44:m/48=12:11;
(8)24.5g H2SO4的物质的量为:n(H2SO4)=24.5g/98g·mol-1=0.25mol,H2SO4为强电解质,n(SO42-)=n(H2SO4)=0.25mol,则c(SO42-)=0.25mol/0.5L=0.5mol·L-1。
【分析】Ⅰ.(1)常见电解质包括:酸、碱、盐、活泼金属氧化物、水;
(2)离子方程式需要拆开的:强酸、强碱和可溶性盐 ;
(3)碳酸氢钠为是强电解质,拆成碳酸氢根和Na+;
Ⅱ. (4)氯离子外层电子排布:2,8,8 。
(5) 中Z代表质子数,A代表质量数,中子数用N表示,N=A-Z。
(6) 1molMCl2含有2molCl- ,求出 MCl2 的物质的量,然后利用公式:n=m/M可以求出M的摩尔质量;
(7)同体积同密度,则同质量,设两种气体质量都是1g,则根据n=可以求出两种气体物质的量之比;
(8)根据公式:n=求出硫酸的物质的量,然后再根据公式c=可以求出c(SO42-)。
19.【答案】(1)Cu+2H++H2O2=Cu2++2H2O
(2)0.24
(3)高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉淀;低温下,高铁酸钾比高铁酸钠的溶解度小
(4)ClO-+H2O+CO2=HClO+HCO 、2HClO 2HCl↑+O2↑;3ClO-+2NH =3Cl-+N2↑+2H++3H2O;63.9
【解析】【解答】(1)稀硫酸与H2O2和铜反应生成硫酸铜和水,离子方程式为:Cu+2H++H2O2=Cu2++2H2O,故答案为:Cu+2H++H2O2=Cu2++2H2O;
(2)300mL0.3mol·L-1的KI溶液含I-物质的量 ,生成等物质的量的I2和KIO3,则生成I2和KIO3物质的为0.03mol,转移电子物质的量 ,故答案为:0.24;
(3)①高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉淀,故答案为:高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉淀;
②低温下,高铁酸钠的溶解度大于高铁酸钾,则在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,故答案为:低温下,高铁酸钾比高铁酸钠的溶解度小;
(4)①由HClO和H2CO3的电离平衡常数可知酸性 ,则CO2与NaClO反应离子方程式为ClO-+H2O+CO2=HClO+HCO ,生成的HClO见光易分解发生2HClO 2HCl↑+O2↑导致“84”消毒液变质,故答案为:ClO-+H2O+CO2=HClO+HCO 、2HClO 2HCl↑+O2↑;
②NaClO与 反应生成N2,离子方程式为:3ClO-+2NH =3Cl-+N2↑+2H++3H2O,产生了0.336LN2物质的量 ,则消耗NaClO物质的量为0.045mol,有效氯为5%的“84”消毒液的质量分数为x则 ,解得 ,则需要有效氯为5%的“84”消毒液的质量 。故答案为:3ClO-+2NH =3Cl-+N2↑+2H++3H2O;63.9。
【分析】 (1)铜片的稀硫酸中加入H2O2后,发生氧化还原反应生成硫酸铜、水;
(2)依据氧化还原反应得失电子守恒规律计算;
(3)利用高铁酸钠的强氧化性和相关信息作答;
(4)由HClO和H2CO3的电离平衡常数可知酸性H2CO3>HClO>HCO3-,根据得失电子守恒进行计算。
20.【答案】(1)②⑦;③⑤;①⑥⑨;⑧
(2)NaHCO3=Na++HCO3-
(3)HCO3-+CH3COOH=CH3COO-+H2O+CO2↑
(4)②⑦
(5)一开始没有气泡,加入一定量的稀盐酸后,产生气泡;H++CO32-=HCO3-,HCO3-+H+=H2O+CO2↑;0.1mol
【解析】【解答】(1)②稀NaOH溶液、⑦稀盐酸有能自由移动的阴、阳离子,能导电;
非电解质是在水溶液中或熔融状态下都不能能够导电的化合物,③酒精;⑤二氧化碳符合;
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐,①FeCl3;⑥碳酸氢钠固体;⑨Na2CO3都是强电解质;
弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等,⑧纯醋酸是弱电解质;
其中能导电的是②⑦;属于非电解质的是③⑤;属于强电解质的是①⑥⑨;属于弱电解质的是⑧。(2)碳酸氢钠为强电解质,完全电离,电离方程式为:NaHCO3=Na++HCO3-。(3)碳酸氢钠和醋酸反应生成醋酸钠和水、二氧化碳,反应离子方程式为:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑。(4)②稀NaOH溶液和⑦稀盐酸两种物质发生反应生成强电解质NaCl和水,离子方程式为:H++OH-=H2O,这两种物质的序号是②⑦;(5)现取0.1mol样品⑨Na2CO3,逐滴加入⑦稀盐酸,现象为一开始没有气泡,加入一定量的稀盐酸后,产生气泡,其所发生的离子方程式为H++CO32-=HCO3-,HCO3-+H+=H2O+CO2↑。完全反应时生成气体的物质的量为0.1mol。
【分析】(1)能导电的物质:必须具有能自由移动的带电的微粒;金属能导电:是由于金属中存在能自由移动的带负电的电子;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物;单质,混合物既不是电解质也不是非电解质;
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;
弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;(2)NaHCO3是强电解质,在水溶液里完全电离生成钠离子和碳酸氢根离子;(3)碳酸氢钠和醋酸反应生成醋酸钠和水、二氧化碳,写出离子方程式;(4)H++OH-=H2O的含义是:强碱和强酸两种物质发生反应生成强电解质和水,由此判断;(5)Na2CO3与盐酸的反应是分两步进行的,由此分析。
21.【答案】(1);CO >SO >HCO >HSO ;CO2+H2O+SO HSO +HCO
(2)HnA+nOH-=An-+nH2O;HnA Hn-1A-+H+
【解析】【解答】(1)①HCO 电离生成CO 、H+,则HCO 的电离平衡常数表达式K= ;
②酸的电离平衡常数越大,酸的酸性越强,其对应酸根离子结合H+的能力越弱。根据电离平衡常数知,酸性:H2SO3>H2CO3> > ,则结合H+的能力由强到弱的顺序为CO >SO >HCO >HSO 。则Na2SO3溶液中通入CO2反应生成HCO 、HSO ,反应的离子方程式为CO2+H2O+SO =HCO +HSO ;
(2)①HnA是n元弱酸,主要以电解质分子存在,当NaOH足量时HnA与NaOH反应生成正盐NanA和H2O,离子方程式为HnA+nOH-=An-+nH2O;
②HnA是n元弱酸,分步电离,每一步都存在电离平衡,则第一步电离生成H+和Hn-1A-,电离方程式为HnA H++Hn-1A-。
【分析】(1)①根据K= 分析;
②根据酸的电离平衡常数越大,酸的酸性越强,对应酸根离子结合H+的能力越弱分析;
(2)①多元弱酸与NaOH反应生成正盐;
②多元弱酸分步电离。
一、单选题
1.根据下表信息,判断0.10 mol/L的下列各溶液pH最大的是( )
酸 电离常数(常温下)
CH3COOH Ka=1.8×10-5
H2CO3 Ka1=4.3×10-7,Ka2=5.6×10-11
H2S Ka1=9.1×10-8,Ka2=1.1×10-12
A.CH3COONa B.Na2CO3 C.NaHCO3 D.Na2S
2.下列物质属于弱电解质的是( )
A.CaCO3 B.CH3CH2OH C.H2O D.SO2
3.下表中物质的分类组合,完全正确的是( )
编号 A B C D
强电解质 KNO3 H2SO4 Na2SO4 HClO4
弱电解质 NH3·H2O CaCO3 HClO C2H5OH
非电解质 SO2 Al H2O CH3COOH
A.A B.B C.C D.D
4.下列属于酸,又是强电解质的是( )
A.蔗糖 B.醋酸 C.硫酸 D.稀盐酸
5.下表中物质的分类组合完全正确的是 ( )
选项 A B C D
强电解质 KNO3 H2SO4 BaSO4 HClO4
弱电解质 HF CaCO3 H2SO3 CH3COONH4
非电解质 SO3 Al H2O C2H5OH
A.A B.B C.C D.D
6.生菜无土栽培营养液的配方要求KNO3、MgSO4、NH4NO3 物质的量之比为1∶2∶1。配制该营养液,已溶解0.02 mol KNO3、0.02 mol NH4NO3,还需MgSO4的质量为( )
A.1.2 g B.2.4 g C.3.6 g D.4.8 g
7.下列过程中:①电离、②电解、③电镀、④电焊、⑤电化学腐蚀,需要通电才能进行的是( )
A.①② B.②③④ C.③④⑤ D.全部
8.下列各图示与对应的描述相符合的是( )
A.图甲表示分别稀释pH=11的NaOH溶液和氨水时溶液pH的变化,图中b>a=100
B.图乙表示某化学平衡的移动,在t1时改变的条件一定是加入催化剂
C.图丙表示平衡2NO2(g) N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
D.图丁表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
9.下列叙述中,正确的是( )
A.KNO3固体不导电,所以KNO3不是电解质
B.铜丝、石墨均能导电,但它们都不是电解质
C.熔融的HCl能导电,所以HCl是电解质
D.NaCl溶于水,在通电条件下才能发生电离
10.下列实验事实不能证明醋酸是弱酸的是( )
A.常温下,测得醋酸钠溶液的pH>7
B.常温下,中和等物质的量浓度等体积的醋酸和盐酸溶液,消耗氢氧化钠溶液体积相等
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4
D.常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快
11.在0.1 mol L﹣1CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO﹣+H+,对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1 mol L﹣1 HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡向正反应方向移动
12.下列关于图示的叙述正确的是
A.固体不含离子 B.b离子是
C.在通电条件才发生电离 D.熔融可导电
13.甲酸(HCOOH)的下列性质中,不能证明它是弱电解质的是( )
A.溶液中HCOOH和共存
B.0.1mol/L HCOOH溶液的pH大于1
C.10mL 1mol/L HCOOH恰好与10mL 1mol/L NaOH溶液完全反应
D.同浓度的HCOOH溶液的导电性比盐酸溶液的弱
14.将等浓度、等体积的盐酸与醋酸分别与足量的镁条反应,测得密闭容器中压强随时间的变化曲线如下图所示。
下列说法错误的是( )
A.反应过程中盐酸中下降更快
B.反应开始前:盐酸>醋酸
C.反应结束时两容器内相等
D.曲线②表示盐酸与镁条反应
15.已知:H2A=H++HA-,HA- H++A2-,则下列说法正确的是( )
A.H2A是弱酸
B.向H2A溶液中通入HCl气体,电离平衡逆向移动,则H2A浓度增大
C.向H2A溶液中加入金属Na,电离平衡常数增大
D.0.1mol/L H2A中pH<1
16.下列对图示的解释错误的是( )
A B C D
向Ba(OH)2溶液中加入稀 硫酸,溶液导电能力变化 光照过程中氯水的pH变化 NaCl的形成 NaCl溶于水
a时刻Ba(OH)2溶液与稀 硫酸恰好完全中和 pH降低的原因可能是HClO分解 NaCl = Na+ + Cl
A.A B.B C.C D.D
二、综合题
17.已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH:
溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN C6H5ONa
pH 8.1 8.8 11.6 10.3 11.1 11.3
(1)请根据上述信息判断下列反应不能发生的是 (填编号).
A.CH3COOH+NaCN═CH3COONa+HCN
B.CO2+H2O+2NaClO═Na2CO3+2HClO
C.Na2CO3+C6H5OH→NaHCO3+C6H5ONa
D.HCN+Na2CO3→NaCN+CO2+H2O
(2)已知常温时Ksp(AgCl)=1.8×10﹣10mol2 L﹣2,向50mL 0.18mol L﹣1的AgNO3溶液中加入相同体积0.22mol L﹣1的盐酸,则c(Ag+)= .
18.
(1)Ⅰ.现有下列十种物质:①Cl2②钠 ③醋酸(CH3COOH) ④CO2⑤H2SO4⑥熔融KNO3⑦氨水 ⑧稀硝酸 ⑨Al2(SO4)3固体 ⑩NaHCO3,回答下列问题:
属于电解质且能导电是 (填序号)。
(2)写出①与水反应的化学方程式 。
(3)写出⑩溶于水时的电离方程式 。
(4)Ⅱ. 按要求回答下列问题:
画 出 Cl-结构示意图 : 。
(5)请用 的形式,写出质子数为8,中子数为10 的微粒符号 。
(6)某金属氯化物 MCl2 40.5g 中含有 0.6mol Cl-,则M的摩尔质量为 。
(7)相同温度和体积的 A 和 B 两容器,A容器中充满CO2,B容器中充满 O3,若密度相同,则二氧化碳和臭氧的物质的量之比为: 。
(8)将24.5g H2SO4溶于水配成500mL溶液,其中SO42-的物质的量浓度为 。
19.在抗击新型冠状病毒疫情期间,酸性KMnO4、NaClO、H2O2等被广泛用于此次抗疫行动中。
(1)向浸泡铜片的稀硫酸中加入H2O2后,铜片溶解,该反应的离子方程式为 。
(2)取300mL0.3mol·L-1的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则转移电子的物质的量为 mol。
(3)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
①简要说明K2FeO4作为水处理剂时所起的作用 。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,原因是 。
(4)NaClO是“84”消毒液的有效成分,含氯消毒剂中HClO的消毒效果远高于ClO-。
①“84”消毒液必须避光密封保存,目的是防止与空气中的CO2反应而变质,该反应的离子方程式为 (HClOKa=2.0×10-8H2CO3Ka1=4.3×10-7Ka2=5.6×10-11)。
②过量NaClO溶液可使酸性废水中NH4+完全转化为N2,该反应的离子方程式为 ,若处理废水产生了0.336LN2(标准状况),则需消耗有效氯为5%的“84”消毒液的质量为 g。(“有效氯”指每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,常以百分数表示)。
20.有以下物质:①FeCl3;②稀NaOH溶液;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦稀盐酸;⑧纯醋酸;⑨Na2CO3;
(1)其中能导电的是 ;属于非电解质的是 ;属于强电解质的是 ;属于弱电解质的是 。
(2)写出物质⑥溶于水的电离方程式: 。
(3)写出物质⑥和⑧在水中反应的离子方程式 。
(4)有两种物质发生反应的离子方程式为:H++OH-=H2O,这两种物质的序号是
(5)现取0.1mol样品⑨,逐滴加入⑦,现象为 ,其所发生的离子方程式为 。完全反应时生成气体的物质的量为 。
21.25℃时,两种常见酸的电离平衡常数如表所示。
Ka1 Ka2
H2SO3 1.3×10-2 6.3×10-8
H2CO3 4.2×10-7 5.6×10-11
(1)①HCO 的电离平衡常数表达式K= 。
②SO 、HSO 、CO 、HCO 结合H+的能力由强到弱的顺序为 ;向Na2SO3溶液中通入CO2反应的离子方程式为 。
(2)已知HnA为n元弱酸。
①写出HnA与足量NaOH反应的离子方程式: 。
②HnA的电离方程式为 (写第一步电离)。
答案解析部分
1.【答案】D
【解析】【解答】根据题干表格中的酸的电离平衡常数可知,酸性的强弱顺序为:CH3COOH>H2CO3>H2S> >HS-,根据越弱越水解的规律可知,水解能力强弱顺序为:S2-> >HS-> >CH3COO-,故0.10 mol/L的下列各溶液pH最大的是Na2S,
故答案为:D。
【分析】电离常数越低产生的氢离子越少,pH值越低
2.【答案】C
【解析】【解答】A.CaCO3是难溶性物质,但溶于水部分是完全电离的,属于强电解质,A不符合题意;
B.CH3CH2OH是由分子构成的物质,易溶于水的物质,在水中和熔融状态下都不能发生电离而导电,属于非电解质,B不符合题意;
C.H2O能够极微弱的电离产生H+、OH-,存在电离平衡,因此H2O是弱电解质,C符合题意;
D.SO2是由分子构成的物质,在水中和熔融状态下都不能因自身发生电离而导电,因此属于非电解质,D不符合题意;
故答案为:C。
【分析】电解质是指在水溶液中或熔融状态下能导电的化合物,弱电解质是不完全电离的电解质。
3.【答案】A
【解析】【解答】A.硝酸钾为强电解质,一水合氨为弱电解质,二氧化硫为非电解质,故A符合题意;
B.碳酸钙为强电解质,故B不符合题意;
C.水为弱电解质,故C不符合题意;
D.乙醇为非电解质,醋酸为弱电解质,故D不符合题意;
故答案为:A。
【分析】掌握常见物质的分类:强酸和强碱和大多数盐为强电解质,弱酸或弱碱为弱电解质,其余化合物为非电解质。
4.【答案】C
【解析】【解答】A.蔗糖水溶液中不导电,是化合物,属于非电解质,A不符合题意;
B.醋酸水溶液中能导电,是化合物,为电解质,水溶液中只能部分电离,属于弱电解质,B不符合题意;
C.硫酸水溶液中完全电离,是化合物,为强电解质,电离产生阳离子都是氢离子,为酸,C符合题意;
D.稀盐酸为混合物,不是电解质,D不符合题意;
故答案为:A
【分析】电离产生的阳离子都是氢离子的化合物为酸;水溶液中能完全电离的电解质为强电解质,只能部分电离的电解质为弱电解质,单质和混合物既不是电解质也不是非电解质,据此判断。
5.【答案】A
【解析】【解答】A、KNO3是强电解质,HF是弱电解质,SO2是非电解质,所以A符合题意;
B、CaCO3是强电解质,电解质和非电解质都是化合物,所以金属铝既不是电解质又不是非电解质,B不符合题意;
C、因为H2O自身部分电离,所以水是弱电解质,而不是非电解质,C不符合题意;
D、CH3COONH4它在水溶液中完全电离,所以是强电解质,不是弱电解质,D不符合题意。
故答案为:A。
【分析】本题考查电解质、非电解质等相关概念。电解质:在水溶液或熔融状态下能够导电的化合物称为电解质,酸、碱、盐、活泼金属的氧化物都是电解质;非电解质:在水溶液和熔融状态下都不能够导电的化合物称为电解质,大多数有机物、非金属氧化物、气态氢化物都是非电解质;据此分析解答。
6.【答案】D
【解析】【解答】已溶解0.02 mol KNO3、0.02 mol NH4NO3,根据KNO3、MgSO4、NH4NO3物质的量之比为1∶2∶1可知还需MgSO4的物质的量是0.04mol,质量为0.04mol×120g/mol=4.8g,
故答案为:D。
【分析】以物质的量为中心计算,需熟记公式。
7.【答案】B
【解析】【解答】解:①电离是电解质在水溶液中离解出自由移动离子的过程,不需要通电,故①错误;②电解是外加电源强迫下的氧化还原反应,必须加外加电源,需要通电,故②正确;③电镀实质是一个电解池,必须加外加电源,需要通电,故③正确;④电焊利用焊条通过电弧高温融化金属部件需要连接的地方而实现的一种焊接操作,需要通电,故④正确;⑤电化学腐蚀原理是原电池原理,原电池中不含电源,故⑤错误;故选B.
【分析】①电离是电解质在水溶液中离解出自由移动离子的过程;②电解是外加电源强迫下的氧化还原反应;③电镀实质是一个电解池;④电焊需电能融化焊条和钢铁;⑤电化学腐蚀原理是原电池原理.
8.【答案】A
【解析】【解答】A 、NaOH为强碱完全电离,稀释100倍,pH从11变到9,氨水为弱碱部分电离,稀释100倍时,在稀释过程中,氨水会继续电离出OH-,导致溶液中的OH-浓度大于NaOH溶液中的OH-,要使稀释后两者的OH-浓度仍相等,则氨水稀释的倍数要大于100倍,所以b>a=100,A正确;
B、在t1时改变某个条件,反应速率增大,但是平衡不移动,可能是使用了催化剂,也可能是增大了压强,改变压强平衡不一定会移动,B错误;
C、压缩体积,NO2和N2O4的浓度瞬间增大,同时平衡向气体体积缩小的方向移动,即往正方向移动,所以N2O4的浓度继续增大,而丙图中N2O4的浓度在减小,C错误;
D、CH3COOH为弱电解质,导电能力弱,通入氨气后生成强电解质CH3COONH4,导电性增强,继续通入氨气,导电性仍然增强,D错误。正确答案为A。
【分析】B、催化剂不能使化学平衡移动
C、溶液的导电性:取决于可自由移动带电粒子的浓度
9.【答案】B
【解析】【解答】A.KNO3固体中离子受到离子键的作用,不能自由移动,所以不导电,但KNO3固体溶于水或熔融状态下能够发生电离,可以导电,所以KNO3属于电解质,A项不符合题意;
B.铜丝、石墨虽能导电,但均是单质,不是化合物,因此既不是电解质也不是非电解质,B项符合题意;
C.熔融状态下,HCl仍是分子,不会电离成离子,是一种共价化合物,所以不能导电。HCl水溶液状态下可以电离出离子,从而可以导电,所以HCl是电解质,C项不符合题意;
D.NaCl溶于水可电离生成钠离子与氯离子,无需外接电源,D项不符合题意;
故答案为:B。
【分析】 A.电解质是在水溶液中或熔融状态下能导电的化合物;
B.电解质必须是化合物;
C.熔融的HCl为分子,不能导电;
D.电离不需要通电。
10.【答案】B
【解析】【解答】解:A.常温下,测得醋酸钠溶液的pH>7,说明醋酸钠为强碱弱酸盐,水解呈碱性,可证明醋酸为弱酸,故A不选;
B.醋酸为一元酸,氢氧化钠为一元碱,二者恰好反应,不能证明醋酸为弱酸,故B选;
C.常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4,说明加水稀释促进电离,如为强酸,稀释后pH=4,可证明为弱酸,故C不选;
D.常温下,等量形状相同的锌粒分别与等pH的醋酸和盐酸反应,反应过程中醋酸速率较快,可说明醋酸在反应可进一步电离,说明存在电离平衡,为弱酸,故D不选.
故选B.
【分析】要证明醋酸为弱酸,可证明存在电离平衡、不能完全电离或从对应的强碱盐溶液呈碱性的角度,以此解答该题.
11.【答案】B
【解析】【解答】解:A.加水促进弱电解质的电离,则电离平衡正向移动,故A错误;
B.加入少量NaOH固体,与CH3COOH电离生成的H+结合,使电离平衡正向移动,故B正确;
C.加入少量0.1mol L﹣1HCl溶液,c(H+)增大,pH减小,故C错误;
D.加入少量CH3COONa固体,由电离平衡可知,c(CH3COO﹣)增大,则电离平衡逆向移动,故D错误;
故选B.
【分析】因加入水、加热促进弱电解质的电离,加酸抑制弱酸的电离,加碱能够中和氢离子,促进醋酸电离,加入与弱电解质电离出相同离子的电解质抑制电离,以此来解答.
12.【答案】D
【解析】【解答】A.NaCl固体中含Na+、Cl-,但要溶于水或熔融态离子才可以自由移动,才能导电,A项不符合题意;
B.b离子周围结合的水分子,水分子中的氢原子朝向b离子,说明b离子是阴离子,故b离子为Cl-,B不符合题意;
C.NaCl在溶于水或熔融态发生电离,C项不符合题意;
D.熔融NaCl存在自由移动的离子,可导电,D项符合题意;
故答案为:D。
【分析】A.NaCl是离子化合物;
B.电解池中,与电源正极相连的电极是阳极,与电源负极相连的电极是阴极,内电路中阴离子移向阳极、阳离子移向阴极;
C.NaCl在溶于水或熔融态发生电离,电离不需要通电;
D.熔融NaCl存在自由移动的离子,可导电。
13.【答案】C
【解析】【解答】A.溶液中和共存说明甲酸存在电离平衡,即甲酸为弱电解质,故A不符合题意;
B.0.1mol/L HCOOH溶液的pH大于1,说明溶液中浓度小于0.1mol/L,即甲酸不完全电离,为弱电解质,故B不符合题意;
C.10mL 1mol/L HCOOH恰好与10mL 1mol/L NaOH溶液完全反应,是酸碱中和反应,不能说明甲酸为弱电解质,故C符合题意;
D.同浓度的HCOOH溶液的导电性比盐酸溶液的弱,说明甲酸溶液中自由离子浓度小于盐酸,即甲酸不完全电离,故D不符合题意;
故答案为:C。
【分析】依据弱酸溶液存在电离平衡,不完全电离分析。
14.【答案】D
【解析】【解答】A.HCl完全电离,醋酸存在电离平衡,反应过程中醋酸继续电离,所以反应过程中盐酸中c(H+)下降更快,A不符合题意;
B.相同浓度的一元酸,c(H+):强酸>弱酸,盐酸是强酸、醋酸是弱酸,则相同浓度的盐酸和醋酸反应开始前c(H+):盐酸>醋酸,B不符合题意;
C.反应结束时生成n(H2)与n(酸)成正比,二者都是一元酸且体积和物质的量浓度相等,所以两种酸的物质的量相等,则反应结束时两容器内n(H2)相等,C不符合题意;
D.密闭容器中气体物质的量越大,气体压强越大,开始一段时间内c(H+):盐酸>醋酸,则开始一段时间内生成气体体积:盐酸>醋酸,则曲线①代表的是盐酸与镁条反应时容器内压强随时间的变化曲线,D符合题意;
故答案为:D。
【分析】A.弱酸中存在电离平衡,会减弱这种改变;
B.依据相同浓度的一元酸,c(H+):强酸>弱酸分析;
C.依据一元酸体积和物质的量浓度相等分析;
D.密闭容器中气体物质的量越大,气体压强越大。
15.【答案】D
【解析】【解答】A. H2A完全电离生成H+和HA-,属于强电解质,因此H2A是弱酸不是弱酸,A项不符合题意;
B. 向H2A溶液中通入HCl气体,c(H+)增大,使电离平衡HA- H++A2-逆向移动,但H2A浓度并未增大,B项不符合题意;
C. 电离平衡常数只与温度有关,向H2A溶液中加入金属Na,电离平衡常数不发生变化,C项不符合题意;
D. H2A第一步完全电离,第二步为部分电离,0.1mol/L H2A中H+并未完全电离,因此pH<1,D项符合题意;
故答案为:D。
【分析】A. H2A完全电离生成H+和HA-,属于强电解质;
B. 向H2A溶液中通入HCl气体,使电离平衡HA- H++A2-逆向移动;
C. 电离平衡常数只与温度有关;
D. H2A第一步完全电离,第二步为部分电离,据此分析判断。
16.【答案】C
【解析】【解答】A.向Ba(OH)2溶液中加入稀硫酸,二者反应生成硫酸钡沉淀和水,导电性降低,a时刻导电能力几乎为0,这说明a时刻Ba(OH)2溶液与稀 硫酸恰好完全中和,A不符合题意;
B.光照过程中氯水中的次氯酸分解生成氯化氢和氧气,溶液酸性增强,所以pH减小,B不符合题意;
C.用单线桥表示应该为,C符合题意;
D.氯化钠是电解质,溶于水电离出钠离子和氯离子,D不符合题意;
故答案为:C。
【分析】A、氢氧化钡滴加硫酸导电性想减弱后增强;
B、氯水光照后,酸性增强;
C、电子计算错误;
D、氯化钠在水中电离为钠离子和氯离子。
17.【答案】(1)B;D
(2)9.0×10﹣8mol/L
【解析】【解答】解:(1)六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,
A.CH3COOH酸性大于HCN,反应CH3COOH+NaCN═CH3COONa+HCN能发生,故A正确;
B.酸性H2CO3>HClO>HCO3﹣,应生成NaHCO3,反应CO2+H2O+2NaClO═Na2CO3+2HClO不能发生,故B错误;
C.酸性C6H5OH>HCO3﹣,反应Na2CO3+C6H5OH→NaHCO3+C6H5ONa能发生,故C正确;
D.酸性H2CO3>C6H5OH>HCO3﹣,反应生成碳酸氢钠,正确反应为CO2+H2O+C6H5ONa→NaHCO3+C6H5OH反,故D错误,
故答案为:BD;(2)向50mL 0.018mol L﹣1的AgNO3溶液中加入相同体积0.020mol L﹣1的盐酸,盐酸过量,反应后的c(Cl﹣)= =0.002mol/L,
则:c(Ag+)= mol/L=9×10﹣8mol/L,
故答案为:9.0×10﹣8 mol/L.
【分析】(1)六种盐都为强碱弱酸盐,盐的pH越大,说明对应的酸水解程度越大,则对应的酸越弱,根据强酸生成弱酸的特点判断反应能否进行;(2)先判断过量,然后计算出混合液中氯离子的浓度,最后根据氯化银溶度积常数进行计算c(Ag+).
18.【答案】(1)⑥
(2)Cl2+H2O HCl+HClO
(3)NaHCO3=Na++HCO3-
(4)
(5) O
(6)64g/mol
(7)12:11
(8)0.5mol/L
【解析】【解答】Ⅰ.(1)①Cl2、②钠是单质,⑦氨水、⑧稀硝酸是混合物,所以①②⑦⑧既不是电解质也不是非电解质; ④CO2是非电解质;③醋酸(CH3COOH)、⑤H2SO4、⑥熔融KNO3、⑨Al2(SO4)3固体、⑩NaHCO3是电解质,但能导电的只有⑥熔融KNO3,故答案为:⑥;
(2)Cl2与水反应生成盐酸和次氯酸,是可逆反应,方程式为 Cl2+H2O HCl+HClO ;
(3)碳酸氢钠为强电解质,全电离,但碳酸是弱酸,碳酸氢根离子不拆,电离方程式为NaHCO3=Na++HCO3- ;
Ⅱ. (4)氯为17号元素,氯离子最外层为8个电子,Cl-结构示意图 : 。
(5)质子数为8,中子数为10 的微粒,质量数为18,符号为 O。
(6)某金属氯化物 MCl240.5g中含有 0.6mol Cl-,则n(MCl2)=n(Cl-)/2=0.6mol×1/2=0.3mol,M(MCl2)=40.5g/0.3mol=135g·mol-1,则M的相对原子量为:135-35.5×2=64,M的摩尔质量为64g·mol-1;
(7)相同温度和体积的A和B两容器,A容器中充满CO2,B 容器中充满O3,若密度相同,根据m=ρV可知二氧化碳和臭氧的质量相等,则二氧化碳和臭氧的物质的量之比为m/44:m/48=12:11;
(8)24.5g H2SO4的物质的量为:n(H2SO4)=24.5g/98g·mol-1=0.25mol,H2SO4为强电解质,n(SO42-)=n(H2SO4)=0.25mol,则c(SO42-)=0.25mol/0.5L=0.5mol·L-1。
【分析】Ⅰ.(1)常见电解质包括:酸、碱、盐、活泼金属氧化物、水;
(2)离子方程式需要拆开的:强酸、强碱和可溶性盐 ;
(3)碳酸氢钠为是强电解质,拆成碳酸氢根和Na+;
Ⅱ. (4)氯离子外层电子排布:2,8,8 。
(5) 中Z代表质子数,A代表质量数,中子数用N表示,N=A-Z。
(6) 1molMCl2含有2molCl- ,求出 MCl2 的物质的量,然后利用公式:n=m/M可以求出M的摩尔质量;
(7)同体积同密度,则同质量,设两种气体质量都是1g,则根据n=可以求出两种气体物质的量之比;
(8)根据公式:n=求出硫酸的物质的量,然后再根据公式c=可以求出c(SO42-)。
19.【答案】(1)Cu+2H++H2O2=Cu2++2H2O
(2)0.24
(3)高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉淀;低温下,高铁酸钾比高铁酸钠的溶解度小
(4)ClO-+H2O+CO2=HClO+HCO 、2HClO 2HCl↑+O2↑;3ClO-+2NH =3Cl-+N2↑+2H++3H2O;63.9
【解析】【解答】(1)稀硫酸与H2O2和铜反应生成硫酸铜和水,离子方程式为:Cu+2H++H2O2=Cu2++2H2O,故答案为:Cu+2H++H2O2=Cu2++2H2O;
(2)300mL0.3mol·L-1的KI溶液含I-物质的量 ,生成等物质的量的I2和KIO3,则生成I2和KIO3物质的为0.03mol,转移电子物质的量 ,故答案为:0.24;
(3)①高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉淀,故答案为:高铁酸钾具有强氧化性,能杀菌消毒,消毒过程中自身被还原为Fe3+,Fe3+水解生成Fe(OH)3胶体,能吸附水中悬浮杂质而沉淀;
②低温下,高铁酸钠的溶解度大于高铁酸钾,则在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾,故答案为:低温下,高铁酸钾比高铁酸钠的溶解度小;
(4)①由HClO和H2CO3的电离平衡常数可知酸性 ,则CO2与NaClO反应离子方程式为ClO-+H2O+CO2=HClO+HCO ,生成的HClO见光易分解发生2HClO 2HCl↑+O2↑导致“84”消毒液变质,故答案为:ClO-+H2O+CO2=HClO+HCO 、2HClO 2HCl↑+O2↑;
②NaClO与 反应生成N2,离子方程式为:3ClO-+2NH =3Cl-+N2↑+2H++3H2O,产生了0.336LN2物质的量 ,则消耗NaClO物质的量为0.045mol,有效氯为5%的“84”消毒液的质量分数为x则 ,解得 ,则需要有效氯为5%的“84”消毒液的质量 。故答案为:3ClO-+2NH =3Cl-+N2↑+2H++3H2O;63.9。
【分析】 (1)铜片的稀硫酸中加入H2O2后,发生氧化还原反应生成硫酸铜、水;
(2)依据氧化还原反应得失电子守恒规律计算;
(3)利用高铁酸钠的强氧化性和相关信息作答;
(4)由HClO和H2CO3的电离平衡常数可知酸性H2CO3>HClO>HCO3-,根据得失电子守恒进行计算。
20.【答案】(1)②⑦;③⑤;①⑥⑨;⑧
(2)NaHCO3=Na++HCO3-
(3)HCO3-+CH3COOH=CH3COO-+H2O+CO2↑
(4)②⑦
(5)一开始没有气泡,加入一定量的稀盐酸后,产生气泡;H++CO32-=HCO3-,HCO3-+H+=H2O+CO2↑;0.1mol
【解析】【解答】(1)②稀NaOH溶液、⑦稀盐酸有能自由移动的阴、阳离子,能导电;
非电解质是在水溶液中或熔融状态下都不能能够导电的化合物,③酒精;⑤二氧化碳符合;
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐,①FeCl3;⑥碳酸氢钠固体;⑨Na2CO3都是强电解质;
弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等,⑧纯醋酸是弱电解质;
其中能导电的是②⑦;属于非电解质的是③⑤;属于强电解质的是①⑥⑨;属于弱电解质的是⑧。(2)碳酸氢钠为强电解质,完全电离,电离方程式为:NaHCO3=Na++HCO3-。(3)碳酸氢钠和醋酸反应生成醋酸钠和水、二氧化碳,反应离子方程式为:HCO3-+CH3COOH=CH3COO-+H2O+CO2↑。(4)②稀NaOH溶液和⑦稀盐酸两种物质发生反应生成强电解质NaCl和水,离子方程式为:H++OH-=H2O,这两种物质的序号是②⑦;(5)现取0.1mol样品⑨Na2CO3,逐滴加入⑦稀盐酸,现象为一开始没有气泡,加入一定量的稀盐酸后,产生气泡,其所发生的离子方程式为H++CO32-=HCO3-,HCO3-+H+=H2O+CO2↑。完全反应时生成气体的物质的量为0.1mol。
【分析】(1)能导电的物质:必须具有能自由移动的带电的微粒;金属能导电:是由于金属中存在能自由移动的带负电的电子;
非电解质是指:在熔融状态和水溶液中都不能导电的化合物;单质,混合物既不是电解质也不是非电解质;
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;
弱电解质是在水溶液中不能完全电离的电解质,包括弱酸、弱碱、水等;(2)NaHCO3是强电解质,在水溶液里完全电离生成钠离子和碳酸氢根离子;(3)碳酸氢钠和醋酸反应生成醋酸钠和水、二氧化碳,写出离子方程式;(4)H++OH-=H2O的含义是:强碱和强酸两种物质发生反应生成强电解质和水,由此判断;(5)Na2CO3与盐酸的反应是分两步进行的,由此分析。
21.【答案】(1);CO >SO >HCO >HSO ;CO2+H2O+SO HSO +HCO
(2)HnA+nOH-=An-+nH2O;HnA Hn-1A-+H+
【解析】【解答】(1)①HCO 电离生成CO 、H+,则HCO 的电离平衡常数表达式K= ;
②酸的电离平衡常数越大,酸的酸性越强,其对应酸根离子结合H+的能力越弱。根据电离平衡常数知,酸性:H2SO3>H2CO3> > ,则结合H+的能力由强到弱的顺序为CO >SO >HCO >HSO 。则Na2SO3溶液中通入CO2反应生成HCO 、HSO ,反应的离子方程式为CO2+H2O+SO =HCO +HSO ;
(2)①HnA是n元弱酸,主要以电解质分子存在,当NaOH足量时HnA与NaOH反应生成正盐NanA和H2O,离子方程式为HnA+nOH-=An-+nH2O;
②HnA是n元弱酸,分步电离,每一步都存在电离平衡,则第一步电离生成H+和Hn-1A-,电离方程式为HnA H++Hn-1A-。
【分析】(1)①根据K= 分析;
②根据酸的电离平衡常数越大,酸的酸性越强,对应酸根离子结合H+的能力越弱分析;
(2)①多元弱酸与NaOH反应生成正盐;
②多元弱酸分步电离。
