4.2.2电解原理的应用 公开课课件(共22张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1
文档属性
| 名称 | 4.2.2电解原理的应用 公开课课件(共22张PPT) 2023-2024学年高二上学期化学人教版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-29 15:44:33 | ||
图片预览







文档简介
(共22张PPT)
【知识回顾】
阳极
活性金属 >S2->I->Br->Cl->OH->含氧酸根>F-
阴极:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸性)>Pb2+ > Sn2+ > Fe2+>Zn2+ >H+ (水电离出的H+)> Al3+>Mg2+>Na+>Ca2+>K+
2
第四章化学反应与电能
第二节电解原理的应用
2023年12月28日
10:08:39
3
学习目标
1.通过对氯碱工业、电镀、电解精炼铜等原理的分析,认识电能与化学能相互转化的实际意义及其重要应用。
2.能正确书写电解池的电极反应式和总反应方程式。
结合课本106页,完成以下问题
【问题1】通电前,饱和食盐水的溶液中有哪些离子?
【问题2】通电后,带电离子如何运动?
【问题3】通电后,带电的离子如何变化,得到了哪些物质?
【问题4】书写相应的电极反应式及总反应方程式
问题思考
一、电解饱和食盐水应用
一、电解饱和食盐水应用
阳极反应:__________________________ (______反应)
阴极反应:______________________________ (______反应)
总反应:
①化学方程式:________________________________________。
②离子方程式:_______________________________。
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
氧化
还原
1、原理分析
一、电解饱和食盐水应用
烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做氯碱工业
2、氯碱工业生产流程
(2) 避免生成物H2和Cl2混合
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
Cl2 +2NaOH == NaCl + NaClO + H2O
混合遇火或遇强光爆炸
电解饱和食盐水如果投入工业生产需要解决的主要问题是什么?如何解决?
问题思考
一、电解饱和食盐水应用
2.氯碱工业生产流程
工业生产,电解饱和食盐水的反应在阳离子交换膜电解槽中进行。
(2)阳离子交换膜电解槽
一、电解饱和食盐水应用
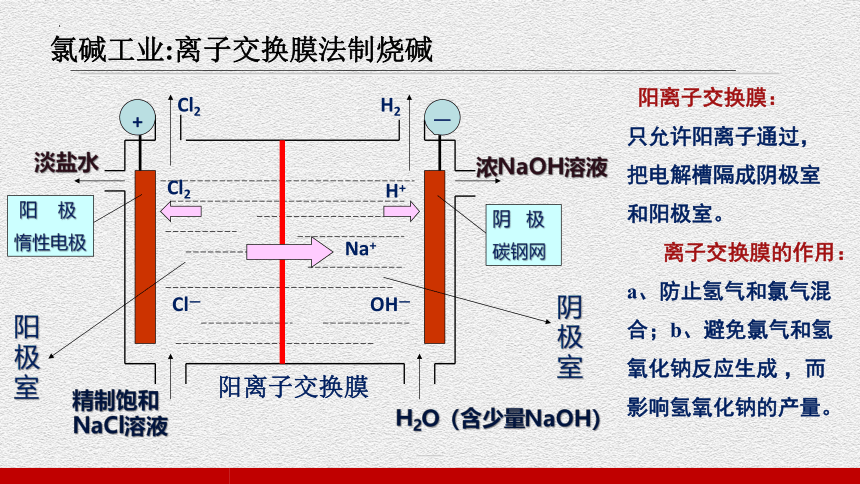
氯碱工业:离子交换膜法制烧碱
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
浓NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
惰性电极
阴 极
碳钢网
阳极室
阴极室
阳离子交换膜:
只允许阳离子通过,把电解槽隔成阴极室和阳极室。
离子交换膜的作用:
a、防止氢气和氯气混合;b、避免氯气和氢氧化钠反应生成 ,而影响氢氧化钠的产量。
【正误辨析】
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑。
(2)工业上电解食盐水的阴极区产物是氯气和氢氧化钠
(3)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区
(4)电解饱和食盐水时,阳极和阴极都可以选择金属材料,如铁。
(5)电解饱和NaCl溶液可以制取金属钠。
(6)利用电解饱和食盐水可制得“84”消毒液。
×
×
×
×
×
√
二、电镀
阳极材料: ; 阴极材料:_______________:
电镀液:用含有 的溶液作电镀液。
1、电镀的含义:
2.电镀的主要目的:
使金属增强抗腐蚀能力,增加美观和表面硬度。
3、电镀池的构成:
镀层金属
镀件
镀层金属的电解质
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。
二、电镀
【活动探究】铁钉镀铜
设计思路及依据 实验装置 实验现象
确定阴极 阴极材料:
阴极反应式:
确定阳极 阳极材料
阳极反应式:
实验目的:设计一个电镀装置给铁钉镀铜
实验用品:铁钉,铜片,石墨棒,CuSO4溶液,FeSO4溶液;
烧杯,导线,电源
实验方案的设计及实施
铁钉
Cu2+ + 2e- = Cu (还原反应)
铜片
Cu - 2e- = Cu2+ (氧化反应)
铜片溶解,铁钉上有红色固体析出
二、电镀
电镀时,若用镀层金属作阳极材料,电镀液中的阳离子浓度是否会发生明显的变化
问题思考
不会;因为阳极上生成阳离子的物质的量与阴极上消耗阳离子的物质的量相等,所以溶液中阳离子浓度不会发生明显变化。
【总结】4、电镀特征:一多、一少、一不变。
“一多”指阴极上镀层金属沉积
“一少”指阳极上镀层金属溶解
“一不变”指电镀液(电解质溶液)的浓度不变。
【随堂测试】
(1)电镀池在本质上是电解池 (2)电镀时,待镀金属制品作阳极、镀层金属作阴极 (3)电镀池中电解液必须含镀层金属阳离子,且电镀时浓度保持不变
【正误辨析】
√
×
√
2.利用如图所示装置可以在铜牌表面电镀一层银。有关说法正确的是
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
√
银片为阳极,Ag+向阴极移动
镀层不可能非常均匀致密,所以将电源反接,阳极上Cu、Ag均会溶解,铜牌不可能恢复如初。
3、如图是工业上电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
√
4.若要在铜片上镀银时,下列叙述中错误的是( )①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是Ag++e-===Ag ④在银片上发生的反应是2H2O-4e-===O2↑+4H+ ⑤可用CuSO4溶液作电解质溶液 ⑥可用AgNO3溶液作电解质溶液A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
√
5.氯碱工业用离子交换膜法电解饱和食盐水,装置示意图如图。下列说法错误的是( )A.a为阳极,发生氧化反应生成氯气 B.b极的电极反应式为2H2O+2e-=H2↑+2OH-C.电解时,Na+穿过离子交换膜进入阴极室
D.饱和食盐水从c处进入,淡盐水从e处流出
√
6.在新冠肺炎疫情期间,“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。(1)a为电源的 (填“正”“负”“阴”或“阳”,下同)极,c为电解池的 极。(2)d电极的电极反应式: 电解产生消毒液的总化学方程式为
负
阳
为充分混合反应,下端产生Cl2
上端产生NaOH
2H2O+2e-===H2↑+2OH-
一、电解饱和食盐水的应用
1、原理分析
2、氯碱工业的生产流程
(1)氯碱工业概念
(2)阳离子交换膜的作用
二、电镀
1、电镀的含义
2、电镀的主要目的
3、电镀池的构成
4、电镀原理分析
【课堂小结】
电解原理的应用
22
同学们,别忘记训练巩固哦!
谢
谢
聆
听
THANK YOU
【知识回顾】
阳极
活性金属 >S2->I->Br->Cl->OH->含氧酸根>F-
阴极:
Ag+>Hg2+>Fe3+>Cu2+>H+(酸性)>Pb2+ > Sn2+ > Fe2+>Zn2+ >H+ (水电离出的H+)> Al3+>Mg2+>Na+>Ca2+>K+
2
第四章化学反应与电能
第二节电解原理的应用
2023年12月28日
10:08:39
3
学习目标
1.通过对氯碱工业、电镀、电解精炼铜等原理的分析,认识电能与化学能相互转化的实际意义及其重要应用。
2.能正确书写电解池的电极反应式和总反应方程式。
结合课本106页,完成以下问题
【问题1】通电前,饱和食盐水的溶液中有哪些离子?
【问题2】通电后,带电离子如何运动?
【问题3】通电后,带电的离子如何变化,得到了哪些物质?
【问题4】书写相应的电极反应式及总反应方程式
问题思考
一、电解饱和食盐水应用
一、电解饱和食盐水应用
阳极反应:__________________________ (______反应)
阴极反应:______________________________ (______反应)
总反应:
①化学方程式:________________________________________。
②离子方程式:_______________________________。
2Cl--2e-===Cl2↑
2H2O+2e-===H2↑+2OH-
氧化
还原
1、原理分析
一、电解饱和食盐水应用
烧碱、氯气都是重要的化工原料,习惯上把电解饱和食盐水的工业生产叫做氯碱工业
2、氯碱工业生产流程
(2) 避免生成物H2和Cl2混合
(1) 避免Cl2接触NaOH溶液反应,使产品不纯
Cl2 +2NaOH == NaCl + NaClO + H2O
混合遇火或遇强光爆炸
电解饱和食盐水如果投入工业生产需要解决的主要问题是什么?如何解决?
问题思考
一、电解饱和食盐水应用
2.氯碱工业生产流程
工业生产,电解饱和食盐水的反应在阳离子交换膜电解槽中进行。
(2)阳离子交换膜电解槽
一、电解饱和食盐水应用
氯碱工业:离子交换膜法制烧碱
-
+
Cl2
Cl2
Cl—
H2
Na+
H+
OH—
淡盐水
浓NaOH溶液
精制饱和NaCl溶液
H2O(含少量NaOH)
阳离子交换膜
阳 极
惰性电极
阴 极
碳钢网
阳极室
阴极室
阳离子交换膜:
只允许阳离子通过,把电解槽隔成阴极室和阳极室。
离子交换膜的作用:
a、防止氢气和氯气混合;b、避免氯气和氢氧化钠反应生成 ,而影响氢氧化钠的产量。
【正误辨析】
(1)电解饱和食盐水时,阴极发生氧化反应:2Cl--2e-===Cl2↑。
(2)工业上电解食盐水的阴极区产物是氯气和氢氧化钠
(3)氯碱工业电解槽中滴入酚酞溶液,变红色的区域为阳极区
(4)电解饱和食盐水时,阳极和阴极都可以选择金属材料,如铁。
(5)电解饱和NaCl溶液可以制取金属钠。
(6)利用电解饱和食盐水可制得“84”消毒液。
×
×
×
×
×
√
二、电镀
阳极材料: ; 阴极材料:_______________:
电镀液:用含有 的溶液作电镀液。
1、电镀的含义:
2.电镀的主要目的:
使金属增强抗腐蚀能力,增加美观和表面硬度。
3、电镀池的构成:
镀层金属
镀件
镀层金属的电解质
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。
二、电镀
【活动探究】铁钉镀铜
设计思路及依据 实验装置 实验现象
确定阴极 阴极材料:
阴极反应式:
确定阳极 阳极材料
阳极反应式:
实验目的:设计一个电镀装置给铁钉镀铜
实验用品:铁钉,铜片,石墨棒,CuSO4溶液,FeSO4溶液;
烧杯,导线,电源
实验方案的设计及实施
铁钉
Cu2+ + 2e- = Cu (还原反应)
铜片
Cu - 2e- = Cu2+ (氧化反应)
铜片溶解,铁钉上有红色固体析出
二、电镀
电镀时,若用镀层金属作阳极材料,电镀液中的阳离子浓度是否会发生明显的变化
问题思考
不会;因为阳极上生成阳离子的物质的量与阴极上消耗阳离子的物质的量相等,所以溶液中阳离子浓度不会发生明显变化。
【总结】4、电镀特征:一多、一少、一不变。
“一多”指阴极上镀层金属沉积
“一少”指阳极上镀层金属溶解
“一不变”指电镀液(电解质溶液)的浓度不变。
【随堂测试】
(1)电镀池在本质上是电解池 (2)电镀时,待镀金属制品作阳极、镀层金属作阴极 (3)电镀池中电解液必须含镀层金属阳离子,且电镀时浓度保持不变
【正误辨析】
√
×
√
2.利用如图所示装置可以在铜牌表面电镀一层银。有关说法正确的是
A.通电后,Ag+向阳极移动
B.银片与电源负极相连
C.该电解池的阴极反应可表示为Ag++e-===Ag
D.当电镀一段时间后,将电源反接,铜牌可恢复如初
√
银片为阳极,Ag+向阴极移动
镀层不可能非常均匀致密,所以将电源反接,阳极上Cu、Ag均会溶解,铜牌不可能恢复如初。
3、如图是工业上电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
√
4.若要在铜片上镀银时,下列叙述中错误的是( )①将铜片接在电源的正极 ②将银片接在电源的正极 ③在铜片上发生的反应是Ag++e-===Ag ④在银片上发生的反应是2H2O-4e-===O2↑+4H+ ⑤可用CuSO4溶液作电解质溶液 ⑥可用AgNO3溶液作电解质溶液A.①③⑥ B.②③⑥ C.①④⑤ D.②③④⑥
√
5.氯碱工业用离子交换膜法电解饱和食盐水,装置示意图如图。下列说法错误的是( )A.a为阳极,发生氧化反应生成氯气 B.b极的电极反应式为2H2O+2e-=H2↑+2OH-C.电解时,Na+穿过离子交换膜进入阴极室
D.饱和食盐水从c处进入,淡盐水从e处流出
√
6.在新冠肺炎疫情期间,“84”消毒液是环境消毒液之一。某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收制得有较强杀菌能力的消毒液,设计了如图所示的装置。c、d都为石墨电极。(1)a为电源的 (填“正”“负”“阴”或“阳”,下同)极,c为电解池的 极。(2)d电极的电极反应式: 电解产生消毒液的总化学方程式为
负
阳
为充分混合反应,下端产生Cl2
上端产生NaOH
2H2O+2e-===H2↑+2OH-
一、电解饱和食盐水的应用
1、原理分析
2、氯碱工业的生产流程
(1)氯碱工业概念
(2)阳离子交换膜的作用
二、电镀
1、电镀的含义
2、电镀的主要目的
3、电镀池的构成
4、电镀原理分析
【课堂小结】
电解原理的应用
22
同学们,别忘记训练巩固哦!
谢
谢
聆
听
THANK YOU
