第3章 物质的性质与转化 同步练习(含解析)2023-2024学年上学期高一化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第3章 物质的性质与转化 同步练习(含解析)2023-2024学年上学期高一化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 312.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-29 22:05:54 | ||
图片预览

文档简介
第3章 物质的性质与转化 同步练习
一、单选题
1.下列物质中可以由两种单质直接化合制得的是( )
A. B.FeS C. D.CuS
2.化学与科学、技术、社会、环境密切相关。下列说法错误的是( )
A.SiO2是酸性氧化物,但不能直接与水反应生成H2SiO3
B.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.Na2O2能与CO2反应产生O2,可用作呼吸面具的供氧剂
3.下列实验过程中颜色的变化描述错误的是( )
A.SO2气体缓慢通入石蕊试液中,溶液先变红后褪色
B.NO和O2按照4:3的体积比同时通入水中,得到无色溶液
C.NH3缓缓通入FeCl3溶液中,产生红褐色沉淀
D.Cl2缓慢通入滴有酚酞的NaOH溶液,红色消失
4.2021年3月全国两会期间,政府工作报告中提到的“碳达峰”、“碳中和”成为热词。“碳中和”指的是通过植树造林、节能减排、碳捕集与封存等形式,抵消生产生活中产生的二氧化碳,达到相对“零排放”。下列有关说法错误的是( )
A.研发催化剂将还原为甲醇
B.积极鼓励植树造林,降低空气中含量
C.利用煤的气化、液化制备清洁燃料,降低碳排放
D.利用中西部地区富含钙离子的碱性土壤,吸收固定
5.下列气体难溶于水的是
A.SO2 B.HCl C.NH3 D.CO
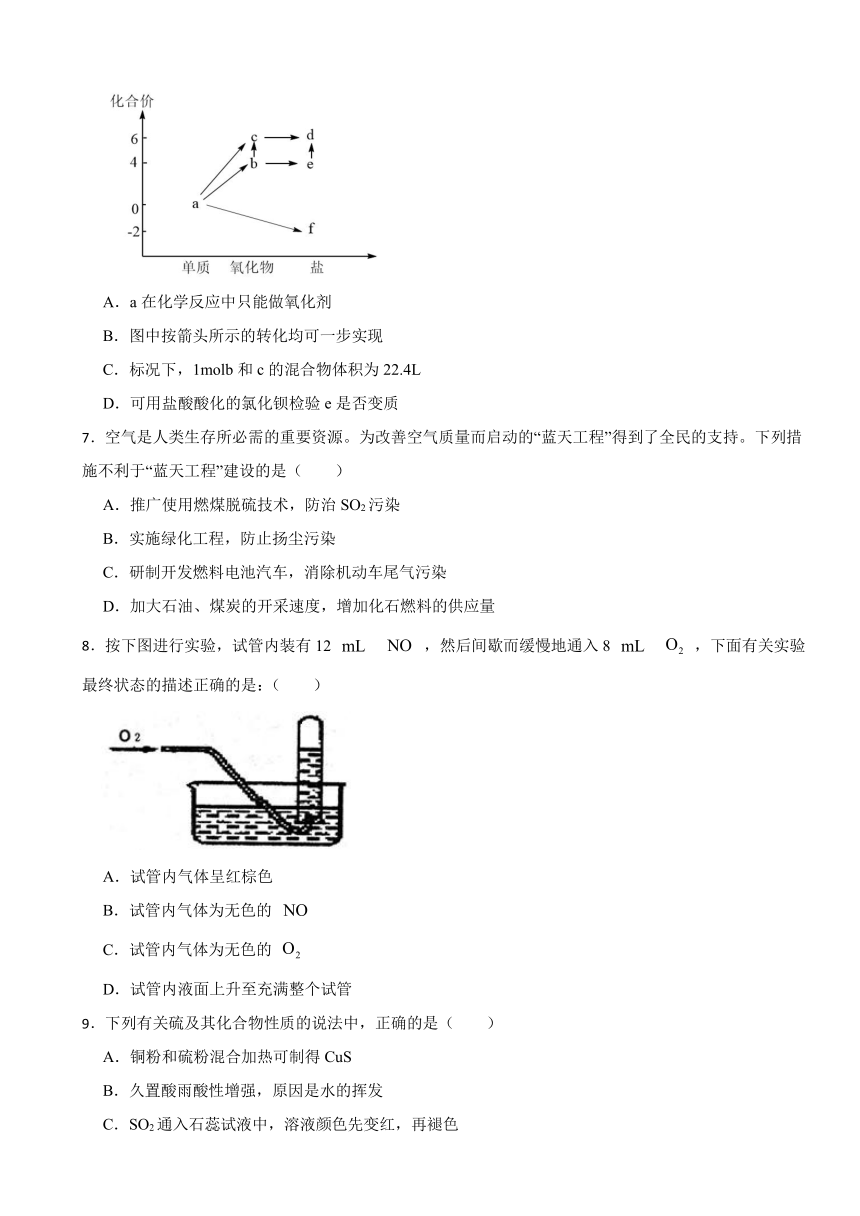
6.价-类二维图是学习元素化合物知识的重要方法,某同学绘制某常见元素的价-类二维图如图所示。下列推断合理的是
A.a在化学反应中只能做氧化剂
B.图中按箭头所示的转化均可一步实现
C.标况下,1molb和c的混合物体积为22.4L
D.可用盐酸酸化的氯化钡检验e是否变质
7.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防止扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
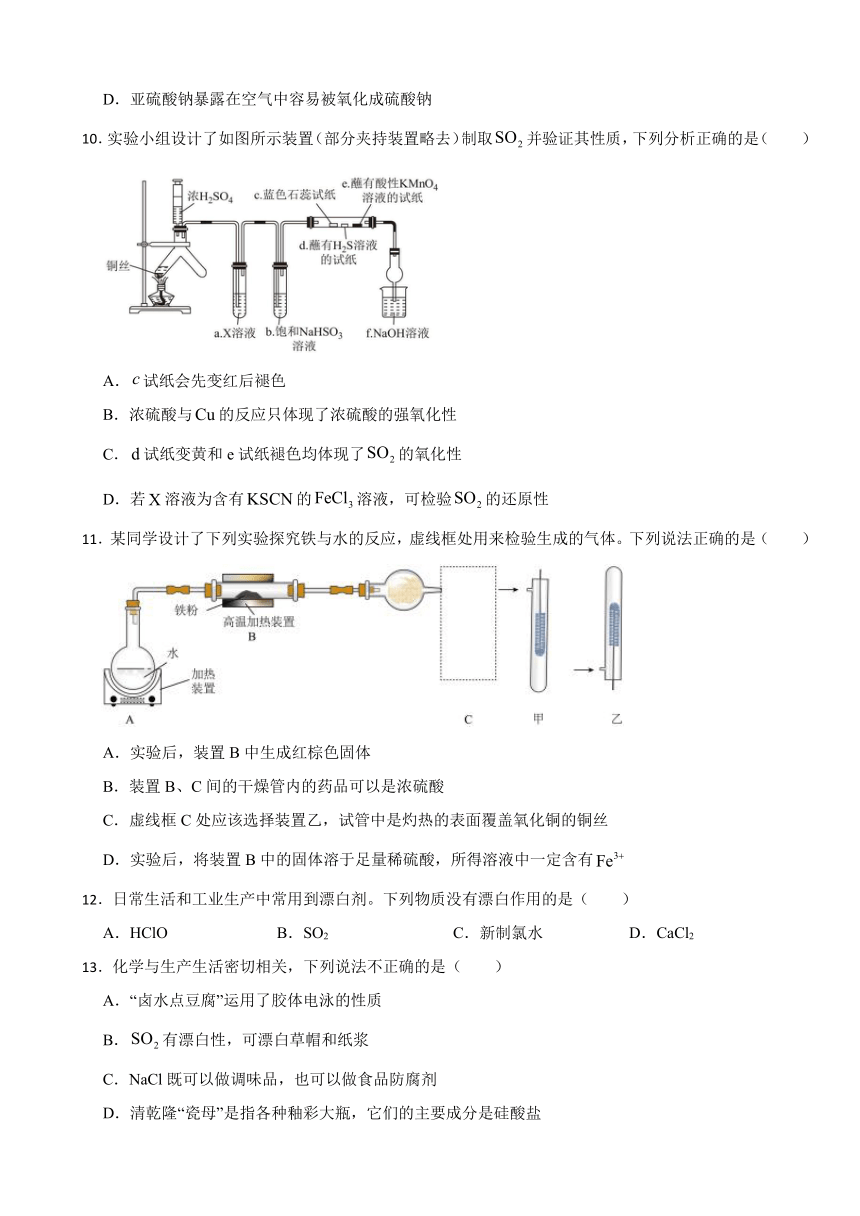
8.按下图进行实验,试管内装有12 ,然后间歇而缓慢地通入8 ,下面有关实验最终状态的描述正确的是:( )
A.试管内气体呈红棕色
B.试管内气体为无色的
C.试管内气体为无色的
D.试管内液面上升至充满整个试管
9.下列有关硫及其化合物性质的说法中,正确的是( )
A.铜粉和硫粉混合加热可制得CuS
B.久置酸雨酸性增强,原因是水的挥发
C.SO2通入石蕊试液中,溶液颜色先变红,再褪色
D.亚硫酸钠暴露在空气中容易被氧化成硫酸钠
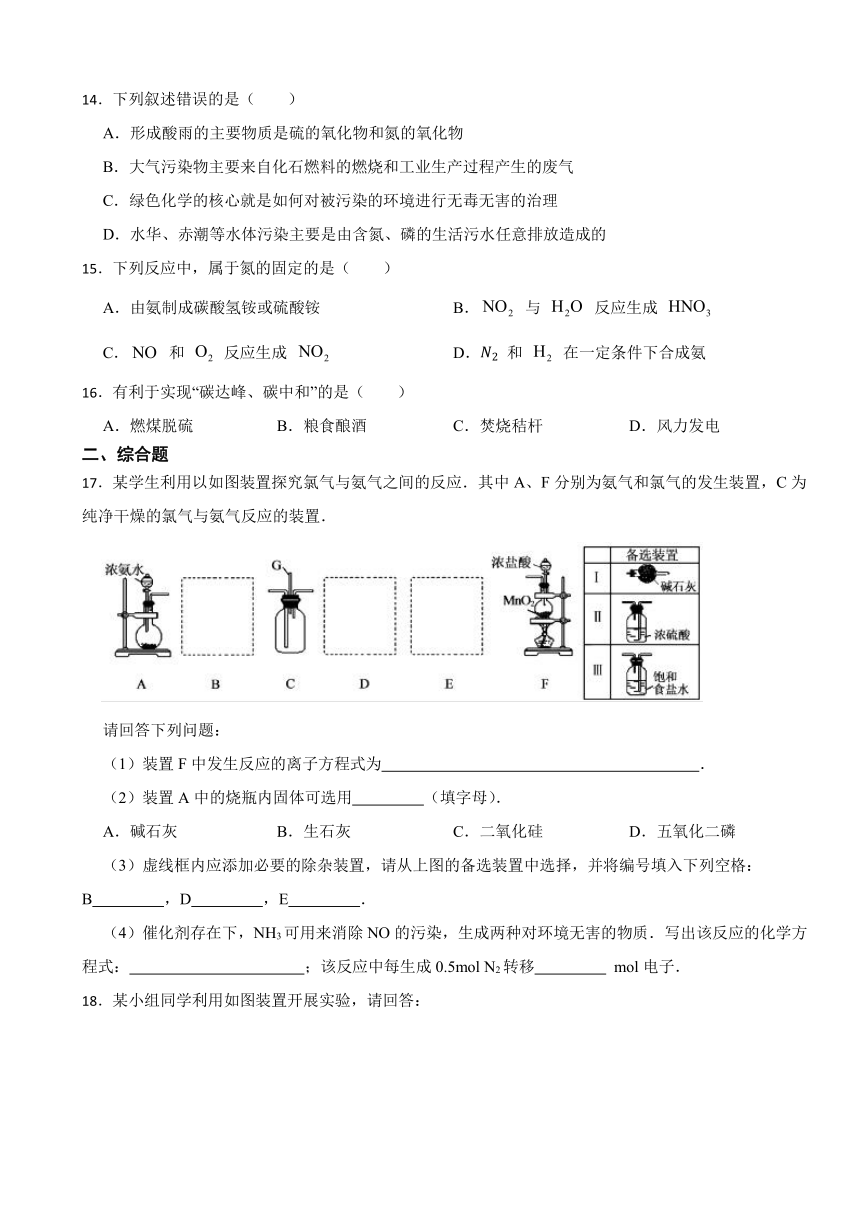
10.实验小组设计了如图所示装置(部分夹持装置略去)制取并验证其性质,下列分析正确的是( )
A.试纸会先变红后褪色
B.浓硫酸与的反应只体现了浓硫酸的强氧化性
C.试纸变黄和e试纸褪色均体现了的氧化性
D.若溶液为含有的溶液,可检验的还原性
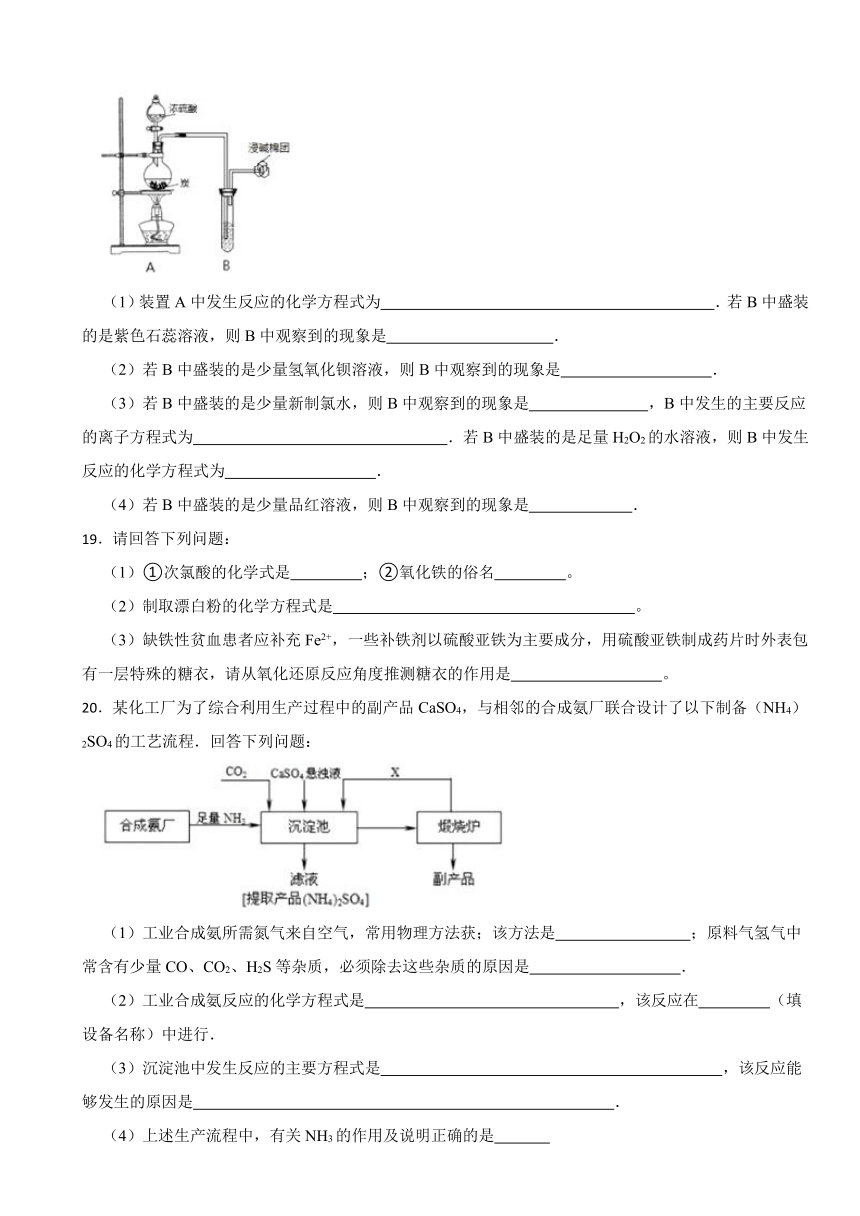
11.某同学设计了下列实验探究铁与水的反应,虚线框处用来检验生成的气体。下列说法正确的是( )
A.实验后,装置B中生成红棕色固体
B.装置B、C间的干燥管内的药品可以是浓硫酸
C.虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝
D.实验后,将装置B中的固体溶于足量稀硫酸,所得溶液中一定含有
12.日常生活和工业生产中常用到漂白剂。下列物质没有漂白作用的是( )
A.HClO B.SO2 C.新制氯水 D.CaCl2
13.化学与生产生活密切相关,下列说法不正确的是( )
A.“卤水点豆腐”运用了胶体电泳的性质
B.有漂白性,可漂白草帽和纸浆
C.NaCl既可以做调味品,也可以做食品防腐剂
D.清乾隆“瓷母”是指各种釉彩大瓶,它们的主要成分是硅酸盐
14.下列叙述错误的是( )
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料的燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
15.下列反应中,属于氮的固定的是( )
A.由氨制成碳酸氢铵或硫酸铵 B. 与 反应生成
C. 和 反应生成 D. 和 在一定条件下合成氨
16.有利于实现“碳达峰、碳中和”的是( )
A.燃煤脱硫 B.粮食酿酒 C.焚烧秸杆 D.风力发电
二、综合题
17.某学生利用以如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)装置A中的烧瓶内固体可选用 (填字母).
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D ,E .
(4)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质.写出该反应的化学方程式: ;该反应中每生成0.5mol N2转移 mol电子.
18.某小组同学利用如图装置开展实验,请回答:
(1)装置A中发生反应的化学方程式为 .若B中盛装的是紫色石蕊溶液,则B中观察到的现象是 .
(2)若B中盛装的是少量氢氧化钡溶液,则B中观察到的现象是 .
(3)若B中盛装的是少量新制氯水,则B中观察到的现象是 ,B中发生的主要反应的离子方程式为 .若B中盛装的是足量H2O2的水溶液,则B中发生反应的化学方程式为 .
(4)若B中盛装的是少量品红溶液,则B中观察到的现象是 .
19.请回答下列问题:
(1)①次氯酸的化学式是 ;②氧化铁的俗名 。
(2)制取漂白粉的化学方程式是 。
(3)缺铁性贫血患者应补充Fe2+,一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,请从氧化还原反应角度推测糖衣的作用是 。
20.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题:
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是 ;原料气氢气中常含有少量CO、CO2、H2S等杂质,必须除去这些杂质的原因是 .
(2)工业合成氨反应的化学方程式是 ,该反应在 (填设备名称)中进行.
(3)沉淀池中发生反应的主要方程式是 ,该反应能够发生的原因是 .
(4)上述生产流程中,有关NH3的作用及说明正确的是
A.提供制各产品所需的氮元素
B.增大CO32﹣的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是 .从绿色化学和资源综合利用的角度说明上述流程的主要优点是 .
(6)写出硫酸钙的其它一种用途 .
21.HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述错误的是______________(填字母)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式: 。
(3)Fe与过量稀硫酸反应可以制取FeSO4,若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是 (填字母)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(4)FeSO4可用于制备高铁酸钾(K2FeO4),写出在碱性条件下用
FeSO4 与NaClO反应制高铁酸钾的离子方程式: 。
①该反应中的还原剂是 ;②当有38g的FeSO4反应转移的电子数目为 。
答案解析部分
1.【答案】B
【解析】【解答】A. S和O2反应是SO2,A不符合题意 ;
B. Fe和S反应是FeS,B符合题意 ;
C. N2和O2反应是NO,C不符合题意 ;
D. Cu和S反应是Cu2S,D不符合题意 ;
故答案为:B 。
【分析】S和O2反应是SO2, Fe和S反应是FeS,N2和O2反应是NO,Cu和S反应是Cu2S。
2.【答案】B
【解析】【解答】A、SiO2属于酸性氧化物,难溶于水,且不与水反应生成H2SiO3,故A说法符合题意;
B、铝与浓硝酸发生钝化反应,阻碍反应的进行,可用铝制容器存放浓硝酸,故B说法不符合题意;
C、氯气与碱反应生成次氯酸盐和氯化物,次氯酸盐可以作消毒剂,故C说法符合题意;
D、2Na2O2+2CO2=2Na2CO3+O2,可用作呼吸面具的供氧剂,故D说法符合题意。
【分析】浓硝酸具有强氧化性,与铝发生钝化反应,生成致密氧化膜
3.【答案】A
【解析】【解答】A.SO2的水溶液呈酸性,SO2缓慢通入石蕊试液中能使石蕊试液变红,但不会褪色,A符合题意;
B.NO和O2按照4:3的体积比同时通入水中,发生的总反应可以表示为4NO+3O2+2H2O=4HNO3,NO、O2恰好完全反应,得到无色的HNO3溶液,B不符合题意;
C.NH3缓缓通入FeCl3溶液中,发生反应3NH3+3H2O+FeCl3=Fe(OH)3↓+3NH4Cl,产生红褐色的Fe(OH)3沉淀,C不符合题意;
D.滴有酚酞的NaOH溶液呈红色,Cl2缓慢通入滴有酚酞的NaOH溶液中发生反应Cl2+2NaOH=NaCl+NaClO+H2O,红色消失,D不符合题意;
故答案为:A。
【分析】A.二氧化硫不能漂白指示剂;
B.NO和O2按照4:3的体积比同时通入水中发生反应4NO+3O2+2H2O=4HNO3,硝酸为无色溶液;
C.NH3通入FeCl3溶液中发生反应3NH3+3H2O+FeCl3=Fe(OH)3↓+3NH4Cl;
D.氯气与NaOH反应使溶液碱性降低。
4.【答案】C
【解析】【解答】A.研发催化剂将还原为甲醇,能促进碳中和,A项不符合题意;
B.植物光合作用吸收二氧化碳,所以积极鼓励植树造林,降低空气中含量,B项不符合题意;
C.为了减少煤燃烧对大气造成的污染,所以利用煤的气化、液化制备清洁燃料,但是对于二氧化碳的排放而言,并没有任何的减少,C项符合题意;
D.二氧化碳为酸性氧化物,能够与碱和碱性氧化物反应,所以利用中西部地区富含钙离子的碱性土壤,吸收固定,D项不符合题意;
故答案为:C。
【分析】A.研究催化剂将二氧化碳还原为甲醇能减少二氧化碳的排放;
B.二氧化碳是植物光合作用的原料;
D.二氧化碳为酸性氧化物,能够与碱和碱性氧化物反应。
5.【答案】D
【解析】【解答】A.SO2溶于水,能与水反应,A与题意不符;
B.HCl极易溶于水,B与题意不符;
C.NH3极易溶于水,能与水反应,C与题意不符;
D.CO不溶于水,不与水反应,D符合题意;
答案为D。
【分析】A.二氧化硫易溶于水;
B.HCl极易溶于水;
C.NH3极易溶于水。
6.【答案】D
【解析】【解答】A.S元素最高价为+6、最低价为-2,S单质在化学反应中既能作氧化剂又能作还原剂,故A不符合题意;
B.S和氧气反应不能一步生成SO3,故B不符合题意;
C.标况下,SO3不是气体,1mol SO2、SO3的混合物体积小于22.4L,故C不符合题意;
D.亚硫酸钠中加入盐酸酸化的氯化钡,若有白色沉淀生成,沉淀一定是硫酸钡,说明亚硫酸钠已变质,故D符合题意;
故答案为:D。
【分析】A.S单质的化合价为中间价;
B.S和氧气反应只生成SO2;
C.标况下,SO3不是气体;
D.依据现象可知含有。
7.【答案】D
【解析】【解答】A.使用燃煤脱硫技术,可以减少二氧化硫的排放,防治SO2污染,A不符合题意;
B.实施绿化工程,防止扬尘污染,可改善空气质量,B不符合题意;
C.开发燃料电池汽车,可减少有害气体的排放,C不符合题意;
D.加大不可再生资源石油、煤的开采,会造成资源缺乏,同时会使空气中的SO2、NOx含量的增加,D符合题意;
答案为D。
【分析】蓝天工程就是减少空气污染物的排放,主要是污染性气体和烟尘,主要来自化石燃料的燃烧和汽车尾气的排放以及工业废气的排放,使用脱硫技术可以减少二氧化硫的排放,可以避免硫酸型酸雨的排放,实施绿化工程可以减少烟尘的排放,研究新型能源的汽车可减少汽车尾气的排放。
8.【答案】B
【解析】【解答】A.由分析可知,反应后剩余的气体为NO,NO为无色气体,A不符合题意;
B.由分析可知,反应后剩余的气体为NO,B符合题意;
C.由分析可知,反应后剩余的气体为NO,C不符合题意;
D.由分析可知,反应后有NO剩余,则试管内液体不会充满整只试管,D不符合题意;
故答案为:B
【分析】通入O2后发生反应的化学方程式为4NO+3O2+2H2O=4HNO3,反应后NO有剩余。据此分析选项。
9.【答案】D
【解析】【解答】A、硫单质氧化性弱,氧化变价金属生成低价化合物,铜粉和硫粉混合加热可制得Cu2S,故A不符合题意;
B、酸雨酸性增强是二氧化硫和水反应生成的亚硫酸被空气中的氧气氧化得到硫酸溶液,因此久置酸雨酸性增强,故B不符合题意;
C、二氧化硫是酸性氧化物,溶于水形成亚硫酸,显酸性;二氧化硫的漂白性具有选择性,不能使变红的石蕊溶液褪色,故C不符合题意;
D、亚硫酸钠暴露在空气中容易被空气中的氧气氧化成硫酸钠,故D符合题意;
故答案为:D。
【分析】A.S只能把Cu氧化为+1价;
B.久置酸雨酸性增强是氧化的原因;
C.SO2不能使石蕊褪色;
D.O2可以将Na2SO3氧化;
10.【答案】D
【解析】【解答】A、蓝色石蕊试纸变红后不会褪色,故A选项错误;
B、浓硫酸与Cu的反应体现了浓硫酸的强氧化性、酸性,故B选项错误;
C、蘸有H2S溶液的试纸变黄体现SO2的氧化性,蘸有酸性KMnO4溶液的试纸褪色体现SO2的还原性,故C选项错误;
D、若X溶液为含有KSCN的FeCl3溶液,红色褪去,说明SO2具有还原性,故D选项正确。
故答案为:D.
【分析】主要考察SO2的的性质,判断氧化性与还原性。
11.【答案】C
【解析】【解答】A.铁与高温水蒸气反应生成Fe3O4,Fe3O4是黑色固体,A不符合题意;
B.干燥管只能装固体干燥剂,B不符合题意;
C.铁与高温水蒸气反应生成Fe3O4和氢气,氢气收集要用向下排空气法,故使用乙装置进行实验,C符合题意;
D.将固体放入稀硫酸中反应,Fe3O4与硫酸反应有Fe3+离子出现,Fe与Fe3+在溶液中反应生成Fe2+,若B中固体有铁粉剩余且足够多,最终溶液中不会有Fe3+,D不符合题意;
故答案为:C。
【分析】A.铁和水蒸气反应生成四氧化三铁,黑色固体;
B.球型干燥管只可以盛装固体干燥剂;
C.铁和水蒸气反应生成四氧化三铁和氢气,用灼热的氧化铜来检验生成的氢气;
D.Fe3O4与硫酸反应有Fe3+和Fe2+物质的量之比为2:1,但B中固体有铁粉剩余且足够多的话,会把铁离子还原为亚铁离子。
12.【答案】D
【解析】【解答】A.HClO具有氧化性,故具有漂白作用,A不符合题意;
B.SO2能使品红溶液褪色,体现了SO2的漂白性,B不符合题意;
C.新制氯水具有氧化性,故具有漂白性,C不符合题意;
D.CaCl2不具有氧化性,故不具有漂白性,D符合题意;
故答案为:D
【分析】具有氧化性的物质具有漂白作用,据此分析选项。
13.【答案】A
【解析】【解答】A、用盐卤点豆腐是胶体聚沉的应用,A符合题意;
B、SO2有漂白性,可漂白草帽和纸浆,B不符合题意;
C. NaCl有咸味,用食盐腌制食品可以防止食品腐烂变质,C不符合题意;
D. 陶瓷主要成分是硅酸盐,D不符合题意;
故答案为:A
【分析】A、胶体聚沉的应用;
B、SO2有漂白性;
C. 用食盐腌制食品可以防止食品腐烂变质;
D. 陶瓷主要成分是硅酸盐。
14.【答案】C
【解析】【解答】A.二氧化硫是形成硫酸型酸雨,氮的氧化物会形成硝酸型酸雨,因此形成酸雨的主要物质是硫的氧化物和氮的氧化物,故A不符合题意;
B.化石燃料燃烧和工业生产过程产生的废气中往往含有二氧化硫、CO等,是产生大气污染物的主要气体,故B不符合题意;
C.绿色化学不是对环境进行无毒无害的治理,故C符合题意;
D.含氮、磷的生活污水任意排放会造成水体富营养化,形成水华、赤潮等水体污染现象,故D不符合题意;
故答案为:C。
【分析】A.酸雨主要是硫酸型酸雨,主要是二氧化硫和硝酸进行酸雨主要是二氧化氮
B.大气污染物包括气体污染物和烟尘污染物,主要来自化石燃料的燃烧和工业废气以及汽车尾气的排放
C.绿色化学的核心就是要利用化学原理从源头消除污染
D.氮元素和磷元素太多易造成水华和赤潮
15.【答案】D
【解析】【解答】A.由氨制成碳酸氢铵或硫酸铵,N在氨以及在铵盐中均为化合态,故A不是氮的固定;
B.NO2 与H2O反应生成HNO3,N在反应物和生成物中均为化合态,故B不是氮的固定;
C.NO 和O2反应生成NO2,N在反应物和生成物中均为化合态,故C不是氮的固定;
D.N2 和H2在一定条件下合成氨,N由氮气中的游离态变为氨中的化合态,故D是氮的固定;
故答案为:D。
【分析】氮的固定是将游离态的氮转化为化合态的氮的过程。
16.【答案】D
【解析】【解答】A.燃煤脱硫可以减少二氧化硫的排放,但不能减少二氧化碳的排放,不利于实现“碳达峰、碳中和”,故A不符合题意;
B.粮食酿酒的过程为,粮食中的淀粉在酶的作用下水解生成葡萄糖,葡萄糖在酒化酶的作用下反应生成乙醇和二氧化碳,则粮食酿酒会增加二氧化碳的排放,不利于实现“碳达峰、碳中和”,故B不符合题意;
C.焚烧秸杆会增加二氧化碳的排放,不利于实现“碳达峰、碳中和”,故C不符合题意;
D.风力发电能减少化石能源的使用,能减少二氧化碳的排放,有利于实现“碳达峰、碳中和”,故D符合题意;
故答案为:D。
【分析】“碳达峰、碳中和”主要是针对减少二氧化碳排放。
17.【答案】(1)MnO2+4H++2Cl﹣ Mn2++Cl2↑+2H2O
(2)A;B
(3)Ⅰ;Ⅱ;Ⅲ
(4)4NH3+6NO=5N2+6H2O;1.2
【解析】【解答】解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,离子反应为MnO2+4H++2Cl﹣ Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl﹣ Mn2++Cl2↑+2H2O(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、B.生石灰都是碱性物质,且溶解于水时放出热量,C、二氧化硅不溶于水,D.五氧化二磷虽然溶于水时放热,但是酸性物质.故选A、B故答案为:AB(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ.故答案为:Ⅰ;Ⅱ;Ⅲ;(4)因为根据化学反应前后元素守恒且NH3和NO生成两种对环境无害的物质故方程式为
4NH3+6NO= 5N2+6H2O 转移电子12mole﹣
5mol 12mol
0. 5mol 1.2mol
故答案为:4NH3+6NO=5N2+6H2O;1.2mol
【分析】(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,注意稀盐酸和二氧化锰不反应;(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应;(3)根据杂质的性质选择除杂装置,氨气是碱性气体,要除去水蒸气只能用碱性物质,制得的氯气中混有氯化氢气体和水蒸气,因用饱和的氯化钠溶液和浓硫酸除去;(4)根据化学反应前后元素守恒来书写方程式;
18.【答案】(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;紫色石蕊溶液变红
(2)有白色沉淀产生
(3)黄绿色褪去;Cl2+SO2+2H2O=4H++2Cl﹣+SO42;SO2+H2O2=H2SO4
(4)红色褪去
【解析】【解答】解:(1)炭与浓硫酸加热,反应生成二氧化硫、二氧化碳、水;二氧化硫与水反应生成亚硫酸;二氧化硫、二氧化碳与氢氧化钡反应生成亚硫酸钡或碳酸钡沉淀;(3)新制氯水呈浅黄绿色,二氧化硫具有还原性,能与新制氯水反应生成硫酸和盐酸,二氧化硫与过氧化氢反应生成硫酸;(4)二氧化硫具有漂白性。
解析:(1)炭与浓硫酸加热,反应生成二氧化硫、二氧化碳、水,A中反应的方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;二氧化硫与水反应生成亚硫酸,所以B中紫色石蕊溶液变红;二氧化硫、二氧化碳与氢氧化钡反应生成亚硫酸钡或碳酸钡沉淀,所以若B中盛装的是少量氢氧化钡溶液,则B中观察到的现象是有白色沉淀生成(3)新制氯水呈浅黄绿色,二氧化硫具有还原性,能与新制氯水反应生成硫酸和盐酸,所以现象是氯水黄绿色褪去,发生的主要反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl﹣+SO42-;二氧化硫与过氧化氢反应生成硫酸,发生反应的化学方程式为SO2+H2O2=H2SO4;(4)二氧化硫具有漂白性,能使品红溶液褪色,所以B中观察到的现象是红色褪去。
【分析】
(1)A中反应的方程式为C+2H2SO4(浓) Δ= CO2↑+2SO2↑+2H2O;紫色石蕊溶液检验酸(二氧化硫与水反应生成亚硫酸),现象变红
(2)二氧化硫、二氧化碳与氢氧化钡反应生成亚硫酸钡或碳酸钡沉淀,所以B中观察到的现象是有白色沉淀生成
(3)二氧化硫具有还原性,新制氯水具强氧化性,Cl2+SO2+2H2O=4H++2Cl﹣+SO42- 氯水被二氧化硫还原而褪色
(4)二氧化硫具有漂白性(使品红褪色)
19.【答案】(1)HClO;铁红
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(CLO)2+2H2O
(3)防止Fe2+被氧化
【解析】【解答】(1)①次氯酸是含氯元素的化合物,其化学式是HClO;②氧化铁为红棕色粉末状固体,其俗名铁红;
(2)漂白粉的有效成分为次氯酸钙,氯气与石灰乳反应生成氯化钙、次氯酸钙和水,制取漂白粉的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(CLO)2+2H2O;
(3)亚铁离子具有还原性,易被氧化变质,糖衣可以起到保护亚铁离子不被空气中的氧气氧化的作用。
【分析】(1)次氯酸的化学式为HClO;氧化铁的俗名为铁红。
(2)漂白粉的主要成分是CaCl2和Ca(ClO)2,是由Cl2与Ca(OH)2反应得到,据此写出反应的化学方程式。
(3)Fe2+具有强还原性,易被空气中的O2氧化,据此确定糖衣的作用。
20.【答案】(1)蒸馏液态空气;防止催化剂中毒
(2)N2+3H2 2NH3;合成塔
(3)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;生成碳酸钙溶解度小于硫酸钙,有利于反应向正向进行
(4)A;B
(5)CO2;该流程中产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生
(6)生产水泥石膏
【解析】【解答】解:(1)工业合成氨所需氮气来自空气,常用蒸馏空气的物理方法获得;原料气氢气中常含有少量CO、CO2、H2S等杂质,会引起催化剂中毒,必须除去,
故答案为:蒸馏液态空气;防止催化剂中毒;(2)氮气和氢气在高温高压、催化剂条件下反应生成氨气,该反应在合成塔中进行,
故答案为:N2+3H2 2NH3;合成塔;(3)NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,得以发生的原因是碳酸钙的溶解性比硫酸钙小,有利于反应向正方向进行,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;生成碳酸钙溶解度小于硫酸钙,有利于反应向正向进行;(4)上述生产流程中,氨气的作用是提供制各产品所需的氮元素,增大CO32﹣的浓度促进反应发生,不作为催化剂,
故答案为:AB;(5))CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用,副产品为生石灰,根据反应流程离子,该反应的有利点为:生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,
故答案为:CO2;该流程中产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生;(6)硫酸钙的用途可以是生产水泥,石膏等,
故答案为:生产水泥,石膏.
【分析】(1)工业合成氨所需氮气来自空气,常用蒸馏空气的物理方法获得;原料气氢气中常含有少量CO、CO2、H2S等杂质,会引起催化剂中毒,必须除去;(2)氮气和氢气在高温高压、催化剂条件下反应生成氨气,该反应在合成塔中进行,催化剂为铁触媒;(3)NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,得以发生的原因是沉淀转化的问题;(4)根据氨在生产生活中的使用分析;(5)碳酸钙高温下分解生成氧化钙和二氧化碳,二氧化碳可以循环利用,氧化钙为副产品;从反应原理及可循环利用物质、副产品及是否有污染物生成等角度分析;(6)硫酸钙可以生产水泥石膏等.
21.【答案】(1)D
(2)Cl2+H2O+ NO2-= NO3-+2Cl-+2H+
(3)C
(4)Fe2++2ClO-+4OH-=FeO42-+2Cl-+2H2O;FeSO4;NA
【解析】【解答】(1)误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,说明亚硝酸盐具有氧化性,能把亚铁离子氧化生成铁离子;服用维生素C可解毒,说明维生素C能把铁离子还原生成亚铁离子,这说明维生素C具有还原性,因此选项D错误,其余都是正确的,故答案为:D;
(2)把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成硝酸钠和氯化氢,说明在反应中氯气不亚硝酸钠氧化,反应的化学方程式是NO+Cl2+H2O=NO3-+2H++2Cl-,故答案为:NO+Cl2+H2O=NO3-+2H++2Cl-;
(3)由于Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确是双氧水,故答案为:c;
(4)碱性条件下用 FeSO4 与NaClO反应,反应中Fe元素化合价由+2价变为+6价、氯元素化合价由+1价变为、-1价,反应的离子方程式为:Fe2++2ClO-+4OH-=FeO42-+2Cl-+2H2O,故答案为:Fe2++2ClO-+4OH-=FeO42-+2Cl-+2H2O;
①该反应中铁元素化合价升高被氧化,FeSO4是还原剂,故答案为:FeSO4;
②1mol FeSO4反应,转移电子数目为4mol ,38gFeSO4的物质的量为0.25mol,则反应转移的电子数目为0.25×4mol=1 mol,故答案为:NA。
【分析】(1)根据反应过程中元素化合价的变化,结合氧化还原反应的相关概念分析;
(2)根据题干信息确定反应物和生成物,结合得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
(3)H2O2是一种绿色氧化剂,其还原产物为H2O,不会引入新的杂质;
(4)ClO-具有氧化性,能将Fe2+氧化成FeO42-,自身还原为Cl-,结合得失电子守恒、电荷守恒和原子个数守恒书写反应的离子方程式;
①反应过程中有元素化合价升高的物质为还原剂;
②根据公式计算n(FeSO4),结合反应过程中化合价的变化计算转移电子数;
一、单选题
1.下列物质中可以由两种单质直接化合制得的是( )
A. B.FeS C. D.CuS
2.化学与科学、技术、社会、环境密切相关。下列说法错误的是( )
A.SiO2是酸性氧化物,但不能直接与水反应生成H2SiO3
B.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
C.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
D.Na2O2能与CO2反应产生O2,可用作呼吸面具的供氧剂
3.下列实验过程中颜色的变化描述错误的是( )
A.SO2气体缓慢通入石蕊试液中,溶液先变红后褪色
B.NO和O2按照4:3的体积比同时通入水中,得到无色溶液
C.NH3缓缓通入FeCl3溶液中,产生红褐色沉淀
D.Cl2缓慢通入滴有酚酞的NaOH溶液,红色消失
4.2021年3月全国两会期间,政府工作报告中提到的“碳达峰”、“碳中和”成为热词。“碳中和”指的是通过植树造林、节能减排、碳捕集与封存等形式,抵消生产生活中产生的二氧化碳,达到相对“零排放”。下列有关说法错误的是( )
A.研发催化剂将还原为甲醇
B.积极鼓励植树造林,降低空气中含量
C.利用煤的气化、液化制备清洁燃料,降低碳排放
D.利用中西部地区富含钙离子的碱性土壤,吸收固定
5.下列气体难溶于水的是
A.SO2 B.HCl C.NH3 D.CO
6.价-类二维图是学习元素化合物知识的重要方法,某同学绘制某常见元素的价-类二维图如图所示。下列推断合理的是
A.a在化学反应中只能做氧化剂
B.图中按箭头所示的转化均可一步实现
C.标况下,1molb和c的混合物体积为22.4L
D.可用盐酸酸化的氯化钡检验e是否变质
7.空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )
A.推广使用燃煤脱硫技术,防治SO2污染
B.实施绿化工程,防止扬尘污染
C.研制开发燃料电池汽车,消除机动车尾气污染
D.加大石油、煤炭的开采速度,增加化石燃料的供应量
8.按下图进行实验,试管内装有12 ,然后间歇而缓慢地通入8 ,下面有关实验最终状态的描述正确的是:( )
A.试管内气体呈红棕色
B.试管内气体为无色的
C.试管内气体为无色的
D.试管内液面上升至充满整个试管
9.下列有关硫及其化合物性质的说法中,正确的是( )
A.铜粉和硫粉混合加热可制得CuS
B.久置酸雨酸性增强,原因是水的挥发
C.SO2通入石蕊试液中,溶液颜色先变红,再褪色
D.亚硫酸钠暴露在空气中容易被氧化成硫酸钠
10.实验小组设计了如图所示装置(部分夹持装置略去)制取并验证其性质,下列分析正确的是( )
A.试纸会先变红后褪色
B.浓硫酸与的反应只体现了浓硫酸的强氧化性
C.试纸变黄和e试纸褪色均体现了的氧化性
D.若溶液为含有的溶液,可检验的还原性
11.某同学设计了下列实验探究铁与水的反应,虚线框处用来检验生成的气体。下列说法正确的是( )
A.实验后,装置B中生成红棕色固体
B.装置B、C间的干燥管内的药品可以是浓硫酸
C.虚线框C处应该选择装置乙,试管中是灼热的表面覆盖氧化铜的铜丝
D.实验后,将装置B中的固体溶于足量稀硫酸,所得溶液中一定含有
12.日常生活和工业生产中常用到漂白剂。下列物质没有漂白作用的是( )
A.HClO B.SO2 C.新制氯水 D.CaCl2
13.化学与生产生活密切相关,下列说法不正确的是( )
A.“卤水点豆腐”运用了胶体电泳的性质
B.有漂白性,可漂白草帽和纸浆
C.NaCl既可以做调味品,也可以做食品防腐剂
D.清乾隆“瓷母”是指各种釉彩大瓶,它们的主要成分是硅酸盐
14.下列叙述错误的是( )
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料的燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.水华、赤潮等水体污染主要是由含氮、磷的生活污水任意排放造成的
15.下列反应中,属于氮的固定的是( )
A.由氨制成碳酸氢铵或硫酸铵 B. 与 反应生成
C. 和 反应生成 D. 和 在一定条件下合成氨
16.有利于实现“碳达峰、碳中和”的是( )
A.燃煤脱硫 B.粮食酿酒 C.焚烧秸杆 D.风力发电
二、综合题
17.某学生利用以如图装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
请回答下列问题:
(1)装置F中发生反应的离子方程式为 .
(2)装置A中的烧瓶内固体可选用 (填字母).
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:B ,D ,E .
(4)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质.写出该反应的化学方程式: ;该反应中每生成0.5mol N2转移 mol电子.
18.某小组同学利用如图装置开展实验,请回答:
(1)装置A中发生反应的化学方程式为 .若B中盛装的是紫色石蕊溶液,则B中观察到的现象是 .
(2)若B中盛装的是少量氢氧化钡溶液,则B中观察到的现象是 .
(3)若B中盛装的是少量新制氯水,则B中观察到的现象是 ,B中发生的主要反应的离子方程式为 .若B中盛装的是足量H2O2的水溶液,则B中发生反应的化学方程式为 .
(4)若B中盛装的是少量品红溶液,则B中观察到的现象是 .
19.请回答下列问题:
(1)①次氯酸的化学式是 ;②氧化铁的俗名 。
(2)制取漂白粉的化学方程式是 。
(3)缺铁性贫血患者应补充Fe2+,一些补铁剂以硫酸亚铁为主要成分,用硫酸亚铁制成药片时外表包有一层特殊的糖衣,请从氧化还原反应角度推测糖衣的作用是 。
20.某化工厂为了综合利用生产过程中的副产品CaSO4,与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题:
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是 ;原料气氢气中常含有少量CO、CO2、H2S等杂质,必须除去这些杂质的原因是 .
(2)工业合成氨反应的化学方程式是 ,该反应在 (填设备名称)中进行.
(3)沉淀池中发生反应的主要方程式是 ,该反应能够发生的原因是 .
(4)上述生产流程中,有关NH3的作用及说明正确的是
A.提供制各产品所需的氮元素
B.增大CO32﹣的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是 .从绿色化学和资源综合利用的角度说明上述流程的主要优点是 .
(6)写出硫酸钙的其它一种用途 .
21.HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物,试回答下列问题:
(1)人体正常的血红蛋白含有Fe2+,若误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,服用维生素C可解毒。下列叙述错误的是______________(填字母)。
A.亚硝酸盐被还原 B.维生素C是还原剂
C.维生素C将Fe3+还原为Fe2+ D.亚硝酸盐是还原剂
(2)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式: 。
(3)Fe与过量稀硫酸反应可以制取FeSO4,若用反应所得的酸性溶液,将Fe2+转化为Fe3+,要求产物纯净,可选用的最佳试剂是 (填字母)。
a.Cl2 b.Fe c.H2O2 d.HNO3
(4)FeSO4可用于制备高铁酸钾(K2FeO4),写出在碱性条件下用
FeSO4 与NaClO反应制高铁酸钾的离子方程式: 。
①该反应中的还原剂是 ;②当有38g的FeSO4反应转移的电子数目为 。
答案解析部分
1.【答案】B
【解析】【解答】A. S和O2反应是SO2,A不符合题意 ;
B. Fe和S反应是FeS,B符合题意 ;
C. N2和O2反应是NO,C不符合题意 ;
D. Cu和S反应是Cu2S,D不符合题意 ;
故答案为:B 。
【分析】S和O2反应是SO2, Fe和S反应是FeS,N2和O2反应是NO,Cu和S反应是Cu2S。
2.【答案】B
【解析】【解答】A、SiO2属于酸性氧化物,难溶于水,且不与水反应生成H2SiO3,故A说法符合题意;
B、铝与浓硝酸发生钝化反应,阻碍反应的进行,可用铝制容器存放浓硝酸,故B说法不符合题意;
C、氯气与碱反应生成次氯酸盐和氯化物,次氯酸盐可以作消毒剂,故C说法符合题意;
D、2Na2O2+2CO2=2Na2CO3+O2,可用作呼吸面具的供氧剂,故D说法符合题意。
【分析】浓硝酸具有强氧化性,与铝发生钝化反应,生成致密氧化膜
3.【答案】A
【解析】【解答】A.SO2的水溶液呈酸性,SO2缓慢通入石蕊试液中能使石蕊试液变红,但不会褪色,A符合题意;
B.NO和O2按照4:3的体积比同时通入水中,发生的总反应可以表示为4NO+3O2+2H2O=4HNO3,NO、O2恰好完全反应,得到无色的HNO3溶液,B不符合题意;
C.NH3缓缓通入FeCl3溶液中,发生反应3NH3+3H2O+FeCl3=Fe(OH)3↓+3NH4Cl,产生红褐色的Fe(OH)3沉淀,C不符合题意;
D.滴有酚酞的NaOH溶液呈红色,Cl2缓慢通入滴有酚酞的NaOH溶液中发生反应Cl2+2NaOH=NaCl+NaClO+H2O,红色消失,D不符合题意;
故答案为:A。
【分析】A.二氧化硫不能漂白指示剂;
B.NO和O2按照4:3的体积比同时通入水中发生反应4NO+3O2+2H2O=4HNO3,硝酸为无色溶液;
C.NH3通入FeCl3溶液中发生反应3NH3+3H2O+FeCl3=Fe(OH)3↓+3NH4Cl;
D.氯气与NaOH反应使溶液碱性降低。
4.【答案】C
【解析】【解答】A.研发催化剂将还原为甲醇,能促进碳中和,A项不符合题意;
B.植物光合作用吸收二氧化碳,所以积极鼓励植树造林,降低空气中含量,B项不符合题意;
C.为了减少煤燃烧对大气造成的污染,所以利用煤的气化、液化制备清洁燃料,但是对于二氧化碳的排放而言,并没有任何的减少,C项符合题意;
D.二氧化碳为酸性氧化物,能够与碱和碱性氧化物反应,所以利用中西部地区富含钙离子的碱性土壤,吸收固定,D项不符合题意;
故答案为:C。
【分析】A.研究催化剂将二氧化碳还原为甲醇能减少二氧化碳的排放;
B.二氧化碳是植物光合作用的原料;
D.二氧化碳为酸性氧化物,能够与碱和碱性氧化物反应。
5.【答案】D
【解析】【解答】A.SO2溶于水,能与水反应,A与题意不符;
B.HCl极易溶于水,B与题意不符;
C.NH3极易溶于水,能与水反应,C与题意不符;
D.CO不溶于水,不与水反应,D符合题意;
答案为D。
【分析】A.二氧化硫易溶于水;
B.HCl极易溶于水;
C.NH3极易溶于水。
6.【答案】D
【解析】【解答】A.S元素最高价为+6、最低价为-2,S单质在化学反应中既能作氧化剂又能作还原剂,故A不符合题意;
B.S和氧气反应不能一步生成SO3,故B不符合题意;
C.标况下,SO3不是气体,1mol SO2、SO3的混合物体积小于22.4L,故C不符合题意;
D.亚硫酸钠中加入盐酸酸化的氯化钡,若有白色沉淀生成,沉淀一定是硫酸钡,说明亚硫酸钠已变质,故D符合题意;
故答案为:D。
【分析】A.S单质的化合价为中间价;
B.S和氧气反应只生成SO2;
C.标况下,SO3不是气体;
D.依据现象可知含有。
7.【答案】D
【解析】【解答】A.使用燃煤脱硫技术,可以减少二氧化硫的排放,防治SO2污染,A不符合题意;
B.实施绿化工程,防止扬尘污染,可改善空气质量,B不符合题意;
C.开发燃料电池汽车,可减少有害气体的排放,C不符合题意;
D.加大不可再生资源石油、煤的开采,会造成资源缺乏,同时会使空气中的SO2、NOx含量的增加,D符合题意;
答案为D。
【分析】蓝天工程就是减少空气污染物的排放,主要是污染性气体和烟尘,主要来自化石燃料的燃烧和汽车尾气的排放以及工业废气的排放,使用脱硫技术可以减少二氧化硫的排放,可以避免硫酸型酸雨的排放,实施绿化工程可以减少烟尘的排放,研究新型能源的汽车可减少汽车尾气的排放。
8.【答案】B
【解析】【解答】A.由分析可知,反应后剩余的气体为NO,NO为无色气体,A不符合题意;
B.由分析可知,反应后剩余的气体为NO,B符合题意;
C.由分析可知,反应后剩余的气体为NO,C不符合题意;
D.由分析可知,反应后有NO剩余,则试管内液体不会充满整只试管,D不符合题意;
故答案为:B
【分析】通入O2后发生反应的化学方程式为4NO+3O2+2H2O=4HNO3,反应后NO有剩余。据此分析选项。
9.【答案】D
【解析】【解答】A、硫单质氧化性弱,氧化变价金属生成低价化合物,铜粉和硫粉混合加热可制得Cu2S,故A不符合题意;
B、酸雨酸性增强是二氧化硫和水反应生成的亚硫酸被空气中的氧气氧化得到硫酸溶液,因此久置酸雨酸性增强,故B不符合题意;
C、二氧化硫是酸性氧化物,溶于水形成亚硫酸,显酸性;二氧化硫的漂白性具有选择性,不能使变红的石蕊溶液褪色,故C不符合题意;
D、亚硫酸钠暴露在空气中容易被空气中的氧气氧化成硫酸钠,故D符合题意;
故答案为:D。
【分析】A.S只能把Cu氧化为+1价;
B.久置酸雨酸性增强是氧化的原因;
C.SO2不能使石蕊褪色;
D.O2可以将Na2SO3氧化;
10.【答案】D
【解析】【解答】A、蓝色石蕊试纸变红后不会褪色,故A选项错误;
B、浓硫酸与Cu的反应体现了浓硫酸的强氧化性、酸性,故B选项错误;
C、蘸有H2S溶液的试纸变黄体现SO2的氧化性,蘸有酸性KMnO4溶液的试纸褪色体现SO2的还原性,故C选项错误;
D、若X溶液为含有KSCN的FeCl3溶液,红色褪去,说明SO2具有还原性,故D选项正确。
故答案为:D.
【分析】主要考察SO2的的性质,判断氧化性与还原性。
11.【答案】C
【解析】【解答】A.铁与高温水蒸气反应生成Fe3O4,Fe3O4是黑色固体,A不符合题意;
B.干燥管只能装固体干燥剂,B不符合题意;
C.铁与高温水蒸气反应生成Fe3O4和氢气,氢气收集要用向下排空气法,故使用乙装置进行实验,C符合题意;
D.将固体放入稀硫酸中反应,Fe3O4与硫酸反应有Fe3+离子出现,Fe与Fe3+在溶液中反应生成Fe2+,若B中固体有铁粉剩余且足够多,最终溶液中不会有Fe3+,D不符合题意;
故答案为:C。
【分析】A.铁和水蒸气反应生成四氧化三铁,黑色固体;
B.球型干燥管只可以盛装固体干燥剂;
C.铁和水蒸气反应生成四氧化三铁和氢气,用灼热的氧化铜来检验生成的氢气;
D.Fe3O4与硫酸反应有Fe3+和Fe2+物质的量之比为2:1,但B中固体有铁粉剩余且足够多的话,会把铁离子还原为亚铁离子。
12.【答案】D
【解析】【解答】A.HClO具有氧化性,故具有漂白作用,A不符合题意;
B.SO2能使品红溶液褪色,体现了SO2的漂白性,B不符合题意;
C.新制氯水具有氧化性,故具有漂白性,C不符合题意;
D.CaCl2不具有氧化性,故不具有漂白性,D符合题意;
故答案为:D
【分析】具有氧化性的物质具有漂白作用,据此分析选项。
13.【答案】A
【解析】【解答】A、用盐卤点豆腐是胶体聚沉的应用,A符合题意;
B、SO2有漂白性,可漂白草帽和纸浆,B不符合题意;
C. NaCl有咸味,用食盐腌制食品可以防止食品腐烂变质,C不符合题意;
D. 陶瓷主要成分是硅酸盐,D不符合题意;
故答案为:A
【分析】A、胶体聚沉的应用;
B、SO2有漂白性;
C. 用食盐腌制食品可以防止食品腐烂变质;
D. 陶瓷主要成分是硅酸盐。
14.【答案】C
【解析】【解答】A.二氧化硫是形成硫酸型酸雨,氮的氧化物会形成硝酸型酸雨,因此形成酸雨的主要物质是硫的氧化物和氮的氧化物,故A不符合题意;
B.化石燃料燃烧和工业生产过程产生的废气中往往含有二氧化硫、CO等,是产生大气污染物的主要气体,故B不符合题意;
C.绿色化学不是对环境进行无毒无害的治理,故C符合题意;
D.含氮、磷的生活污水任意排放会造成水体富营养化,形成水华、赤潮等水体污染现象,故D不符合题意;
故答案为:C。
【分析】A.酸雨主要是硫酸型酸雨,主要是二氧化硫和硝酸进行酸雨主要是二氧化氮
B.大气污染物包括气体污染物和烟尘污染物,主要来自化石燃料的燃烧和工业废气以及汽车尾气的排放
C.绿色化学的核心就是要利用化学原理从源头消除污染
D.氮元素和磷元素太多易造成水华和赤潮
15.【答案】D
【解析】【解答】A.由氨制成碳酸氢铵或硫酸铵,N在氨以及在铵盐中均为化合态,故A不是氮的固定;
B.NO2 与H2O反应生成HNO3,N在反应物和生成物中均为化合态,故B不是氮的固定;
C.NO 和O2反应生成NO2,N在反应物和生成物中均为化合态,故C不是氮的固定;
D.N2 和H2在一定条件下合成氨,N由氮气中的游离态变为氨中的化合态,故D是氮的固定;
故答案为:D。
【分析】氮的固定是将游离态的氮转化为化合态的氮的过程。
16.【答案】D
【解析】【解答】A.燃煤脱硫可以减少二氧化硫的排放,但不能减少二氧化碳的排放,不利于实现“碳达峰、碳中和”,故A不符合题意;
B.粮食酿酒的过程为,粮食中的淀粉在酶的作用下水解生成葡萄糖,葡萄糖在酒化酶的作用下反应生成乙醇和二氧化碳,则粮食酿酒会增加二氧化碳的排放,不利于实现“碳达峰、碳中和”,故B不符合题意;
C.焚烧秸杆会增加二氧化碳的排放,不利于实现“碳达峰、碳中和”,故C不符合题意;
D.风力发电能减少化石能源的使用,能减少二氧化碳的排放,有利于实现“碳达峰、碳中和”,故D符合题意;
故答案为:D。
【分析】“碳达峰、碳中和”主要是针对减少二氧化碳排放。
17.【答案】(1)MnO2+4H++2Cl﹣ Mn2++Cl2↑+2H2O
(2)A;B
(3)Ⅰ;Ⅱ;Ⅲ
(4)4NH3+6NO=5N2+6H2O;1.2
【解析】【解答】解:(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,离子反应为MnO2+4H++2Cl﹣ Mn2++Cl2↑+2H2O,故答案为:MnO2+4H++2Cl﹣ Mn2++Cl2↑+2H2O(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应,氨气是碱性气体,所以溶解的物质必须是碱性物质,A.碱石灰、B.生石灰都是碱性物质,且溶解于水时放出热量,C、二氧化硅不溶于水,D.五氧化二磷虽然溶于水时放热,但是酸性物质.故选A、B故答案为:AB(3)氨气中混有水蒸气,氨气是碱性气体,要除去水蒸气只能用碱性物质,故B选Ⅰ;制取的氯气中混有氯化氢气体和水蒸气,氯化氢极易溶于水,氯气也能溶于水,所以不能用水除去氯化氢气体;氯气和水反应生成盐酸和次氯酸,食盐水中含有氯离子,能抑制氯气的溶解,所以要想除去氯气中的氯化氢E应选Ⅲ;水蒸气常用浓硫酸除去,故D选Ⅱ.故答案为:Ⅰ;Ⅱ;Ⅲ;(4)因为根据化学反应前后元素守恒且NH3和NO生成两种对环境无害的物质故方程式为
4NH3+6NO= 5N2+6H2O 转移电子12mole﹣
5mol 12mol
0. 5mol 1.2mol
故答案为:4NH3+6NO=5N2+6H2O;1.2mol
【分析】(1)浓盐酸和二氧化锰在加热条件下反应生成氯化锰、氯气和水,注意稀盐酸和二氧化锰不反应;(2)利用物质溶解时放出的热量促进氨水的挥发来制取氨气,且该物质和氨气不反应;(3)根据杂质的性质选择除杂装置,氨气是碱性气体,要除去水蒸气只能用碱性物质,制得的氯气中混有氯化氢气体和水蒸气,因用饱和的氯化钠溶液和浓硫酸除去;(4)根据化学反应前后元素守恒来书写方程式;
18.【答案】(1)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;紫色石蕊溶液变红
(2)有白色沉淀产生
(3)黄绿色褪去;Cl2+SO2+2H2O=4H++2Cl﹣+SO42;SO2+H2O2=H2SO4
(4)红色褪去
【解析】【解答】解:(1)炭与浓硫酸加热,反应生成二氧化硫、二氧化碳、水;二氧化硫与水反应生成亚硫酸;二氧化硫、二氧化碳与氢氧化钡反应生成亚硫酸钡或碳酸钡沉淀;(3)新制氯水呈浅黄绿色,二氧化硫具有还原性,能与新制氯水反应生成硫酸和盐酸,二氧化硫与过氧化氢反应生成硫酸;(4)二氧化硫具有漂白性。
解析:(1)炭与浓硫酸加热,反应生成二氧化硫、二氧化碳、水,A中反应的方程式为C+2H2SO4(浓) CO2↑+2SO2↑+2H2O;二氧化硫与水反应生成亚硫酸,所以B中紫色石蕊溶液变红;二氧化硫、二氧化碳与氢氧化钡反应生成亚硫酸钡或碳酸钡沉淀,所以若B中盛装的是少量氢氧化钡溶液,则B中观察到的现象是有白色沉淀生成(3)新制氯水呈浅黄绿色,二氧化硫具有还原性,能与新制氯水反应生成硫酸和盐酸,所以现象是氯水黄绿色褪去,发生的主要反应的离子方程式为Cl2+SO2+2H2O=4H++2Cl﹣+SO42-;二氧化硫与过氧化氢反应生成硫酸,发生反应的化学方程式为SO2+H2O2=H2SO4;(4)二氧化硫具有漂白性,能使品红溶液褪色,所以B中观察到的现象是红色褪去。
【分析】
(1)A中反应的方程式为C+2H2SO4(浓) Δ= CO2↑+2SO2↑+2H2O;紫色石蕊溶液检验酸(二氧化硫与水反应生成亚硫酸),现象变红
(2)二氧化硫、二氧化碳与氢氧化钡反应生成亚硫酸钡或碳酸钡沉淀,所以B中观察到的现象是有白色沉淀生成
(3)二氧化硫具有还原性,新制氯水具强氧化性,Cl2+SO2+2H2O=4H++2Cl﹣+SO42- 氯水被二氧化硫还原而褪色
(4)二氧化硫具有漂白性(使品红褪色)
19.【答案】(1)HClO;铁红
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(CLO)2+2H2O
(3)防止Fe2+被氧化
【解析】【解答】(1)①次氯酸是含氯元素的化合物,其化学式是HClO;②氧化铁为红棕色粉末状固体,其俗名铁红;
(2)漂白粉的有效成分为次氯酸钙,氯气与石灰乳反应生成氯化钙、次氯酸钙和水,制取漂白粉的化学方程式2Cl2+2Ca(OH)2=CaCl2+Ca(CLO)2+2H2O;
(3)亚铁离子具有还原性,易被氧化变质,糖衣可以起到保护亚铁离子不被空气中的氧气氧化的作用。
【分析】(1)次氯酸的化学式为HClO;氧化铁的俗名为铁红。
(2)漂白粉的主要成分是CaCl2和Ca(ClO)2,是由Cl2与Ca(OH)2反应得到,据此写出反应的化学方程式。
(3)Fe2+具有强还原性,易被空气中的O2氧化,据此确定糖衣的作用。
20.【答案】(1)蒸馏液态空气;防止催化剂中毒
(2)N2+3H2 2NH3;合成塔
(3)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;生成碳酸钙溶解度小于硫酸钙,有利于反应向正向进行
(4)A;B
(5)CO2;该流程中产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生
(6)生产水泥石膏
【解析】【解答】解:(1)工业合成氨所需氮气来自空气,常用蒸馏空气的物理方法获得;原料气氢气中常含有少量CO、CO2、H2S等杂质,会引起催化剂中毒,必须除去,
故答案为:蒸馏液态空气;防止催化剂中毒;(2)氮气和氢气在高温高压、催化剂条件下反应生成氨气,该反应在合成塔中进行,
故答案为:N2+3H2 2NH3;合成塔;(3)NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,得以发生的原因是碳酸钙的溶解性比硫酸钙小,有利于反应向正方向进行,
故答案为:CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4;生成碳酸钙溶解度小于硫酸钙,有利于反应向正向进行;(4)上述生产流程中,氨气的作用是提供制各产品所需的氮元素,增大CO32﹣的浓度促进反应发生,不作为催化剂,
故答案为:AB;(5))CaCO3在煅烧炉中分解生成CO2和CaO,CO2可循环使用,副产品为生石灰,根据反应流程离子,该反应的有利点为:生成的CO2可循环使用,CaO可制备硫酸钙,没有废物生成,
故答案为:CO2;该流程中产生的CO2循环使用,得到的产品和副产品都是有用的物质,无废物产生;(6)硫酸钙的用途可以是生产水泥,石膏等,
故答案为:生产水泥,石膏.
【分析】(1)工业合成氨所需氮气来自空气,常用蒸馏空气的物理方法获得;原料气氢气中常含有少量CO、CO2、H2S等杂质,会引起催化剂中毒,必须除去;(2)氮气和氢气在高温高压、催化剂条件下反应生成氨气,该反应在合成塔中进行,催化剂为铁触媒;(3)NH3和CO2通入沉淀池中并加入CaSO4,生成(NH4)2SO4和CaCO3,发生CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4,得以发生的原因是沉淀转化的问题;(4)根据氨在生产生活中的使用分析;(5)碳酸钙高温下分解生成氧化钙和二氧化碳,二氧化碳可以循环利用,氧化钙为副产品;从反应原理及可循环利用物质、副产品及是否有污染物生成等角度分析;(6)硫酸钙可以生产水泥石膏等.
21.【答案】(1)D
(2)Cl2+H2O+ NO2-= NO3-+2Cl-+2H+
(3)C
(4)Fe2++2ClO-+4OH-=FeO42-+2Cl-+2H2O;FeSO4;NA
【解析】【解答】(1)误食亚硝酸盐(如NaNO2),则导致血红蛋白中的Fe2+转化为Fe3+而中毒,说明亚硝酸盐具有氧化性,能把亚铁离子氧化生成铁离子;服用维生素C可解毒,说明维生素C能把铁离子还原生成亚铁离子,这说明维生素C具有还原性,因此选项D错误,其余都是正确的,故答案为:D;
(2)把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成硝酸钠和氯化氢,说明在反应中氯气不亚硝酸钠氧化,反应的化学方程式是NO+Cl2+H2O=NO3-+2H++2Cl-,故答案为:NO+Cl2+H2O=NO3-+2H++2Cl-;
(3)由于Cl2、HNO3都能氧化亚铁离子,但能引入新的杂质,铁不能氧化亚铁离子,双氧水的还原产物是水,不引入杂质,所以正确是双氧水,故答案为:c;
(4)碱性条件下用 FeSO4 与NaClO反应,反应中Fe元素化合价由+2价变为+6价、氯元素化合价由+1价变为、-1价,反应的离子方程式为:Fe2++2ClO-+4OH-=FeO42-+2Cl-+2H2O,故答案为:Fe2++2ClO-+4OH-=FeO42-+2Cl-+2H2O;
①该反应中铁元素化合价升高被氧化,FeSO4是还原剂,故答案为:FeSO4;
②1mol FeSO4反应,转移电子数目为4mol ,38gFeSO4的物质的量为0.25mol,则反应转移的电子数目为0.25×4mol=1 mol,故答案为:NA。
【分析】(1)根据反应过程中元素化合价的变化,结合氧化还原反应的相关概念分析;
(2)根据题干信息确定反应物和生成物,结合得失电子守恒、电荷守恒和原子守恒书写反应的离子方程式;
(3)H2O2是一种绿色氧化剂,其还原产物为H2O,不会引入新的杂质;
(4)ClO-具有氧化性,能将Fe2+氧化成FeO42-,自身还原为Cl-,结合得失电子守恒、电荷守恒和原子个数守恒书写反应的离子方程式;
①反应过程中有元素化合价升高的物质为还原剂;
②根据公式计算n(FeSO4),结合反应过程中化合价的变化计算转移电子数;
