4.2.1元素性质的周期性变化规律课件(共17张PPT)
文档属性
| 名称 | 4.2.1元素性质的周期性变化规律课件(共17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 19.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-29 22:29:04 | ||
图片预览





文档简介
(共17张PPT)
第四章 物质结构 元素周期律
第二节 元素周期律
第一课时 元素性质的周期性变化规律
1.结合有关数据和实验事实认识原子核外电子排布、元素最高价和最低价、原子半径随元素原子序数递增而呈周期性变化规律。
2.以第三周期元素为例,结合已有知识和实验探究,从宏观上认识同周期元素金属性、非金属性等随原子序数递增而呈周期性变化规律,建构元素周期律。
3.能从结构上理解变化的本质原因,总结同周期元素原子结构、性质的规律,发展学生“科学探究与创新意识”、“宏观辨识与微观探析”、“证据推理与模型认知”化学学科核心素养。
核心素养
情境导学
通过对碱金属元素,卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,周期表中同周期元素的性质有什么变化规律呢?
同主族元素:化学性质相似;
从上到下,金属性逐渐增强,非金属性逐渐减弱
任务一:元素周期律
1、1-18号元素随着核电荷数的递增,元素原子最外层电子排布呈现出怎样的规律?
2、1-18号元素(除稀有气体元素外)随着核电荷数的递增,元素原子半径呈现出怎样的规律
3、1-18号元素(除稀有气体元素外)随着核电荷数的递增,元素的主要化合价(最低和最高)呈现出怎样的规律
4、1-18号元素(除稀有气体元素外)随着核电荷数的递增,元素的化学性质(金属性和非金属性)呈现出怎样的规律
观察教材p107页表4-5思考并讨论:
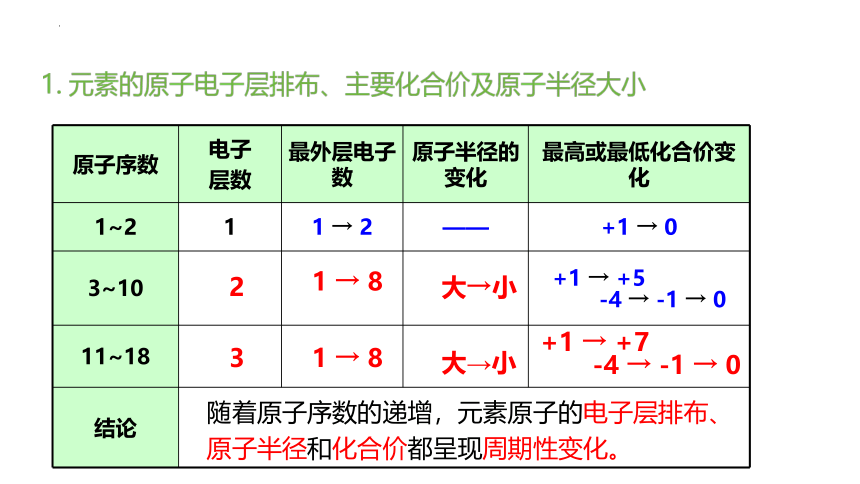
1. 元素的原子电子层排布、主要化合价及原子半径大小
原子序数 电子 层数 最外层电子数 原子半径的变化 最高或最低化合价变化
1~2 1 1 → 2 —— +1 → 0
3~10 +1 → +5
-4 → -1 → 0
11~18
结论 2
3
1 → 8
1 → 8
+1 → +7
-4 → -1 → 0
随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化。
大→小
大→小
思考交流
1、为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?
2、元素的最高正价和最低负价如何确定?随着原子序数的递增,C、N、O、F的最高正化合价依次递增吗?
最高正价=主族序数=最外层电子数
最低负价=最高正价-8
金属没有正价,O没有最高正价、F没有正价。H的最高价为+1,最低价为-1;
同一周期元素的原子电子层数相同,随着核电荷数的递增,原子核对核外电子的吸引力逐渐增强,故原子半径逐渐减小。
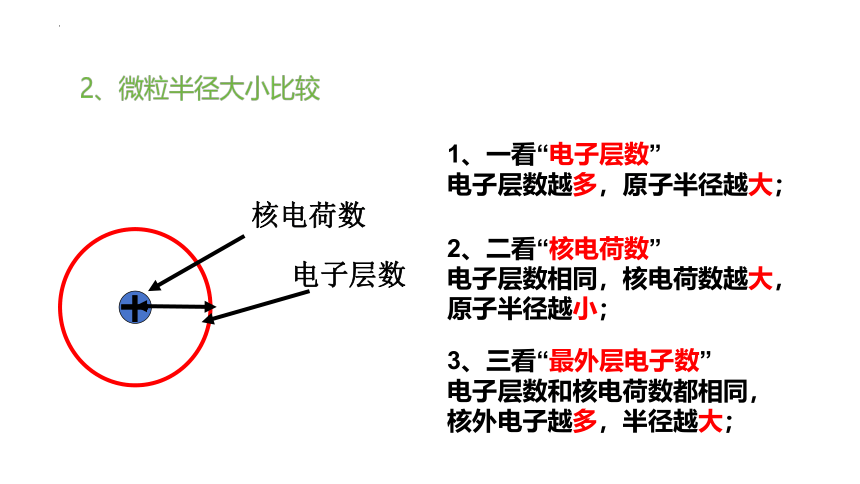
2、微粒半径大小比较
核电荷数
电子层数
1、一看“电子层数”
电子层数越多,原子半径越大;
2、二看“核电荷数”
电子层数相同,核电荷数越大,原子半径越小;
3、三看“最外层电子数”
电子层数和核电荷数都相同,核外电子越多,半径越大;
2.比较下列粒子半径的大小:
A.Na+、Mg2+、Al3+、K+
B.Ca2+、S2-、Cl-、K+
1.下列元素的原子半径依次减小的是( )
A. Al、Mg、 Na B. N、O、F
C. P、Al 、 Si D. C、Si、P
B
K+>Na+>Mg2+>Al3+
S2->Cl->K+>Ca2+
3、试比较下列微粒的半径大小(填“>”“<”或“=”)。
(1)Mg______Ca______K; Mg Mg2+;Cl Cl—;
(2)Fe3+______Fe2+______Fe;
(3)S2-______Cl-______Na+______Mg2+。
<
<
<
<
>
>
>
>
<
3、第三周期元素性质的递变
根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗
由左向右,电子层数 ,核电荷数依次 ,原子半径依次 ,
失电子的能力依次 ,得电子的能力依次 ,
预测它们的金属性依次 ,非金属性依次 。
相同
增多
减小
减弱
增强
减弱
增强
(1)钠、镁、铝元素金属性强弱的实验探究
知识衔接:金属性越强
单质与水或酸反应置换出H2越容易,
最高价氧化物对应水化物的碱性越强。
实验1:钠、镁与水反应
镁与冷水反应缓慢,与沸水反应加快,有气泡产生,溶液变红。
Mg + 2H2O Mg(OH)2 + H2 ↑
结论:金属性:Na Mg
>
实验2:比较氢氧化镁和氢氧化铝的碱性
实验操作 实验现象 解释或方程式
①生成________沉淀;
②两试管中白色沉淀均_______。
白色絮状
溶解
①生成______沉淀;
②白色沉淀溶于_______,不溶于_____________。
白色
NaOH溶液
盐酸
Al 3+ + NH3·H2O=Al(OH)3↓+3NH4+
Al(OH)3 +3H + =Al 3+ +3H2O
Al(OH)3 + OH - =[Al(OH)4] -
Mg2+ +2NH3·H2O=Mg(OH) 2↓+NH4+
Mg(OH)2 +2H+=Mg2+ +2H2O
MgCl2 +2NH3·H2O=Mg(OH)2↓+2NH4Cl
Mg(OH)2 +2HCl=MgCl2 +2H2O
AlCl3 +3NH3·H2O=Al(OH)3↓+3NH4Cl
Al(OH)3 +3HCl=AlCl3+3H2O
Al(OH)3 +NaOH=Na[Al(OH)4]
Al(OH)3是两性氢氧化物,其碱性弱于Mg(OH)2,则金属性:Mg>Al
(2)硅、磷、硫、氯元素非金属性强弱的实验探究
知识衔接:非金属性越强
单质H2化合越容易,氢化物越稳定
最高价氧化物对应水化物的酸性越强。
非金属元素 Si P S Cl
最高价氧化物对应的 水化物(含氧酸) 的酸性强弱 H2SiO3 (硅酸) 弱酸 H3PO4 (磷酸) 中强酸 H2SO4 (硫酸) 强酸 HClO4
(高氯酸)
强酸(酸性比H2SO4强)
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
非金属性:Si<P<S<Cl
结论:同一周期从左到右,元素金属性逐渐_____,非金属性逐渐_____。
减弱
增强
4、元素周期律
(1)内容:元素的性质随着原子序数的递增而呈周期性的变化。
(2)实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
2.下列性质的比较,错误的是
A.非金属性:O>N>P
B.酸性:H2SO4>H2SiO3>H2CO3
C.碱性:KOH>NaOH>LiOH
D.热稳定性:HF>HCl>HBr
B
1.下列递变规律正确的是( )
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱
D.Na+、Mg2+、Al3+离子半径逐渐增大
D
3.Ge、As、Se、Br为第四周期相邻元素,原子序数依次增大。下列说法错误的是( )
A.原子半径:Ge>As>Se
B.还原性:As3->Se2->Br-
C.酸性:H2GeO3>H2SeO4>HBrO4
D.非金属性:AsD
第四章 物质结构 元素周期律
第二节 元素周期律
第一课时 元素性质的周期性变化规律
1.结合有关数据和实验事实认识原子核外电子排布、元素最高价和最低价、原子半径随元素原子序数递增而呈周期性变化规律。
2.以第三周期元素为例,结合已有知识和实验探究,从宏观上认识同周期元素金属性、非金属性等随原子序数递增而呈周期性变化规律,建构元素周期律。
3.能从结构上理解变化的本质原因,总结同周期元素原子结构、性质的规律,发展学生“科学探究与创新意识”、“宏观辨识与微观探析”、“证据推理与模型认知”化学学科核心素养。
核心素养
情境导学
通过对碱金属元素,卤素的原子结构和性质的研究,我们已经知道元素周期表中同主族元素的性质有着相似性和递变性。那么,周期表中同周期元素的性质有什么变化规律呢?
同主族元素:化学性质相似;
从上到下,金属性逐渐增强,非金属性逐渐减弱
任务一:元素周期律
1、1-18号元素随着核电荷数的递增,元素原子最外层电子排布呈现出怎样的规律?
2、1-18号元素(除稀有气体元素外)随着核电荷数的递增,元素原子半径呈现出怎样的规律
3、1-18号元素(除稀有气体元素外)随着核电荷数的递增,元素的主要化合价(最低和最高)呈现出怎样的规律
4、1-18号元素(除稀有气体元素外)随着核电荷数的递增,元素的化学性质(金属性和非金属性)呈现出怎样的规律
观察教材p107页表4-5思考并讨论:
1. 元素的原子电子层排布、主要化合价及原子半径大小
原子序数 电子 层数 最外层电子数 原子半径的变化 最高或最低化合价变化
1~2 1 1 → 2 —— +1 → 0
3~10 +1 → +5
-4 → -1 → 0
11~18
结论 2
3
1 → 8
1 → 8
+1 → +7
-4 → -1 → 0
随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化。
大→小
大→小
思考交流
1、为什么同周期元素的原子半径会随着原子序数的递增而逐渐减小呢?
2、元素的最高正价和最低负价如何确定?随着原子序数的递增,C、N、O、F的最高正化合价依次递增吗?
最高正价=主族序数=最外层电子数
最低负价=最高正价-8
金属没有正价,O没有最高正价、F没有正价。H的最高价为+1,最低价为-1;
同一周期元素的原子电子层数相同,随着核电荷数的递增,原子核对核外电子的吸引力逐渐增强,故原子半径逐渐减小。
2、微粒半径大小比较
核电荷数
电子层数
1、一看“电子层数”
电子层数越多,原子半径越大;
2、二看“核电荷数”
电子层数相同,核电荷数越大,原子半径越小;
3、三看“最外层电子数”
电子层数和核电荷数都相同,核外电子越多,半径越大;
2.比较下列粒子半径的大小:
A.Na+、Mg2+、Al3+、K+
B.Ca2+、S2-、Cl-、K+
1.下列元素的原子半径依次减小的是( )
A. Al、Mg、 Na B. N、O、F
C. P、Al 、 Si D. C、Si、P
B
K+>Na+>Mg2+>Al3+
S2->Cl->K+>Ca2+
3、试比较下列微粒的半径大小(填“>”“<”或“=”)。
(1)Mg______Ca______K; Mg Mg2+;Cl Cl—;
(2)Fe3+______Fe2+______Fe;
(3)S2-______Cl-______Na+______Mg2+。
<
<
<
<
>
>
>
>
<
3、第三周期元素性质的递变
根据第三周期元素原子的核外电子排布规律,你能推测出该周期元素金属性和非金属性的变化规律吗
由左向右,电子层数 ,核电荷数依次 ,原子半径依次 ,
失电子的能力依次 ,得电子的能力依次 ,
预测它们的金属性依次 ,非金属性依次 。
相同
增多
减小
减弱
增强
减弱
增强
(1)钠、镁、铝元素金属性强弱的实验探究
知识衔接:金属性越强
单质与水或酸反应置换出H2越容易,
最高价氧化物对应水化物的碱性越强。
实验1:钠、镁与水反应
镁与冷水反应缓慢,与沸水反应加快,有气泡产生,溶液变红。
Mg + 2H2O Mg(OH)2 + H2 ↑
结论:金属性:Na Mg
>
实验2:比较氢氧化镁和氢氧化铝的碱性
实验操作 实验现象 解释或方程式
①生成________沉淀;
②两试管中白色沉淀均_______。
白色絮状
溶解
①生成______沉淀;
②白色沉淀溶于_______,不溶于_____________。
白色
NaOH溶液
盐酸
Al 3+ + NH3·H2O=Al(OH)3↓+3NH4+
Al(OH)3 +3H + =Al 3+ +3H2O
Al(OH)3 + OH - =[Al(OH)4] -
Mg2+ +2NH3·H2O=Mg(OH) 2↓+NH4+
Mg(OH)2 +2H+=Mg2+ +2H2O
MgCl2 +2NH3·H2O=Mg(OH)2↓+2NH4Cl
Mg(OH)2 +2HCl=MgCl2 +2H2O
AlCl3 +3NH3·H2O=Al(OH)3↓+3NH4Cl
Al(OH)3 +3HCl=AlCl3+3H2O
Al(OH)3 +NaOH=Na[Al(OH)4]
Al(OH)3是两性氢氧化物,其碱性弱于Mg(OH)2,则金属性:Mg>Al
(2)硅、磷、硫、氯元素非金属性强弱的实验探究
知识衔接:非金属性越强
单质H2化合越容易,氢化物越稳定
最高价氧化物对应水化物的酸性越强。
非金属元素 Si P S Cl
最高价氧化物对应的 水化物(含氧酸) 的酸性强弱 H2SiO3 (硅酸) 弱酸 H3PO4 (磷酸) 中强酸 H2SO4 (硫酸) 强酸 HClO4
(高氯酸)
强酸(酸性比H2SO4强)
酸性:H2SiO3 < H3PO4 < H2SO4 < HClO4
非金属性:Si<P<S<Cl
结论:同一周期从左到右,元素金属性逐渐_____,非金属性逐渐_____。
减弱
增强
4、元素周期律
(1)内容:元素的性质随着原子序数的递增而呈周期性的变化。
(2)实质:元素性质的周期性变化是元素原子的核外电子排布周期性变化的必然结果。
2.下列性质的比较,错误的是
A.非金属性:O>N>P
B.酸性:H2SO4>H2SiO3>H2CO3
C.碱性:KOH>NaOH>LiOH
D.热稳定性:HF>HCl>HBr
B
1.下列递变规律正确的是( )
A.HClO4、H2SO4、H3PO4的酸性依次增强
B.HCl、HBr、HI的稳定性依次增强
C.钠、镁、铝的还原性依次减弱
D.Na+、Mg2+、Al3+离子半径逐渐增大
D
3.Ge、As、Se、Br为第四周期相邻元素,原子序数依次增大。下列说法错误的是( )
A.原子半径:Ge>As>Se
B.还原性:As3->Se2->Br-
C.酸性:H2GeO3>H2SeO4>HBrO4
D.非金属性:As
