说课竞赛 原电池 说课课件(共26张PPT)选择性必修1第四章 化学反应与电能第一节 原电池
文档属性
| 名称 | 说课竞赛 原电池 说课课件(共26张PPT)选择性必修1第四章 化学反应与电能第一节 原电池 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-30 10:55:21 | ||
图片预览



文档简介
(共26张PPT)
第四章 化学反应与电能
第一节 原 电 池
说课人:XXX
说课内容
说教材(教材分析)
4
1
2
3
说教法(教学策略)
说学法(学情分析)
说教学过程及设想
5
说板书设计
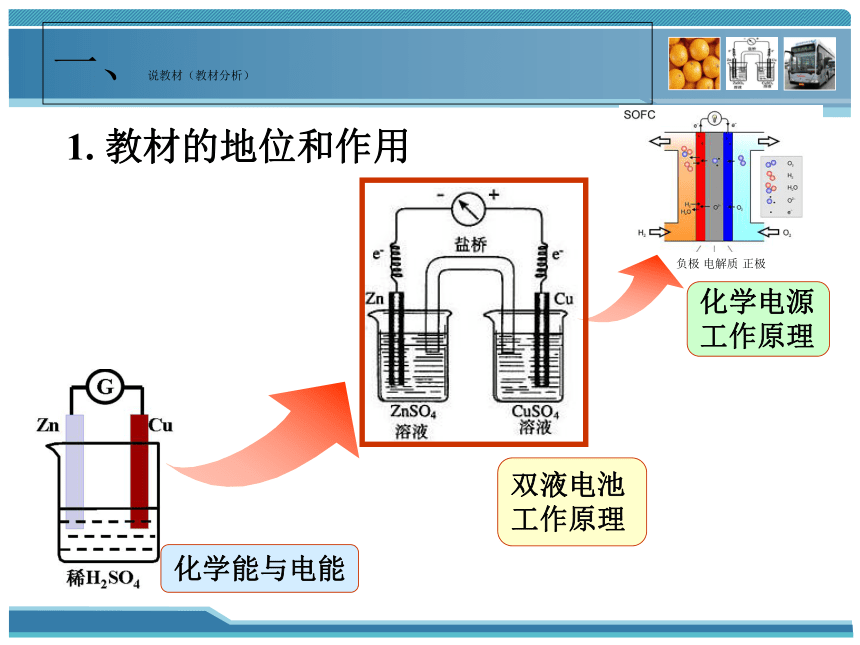
一、说教材(教材分析)
双液电池
工作原理
1. 教材的地位和作用
负极 电解质 正极
化学电源
工作原理
化学能与电能
1.进一步认识原电池的工作原理,能够写出电极反应式和电池反应式。
2.了解盐桥的作用,能根据原电池原理设计简单的原电池。
3.通过对原电池实验的研究,学会发现问题、解决问题的方法。
4.以实验为载体,创设问题情境,将实验探究与思考交流有机结合,将原有知识的回顾与新知识的引入融为一体。
一、说教材(教材分析)
2. 教学目标的确定
一、说教材(教材分析)
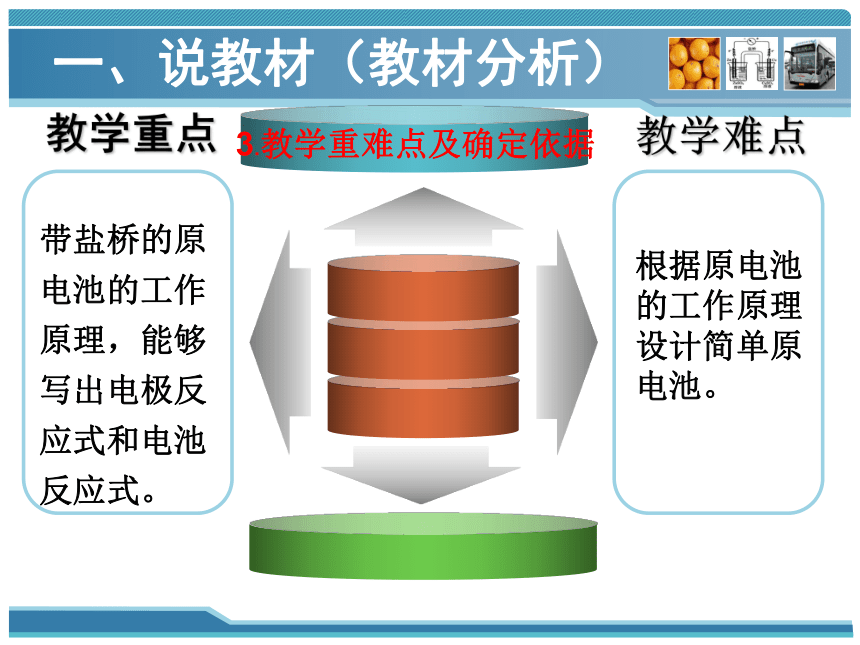
教学重点
带盐桥的原电池的工作原理,能够写出电极反应式和电池反应式。
教学难点
根据原电池的工作原理设计简单原电池。
3.教学重难点及确定依据
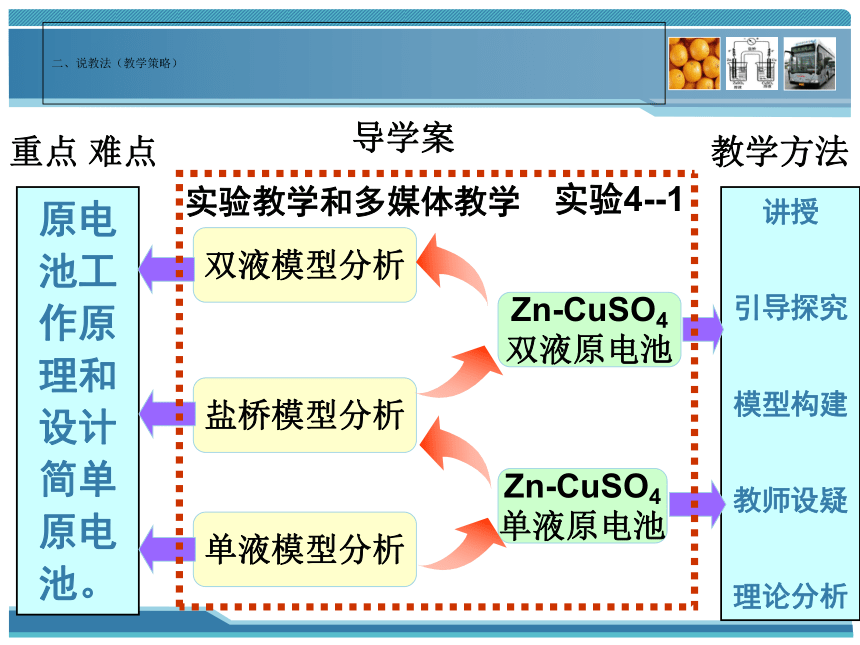
二、说教法(教学策略)
单液模型分析
盐桥模型分析
双液模型分析
Zn-CuSO4
单液原电池
Zn-CuSO4
双液原电池
原电池工作原理和设计简单原电池。
讲授
引导探究
模型构建
教师设疑
理论分析
重点 难点
教学方法
实验教学和多媒体教学
实验4--1
导学案
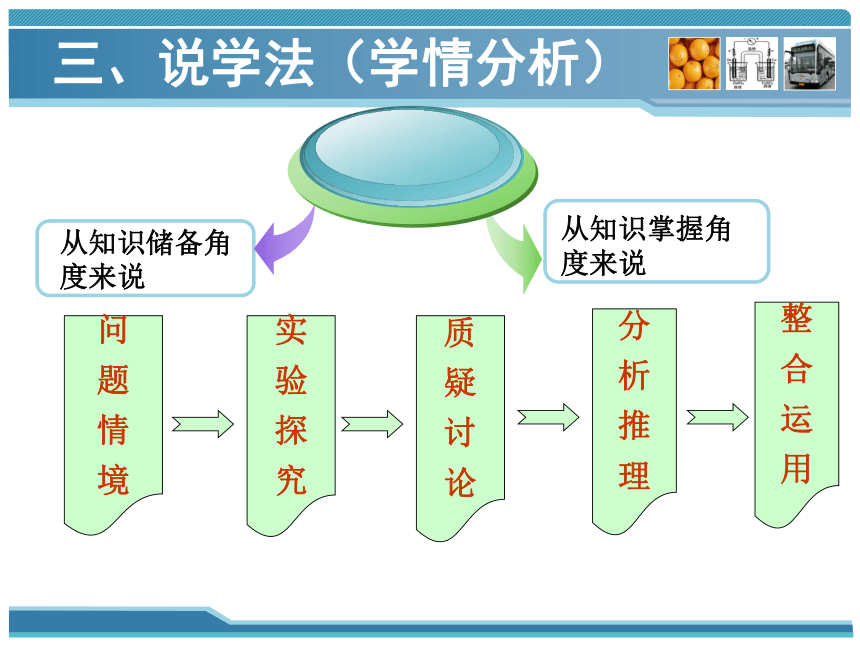
三、说学法(学情分析)
从知识储备角
度来说
从知识掌握角
度来说
问
题
情
境
实
验
探
究
质
疑
讨
论
分
析
推
理
整
合
运
用
四、说教学过程及设想
电池
化学能→电能
环节一【导入新课】
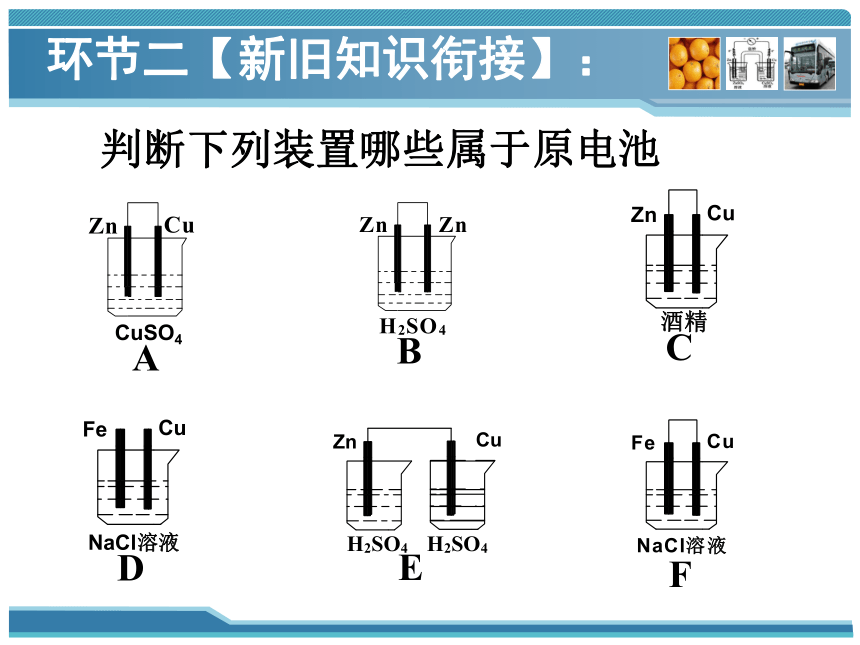
判断下列装置哪些属于原电池
F
C
D
B
E
A
CuSO4
环节二【新旧知识衔接】:
与原 电 池 相关的概念
1.电路:
外电路
内电路
电子流向:负极→正极
电流方向:正极→负极
阴离子向负极移动
阳离子向正极移动
2.电极:
正极:不活泼的一极(金属或能导电的非金属)
负极:活泼的一极(金属)
3.电极反应式:
正极(Cu): Cu2++ 2e-= Cu
负极(Zn): Zn - 2e-= Zn2+
4.总反应式:
Zn+ Cu2+ = Zn2+ + Cu
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
失e,沿导线传递,有电流产生
还原反应
Cu2++2e- =Cu
阴离子
阳离子
总反应:
负极
正极
Zn+Cu2+=Zn2++Cu
Zn+CuSO4=ZnSO4+Cu
(离子方程式)
(化学方程式)
阳离子
单液原 电 池 原 理
外电路
内电路
学生实验:将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有CuSO4溶液的烧杯中。注意观察有什么实验现象发生?并分析原因?
探究铜锌单液原电池的缺点
CuSO4
Zn
Cu
G
环节三【学习新课】:
CuSO4
Zn
Cu
G
该单液原电池对外提供的电流是稳定、持久的吗?
造成原电池提供电能的能力减弱的原因是什么?
教师引导设疑提出问题
问题1. 能否阻止Cu2+在锌片表面还原?
问题2. 锌片可以插入什么溶液中
问题3. 怎样能使电解质溶液
连通形成持续稳定的电流?
第一次理论分析:发现单液原电池存在的缺点
教师引导解决问题
共同构建新的原电池
提出带盐桥的原电池
环节三【学习新课】:
探究实验:用盐桥将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液的烧杯连接起来,然后将锌片和铜片分别用导线与电流表相连。
多媒体视频展示教材实验,并组织学生观看视频,总结实验现象。
视频实验:构建模型,引出双液原电池
环节三【学习新课】:
建立双液原电池模型
提炼模型
环节三【学习新课】:
问题4:对比两种电池有何不同?
改进后
CuSO4
Zn
Cu
G
环节三【学习新课】:
建立盐桥模型
介绍盐桥
盐桥中通常装有含琼胶的KCl饱和溶液
环节三【学习新课】:
Cu
提供电子的物质
接受电子的物质
负极:氧化反应
Zn-2e- =Zn2+
正极:还原反应
Cu2++2e- = Cu
第二次理论分析:学生对原电池原理有了更加完整的认识。
分析盐桥模型的工作原理
环节三【学习新课】:
通过设计带盐桥的原电池,总结电解质溶液和电极材料的选择。
根据反应Cu+ 2AgNO3 = Cu(NO3)2 +2Ag 设计一个能持续产生电流的原电池装置
氧化还原反应拆分成电极反应
根据电极反应选择电极和电解质溶液
环节三【学习新课】:
环节四【巩固练习】:
1.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③
C.②④ D.③④
2.请结合组成原电池的条件,将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+设计成一个原电池(注意有盐桥的设计)。
1、电解液: 。
2、电极材料:正极 ,负极 。
3、电极反应式 :
负极: 。正极: 。
4、电池反应式: 。
环节四【巩固练习】:
环节五【课堂小结 】:
1、复习回忆了原电池的形成。
2、进一步了解原电池的反应原理,正确书写电极反应式。
3、利用氧化还原反应原理设计了原电池。
环节六【布置作业 】:
请同学们自己到图书馆或阅览室查阅相关资料写一篇小论文(400字左右),介绍“盐桥原理”在实用电池中的应用现状。
第四章
第一节 化学反应与电能----原电池
一、单液原电池工作原理
负极(Zn):Zn + 2e- =Zn2+ 氧化反应
正极(Cu):Cu2+ + 2e- =Cu 还原反应
总反应:Cu2+ + Zn =Cu + Zn2+
二、带盐桥的原电池
1、构成 (1)盐桥 (2)半电池
2、盐桥的作用 (1).构成通路 (2).平衡电荷 (3).提高了能量转换率
3、工作原理 外电路: 负极 e- 正极
内电路:阴离子 盐桥 阳离子
三、原电池的设计
五、说板书设计
欢迎各位评委、老师批评指正
谢谢大家
预祝全市高中教师说课竞赛圆满成功
第四章 化学反应与电能
第一节 原 电 池
说课人:XXX
说课内容
说教材(教材分析)
4
1
2
3
说教法(教学策略)
说学法(学情分析)
说教学过程及设想
5
说板书设计
一、说教材(教材分析)
双液电池
工作原理
1. 教材的地位和作用
负极 电解质 正极
化学电源
工作原理
化学能与电能
1.进一步认识原电池的工作原理,能够写出电极反应式和电池反应式。
2.了解盐桥的作用,能根据原电池原理设计简单的原电池。
3.通过对原电池实验的研究,学会发现问题、解决问题的方法。
4.以实验为载体,创设问题情境,将实验探究与思考交流有机结合,将原有知识的回顾与新知识的引入融为一体。
一、说教材(教材分析)
2. 教学目标的确定
一、说教材(教材分析)
教学重点
带盐桥的原电池的工作原理,能够写出电极反应式和电池反应式。
教学难点
根据原电池的工作原理设计简单原电池。
3.教学重难点及确定依据
二、说教法(教学策略)
单液模型分析
盐桥模型分析
双液模型分析
Zn-CuSO4
单液原电池
Zn-CuSO4
双液原电池
原电池工作原理和设计简单原电池。
讲授
引导探究
模型构建
教师设疑
理论分析
重点 难点
教学方法
实验教学和多媒体教学
实验4--1
导学案
三、说学法(学情分析)
从知识储备角
度来说
从知识掌握角
度来说
问
题
情
境
实
验
探
究
质
疑
讨
论
分
析
推
理
整
合
运
用
四、说教学过程及设想
电池
化学能→电能
环节一【导入新课】
判断下列装置哪些属于原电池
F
C
D
B
E
A
CuSO4
环节二【新旧知识衔接】:
与原 电 池 相关的概念
1.电路:
外电路
内电路
电子流向:负极→正极
电流方向:正极→负极
阴离子向负极移动
阳离子向正极移动
2.电极:
正极:不活泼的一极(金属或能导电的非金属)
负极:活泼的一极(金属)
3.电极反应式:
正极(Cu): Cu2++ 2e-= Cu
负极(Zn): Zn - 2e-= Zn2+
4.总反应式:
Zn+ Cu2+ = Zn2+ + Cu
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
失e,沿导线传递,有电流产生
还原反应
Cu2++2e- =Cu
阴离子
阳离子
总反应:
负极
正极
Zn+Cu2+=Zn2++Cu
Zn+CuSO4=ZnSO4+Cu
(离子方程式)
(化学方程式)
阳离子
单液原 电 池 原 理
外电路
内电路
学生实验:将锌片和铜片分别用夹子夹好与电流表串联,再同时放入盛有CuSO4溶液的烧杯中。注意观察有什么实验现象发生?并分析原因?
探究铜锌单液原电池的缺点
CuSO4
Zn
Cu
G
环节三【学习新课】:
CuSO4
Zn
Cu
G
该单液原电池对外提供的电流是稳定、持久的吗?
造成原电池提供电能的能力减弱的原因是什么?
教师引导设疑提出问题
问题1. 能否阻止Cu2+在锌片表面还原?
问题2. 锌片可以插入什么溶液中
问题3. 怎样能使电解质溶液
连通形成持续稳定的电流?
第一次理论分析:发现单液原电池存在的缺点
教师引导解决问题
共同构建新的原电池
提出带盐桥的原电池
环节三【学习新课】:
探究实验:用盐桥将置有锌片的ZnSO4溶液和置有铜片的CuSO4溶液的烧杯连接起来,然后将锌片和铜片分别用导线与电流表相连。
多媒体视频展示教材实验,并组织学生观看视频,总结实验现象。
视频实验:构建模型,引出双液原电池
环节三【学习新课】:
建立双液原电池模型
提炼模型
环节三【学习新课】:
问题4:对比两种电池有何不同?
改进后
CuSO4
Zn
Cu
G
环节三【学习新课】:
建立盐桥模型
介绍盐桥
盐桥中通常装有含琼胶的KCl饱和溶液
环节三【学习新课】:
Cu
提供电子的物质
接受电子的物质
负极:氧化反应
Zn-2e- =Zn2+
正极:还原反应
Cu2++2e- = Cu
第二次理论分析:学生对原电池原理有了更加完整的认识。
分析盐桥模型的工作原理
环节三【学习新课】:
通过设计带盐桥的原电池,总结电解质溶液和电极材料的选择。
根据反应Cu+ 2AgNO3 = Cu(NO3)2 +2Ag 设计一个能持续产生电流的原电池装置
氧化还原反应拆分成电极反应
根据电极反应选择电极和电解质溶液
环节三【学习新课】:
环节四【巩固练习】:
1.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为:Ag++e-=Ag
③实验过程中取出盐桥,原电池仍继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③
C.②④ D.③④
2.请结合组成原电池的条件,将氧化还原反应:
Fe + Cu2+ = Cu + Fe2+设计成一个原电池(注意有盐桥的设计)。
1、电解液: 。
2、电极材料:正极 ,负极 。
3、电极反应式 :
负极: 。正极: 。
4、电池反应式: 。
环节四【巩固练习】:
环节五【课堂小结 】:
1、复习回忆了原电池的形成。
2、进一步了解原电池的反应原理,正确书写电极反应式。
3、利用氧化还原反应原理设计了原电池。
环节六【布置作业 】:
请同学们自己到图书馆或阅览室查阅相关资料写一篇小论文(400字左右),介绍“盐桥原理”在实用电池中的应用现状。
第四章
第一节 化学反应与电能----原电池
一、单液原电池工作原理
负极(Zn):Zn + 2e- =Zn2+ 氧化反应
正极(Cu):Cu2+ + 2e- =Cu 还原反应
总反应:Cu2+ + Zn =Cu + Zn2+
二、带盐桥的原电池
1、构成 (1)盐桥 (2)半电池
2、盐桥的作用 (1).构成通路 (2).平衡电荷 (3).提高了能量转换率
3、工作原理 外电路: 负极 e- 正极
内电路:阴离子 盐桥 阳离子
三、原电池的设计
五、说板书设计
欢迎各位评委、老师批评指正
谢谢大家
预祝全市高中教师说课竞赛圆满成功
