3.1电离平衡 第一课时课件(共17张PPT)
文档属性
| 名称 | 3.1电离平衡 第一课时课件(共17张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 32.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-30 12:12:06 | ||
图片预览





文档简介
(共17张PPT)
第一课时
强电解质和弱电解质
弱电解质的电离平衡
第一节 电离平衡
人体生命活动的各种化学反应
———离不开电解质
学习目标
1、从电离角度微观探析强、弱电解质的本质区别,落实分类观;
2、掌握强、弱电解质电离方程式书写;
3、认识弱电解质的电离平衡,能运用勒夏特列原理解释影响电离平衡的因素,树立 动态平衡的观点。
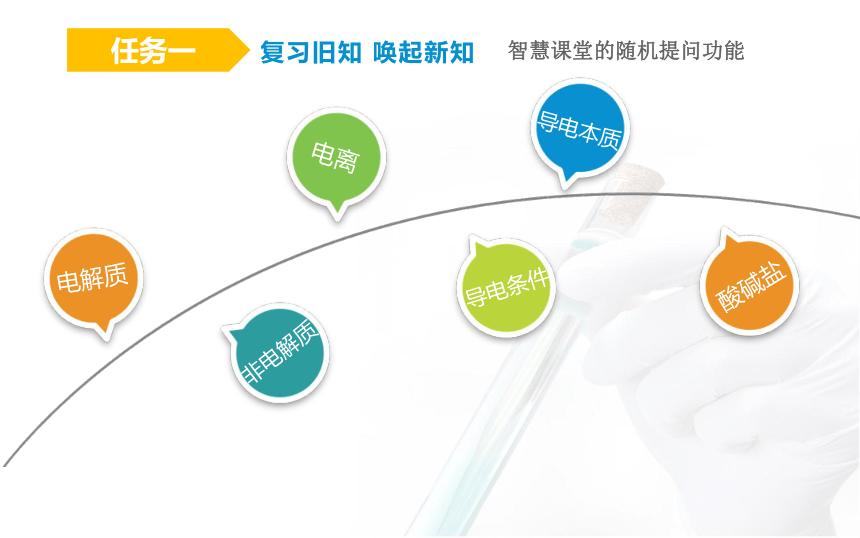
观看视频:复习旧知 唤起新知
任务一
任务一
电解质
非电解质
电离
导电条件
导电本质
酸碱盐
复习旧知 唤起新知
智慧课堂的随机提问功能
任务二
学生通过智慧课堂抢答功能,提出自己的预测
已知:
1、洁厕液主要成分为盐酸,为什么不用醋酸?
2、除水垢用醋酸,为什么不用盐酸?
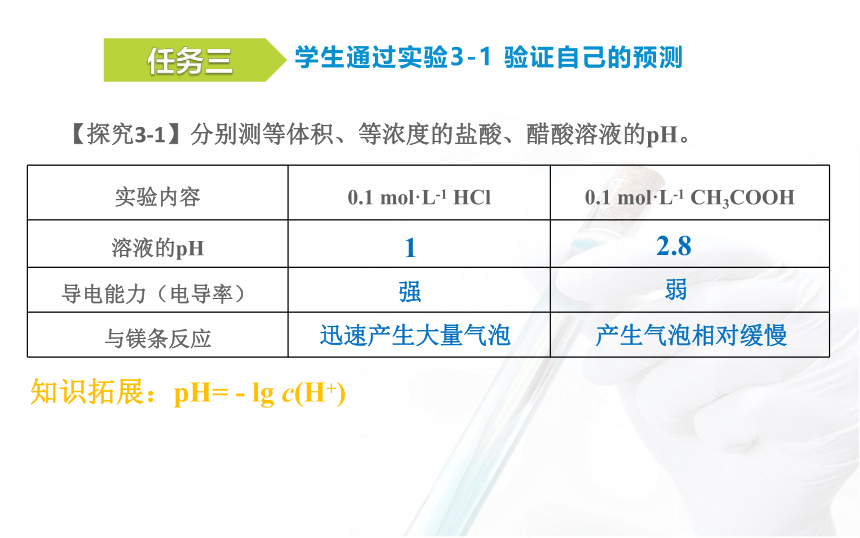
任务三
学生通过实验3-1 验证自己的预测
【探究3-1】分别测等体积、等浓度的盐酸、醋酸溶液的pH。
实验内容 0.1 mol·L-1 HCl 0.1 mol·L-1 CH3COOH
溶液的pH
导电能力(电导率)
与镁条反应
1
2.8
知识拓展:pH= - lg c(H+)
强
弱
迅速产生大量气泡
产生气泡相对缓慢
任务三
实验测定电导率
任务三
学生抢答
1、强、弱电解质与导电性、溶解性有关吗?
2、导电能力与什么有关?
3、相同浓度的盐酸、醋酸、硫酸铜溶液导电能力谁强?
无关
离子浓度和离子所带电荷
硫酸铜>盐酸>醋酸
任务三
对物质进行重新分类,并拍照上传
思考
电解质一定能导电吗?
氯化钠的导电性
任务四
电离方程式的书写,拍照上传
已知:
书写 CH3COOH 、NH3 H2O 、H2CO3 、Fe(OH)3 、NaHCO3 、NaHSO3的电离方程式
拍照上传。
总结:
a.多元弱酸分步电离,分步书写;
b.多元弱碱分步电离,一步书写;
c.强酸酸式盐的电离,水溶液一步电离;
d.弱酸酸式盐的电离,分步电离。
电离平衡状态
1、小组合作,以 CH3COOH CH3COO- + H+ 为例,
根据化学平衡状态的建立和影响因素,预测电离平衡状态的构建过程及特征、
电离平衡的影响因素。
任务五
启动智慧课堂的计时功能
电离平衡状态
任务五
t1:电离平衡状态
逆、等、动、定、变
影响电离平衡的因素
任务五
电离过程是吸热过程,升高温度,平衡向电离方向移动。
①温度:
②浓度:
(2) 外因:
遵循“勒夏特列原理”
(1)内因:
电解质本身的性质。通常电解质越弱电离程度越小。
适用于气体。
③压强:
越稀越电离。
条件改变 平衡移动方向 c(H+) n(H+) 电离程度 导电能力
升温
加水
加入冰醋酸
加少量NaOH(s)
加少量CH3COONa(s)
通HCl气体
结论 电离平衡状态
任务五
启动智慧课堂的计时功能
越热越电离
越稀越电离
同离子效应:抑制电离
离子反应:促进电离
正向 增大 增大 增大 增大
正向 减小 增大 增大 减小
正向 增大 增大 减小 增大
正向 减小 减小 增大 增大
逆向 减小 减小 减小 增大
逆向 减小 减小 减小 增大
2、根据“勒夏特列原理” 完成表格。
拓展延伸
纯硫酸(熔融态酸)不导电,硫酸溶液导电,试解释原因。
第一课时
强电解质和弱电解质
弱电解质的电离平衡
第一节 电离平衡
人体生命活动的各种化学反应
———离不开电解质
学习目标
1、从电离角度微观探析强、弱电解质的本质区别,落实分类观;
2、掌握强、弱电解质电离方程式书写;
3、认识弱电解质的电离平衡,能运用勒夏特列原理解释影响电离平衡的因素,树立 动态平衡的观点。
观看视频:复习旧知 唤起新知
任务一
任务一
电解质
非电解质
电离
导电条件
导电本质
酸碱盐
复习旧知 唤起新知
智慧课堂的随机提问功能
任务二
学生通过智慧课堂抢答功能,提出自己的预测
已知:
1、洁厕液主要成分为盐酸,为什么不用醋酸?
2、除水垢用醋酸,为什么不用盐酸?
任务三
学生通过实验3-1 验证自己的预测
【探究3-1】分别测等体积、等浓度的盐酸、醋酸溶液的pH。
实验内容 0.1 mol·L-1 HCl 0.1 mol·L-1 CH3COOH
溶液的pH
导电能力(电导率)
与镁条反应
1
2.8
知识拓展:pH= - lg c(H+)
强
弱
迅速产生大量气泡
产生气泡相对缓慢
任务三
实验测定电导率
任务三
学生抢答
1、强、弱电解质与导电性、溶解性有关吗?
2、导电能力与什么有关?
3、相同浓度的盐酸、醋酸、硫酸铜溶液导电能力谁强?
无关
离子浓度和离子所带电荷
硫酸铜>盐酸>醋酸
任务三
对物质进行重新分类,并拍照上传
思考
电解质一定能导电吗?
氯化钠的导电性
任务四
电离方程式的书写,拍照上传
已知:
书写 CH3COOH 、NH3 H2O 、H2CO3 、Fe(OH)3 、NaHCO3 、NaHSO3的电离方程式
拍照上传。
总结:
a.多元弱酸分步电离,分步书写;
b.多元弱碱分步电离,一步书写;
c.强酸酸式盐的电离,水溶液一步电离;
d.弱酸酸式盐的电离,分步电离。
电离平衡状态
1、小组合作,以 CH3COOH CH3COO- + H+ 为例,
根据化学平衡状态的建立和影响因素,预测电离平衡状态的构建过程及特征、
电离平衡的影响因素。
任务五
启动智慧课堂的计时功能
电离平衡状态
任务五
t1:电离平衡状态
逆、等、动、定、变
影响电离平衡的因素
任务五
电离过程是吸热过程,升高温度,平衡向电离方向移动。
①温度:
②浓度:
(2) 外因:
遵循“勒夏特列原理”
(1)内因:
电解质本身的性质。通常电解质越弱电离程度越小。
适用于气体。
③压强:
越稀越电离。
条件改变 平衡移动方向 c(H+) n(H+) 电离程度 导电能力
升温
加水
加入冰醋酸
加少量NaOH(s)
加少量CH3COONa(s)
通HCl气体
结论 电离平衡状态
任务五
启动智慧课堂的计时功能
越热越电离
越稀越电离
同离子效应:抑制电离
离子反应:促进电离
正向 增大 增大 增大 增大
正向 减小 增大 增大 减小
正向 增大 增大 减小 增大
正向 减小 减小 增大 增大
逆向 减小 减小 减小 增大
逆向 减小 减小 减小 增大
2、根据“勒夏特列原理” 完成表格。
拓展延伸
纯硫酸(熔融态酸)不导电,硫酸溶液导电,试解释原因。
