第九单元复习 课件(共31张PPT) 2023-2024学年人教版化学九年级下册
文档属性
| 名称 | 第九单元复习 课件(共31张PPT) 2023-2024学年人教版化学九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 703.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-30 19:52:09 | ||
图片预览










文档简介
(共31张PPT)
第九单元复习
溶液
1.能区分溶液、乳浊液、悬浊液。
2.能判断溶液中的溶质、溶剂。
3.能说出溶解时的热效应和乳化现象。
4.能理解饱和溶液、不和溶液、溶解度、溶质质量分数的含义。
5.能应用溶解度曲线解释常见的现象。
6.能掌握与溶质质量分数有关的计算。
7.能说出溶液配制的步骤、仪器、误差的原因。
课题1 溶液的形成
【知识点1】 溶液、乳浊液、悬浊液
溶液的概念
溶液的特征
一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物。
均一性
稳定性
悬浊液
乳浊液
固体分散于液体
液体分散于液体
不均一、不稳定
悬浊液和乳浊液
【知识点2】 溶液的组成
溶液的组成
溶液的体积≠溶剂的体积+溶质的体积
溶液的质量=溶质质量+溶剂质量
溶质
溶剂
被溶解的物质
起溶解作用的物质
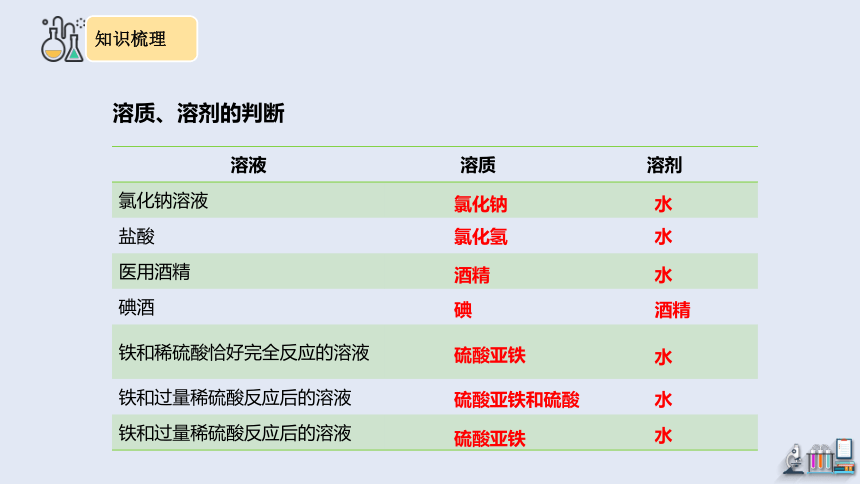
溶液 溶质 溶剂
氯化钠溶液
盐酸
医用酒精
碘酒
铁和稀硫酸恰好完全反应的溶液
铁和过量稀硫酸反应后的溶液
铁和过量稀硫酸反应后的溶液
溶质、溶剂的判断
氯化钠
水
氯化氢
水
酒精
水
碘
酒精
硫酸亚铁
水
硫酸亚铁和硫酸
水
硫酸亚铁
水
1、若加入的溶质没有完全溶解,那么溶质只是实际溶解的部分。
如:把80g的蔗糖加入100g水中,只是溶解了30g蔗糖,则蔗糖溶液中,溶质只是那30g蔗糖。
2、当两种物质完全反应后,新生成的物质是溶质,析出的沉淀或逸散的气体不是溶质。
如:将大理石加到稀盐酸中恰好完全反应,此时溶液中溶质是氯化钙,而不是HCl。
但是如果盐酸过量,则溶质为HCl和氯化钙。
注意
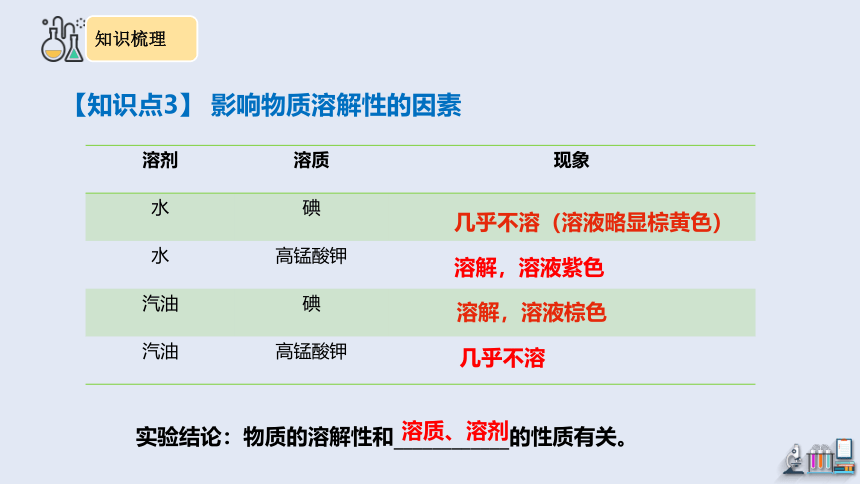
【知识点3】 影响物质溶解性的因素
几乎不溶(溶液略显棕黄色)
溶解,溶液紫色
溶解,溶液棕色
几乎不溶
实验结论:物质的溶解性和____________的性质有关。
溶剂 溶质 现象
水 碘
水 高锰酸钾
汽油 碘
汽油 高锰酸钾
溶质、溶剂
【知识点4】 溶解时的吸热和放热现象、乳化现象
乳化现象:乳化剂能使植物油分散成无数细小的液滴,而不聚成大油珠。小液滴能随水流走。如__________________等。
物质溶解伴随着热量的变化,有的物质溶解时会出现放热现象,如________等;有的物质溶解时会出现吸热现象,如_______等
氢氧化钠
硝酸铵
用洗衣液清洗衣服
1.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.碘 B.蔗糖 C.汽油 D.泥土
2. 日常生活中除去油污的方法很多,下列现象不属于乳化的是( )
A.修车工用汽油洗去手上的油污
B.洗发精洗去头发上的油脂
C.洗面奶洗去皮肤上的油脂
D.洗洁精洗去餐具上的油污
B
A
课题2 溶解度
【知识点1】 饱和溶液和不饱和溶液
饱和溶液
不饱和溶液
在一定温度、一定量的溶剂中,
溶质不能再溶解的溶液
在一定温度、一定量的溶剂中,
溶质还能再溶解的溶液
浓溶液
饱和溶液
不饱和溶液
稀溶液
饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。但在相同温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
不饱和溶液
饱和溶液
增加溶质、降低温度、恒温蒸发溶剂
增加溶剂、升高温度
特殊情况:
对于Ca(OH)2溶液,升高温度和降低温度的转化刚好相反。
【知识点2】 溶解度
溶解度
四要素
一定温度
100g水
饱和状态
单位:g
固体溶解度:一定温度下,某固体物质在100克溶剂中达到饱和时所溶解的质量。
气体溶解度
相同情况下,温度越高,溶解度越_____
相同情况下,压强越大,溶解度越_____
小
大
溶质质量∶溶剂质量∶溶液质量 20℃时,溶解度为36g的氯化钠饱和溶液 20%的氯化钠溶液
36∶100∶136
20∶80∶100
溶解度曲线的意义和应用
点:曲线上的点均表示某物质在该温度下的溶解度。
线:物质溶解度随温度改变的变化趋势。
面:在曲线上方的点表示饱和溶液,且有固体析出,在曲线上 的点表示恰好为饱和溶液,在曲线下方的点表示不饱和溶液。
意义
1.比较相同温度下,不同物质溶解度的大小
2.一定温度下,判断物质形成溶液的状态(饱和或不饱和)
3.判断饱和溶液和不饱和溶液的转化方法
5.混合溶液的分离、提纯方法(如KNO3混有NaCl,采用_________提纯)
4.固体物质的结晶方法
(陡升型适合________,平缓型适合_______)
降温结晶
降温结晶
蒸发结晶
应用
【知识点3】 溶解度曲线的意义和应用
t1℃下,A、B、C的溶解度大小:__________
A、B、C的饱和溶液分别从t3℃降温至t2℃,溶质质量分数大小关系:__________
A中混有少量的B,采用___________提纯。
C>B>A
B>A>C
降温结晶
等质量的A、B的饱和溶液分别从t3℃降温至t2℃,析出固体质量大小:__________
A>B
课题3 溶液的浓度
【知识点1】 溶质质量分数的计算
溶质的质量分数
=
溶质质量
溶质质量+溶剂质量
溶质质量
溶液质量
=
×100%
×100%
溶解度(S) 溶质的质量分数
意义 定量地表示物质溶解能力的强弱 表示溶液中溶质质量与溶液质量之比
条件 一定的温度 100克溶剂 达到饱和状态 温度不一定
溶剂不定量
不一定饱和
单位 克 无单位
溶质的质量分数=
溶解度
溶解度+100克
×100%
联系:在一定温度下的饱和溶液中
1. 生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用100 g生理盐水给某病人输液,输入病人体内的氯化钠和水的的质量各是多少?
氯化钠的质量=0.9%×100g=9g
水的质量=100g-9g=91g
2. 把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量是多少?
100g×98%=(100g+m水)×10%
m水=880g
3. 100g某硫酸恰好与13g锌完全起反应。试计算反应后溶液溶质质量分数为多少?
Zn+H2SO4=ZnSO4+H2↑
65 161 2
13g x y
13g x
65
161
=
y=0.4g
32.2g
100g+13g-0.4g
×100%
硫酸锌的质量分数=
=28.6%
解:设生成硫酸锌质量为x,氢气质量为y
13g y
65
2
=
x=32.2g
【知识点2】 溶液的配制
1. 实验步骤
用食盐固体配制100g溶质质量分数为15%的食盐溶液,现有下列操作:
①溶解;②称取食盐;③过滤;④量取水;⑤计算;⑥蒸发。正确的操作顺序是( )
A. ①②③④ B. ⑤②④① C.①③⑤②④① D.①③⑥⑤②④①
B
2. 实验误差分析
实验操作 质量分数
称量溶质时,砝码和物体放反了,且使用了游码
仰视读数量取溶剂
俯视读数量取溶剂
称量完毕,溶质有撒落,没有全部转移到烧杯中
配好溶液后,向试剂瓶中转移时,溶液有洒落
偏小
偏小
偏大
偏小
无影响
下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
1、
2、
3、
4、
溶液
溶液
溶解度
溶液的浓度
概念和特征
组成
溶解的吸放热现象、乳化和乳化现象
溶解度
溶解度曲线
溶质质量分数的计算
溶液的配制
饱和溶液和不饱和溶液
第九单元复习
溶液
1.能区分溶液、乳浊液、悬浊液。
2.能判断溶液中的溶质、溶剂。
3.能说出溶解时的热效应和乳化现象。
4.能理解饱和溶液、不和溶液、溶解度、溶质质量分数的含义。
5.能应用溶解度曲线解释常见的现象。
6.能掌握与溶质质量分数有关的计算。
7.能说出溶液配制的步骤、仪器、误差的原因。
课题1 溶液的形成
【知识点1】 溶液、乳浊液、悬浊液
溶液的概念
溶液的特征
一种或几种物质分散到另一种物质里,形成的均一、稳定的混合物。
均一性
稳定性
悬浊液
乳浊液
固体分散于液体
液体分散于液体
不均一、不稳定
悬浊液和乳浊液
【知识点2】 溶液的组成
溶液的组成
溶液的体积≠溶剂的体积+溶质的体积
溶液的质量=溶质质量+溶剂质量
溶质
溶剂
被溶解的物质
起溶解作用的物质
溶液 溶质 溶剂
氯化钠溶液
盐酸
医用酒精
碘酒
铁和稀硫酸恰好完全反应的溶液
铁和过量稀硫酸反应后的溶液
铁和过量稀硫酸反应后的溶液
溶质、溶剂的判断
氯化钠
水
氯化氢
水
酒精
水
碘
酒精
硫酸亚铁
水
硫酸亚铁和硫酸
水
硫酸亚铁
水
1、若加入的溶质没有完全溶解,那么溶质只是实际溶解的部分。
如:把80g的蔗糖加入100g水中,只是溶解了30g蔗糖,则蔗糖溶液中,溶质只是那30g蔗糖。
2、当两种物质完全反应后,新生成的物质是溶质,析出的沉淀或逸散的气体不是溶质。
如:将大理石加到稀盐酸中恰好完全反应,此时溶液中溶质是氯化钙,而不是HCl。
但是如果盐酸过量,则溶质为HCl和氯化钙。
注意
【知识点3】 影响物质溶解性的因素
几乎不溶(溶液略显棕黄色)
溶解,溶液紫色
溶解,溶液棕色
几乎不溶
实验结论:物质的溶解性和____________的性质有关。
溶剂 溶质 现象
水 碘
水 高锰酸钾
汽油 碘
汽油 高锰酸钾
溶质、溶剂
【知识点4】 溶解时的吸热和放热现象、乳化现象
乳化现象:乳化剂能使植物油分散成无数细小的液滴,而不聚成大油珠。小液滴能随水流走。如__________________等。
物质溶解伴随着热量的变化,有的物质溶解时会出现放热现象,如________等;有的物质溶解时会出现吸热现象,如_______等
氢氧化钠
硝酸铵
用洗衣液清洗衣服
1.把少量下列物质分别放入水中,充分搅拌,可以得到溶液的是( )
A.碘 B.蔗糖 C.汽油 D.泥土
2. 日常生活中除去油污的方法很多,下列现象不属于乳化的是( )
A.修车工用汽油洗去手上的油污
B.洗发精洗去头发上的油脂
C.洗面奶洗去皮肤上的油脂
D.洗洁精洗去餐具上的油污
B
A
课题2 溶解度
【知识点1】 饱和溶液和不饱和溶液
饱和溶液
不饱和溶液
在一定温度、一定量的溶剂中,
溶质不能再溶解的溶液
在一定温度、一定量的溶剂中,
溶质还能再溶解的溶液
浓溶液
饱和溶液
不饱和溶液
稀溶液
饱和溶液不一定是浓溶液,不饱和溶液不一定是稀溶液。但在相同温度下,同种溶剂、同种溶质的饱和溶液要比其不饱和溶液浓度大。
不饱和溶液
饱和溶液
增加溶质、降低温度、恒温蒸发溶剂
增加溶剂、升高温度
特殊情况:
对于Ca(OH)2溶液,升高温度和降低温度的转化刚好相反。
【知识点2】 溶解度
溶解度
四要素
一定温度
100g水
饱和状态
单位:g
固体溶解度:一定温度下,某固体物质在100克溶剂中达到饱和时所溶解的质量。
气体溶解度
相同情况下,温度越高,溶解度越_____
相同情况下,压强越大,溶解度越_____
小
大
溶质质量∶溶剂质量∶溶液质量 20℃时,溶解度为36g的氯化钠饱和溶液 20%的氯化钠溶液
36∶100∶136
20∶80∶100
溶解度曲线的意义和应用
点:曲线上的点均表示某物质在该温度下的溶解度。
线:物质溶解度随温度改变的变化趋势。
面:在曲线上方的点表示饱和溶液,且有固体析出,在曲线上 的点表示恰好为饱和溶液,在曲线下方的点表示不饱和溶液。
意义
1.比较相同温度下,不同物质溶解度的大小
2.一定温度下,判断物质形成溶液的状态(饱和或不饱和)
3.判断饱和溶液和不饱和溶液的转化方法
5.混合溶液的分离、提纯方法(如KNO3混有NaCl,采用_________提纯)
4.固体物质的结晶方法
(陡升型适合________,平缓型适合_______)
降温结晶
降温结晶
蒸发结晶
应用
【知识点3】 溶解度曲线的意义和应用
t1℃下,A、B、C的溶解度大小:__________
A、B、C的饱和溶液分别从t3℃降温至t2℃,溶质质量分数大小关系:__________
A中混有少量的B,采用___________提纯。
C>B>A
B>A>C
降温结晶
等质量的A、B的饱和溶液分别从t3℃降温至t2℃,析出固体质量大小:__________
A>B
课题3 溶液的浓度
【知识点1】 溶质质量分数的计算
溶质的质量分数
=
溶质质量
溶质质量+溶剂质量
溶质质量
溶液质量
=
×100%
×100%
溶解度(S) 溶质的质量分数
意义 定量地表示物质溶解能力的强弱 表示溶液中溶质质量与溶液质量之比
条件 一定的温度 100克溶剂 达到饱和状态 温度不一定
溶剂不定量
不一定饱和
单位 克 无单位
溶质的质量分数=
溶解度
溶解度+100克
×100%
联系:在一定温度下的饱和溶液中
1. 生理盐水是溶质质量分数为0.9%的氯化钠溶液,现用100 g生理盐水给某病人输液,输入病人体内的氯化钠和水的的质量各是多少?
氯化钠的质量=0.9%×100g=9g
水的质量=100g-9g=91g
2. 把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量是多少?
100g×98%=(100g+m水)×10%
m水=880g
3. 100g某硫酸恰好与13g锌完全起反应。试计算反应后溶液溶质质量分数为多少?
Zn+H2SO4=ZnSO4+H2↑
65 161 2
13g x y
13g x
65
161
=
y=0.4g
32.2g
100g+13g-0.4g
×100%
硫酸锌的质量分数=
=28.6%
解:设生成硫酸锌质量为x,氢气质量为y
13g y
65
2
=
x=32.2g
【知识点2】 溶液的配制
1. 实验步骤
用食盐固体配制100g溶质质量分数为15%的食盐溶液,现有下列操作:
①溶解;②称取食盐;③过滤;④量取水;⑤计算;⑥蒸发。正确的操作顺序是( )
A. ①②③④ B. ⑤②④① C.①③⑤②④① D.①③⑥⑤②④①
B
2. 实验误差分析
实验操作 质量分数
称量溶质时,砝码和物体放反了,且使用了游码
仰视读数量取溶剂
俯视读数量取溶剂
称量完毕,溶质有撒落,没有全部转移到烧杯中
配好溶液后,向试剂瓶中转移时,溶液有洒落
偏小
偏小
偏大
偏小
无影响
下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
1、
2、
3、
4、
溶液
溶液
溶解度
溶液的浓度
概念和特征
组成
溶解的吸放热现象、乳化和乳化现象
溶解度
溶解度曲线
溶质质量分数的计算
溶液的配制
饱和溶液和不饱和溶液
同课章节目录
