第十一单元复习 课件(共28张PPT) 2023-2024学年人教版化学九年级下册
文档属性
| 名称 | 第十一单元复习 课件(共28张PPT) 2023-2024学年人教版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 414.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-30 00:00:00 | ||
图片预览






文档简介
(共28张PPT)
第十一单元复习
盐 化肥
1.能区分单质、氧化物、酸、碱、盐。
2.能列举氯化钠、碳酸钠、碳酸氢钠、碳酸钙的物理性质和用途。
3.能识别复分解反应。
4.能根据复分解反应的条件判断酸、碱、盐能否反应,离子能否共存。
5.能列举盐的化学性质,并能书写化学方程式。
课题1 生活中常见的盐
NaCl →
Na2CO3 →
CaCO3→
NH4Cl →
盐的定义:在水溶液中,能解离出__________(或_____)和酸根离子的化合物
盐在水溶液中的解离
Na+ + Cl-
2Na+ + CO32-
NH4+ + Cl-
Ca2+ + CO32-
金属阳离子
NH4+
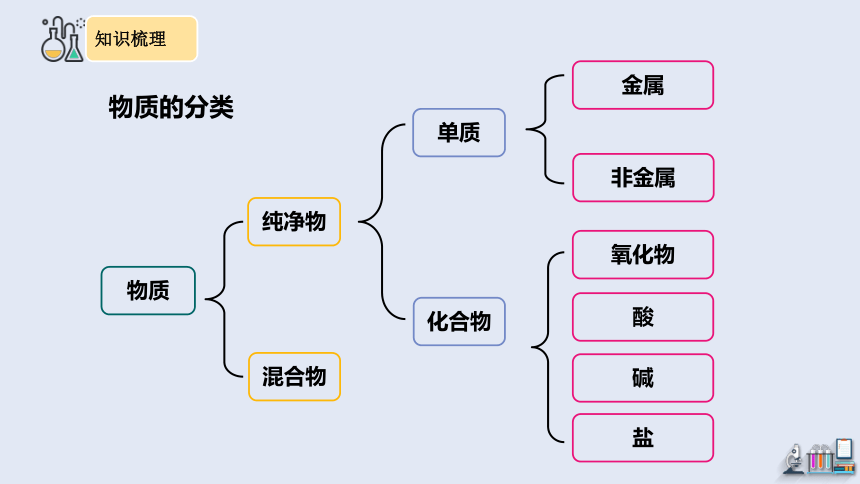
物质
纯净物
混合物
单质
化合物
金属
酸
氧化物
非金属
碱
盐
物质的分类
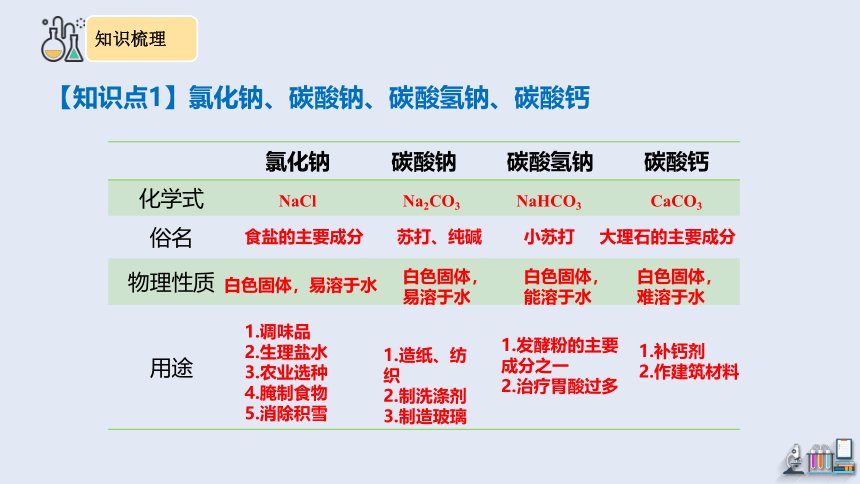
【知识点1】氯化钠、碳酸钠、碳酸氢钠、碳酸钙
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗名
物理性质
用途
NaCl
Na2CO3
NaHCO3
CaCO3
食盐的主要成分
苏打、纯碱
小苏打
大理石的主要成分
白色固体,易溶于水
白色固体,易溶于水
白色固体,能溶于水
白色固体,难溶于水
1.调味品
2.生理盐水
3.农业选种
4.腌制食物
5.消除积雪
1.造纸、纺织
2.制洗涤剂
3.制造玻璃
1.发酵粉的主要成分之一
2.治疗胃酸过多
1.补钙剂
2.作建筑材料
【知识点2】复分解反应
(1)定义:两种化合物互相交换成分,生成另外两种化合物的反应。
(2)通式:AB+CD __________
(3)特点:“双交换,价不变”,反应物仅交换成分,元素化合价不发生变化。
AD+CB
沉淀
(4)发生条件:
反应类型 反应物的条件 生成物的条件
酸+碱 盐+水 反应物可不溶于水 有 、 或 生成(至少有其一)
酸+盐 新盐+新酸
碱+盐 新盐+新碱 反应物均溶于水
盐+盐 新盐+新盐
气体
水
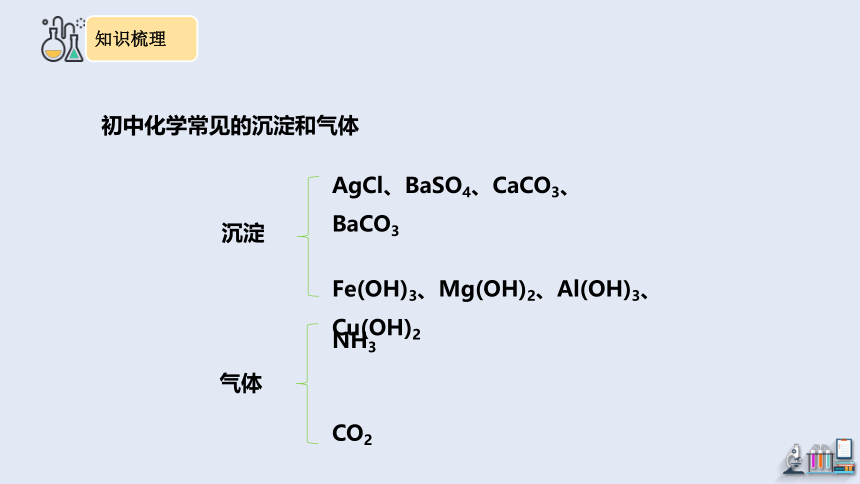
沉淀
AgCl、BaSO4、CaCO3、BaCO3
Fe(OH)3、Mg(OH)2、Al(OH)3、Cu(OH)2
气体
NH3
CO2
初中化学常见的沉淀和气体
【知识点3】盐的化学性质
规律 示例 备注
与金属 反应 盐+金属 新盐+新金属 Fe+CuSO4 _____________________ 该反应为置换反应,活动性较强的金属可以置换出活动性较弱的金属;作为反应物的盐必须可溶;K、Na、Ca等活泼金属与盐溶液反应不能置换出金属
与酸 反应 盐+酸 新盐+新酸 CaCO3+2HCl __________________ 碳酸盐与酸反应生成二氧化碳,常用于检验碳酸盐
与碱 反应 盐+碱 新盐+新碱 CuSO4+2NaOH ___________________ 盐与碱反应常生成沉淀,但是铵盐与碱反应会放出氨气(氨气可使湿润的红色石蕊试纸变蓝)
与盐 反应 盐1+盐2 新盐1+新盐2 Na2SO4+BaCl2 _________________________________ 反应物中的两种盐需要都溶于水,生成物中有沉淀
Cu+FeSO4
CaCl2+CO2↑+H2O
Cu(OH)2↓+Na2SO4
BaSO4↓+2NaCl
1.与碳酸钠有关的物质转化
①Na2CO3+H2O+CO2 2NaHCO3。
②2NaHCO3 Na2CO3+H2O+CO2↑。
③Na2CO3+2HCl 2NaCl+H2O+CO2↑。
④Na2CO3+Ba(OH)2 BaCO3↓+2NaOH。
⑤Na2CO3+Ca(OH)2 CaCO3↓+2NaOH。
⑥CO2+2NaOH Na2CO3+H2O 。
2.含钙化合物之间的转化
①CaCO3 CaO+CO2↑。
②CaO+H2O Ca(OH)2。
③CaO+2HCl CaCl2+H2O。
④CaCO3+2HCl CaCl2+H2O+CO2↑。
⑤CaCl2+Na2CO3 CaCO3↓+2NaCl。
⑥Ca(OH)2+Na2CO3 CaCO3↓+2NaOH。
⑦Ca(OH)2+2HCl CaCl2+2H2O。
高温
学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成,主要有以下八种反应:
1.某同学在学习了酸、碱、盐之间的转化规律后,绘制了可以通过一步反应制取MgCl2的思维导图。
(1)若反应①中的盐是CuCl2,且反应①为置换反应,
则另一种反应物的化学式为 。
(2)请写出符合反应⑤的化学方程式:
。
(3)已知A不同于图中其他物质类别,它属于 (填物质类别),反应③的化学方程式为 。
Mg
2HCl+Mg(OH)2 MgCl2+2H2O
金属氧化物
MgO+2HCl MgCl2+H2O
2.下列各组物质在水中能大量共存且溶液为无色的是( )
A.NH4Cl、K2CO3、NaOH、Na2SO4
B.MgSO4、NaCl、Ba(NO3)2、FeCl3
C.KNO3、Na2SO4、HCl、NaHCO3
D.HCl、NaNO3、K2SO4、NH4Cl
D
课题2 化学肥料
种类 特征元素 举例 主要作用
氮肥 ________ 尿素[CO(NH2)2]、NH4HCO3、NH4Cl、NH4NO3、NaNO3 促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量
磷肥 ________ 磷矿粉[Ca3(PO4)2]、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙[Ca(H2PO4)2和CaSO4的混合物] 促进植物生长,增强作物的抗寒、抗旱能力
氮元素
磷元素
种类 特征元素 举例 主要作用
钾肥 _________ K2SO4、KCl 保证各种代谢过程的顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力
复合肥 N、P、K三种营养元素中,同时含有 或者 的营养元素 KNO3、NH4H2PO4、(NH4)2HPO4 能同时均匀地供给作物几种营养
钾元素
两种
两种以上
2.化肥的简易鉴别
(1)初步区分氮肥、磷肥和钾肥的方法
方法 氮肥 钾肥 磷肥
外观 色晶体 状
加水 全部溶于水 大多不溶于水
或部分溶于水
加熟石 灰研磨 铵态氮肥会放出具有刺激性气味的氨气 无具有刺激性气味的氨气放出
灰白色粉末
白
(2)氮肥的简易鉴别
施用化肥的注意事项
1.碳酸氢铵的性质不稳定,施肥后应立即用土覆盖,避免暴晒。
2.长期施用硫酸铵,会使土壤酸化、板结,故硫酸铵不宜长期施用。
3.硝酸铵在高温或者受到猛烈撞击时会爆炸。
4.铵态氮肥与碱反应,能放出氨气,所以不能与熟石灰或草木灰等碱性物质混合施用,以免降低肥效。
3.化肥和农药的使用
(1)利:防治病虫害,提高农作物产量。
(2)弊:不合理的施用会污染环境,危害人体健康。
1.下列化肥属于钾肥的是( )
A.CO(NH2)2 B.K2SO4 C.Ca3(PO4)2 D.NH4H2PO4
B
2.在植物生长过程中,施用氮肥能使枝叶繁茂,磷肥能使果实饱满,钾肥能使茎秆健壮。种植食叶类蔬菜(如青菜),应施用较多的化肥是( )
A.磷肥 B.NH4NO3 C.K2SO4 D.微量元素肥料
B
实验活动8 粗盐中难溶性杂质的去除
1.实验步骤及注意事项
(1)称量时,要注意遵循“左物右码”的原则,且在托盘的两端各放一张相同的称量纸。
(2)溶解时玻璃棒的作用是 。
(3)过滤时“一贴、二低、三靠”。
搅拌,加快粗盐溶解
(4)蒸发时,玻璃棒的作用是 。当蒸发皿中
时要停止加热,利用蒸发皿的余热将剩余的滤液蒸干;停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
(5)计算产率:
搅拌以防滤液局部过热引起液滴飞溅
有大量晶体析出
产率= ×100%
精盐质量
粗盐质量
2.误差分析
造成精盐产率偏低的原因:
(1)溶解搅拌不充分或搅拌时液滴溅出;
(2)蒸发时未用玻璃棒搅拌,液滴飞溅;
(3)转移时有部分精盐沾在蒸发皿上。
造成精盐产率偏高的原因:
(1)过滤后得到的滤液不澄清就蒸发;
(2)蒸发时,没完全蒸干就称量。
在粗盐的提纯实验中:
(1)其主要操作步骤顺序是 ;
①过滤 ②溶解 ③蒸发 ④计算产率
(2)如图是某同学过滤的操作图,指出图中的明显错误
;过滤后,如果滤液仍然浑浊,其原
因可能是_____________________________________
(填一种);
(3)蒸发时,当蒸发皿内出现 时应停止加热;
没有用玻璃棒引流
液面高于滤纸边缘(或滤纸破损,或仪器不干净)
②①③④
较多固体
盐 化肥
盐的概念和物质的分类
氯化钠、碳酸钠、碳酸氢钠、碳酸钙
复分解反应
盐的化学性质
化肥的种类和作用
第十一单元复习
盐 化肥
1.能区分单质、氧化物、酸、碱、盐。
2.能列举氯化钠、碳酸钠、碳酸氢钠、碳酸钙的物理性质和用途。
3.能识别复分解反应。
4.能根据复分解反应的条件判断酸、碱、盐能否反应,离子能否共存。
5.能列举盐的化学性质,并能书写化学方程式。
课题1 生活中常见的盐
NaCl →
Na2CO3 →
CaCO3→
NH4Cl →
盐的定义:在水溶液中,能解离出__________(或_____)和酸根离子的化合物
盐在水溶液中的解离
Na+ + Cl-
2Na+ + CO32-
NH4+ + Cl-
Ca2+ + CO32-
金属阳离子
NH4+
物质
纯净物
混合物
单质
化合物
金属
酸
氧化物
非金属
碱
盐
物质的分类
【知识点1】氯化钠、碳酸钠、碳酸氢钠、碳酸钙
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
俗名
物理性质
用途
NaCl
Na2CO3
NaHCO3
CaCO3
食盐的主要成分
苏打、纯碱
小苏打
大理石的主要成分
白色固体,易溶于水
白色固体,易溶于水
白色固体,能溶于水
白色固体,难溶于水
1.调味品
2.生理盐水
3.农业选种
4.腌制食物
5.消除积雪
1.造纸、纺织
2.制洗涤剂
3.制造玻璃
1.发酵粉的主要成分之一
2.治疗胃酸过多
1.补钙剂
2.作建筑材料
【知识点2】复分解反应
(1)定义:两种化合物互相交换成分,生成另外两种化合物的反应。
(2)通式:AB+CD __________
(3)特点:“双交换,价不变”,反应物仅交换成分,元素化合价不发生变化。
AD+CB
沉淀
(4)发生条件:
反应类型 反应物的条件 生成物的条件
酸+碱 盐+水 反应物可不溶于水 有 、 或 生成(至少有其一)
酸+盐 新盐+新酸
碱+盐 新盐+新碱 反应物均溶于水
盐+盐 新盐+新盐
气体
水
沉淀
AgCl、BaSO4、CaCO3、BaCO3
Fe(OH)3、Mg(OH)2、Al(OH)3、Cu(OH)2
气体
NH3
CO2
初中化学常见的沉淀和气体
【知识点3】盐的化学性质
规律 示例 备注
与金属 反应 盐+金属 新盐+新金属 Fe+CuSO4 _____________________ 该反应为置换反应,活动性较强的金属可以置换出活动性较弱的金属;作为反应物的盐必须可溶;K、Na、Ca等活泼金属与盐溶液反应不能置换出金属
与酸 反应 盐+酸 新盐+新酸 CaCO3+2HCl __________________ 碳酸盐与酸反应生成二氧化碳,常用于检验碳酸盐
与碱 反应 盐+碱 新盐+新碱 CuSO4+2NaOH ___________________ 盐与碱反应常生成沉淀,但是铵盐与碱反应会放出氨气(氨气可使湿润的红色石蕊试纸变蓝)
与盐 反应 盐1+盐2 新盐1+新盐2 Na2SO4+BaCl2 _________________________________ 反应物中的两种盐需要都溶于水,生成物中有沉淀
Cu+FeSO4
CaCl2+CO2↑+H2O
Cu(OH)2↓+Na2SO4
BaSO4↓+2NaCl
1.与碳酸钠有关的物质转化
①Na2CO3+H2O+CO2 2NaHCO3。
②2NaHCO3 Na2CO3+H2O+CO2↑。
③Na2CO3+2HCl 2NaCl+H2O+CO2↑。
④Na2CO3+Ba(OH)2 BaCO3↓+2NaOH。
⑤Na2CO3+Ca(OH)2 CaCO3↓+2NaOH。
⑥CO2+2NaOH Na2CO3+H2O 。
2.含钙化合物之间的转化
①CaCO3 CaO+CO2↑。
②CaO+H2O Ca(OH)2。
③CaO+2HCl CaCl2+H2O。
④CaCO3+2HCl CaCl2+H2O+CO2↑。
⑤CaCl2+Na2CO3 CaCO3↓+2NaCl。
⑥Ca(OH)2+Na2CO3 CaCO3↓+2NaOH。
⑦Ca(OH)2+2HCl CaCl2+2H2O。
高温
学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成,主要有以下八种反应:
1.某同学在学习了酸、碱、盐之间的转化规律后,绘制了可以通过一步反应制取MgCl2的思维导图。
(1)若反应①中的盐是CuCl2,且反应①为置换反应,
则另一种反应物的化学式为 。
(2)请写出符合反应⑤的化学方程式:
。
(3)已知A不同于图中其他物质类别,它属于 (填物质类别),反应③的化学方程式为 。
Mg
2HCl+Mg(OH)2 MgCl2+2H2O
金属氧化物
MgO+2HCl MgCl2+H2O
2.下列各组物质在水中能大量共存且溶液为无色的是( )
A.NH4Cl、K2CO3、NaOH、Na2SO4
B.MgSO4、NaCl、Ba(NO3)2、FeCl3
C.KNO3、Na2SO4、HCl、NaHCO3
D.HCl、NaNO3、K2SO4、NH4Cl
D
课题2 化学肥料
种类 特征元素 举例 主要作用
氮肥 ________ 尿素[CO(NH2)2]、NH4HCO3、NH4Cl、NH4NO3、NaNO3 促进植物茎、叶生长茂盛,叶色浓绿,提高植物蛋白质含量
磷肥 ________ 磷矿粉[Ca3(PO4)2]、钙镁磷肥(钙和镁的磷酸盐)、过磷酸钙[Ca(H2PO4)2和CaSO4的混合物] 促进植物生长,增强作物的抗寒、抗旱能力
氮元素
磷元素
种类 特征元素 举例 主要作用
钾肥 _________ K2SO4、KCl 保证各种代谢过程的顺利进行、促进植物生长、增强抗病虫害和抗倒伏能力
复合肥 N、P、K三种营养元素中,同时含有 或者 的营养元素 KNO3、NH4H2PO4、(NH4)2HPO4 能同时均匀地供给作物几种营养
钾元素
两种
两种以上
2.化肥的简易鉴别
(1)初步区分氮肥、磷肥和钾肥的方法
方法 氮肥 钾肥 磷肥
外观 色晶体 状
加水 全部溶于水 大多不溶于水
或部分溶于水
加熟石 灰研磨 铵态氮肥会放出具有刺激性气味的氨气 无具有刺激性气味的氨气放出
灰白色粉末
白
(2)氮肥的简易鉴别
施用化肥的注意事项
1.碳酸氢铵的性质不稳定,施肥后应立即用土覆盖,避免暴晒。
2.长期施用硫酸铵,会使土壤酸化、板结,故硫酸铵不宜长期施用。
3.硝酸铵在高温或者受到猛烈撞击时会爆炸。
4.铵态氮肥与碱反应,能放出氨气,所以不能与熟石灰或草木灰等碱性物质混合施用,以免降低肥效。
3.化肥和农药的使用
(1)利:防治病虫害,提高农作物产量。
(2)弊:不合理的施用会污染环境,危害人体健康。
1.下列化肥属于钾肥的是( )
A.CO(NH2)2 B.K2SO4 C.Ca3(PO4)2 D.NH4H2PO4
B
2.在植物生长过程中,施用氮肥能使枝叶繁茂,磷肥能使果实饱满,钾肥能使茎秆健壮。种植食叶类蔬菜(如青菜),应施用较多的化肥是( )
A.磷肥 B.NH4NO3 C.K2SO4 D.微量元素肥料
B
实验活动8 粗盐中难溶性杂质的去除
1.实验步骤及注意事项
(1)称量时,要注意遵循“左物右码”的原则,且在托盘的两端各放一张相同的称量纸。
(2)溶解时玻璃棒的作用是 。
(3)过滤时“一贴、二低、三靠”。
搅拌,加快粗盐溶解
(4)蒸发时,玻璃棒的作用是 。当蒸发皿中
时要停止加热,利用蒸发皿的余热将剩余的滤液蒸干;停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
(5)计算产率:
搅拌以防滤液局部过热引起液滴飞溅
有大量晶体析出
产率= ×100%
精盐质量
粗盐质量
2.误差分析
造成精盐产率偏低的原因:
(1)溶解搅拌不充分或搅拌时液滴溅出;
(2)蒸发时未用玻璃棒搅拌,液滴飞溅;
(3)转移时有部分精盐沾在蒸发皿上。
造成精盐产率偏高的原因:
(1)过滤后得到的滤液不澄清就蒸发;
(2)蒸发时,没完全蒸干就称量。
在粗盐的提纯实验中:
(1)其主要操作步骤顺序是 ;
①过滤 ②溶解 ③蒸发 ④计算产率
(2)如图是某同学过滤的操作图,指出图中的明显错误
;过滤后,如果滤液仍然浑浊,其原
因可能是_____________________________________
(填一种);
(3)蒸发时,当蒸发皿内出现 时应停止加热;
没有用玻璃棒引流
液面高于滤纸边缘(或滤纸破损,或仪器不干净)
②①③④
较多固体
盐 化肥
盐的概念和物质的分类
氯化钠、碳酸钠、碳酸氢钠、碳酸钙
复分解反应
盐的化学性质
化肥的种类和作用
同课章节目录
