11.1 生活中常见的盐 第2课时 课件(共23张PPT 内嵌视频) 2023-2024学年人教版化学九年级下册
文档属性
| 名称 | 11.1 生活中常见的盐 第2课时 课件(共23张PPT 内嵌视频) 2023-2024学年人教版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 56.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-30 00:00:00 | ||
图片预览






文档简介
(共23张PPT)
课题1 生活中常见的盐
第2课时
请同学们回忆:写出上节课的三个化学方程式
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
1.碳酸钠与稀盐酸反应;
2.碳酸氢钠与稀盐酸反应;
3.碳酸钠与石灰水反应。
上面三个反应与我们前面所学的化合、分解、置换三种反应有什么不同?这些反应有什么共同特征?请同学们独立思考,交换意见。
1.能识别复分解反应。
2.能认识复分解反应发生的条件和实质。
3.能判断酸、碱、盐之间是否能发生反应
4.能概括盐的化学性质。
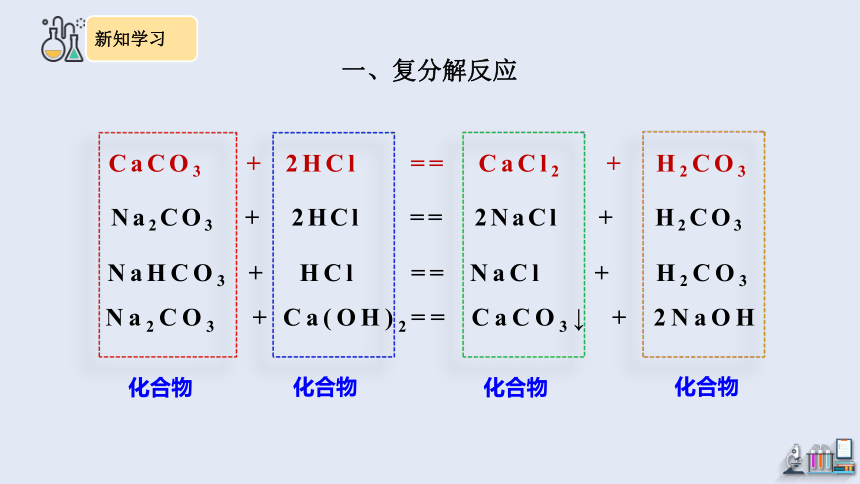
CaCO3 + 2HCl == CaCl2 + H2CO3
Na2CO3 + 2HCl == 2NaCl + H2CO3
NaHCO3 + HCl == NaCl + H2CO3
Na2CO3 + Ca(OH)2== CaCO3↓ + 2NaOH
化合物
化合物
化合物
化合物
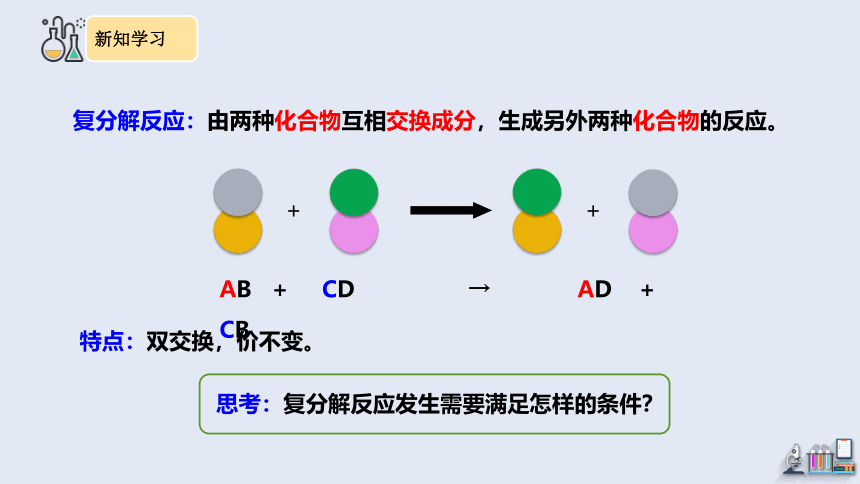
一、复分解反应
+
+
AB + CD → AD + CB
复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
特点:双交换,价不变。
思考:复分解反应发生需要满足怎样的条件?
【实验】向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现 象
化学方程式 有蓝色絮状沉淀生成
有白色絮状沉淀生成
CuSO4 + 2NaOH==Cu(OH)2↓+Na2SO4
CuSO4 + BaCl2==BaSO4↓+ CuCl2
讨论:1. 上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
2. 前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物中,相同的生成物是什么?
3. 碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到的共同现象是什么?
有沉淀生成
有水生成
有气体生成
思考:复分解反应发生的条件是什么呢???
实验现象及结论:
BaCl2+H2SO4==BaSO4↓ +2HCl
2NaOH+H2SO4==Na2SO4 + 2H2O
Na2CO3+H2SO4==Na2SO4 + H2O + CO2↑
BaCl2+ Na2CO3==BaCO3↓ + 2NaCl
BaCl2+ NaOH ==不反应
Na2CO3 + NaOH ==不反应
有白色沉淀生成
有水生成
有气体生成
有白色沉淀生成
复分解反应发生的条件
①生成水;②生成气体;③生成沉淀。(满足一条即可)
思考:复分解反应发生的条件是什么呢???
实验现象及结论:
BaCl2+H2SO4==BaSO4↓ +2HCl
2NaOH+H2SO4==Na2SO4 + 2H2O
Na2CO3+H2SO4==Na2SO4 + H2O + CO2↑
BaCl2+ Na2CO3==BaCO3↓ + 2NaCl
BaCl2+ NaOH ==不反应
Na2CO3 + NaOH ==不反应
有白色沉淀生成
有水生成
有气体生成
有白色沉淀生成
复分解反应发生的条件
①生成水;②生成气体;③生成沉淀。(满足一条即可)
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
酸、碱、盐的溶解性(20℃)
【探究】某些酸、碱、盐之间是否发生反应
1. 根据复分解反应发生的条件,并利用有关酸、碱、盐溶解性的信息,判断稀硫酸与下表中的四种化合物的溶液之间是否能发生反应。
NaOH NaCl K2CO3 Ba(NO3)2
稀硫酸
判断依据
反应
不反应
反应
反应
有水生成
无水、气体或沉淀生成
有CO2气体生成
有BaSO4
沉淀生成
NaOH NaCl K2CO3 Ba(NO3)2
设计实验
向盛有NaOH溶液的试管中滴加2~3滴酚酞溶液,然后滴加稀硫酸,观察现象,若原溶液中红色褪去,则可判断发生了反应
将稀硫酸和NaCl溶液混合于试管中,
观察现象,若无明显变化,则可判断没有发生反应
将稀硫酸和K2CO3溶液混合于试管中,观察现象,若有无色气体生成,该气体能使澄清石灰水变浑浊,则可判断发生了反应
将稀硫酸和
Ba(NO3)2
溶液混合于试管中,观察现象,若有白色沉淀生成,则可判断发生了反应
2. 设计实验证明你的判断。
H+、Cl-
Na+、CO3 2-
Na+、Cl-
反应前
反应后
溶液中离子种类发生改变
2HCl+Na2CO3 ——
2NaCl + H2O+CO2↑
——
复分解反应发生时的离子变化
K2SO4 + NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na2SO4 + KNO3 ——
Na+、NO3-
溶液中离子种类没发生改变
反应前
反应后
√
实质
——
二、盐的化学性质
1.盐 + 金属→新盐 + 新金属
反应条件:
①参加反应的盐必须溶于水;
②“前换后”(或说“强换弱”):即在金属活动性顺序表中,排在前面的金属能把排在后面的金属从其盐溶液中置换出来(除K、Ca、Na外)。
③K、Ca、Na 在盐溶液中一般先容易与水反应。
2.盐 + 酸→新盐 + 新酸
3.盐 + 碱→新盐 + 新碱
4.盐 + 盐→新盐 + 新盐
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥(氮肥)工业所做的贡献。
NH3+CO2+H2O +NaCl ==NaHCO3↓+NH4Cl
原理:将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠析出。
NH3+CO2+H2O ==NH4HCO3
NH4HCO3+NaCl ==NaHCO3↓+NH4Cl
总反应:
2NaHCO3 ===Na2CO3+H2O+CO2↑
△
1、下列化学反应属于复分解反应的是( )
A、Zn+H2SO4=ZnSO4+H2↑ B、2KMnO4==K2MnO4+MnO2+O2↑
C、CaO+H2O=Ca(OH)2 D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
D
2、化学反应要符合一定的原理和条件,下列认识正确的是( )
A.化合反应和分解反应一定有单质参加或生成
B.置换反应只能发生在金属与金属的化合物之间
C.复分解反应要有沉淀或气体或水生成
D.有盐和水生成的反应一定是中和反应
C
3、下列各组离子在溶液中能大量共存的是( )
A.K+、SO42﹣、NO3﹣ B.NH4+、OH﹣、Cl﹣
C.Cu2+、Na+、OH﹣ D.Ca2+、K+、CO32﹣
4、若不用其他试剂,而用最简便的方法鉴别下列四种溶液:①硫酸镁溶液
②氢氧化钾溶液 ③硫酸铜溶液 ④氯化钠溶液。鉴别的正确顺序是( )
A.③②①④ B.④③②① C.①②③④ D.③①④②
A
A
5、食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是( )
①除去热水瓶中的水垢;②鉴别食盐和纯碱;③检验鸡蛋壳能否溶于酸
A.①② B.①③ C.① D.①②③
D
复分解反应的概念
生活中常见的盐
两种化合物互相交换成分,生成另外两种化合物的反应
复分解反应发生的条件
盐的化学性质
有沉淀生成
有水生成
有气体生成
盐 + 金属 = 新盐 + 新金属
盐 + 酸 = 新盐 + 新酸
盐 + 碱 = 新盐 + 新碱
盐 + 盐 = 新盐 + 新盐
课题1 生活中常见的盐
第2课时
请同学们回忆:写出上节课的三个化学方程式
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl=NaCl+H2O+CO2↑
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
1.碳酸钠与稀盐酸反应;
2.碳酸氢钠与稀盐酸反应;
3.碳酸钠与石灰水反应。
上面三个反应与我们前面所学的化合、分解、置换三种反应有什么不同?这些反应有什么共同特征?请同学们独立思考,交换意见。
1.能识别复分解反应。
2.能认识复分解反应发生的条件和实质。
3.能判断酸、碱、盐之间是否能发生反应
4.能概括盐的化学性质。
CaCO3 + 2HCl == CaCl2 + H2CO3
Na2CO3 + 2HCl == 2NaCl + H2CO3
NaHCO3 + HCl == NaCl + H2CO3
Na2CO3 + Ca(OH)2== CaCO3↓ + 2NaOH
化合物
化合物
化合物
化合物
一、复分解反应
+
+
AB + CD → AD + CB
复分解反应:由两种化合物互相交换成分,生成另外两种化合物的反应。
特点:双交换,价不变。
思考:复分解反应发生需要满足怎样的条件?
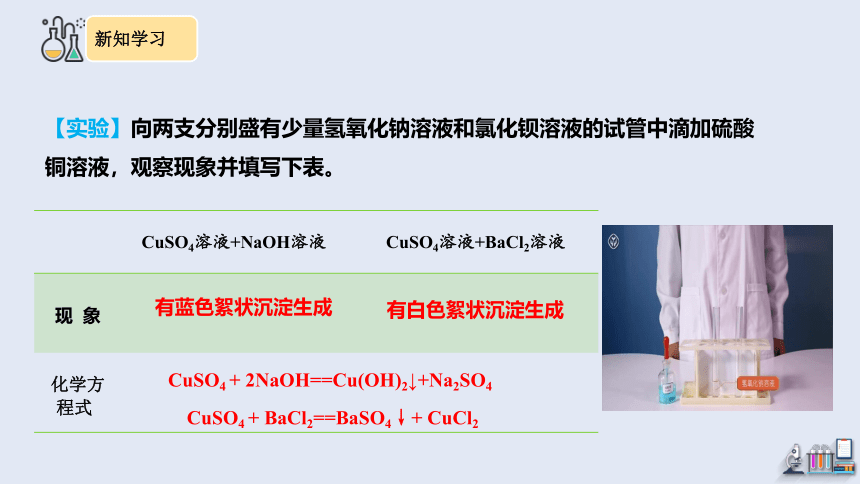
【实验】向两支分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液,观察现象并填写下表。
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现 象
化学方程式 有蓝色絮状沉淀生成
有白色絮状沉淀生成
CuSO4 + 2NaOH==Cu(OH)2↓+Na2SO4
CuSO4 + BaCl2==BaSO4↓+ CuCl2
讨论:1. 上述两个反应是否属于复分解反应?观察到的现象有什么共同之处?
2. 前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物中,相同的生成物是什么?
3. 碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到的共同现象是什么?
有沉淀生成
有水生成
有气体生成
思考:复分解反应发生的条件是什么呢???
实验现象及结论:
BaCl2+H2SO4==BaSO4↓ +2HCl
2NaOH+H2SO4==Na2SO4 + 2H2O
Na2CO3+H2SO4==Na2SO4 + H2O + CO2↑
BaCl2+ Na2CO3==BaCO3↓ + 2NaCl
BaCl2+ NaOH ==不反应
Na2CO3 + NaOH ==不反应
有白色沉淀生成
有水生成
有气体生成
有白色沉淀生成
复分解反应发生的条件
①生成水;②生成气体;③生成沉淀。(满足一条即可)
思考:复分解反应发生的条件是什么呢???
实验现象及结论:
BaCl2+H2SO4==BaSO4↓ +2HCl
2NaOH+H2SO4==Na2SO4 + 2H2O
Na2CO3+H2SO4==Na2SO4 + H2O + CO2↑
BaCl2+ Na2CO3==BaCO3↓ + 2NaCl
BaCl2+ NaOH ==不反应
Na2CO3 + NaOH ==不反应
有白色沉淀生成
有水生成
有气体生成
有白色沉淀生成
复分解反应发生的条件
①生成水;②生成气体;③生成沉淀。(满足一条即可)
OH- NO3- Cl- SO42- CO32-
H+ 溶、挥 溶、挥 溶 溶、挥
NH4+ 溶、挥 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 不 不
Ca2+ 微 溶 溶 微 不
Mg2+ 不 溶 溶 溶 微
Al3+ 不 溶 溶 溶 ——
Mn2+ 不 溶 溶 溶 不
Zn2+ 不 溶 溶 溶 不
Fe2+ 不 溶 溶 溶 不
Fe3+ 不 溶 溶 溶 ——
Cu2+ 不 溶 溶 溶 ——
Ag+ —— 溶 不 微 不
酸、碱、盐的溶解性(20℃)
【探究】某些酸、碱、盐之间是否发生反应
1. 根据复分解反应发生的条件,并利用有关酸、碱、盐溶解性的信息,判断稀硫酸与下表中的四种化合物的溶液之间是否能发生反应。
NaOH NaCl K2CO3 Ba(NO3)2
稀硫酸
判断依据
反应
不反应
反应
反应
有水生成
无水、气体或沉淀生成
有CO2气体生成
有BaSO4
沉淀生成
NaOH NaCl K2CO3 Ba(NO3)2
设计实验
向盛有NaOH溶液的试管中滴加2~3滴酚酞溶液,然后滴加稀硫酸,观察现象,若原溶液中红色褪去,则可判断发生了反应
将稀硫酸和NaCl溶液混合于试管中,
观察现象,若无明显变化,则可判断没有发生反应
将稀硫酸和K2CO3溶液混合于试管中,观察现象,若有无色气体生成,该气体能使澄清石灰水变浑浊,则可判断发生了反应
将稀硫酸和
Ba(NO3)2
溶液混合于试管中,观察现象,若有白色沉淀生成,则可判断发生了反应
2. 设计实验证明你的判断。
H+、Cl-
Na+、CO3 2-
Na+、Cl-
反应前
反应后
溶液中离子种类发生改变
2HCl+Na2CO3 ——
2NaCl + H2O+CO2↑
——
复分解反应发生时的离子变化
K2SO4 + NaNO3
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na2SO4 + KNO3 ——
Na+、NO3-
溶液中离子种类没发生改变
反应前
反应后
√
实质
——
二、盐的化学性质
1.盐 + 金属→新盐 + 新金属
反应条件:
①参加反应的盐必须溶于水;
②“前换后”(或说“强换弱”):即在金属活动性顺序表中,排在前面的金属能把排在后面的金属从其盐溶液中置换出来(除K、Ca、Na外)。
③K、Ca、Na 在盐溶液中一般先容易与水反应。
2.盐 + 酸→新盐 + 新酸
3.盐 + 碱→新盐 + 新碱
4.盐 + 盐→新盐 + 新盐
我国制碱工业的先驱——侯德榜
在中国化学工业史上,有一位杰出的科学家,他为祖国的化学工业事业奋斗终生,并以独创的制碱工艺闻名于世界,他就像一块坚硬的基石,托起了中国现代化学工业的大厦,这位先驱者就是被称为“国宝”的侯德榜。 侯德榜一生在化工技术上有三大贡献。第一,揭开了苏尔维法的秘密。第二,创立了中国人自己的制碱工艺——侯氏制碱法。第三,就是他为发展小化肥(氮肥)工业所做的贡献。
NH3+CO2+H2O +NaCl ==NaHCO3↓+NH4Cl
原理:将二氧化碳通入氨水的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠析出。
NH3+CO2+H2O ==NH4HCO3
NH4HCO3+NaCl ==NaHCO3↓+NH4Cl
总反应:
2NaHCO3 ===Na2CO3+H2O+CO2↑
△
1、下列化学反应属于复分解反应的是( )
A、Zn+H2SO4=ZnSO4+H2↑ B、2KMnO4==K2MnO4+MnO2+O2↑
C、CaO+H2O=Ca(OH)2 D、CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
D
2、化学反应要符合一定的原理和条件,下列认识正确的是( )
A.化合反应和分解反应一定有单质参加或生成
B.置换反应只能发生在金属与金属的化合物之间
C.复分解反应要有沉淀或气体或水生成
D.有盐和水生成的反应一定是中和反应
C
3、下列各组离子在溶液中能大量共存的是( )
A.K+、SO42﹣、NO3﹣ B.NH4+、OH﹣、Cl﹣
C.Cu2+、Na+、OH﹣ D.Ca2+、K+、CO32﹣
4、若不用其他试剂,而用最简便的方法鉴别下列四种溶液:①硫酸镁溶液
②氢氧化钾溶液 ③硫酸铜溶液 ④氯化钠溶液。鉴别的正确顺序是( )
A.③②①④ B.④③②① C.①②③④ D.③①④②
A
A
5、食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是( )
①除去热水瓶中的水垢;②鉴别食盐和纯碱;③检验鸡蛋壳能否溶于酸
A.①② B.①③ C.① D.①②③
D
复分解反应的概念
生活中常见的盐
两种化合物互相交换成分,生成另外两种化合物的反应
复分解反应发生的条件
盐的化学性质
有沉淀生成
有水生成
有气体生成
盐 + 金属 = 新盐 + 新金属
盐 + 酸 = 新盐 + 新酸
盐 + 碱 = 新盐 + 新碱
盐 + 盐 = 新盐 + 新盐
同课章节目录
