【全程复习方略】2015年春高中化学选修四(苏教)多媒体教学优质课件:专题2 第三单元 化学平衡的移动(共32张PPT)
文档属性
| 名称 | 【全程复习方略】2015年春高中化学选修四(苏教)多媒体教学优质课件:专题2 第三单元 化学平衡的移动(共32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-05-27 16:17:29 | ||
图片预览








文档简介
课件32张PPT。第三单元 化学平衡的移动 下图是二氧化氮在常温、热水、冰水中颜色变化的
情况,常温时是红棕色,加热时颜色变深,降温时
颜色变浅。
【思考】(1)为什么会出现这种现象呢?
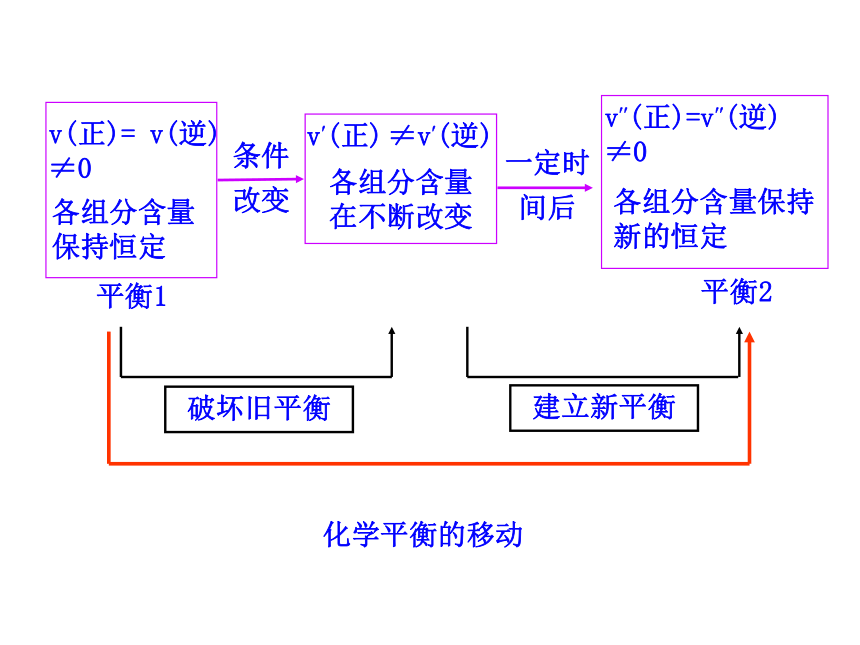
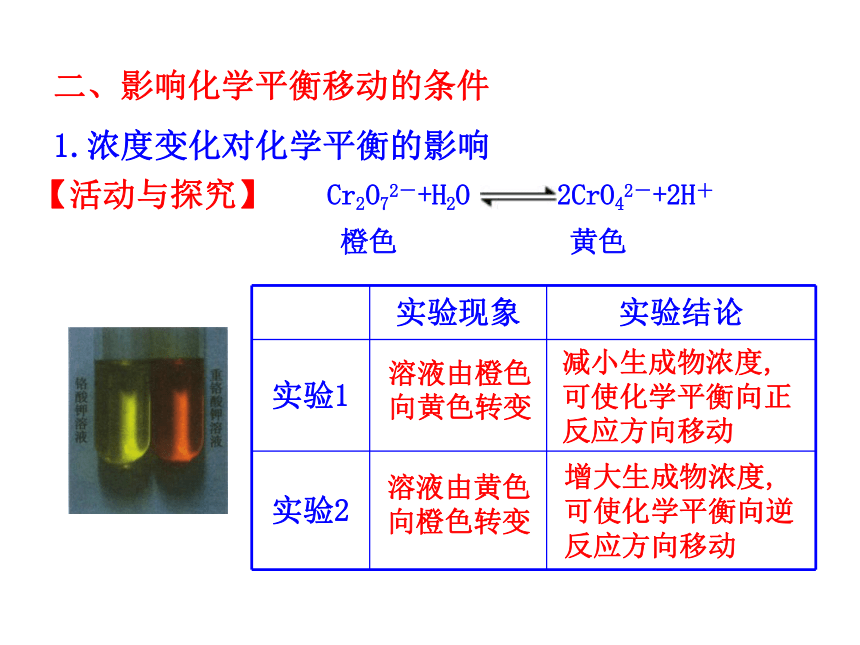
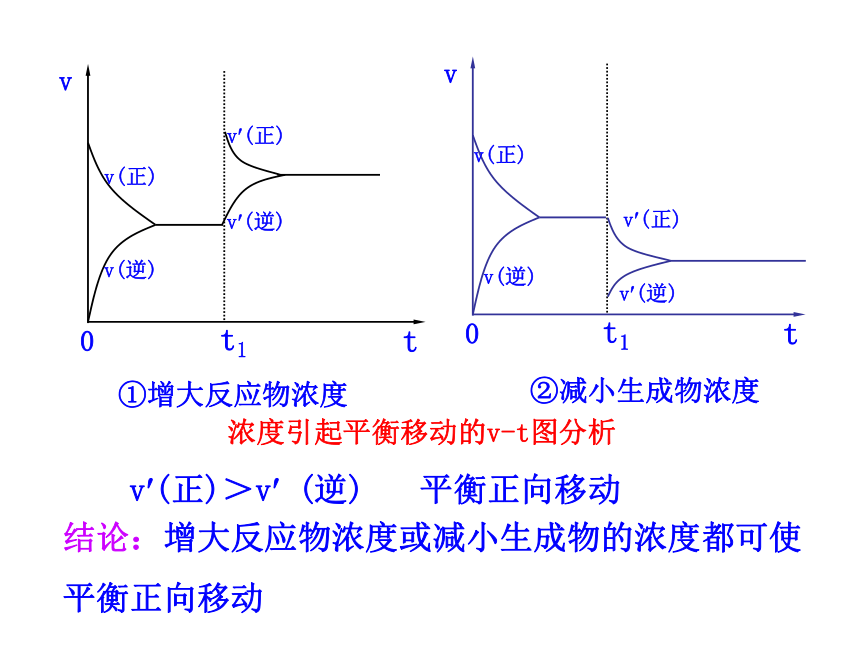
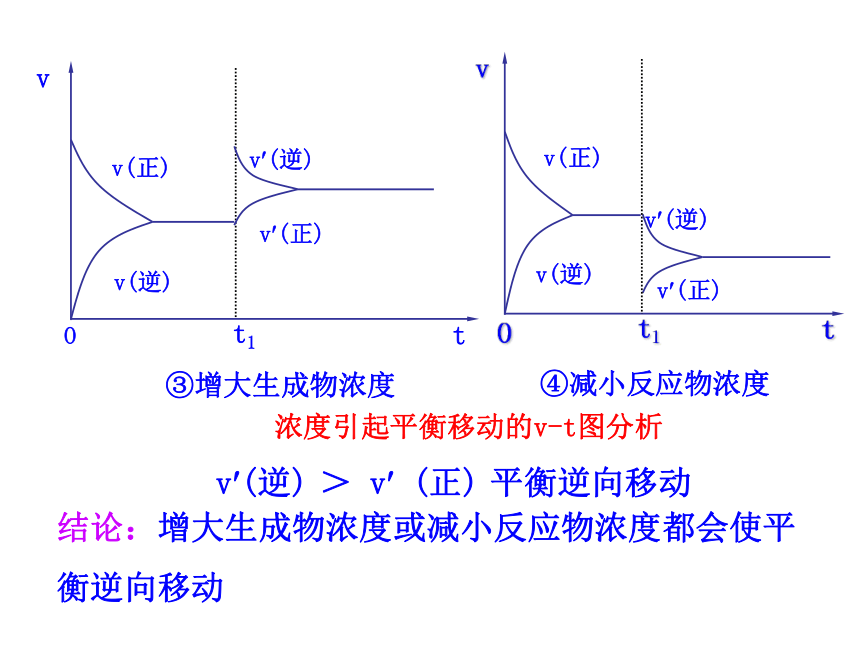
(2)化学平衡受哪些因素的影响呢?1.理解化学平衡的概念,使学生理解浓度、压强、温度、催化剂对化学平衡的影响。(重点)2.理解化学平衡移动原理,并能用平衡移动原理的观点解释有关的化学现象。(难点)回忆:一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。v(逆)思考:当条件改变,使v(正)≠ v(逆),会怎样呢? 化学平衡的移动1.概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。一、化学平衡移动2.研究对象:已建立平衡状态的可逆反应3.平衡移动的本质原因:v?(正) ≠v?(逆) 【思考】如何通过改变条件来打破旧平衡呢? 可以通过改变能影响反应速率的条件来打破原有平衡,建立新平衡。二、影响化学平衡移动的条件Cr2O72-+H2O 2CrO42-+2H+橙色 黄色溶液由橙色向黄色转变溶液由黄色向橙色转变减小生成物浓度,可使化学平衡向正反应方向移动增大生成物浓度,可使化学平衡向逆反应方向移动1.浓度变化对化学平衡的影响【活动与探究】浓度引起平衡移动的v-t图分析①增大反应物浓度②减小生成物浓度结论:增大反应物浓度或减小生成物的浓度都可使平衡正向移动v?(正)>v? (逆) 平衡正向移动③增大生成物浓度v(逆)v(正)④减小反应物浓度v(正)v(逆)浓度引起平衡移动的v-t图分析结论:增大生成物浓度或减小反应物浓度都会使平衡逆向移动v?(逆) > v? (正) 平衡逆向移动结论:其他条件不变的情况下①增大反应物浓度,v(正)>v(逆),平衡向正方向移动②减小生成物浓度,v(正)>v(逆),平衡向正方向移动③增大生成物浓度,v(正)<v(逆),平衡向逆方向移动④减小反应物浓度,v(正)<v(逆),平衡向逆方向移动2.压强变化对化学平衡的影响(1)增大压强,对于有气体参加和气体生成的化学反应来讲,由于缩小了体积,气体的浓度增大,提高了反应速率。(2)若两边都有气体,则改变压强同时改变正逆反应速率:当反应前后分子数目不同时,速率改变的倍数不一样,分子数目多的一侧速率改变的倍数大; 当反应前后体积相同时,增大倍数相同。增大压强,则 a﹥1若 m+n﹥p+q ,则Q﹤ K ,平衡正向移动。若 m+n﹤p+q ,则Q﹥ K ,平衡逆向移动。若 m+n=p+q ,则Q=K ,平衡不发生移动。减小压强,则 a﹤1若 m+n﹥p+q ,则Q﹥ K ,平衡逆向移动。若 m+n﹤p+q ,则Q﹤ K ,平衡正向移动。若 m+n=p+q ,则Q=K ,平衡不发生移动。压强引起平衡移动的相关v-t图分析m A (g)+ nB(g) pC(g)+qD (g)a.当m+n>p+q时,即正方向气体分子数目减少v? (逆) > v? (正) 平衡逆向移动v?(正)>v? (逆) 平衡正向移动b.当m+n<p+q时,即正方向气体分子数目增多压强引起平衡移动的相关v-t图分析mA(g) +nB(g) pC(g)+qD(g)v? (逆) > v? (正)平衡逆向移动v?(正)>v? (逆)平衡正向移动c.当m+n=p+q时,即气体分子数目不变压强引起平衡移动的相关v-t图分析mA(g)+nB (g) pC(g)+qD(g)v?(正) =v?(逆) 平衡不移动3.温度变化对化学平衡的影响溶液变蓝溶液变粉红色平衡向正反应
方向移动平衡向逆反应
方向移动【活动与探究】 温度的改变对正逆反应速率都会产生影响,但影响的程度不同,温度的变化对向吸热反应方向进行的速率的影响比对向放热反应方向进行的速率影响大。具体表现在:升高温度,正、逆反应速率都增大,但增大的倍数不一样,向吸热反应方向进行的速率增大的倍数大。降低温度,正、逆反应速率都减小,但降低的倍数不一样,向吸热反应方向进行的速率降低的倍数大。温度变化对化学平衡的影响2NO2 N2O4△ H < 0v吸 > v放 平衡向吸热方向移动结论:其他条件不变,升高温度,平衡向吸热反应方向移动温度引起平衡移动的相关v-t图分析温度变化对化学平衡的影响温度引起平衡移动的相关v-t图分析v放>v吸 平衡向放热反应方向移动2NO2 N2O4△ H < 0结论:其他条件不变,降低温度平衡向放热反应方向移动注意:温度的变化一定会影响化学平衡,使平衡发生移动。结论:在其他条件不变时,温度升高,会使化学平衡向吸热反应的方向移动,温度降低会使化学平衡向放热反应的方向移动。 催化剂同等程度的改变正、逆反应速率[v′(正)=v′(逆)] 使用催化剂,对化学平衡无影响。使用催化剂能缩短平衡到达的时间。4.使用催化剂对化学平衡的影响增大反应物浓度
减小生成物浓度向正方向移动,即向减小反应物的浓度,增大生成物浓度方向移动减小反应物浓度
增大生成物浓度向逆方向移动,即向增大反应物的浓度,减小生成物浓度方向移动增 大 压 强向气体分子数目减少的方向移动减 小 压 强向气体分子数目增多的方向移动升 高 温 度向吸热反应方向移动向放热反应方向移动降 低 温 度三、化学平衡移动原理——勒夏特列原理 如果改变影响平衡的一个条件(如浓度、温度或压强等),平衡就向能够减弱这种改变的方向移动。注意:①是“减弱”这种改变,不是“消除”这种改变。
②只有单个条件改变,才能应用(多个条件改变就要具体问题具体分析)。
③勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析。 勒夏特列原理应用:判断下列现象能否用勒夏特列原理解释
1.新制氯水长时间放置后,颜色变浅
2.用饱和食盐水除Cl2中的HCl比用水好
3.可用浓氨水和碱石灰(NaOH固体)快速制取NH3
4.打开啤酒瓶盖,有大量气泡产生
5.加催化剂,使N2和H2在一定条件下转化为NH3√√√√3.化学平衡移动的原理——勒夏特列原理1. 在密闭容器中,在一定条件下,进行下列反应:NO(g) + CO(g) 1/2N2(g) + CO2(g);△H =
- 373.2 kJ/mol,达到平衡后,为提高该反应的速
率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强B2.(双选)据某可逆反应绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
A.反应物中一定有气体
B.生成物中一定有气体
C.正反应一定是放热反应
D.正反应一定是吸热反应BD 3.(双选)在一密闭容器中,反应 mA(s)+nB(g)
pC(g),达到平衡时,测得c(C)为0.5 mol·L-1;
在温度不变的条件下,将容器体积扩大一倍,当达到
平衡时,测得c(C)为0.3 mol·L-1。则下列判断正确
的是( )
A.化学计量数:m+n﹥p
B.平衡向正反应方向移动了
C.物质B的转化率减小了
D.物质C的质量分数增加了BD4.(2013·四川高考)在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) 2Z(g) △H<0, 一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是( )
A.反应前2min的平均速率ν(Z)=2.0×10-3
mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前
ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分
数增大 C 我们总是梦想着天边的一座奇妙的玫瑰园,而不去欣赏今天就开在我们窗口的玫瑰。
情况,常温时是红棕色,加热时颜色变深,降温时
颜色变浅。
【思考】(1)为什么会出现这种现象呢?
(2)化学平衡受哪些因素的影响呢?1.理解化学平衡的概念,使学生理解浓度、压强、温度、催化剂对化学平衡的影响。(重点)2.理解化学平衡移动原理,并能用平衡移动原理的观点解释有关的化学现象。(难点)回忆:一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。v(逆)思考:当条件改变,使v(正)≠ v(逆),会怎样呢? 化学平衡的移动1.概念:改变外界条件,破坏原有的平衡状态,建立起新的平衡状态的过程。一、化学平衡移动2.研究对象:已建立平衡状态的可逆反应3.平衡移动的本质原因:v?(正) ≠v?(逆) 【思考】如何通过改变条件来打破旧平衡呢? 可以通过改变能影响反应速率的条件来打破原有平衡,建立新平衡。二、影响化学平衡移动的条件Cr2O72-+H2O 2CrO42-+2H+橙色 黄色溶液由橙色向黄色转变溶液由黄色向橙色转变减小生成物浓度,可使化学平衡向正反应方向移动增大生成物浓度,可使化学平衡向逆反应方向移动1.浓度变化对化学平衡的影响【活动与探究】浓度引起平衡移动的v-t图分析①增大反应物浓度②减小生成物浓度结论:增大反应物浓度或减小生成物的浓度都可使平衡正向移动v?(正)>v? (逆) 平衡正向移动③增大生成物浓度v(逆)v(正)④减小反应物浓度v(正)v(逆)浓度引起平衡移动的v-t图分析结论:增大生成物浓度或减小反应物浓度都会使平衡逆向移动v?(逆) > v? (正) 平衡逆向移动结论:其他条件不变的情况下①增大反应物浓度,v(正)>v(逆),平衡向正方向移动②减小生成物浓度,v(正)>v(逆),平衡向正方向移动③增大生成物浓度,v(正)<v(逆),平衡向逆方向移动④减小反应物浓度,v(正)<v(逆),平衡向逆方向移动2.压强变化对化学平衡的影响(1)增大压强,对于有气体参加和气体生成的化学反应来讲,由于缩小了体积,气体的浓度增大,提高了反应速率。(2)若两边都有气体,则改变压强同时改变正逆反应速率:当反应前后分子数目不同时,速率改变的倍数不一样,分子数目多的一侧速率改变的倍数大; 当反应前后体积相同时,增大倍数相同。增大压强,则 a﹥1若 m+n﹥p+q ,则Q﹤ K ,平衡正向移动。若 m+n﹤p+q ,则Q﹥ K ,平衡逆向移动。若 m+n=p+q ,则Q=K ,平衡不发生移动。减小压强,则 a﹤1若 m+n﹥p+q ,则Q﹥ K ,平衡逆向移动。若 m+n﹤p+q ,则Q﹤ K ,平衡正向移动。若 m+n=p+q ,则Q=K ,平衡不发生移动。压强引起平衡移动的相关v-t图分析m A (g)+ nB(g) pC(g)+qD (g)a.当m+n>p+q时,即正方向气体分子数目减少v? (逆) > v? (正) 平衡逆向移动v?(正)>v? (逆) 平衡正向移动b.当m+n<p+q时,即正方向气体分子数目增多压强引起平衡移动的相关v-t图分析mA(g) +nB(g) pC(g)+qD(g)v? (逆) > v? (正)平衡逆向移动v?(正)>v? (逆)平衡正向移动c.当m+n=p+q时,即气体分子数目不变压强引起平衡移动的相关v-t图分析mA(g)+nB (g) pC(g)+qD(g)v?(正) =v?(逆) 平衡不移动3.温度变化对化学平衡的影响溶液变蓝溶液变粉红色平衡向正反应
方向移动平衡向逆反应
方向移动【活动与探究】 温度的改变对正逆反应速率都会产生影响,但影响的程度不同,温度的变化对向吸热反应方向进行的速率的影响比对向放热反应方向进行的速率影响大。具体表现在:升高温度,正、逆反应速率都增大,但增大的倍数不一样,向吸热反应方向进行的速率增大的倍数大。降低温度,正、逆反应速率都减小,但降低的倍数不一样,向吸热反应方向进行的速率降低的倍数大。温度变化对化学平衡的影响2NO2 N2O4△ H < 0v吸 > v放 平衡向吸热方向移动结论:其他条件不变,升高温度,平衡向吸热反应方向移动温度引起平衡移动的相关v-t图分析温度变化对化学平衡的影响温度引起平衡移动的相关v-t图分析v放>v吸 平衡向放热反应方向移动2NO2 N2O4△ H < 0结论:其他条件不变,降低温度平衡向放热反应方向移动注意:温度的变化一定会影响化学平衡,使平衡发生移动。结论:在其他条件不变时,温度升高,会使化学平衡向吸热反应的方向移动,温度降低会使化学平衡向放热反应的方向移动。 催化剂同等程度的改变正、逆反应速率[v′(正)=v′(逆)] 使用催化剂,对化学平衡无影响。使用催化剂能缩短平衡到达的时间。4.使用催化剂对化学平衡的影响增大反应物浓度
减小生成物浓度向正方向移动,即向减小反应物的浓度,增大生成物浓度方向移动减小反应物浓度
增大生成物浓度向逆方向移动,即向增大反应物的浓度,减小生成物浓度方向移动增 大 压 强向气体分子数目减少的方向移动减 小 压 强向气体分子数目增多的方向移动升 高 温 度向吸热反应方向移动向放热反应方向移动降 低 温 度三、化学平衡移动原理——勒夏特列原理 如果改变影响平衡的一个条件(如浓度、温度或压强等),平衡就向能够减弱这种改变的方向移动。注意:①是“减弱”这种改变,不是“消除”这种改变。
②只有单个条件改变,才能应用(多个条件改变就要具体问题具体分析)。
③勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析。 勒夏特列原理应用:判断下列现象能否用勒夏特列原理解释
1.新制氯水长时间放置后,颜色变浅
2.用饱和食盐水除Cl2中的HCl比用水好
3.可用浓氨水和碱石灰(NaOH固体)快速制取NH3
4.打开啤酒瓶盖,有大量气泡产生
5.加催化剂,使N2和H2在一定条件下转化为NH3√√√√3.化学平衡移动的原理——勒夏特列原理1. 在密闭容器中,在一定条件下,进行下列反应:NO(g) + CO(g) 1/2N2(g) + CO2(g);△H =
- 373.2 kJ/mol,达到平衡后,为提高该反应的速
率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强B2.(双选)据某可逆反应绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是( )
A.反应物中一定有气体
B.生成物中一定有气体
C.正反应一定是放热反应
D.正反应一定是吸热反应BD 3.(双选)在一密闭容器中,反应 mA(s)+nB(g)
pC(g),达到平衡时,测得c(C)为0.5 mol·L-1;
在温度不变的条件下,将容器体积扩大一倍,当达到
平衡时,测得c(C)为0.3 mol·L-1。则下列判断正确
的是( )
A.化学计量数:m+n﹥p
B.平衡向正反应方向移动了
C.物质B的转化率减小了
D.物质C的质量分数增加了BD4.(2013·四川高考)在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应
X(g)+Y(g) 2Z(g) △H<0, 一段时间后达到平衡,反应过程中测定的数据如下表:下列说法正确的是( )
A.反应前2min的平均速率ν(Z)=2.0×10-3
mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前
ν(逆)>ν(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2molZ,平衡时X的体积分
数增大 C 我们总是梦想着天边的一座奇妙的玫瑰园,而不去欣赏今天就开在我们窗口的玫瑰。
