2023-2024学年人教版高中化学必修二 8.2 探究亚硝酸钠的性质 课件(共25张PPT)
文档属性
| 名称 | 2023-2024学年人教版高中化学必修二 8.2 探究亚硝酸钠的性质 课件(共25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-31 00:00:00 | ||
图片预览







文档简介
(共25张PPT)
探究亚硝酸钠的性质
生活情境
知识卡片——认识亚硝酸钠
白色或淡黄色晶体、有咸味、易溶于水。熔点为271℃
亚硝酸钠
氯化钠
白色固体、有咸味、易溶于水。熔点为801℃
学生活动1:
请利用价类二维图预测亚硝酸钠可能具有的化学性质。
已知:25 ℃ 时,Ka(HNO2)=5.6×10-4 ,
Ksp(AgNO2)=5.86×10-4
环节一:预测亚硝酸钠的化学性质
学生活动2:
环节二:探究亚硝酸钠的化学性质
请根据所给试剂讨论并设计实验方案,进行实验,完成实验报告。
化学试剂:NaNO2溶液、酸性KMnO4溶液、FeSO4溶液、KSCN溶液、稀硫酸、KI-淀粉试纸、AgNO3溶液、稀硝酸。
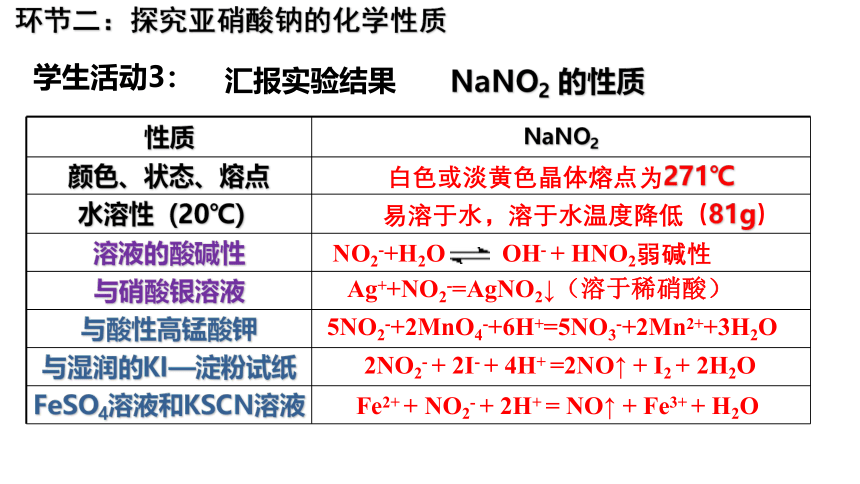
学生活动3:
环节二:探究亚硝酸钠的化学性质
汇报实验结果
性质 NaNO2
颜色、状态、熔点 白色或淡黄色晶体熔点为271℃
水溶性(20℃) 易溶于水,溶于水温度降低(81g)
溶液的酸碱性
与硝酸银溶液
与酸性高锰酸钾
与湿润的KI—淀粉试纸
FeSO4溶液和KSCN溶液
Ag++NO2-=AgNO2↓(溶于稀硝酸)
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O
2NO2- + 2I- + 4H+ =2NO↑ + I2 + 2H2O
Fe2+ + NO2- + 2H+ = NO↑ + Fe3+ + H2O
NaNO2 的性质
NO2-+H2O OH- + HNO2弱碱性
环节三:实际应用
问题情境1:肉类零食为什么要加亚硝酸钠?
环节三:实际应用
【知识卡片】亚硝酸钠的用途
亚硝酸钠在工业生产中有重要的用途,亚硝酸钠用于纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域,它还广泛用作防锈剂,是建筑业常用的一种混凝土添加剂,也常用于鱼类、肉类等食品的染色和防腐。
环节三:实际应用
问题情境2:亚硝酸钠外观与食盐相似,且均有咸味,你可以用哪些方法区分亚硝酸钠和氯化钠?
问题情境3:误食亚硝酸钠可能导致全身发紫,呼吸困难,呕吐等症状,请你运用学到的知识分析中毒原理和解毒方法。
学生活动4:思考与讨论下列问题
环节三:实际应用
问题情境2:亚硝酸钠外观与食盐相似,且均有咸味,你可以用哪些方法区分亚硝酸钠和氯化钠?
KI-淀粉试纸、稀硫酸
硫酸亚铁溶液和硫氰化钾溶液
测水溶液的pH
固体可以观察外观或加热
环节三:实际应用
小百科
苹果中的多酚类物质在多酚氧化酶的作用下能被空气中的氧气氧化为醌类而变褐色。
滴加有亚硝酸钠溶液的苹果表面快速变成褐色
静置1min
静置5min
静置10min
中毒机理:亚硝酸钠能将血红蛋白氧化为高铁血红蛋白(Fe2+变成了Fe3+).高铁血红蛋白不能携带氧,因此造成人体缺氧中毒。
解毒方法:催吐,洗胃(高锰酸钾),维C,血液清洗。
环节三:实际应用
问题情境3:误食亚硝酸钠可能导致全身发紫,呼吸困难,呕吐等症状,请你运用学到的知识分析中毒原理和解毒方法。
环节四:课堂小结
价类观或原子结构预测物质性质
设计实验方案进行实验探究
研究物质性质的一般思路
分析实验现象得出实验结果
性质决定用途(物质的实际应用)
非氧化还原反应:沉淀、水解、气体
氧化还原反应
当堂检测
1.工业废水中含有亚硝酸盐,以氯化铵处理亚硝酸盐的新工艺已在工业上广泛使用。该反应的生成物不会给环境带来任何污染,写出反应的离子方程式。
NH4++NO2- = N2↑ + 2H2O
2NO2-+ CO(NH2)2 +2H+=CO2 ↑ +2N2↑+3H2O
当堂检测
2. NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+ ,可服用维生素C解毒。关于该过程的叙述,不正确的是________(填字母)。
A.亚硝酸钠的氧化性强于Fe3+ B.维生素C是还原剂
C.维生素C的还原性强于Fe2+ D.亚硝酸钠是还原剂
D
学习资源
一、亚硝酸钠
亚硝酸钠,化学式为NaNO2,通常为白色或者略微带淡黄色,呈颗粒或者粉末状,略微带有咸味,外观上与家里的食盐很相似(如图1),因此很容易造成误用。其熔点为271 ℃,分解温度为320 ℃。亚硝酸钠是一种强氧化剂,进入血液之后,其常会与血红蛋白结合,使血红蛋白转变成高铁血红蛋白,高铁血红蛋白不能够携带氧气,从而导致体内组织缺氧,进而使人体发生缺氧中毒。
亚硝酸钠在建筑业中常用作混凝土掺加剂,以促进混凝土凝固,提高其强度,防止在冬天低温施工时混凝土发生冻结。亚硝酸钠也是一种食品添加剂被允许加到肉制品加工中,亚硝酸钠可以增加肉类的鲜度,能够抑制微生物的生长,同时还可以保持肉类的结构和营养价值。
(图1:亚硝酸钠 氯化钠)
亚硝酸钠是一种常用的护色剂,原料肉的红色来自其中的肌红蛋白(Mb)和血红蛋白(Hb),以肌红蛋白为主。鲜肉中为还原型肌红蛋白[含有Fe(Ⅱ)],呈暗紫色,在空气中与氧结合后形成氧合肌红蛋白,色泽鲜红。当进一步氧化时则形成氧化型肌红蛋白[含有Fe(Ⅲ)]而呈褐色。在肉类食品加工时添加少量硝酸盐、亚硝酸盐,硝酸盐可以在细菌的作用下生成亚硝酸盐,亚硝酸盐在乳酸等作用下生成亚硝酸。亚硝酸不稳定,分解产生的NO可与肌红蛋白结合,生成亮红色的MbNO。
强制性国家标准对于亚硝酸钠的含量也有明确的要求,如肉制品生产过程单独使用需要小于0.15 g/kg;成品残留量需要小于30 mg/kg。亚硝酸盐广泛存在于自然环境之中,尤其是在食物中,例如大米,面粉,豆类等食物中都能测出一定含量的亚硝酸盐。正常情况下,日常饮食所摄入的亚硝酸盐会随着人体代谢而排出体内。如果一次性摄入300 mg就会引起中毒,当一次性摄入亚硝酸盐的含量大于3 g,就会导致人体死亡。
二、几种常见的高含量亚硝酸盐食物
日常生活中,亚硝酸钠并不少见,亚硝酸钠广泛存在于我们日常的饮食和饮水中,下面介绍几种生活中常见的高含量亚硝酸盐食物。
1.新制腌菜含亚硝酸盐含量较高。
蔬菜在生长的过程中会吸收土壤之中及化肥中的氮元素,氮在蔬菜中主要以硝酸盐的形式存在,在腌制时,细菌会将蔬菜内部的硝酸盐转化为亚硝酸盐。腌菜中的亚硝酸盐含量呈现先升高后降低的过程5,至少需要腌制20天后食用,此时的风味最佳。
2.吃剩后的隔夜菜。未吃完的隔夜菜也会产生亚硝酸盐,这是因为在吃菜时筷子搅来搅去,将菜中的细菌与蔬菜充分混匀,从而能使能够将硝酸盐转化为亚硝酸盐的细菌大量繁殖,因此放的时间越长,产生的亚硝酸盐含量也越高。
3.久煮火锅汤。肉类和蔬菜中的硝酸盐会溶解在汤中,在长时间的滚烫的沸水中硝酸盐很容易转变成为亚硝酸盐,其中的一部分还会和肉、海鲜等中的蛋白质分解产物合成亚硝胺(亚硝胺是强致癌物,是最重要的化学致癌物之一,是四大食品污染物之一,被誉为致癌的“隐形杀手”),从而使汤的危险性增加。
4.粉嫩的熟肉。肉中加入亚硝酸盐后,煮熟后可以让熟肉看起来颜色更加粉嫩红润、口感也更加鲜嫩,同时还可以延长食品保质期。大多数烧烤肉制品、羊肉串等几乎都会加入亚硝酸盐。
三、食品中亚硝酸盐的测定方法
1.高锰酸钾滴定法。
该方法根据高锰酸钾与亚硝酸钠的化学方程式:2KMnO4 +5NaNO2 +3H2SO4 =Na2SO4 +2MnSO4 +5NaNO3+3H2O。在酸性条件下,高锰酸钾可以将亚硝酸钠氧化为硝酸钠,当反应完全后,微微过量的高锰酸钾溶液即可使溶液变红,从而指示终点。依据公式,即可求得其中亚硝酸盐含量。
2.固体格氏试剂快速测定食品的亚硝酸盐。
固体格氏试剂指的是以一定比例的盐酸1-萘胺、对氨基苯磺酸及酒石酸研成的粉末。该方法利用亚硝酸盐在酸性条件下与对氨基苯磺酸发生重氮化反应,生成的重氮化合物进而与α-萘胺耦合,生成一种红色偶氮染料,该偶氮染料的颜色与亚硝酸盐含量成正比。借助分光光度计测量,通过所得的数据进一步线性拟合,通过线性回归方程测量出试样中的亚硝酸盐含量。
3.盐酸萘乙二胺半定量、定量测定食品中亚硝酸盐。
该方法样品首先沉淀蛋白质,除去脂肪后在pH 2.5~3.5(酸性条件下),亚硝酸盐与对氨基苯磺酸发生重氮化后,和盐酸萘乙二胺进行偶合,偶合后呈现偶氮色素的红紫色(如图3), 通过外标法测得亚硝酸盐含量。
运用化学知识,科学合理使用
谢 谢 !
探究亚硝酸钠的性质
生活情境
知识卡片——认识亚硝酸钠
白色或淡黄色晶体、有咸味、易溶于水。熔点为271℃
亚硝酸钠
氯化钠
白色固体、有咸味、易溶于水。熔点为801℃
学生活动1:
请利用价类二维图预测亚硝酸钠可能具有的化学性质。
已知:25 ℃ 时,Ka(HNO2)=5.6×10-4 ,
Ksp(AgNO2)=5.86×10-4
环节一:预测亚硝酸钠的化学性质
学生活动2:
环节二:探究亚硝酸钠的化学性质
请根据所给试剂讨论并设计实验方案,进行实验,完成实验报告。
化学试剂:NaNO2溶液、酸性KMnO4溶液、FeSO4溶液、KSCN溶液、稀硫酸、KI-淀粉试纸、AgNO3溶液、稀硝酸。
学生活动3:
环节二:探究亚硝酸钠的化学性质
汇报实验结果
性质 NaNO2
颜色、状态、熔点 白色或淡黄色晶体熔点为271℃
水溶性(20℃) 易溶于水,溶于水温度降低(81g)
溶液的酸碱性
与硝酸银溶液
与酸性高锰酸钾
与湿润的KI—淀粉试纸
FeSO4溶液和KSCN溶液
Ag++NO2-=AgNO2↓(溶于稀硝酸)
5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O
2NO2- + 2I- + 4H+ =2NO↑ + I2 + 2H2O
Fe2+ + NO2- + 2H+ = NO↑ + Fe3+ + H2O
NaNO2 的性质
NO2-+H2O OH- + HNO2弱碱性
环节三:实际应用
问题情境1:肉类零食为什么要加亚硝酸钠?
环节三:实际应用
【知识卡片】亚硝酸钠的用途
亚硝酸钠在工业生产中有重要的用途,亚硝酸钠用于纤维纺织品的染色和漂白、照相、生产橡胶、制药等领域,它还广泛用作防锈剂,是建筑业常用的一种混凝土添加剂,也常用于鱼类、肉类等食品的染色和防腐。
环节三:实际应用
问题情境2:亚硝酸钠外观与食盐相似,且均有咸味,你可以用哪些方法区分亚硝酸钠和氯化钠?
问题情境3:误食亚硝酸钠可能导致全身发紫,呼吸困难,呕吐等症状,请你运用学到的知识分析中毒原理和解毒方法。
学生活动4:思考与讨论下列问题
环节三:实际应用
问题情境2:亚硝酸钠外观与食盐相似,且均有咸味,你可以用哪些方法区分亚硝酸钠和氯化钠?
KI-淀粉试纸、稀硫酸
硫酸亚铁溶液和硫氰化钾溶液
测水溶液的pH
固体可以观察外观或加热
环节三:实际应用
小百科
苹果中的多酚类物质在多酚氧化酶的作用下能被空气中的氧气氧化为醌类而变褐色。
滴加有亚硝酸钠溶液的苹果表面快速变成褐色
静置1min
静置5min
静置10min
中毒机理:亚硝酸钠能将血红蛋白氧化为高铁血红蛋白(Fe2+变成了Fe3+).高铁血红蛋白不能携带氧,因此造成人体缺氧中毒。
解毒方法:催吐,洗胃(高锰酸钾),维C,血液清洗。
环节三:实际应用
问题情境3:误食亚硝酸钠可能导致全身发紫,呼吸困难,呕吐等症状,请你运用学到的知识分析中毒原理和解毒方法。
环节四:课堂小结
价类观或原子结构预测物质性质
设计实验方案进行实验探究
研究物质性质的一般思路
分析实验现象得出实验结果
性质决定用途(物质的实际应用)
非氧化还原反应:沉淀、水解、气体
氧化还原反应
当堂检测
1.工业废水中含有亚硝酸盐,以氯化铵处理亚硝酸盐的新工艺已在工业上广泛使用。该反应的生成物不会给环境带来任何污染,写出反应的离子方程式。
NH4++NO2- = N2↑ + 2H2O
2NO2-+ CO(NH2)2 +2H+=CO2 ↑ +2N2↑+3H2O
当堂检测
2. NaNO2像食盐一样有咸味,毒性很强,误食会导致血红蛋白中的Fe2+转化为Fe3+ ,可服用维生素C解毒。关于该过程的叙述,不正确的是________(填字母)。
A.亚硝酸钠的氧化性强于Fe3+ B.维生素C是还原剂
C.维生素C的还原性强于Fe2+ D.亚硝酸钠是还原剂
D
学习资源
一、亚硝酸钠
亚硝酸钠,化学式为NaNO2,通常为白色或者略微带淡黄色,呈颗粒或者粉末状,略微带有咸味,外观上与家里的食盐很相似(如图1),因此很容易造成误用。其熔点为271 ℃,分解温度为320 ℃。亚硝酸钠是一种强氧化剂,进入血液之后,其常会与血红蛋白结合,使血红蛋白转变成高铁血红蛋白,高铁血红蛋白不能够携带氧气,从而导致体内组织缺氧,进而使人体发生缺氧中毒。
亚硝酸钠在建筑业中常用作混凝土掺加剂,以促进混凝土凝固,提高其强度,防止在冬天低温施工时混凝土发生冻结。亚硝酸钠也是一种食品添加剂被允许加到肉制品加工中,亚硝酸钠可以增加肉类的鲜度,能够抑制微生物的生长,同时还可以保持肉类的结构和营养价值。
(图1:亚硝酸钠 氯化钠)
亚硝酸钠是一种常用的护色剂,原料肉的红色来自其中的肌红蛋白(Mb)和血红蛋白(Hb),以肌红蛋白为主。鲜肉中为还原型肌红蛋白[含有Fe(Ⅱ)],呈暗紫色,在空气中与氧结合后形成氧合肌红蛋白,色泽鲜红。当进一步氧化时则形成氧化型肌红蛋白[含有Fe(Ⅲ)]而呈褐色。在肉类食品加工时添加少量硝酸盐、亚硝酸盐,硝酸盐可以在细菌的作用下生成亚硝酸盐,亚硝酸盐在乳酸等作用下生成亚硝酸。亚硝酸不稳定,分解产生的NO可与肌红蛋白结合,生成亮红色的MbNO。
强制性国家标准对于亚硝酸钠的含量也有明确的要求,如肉制品生产过程单独使用需要小于0.15 g/kg;成品残留量需要小于30 mg/kg。亚硝酸盐广泛存在于自然环境之中,尤其是在食物中,例如大米,面粉,豆类等食物中都能测出一定含量的亚硝酸盐。正常情况下,日常饮食所摄入的亚硝酸盐会随着人体代谢而排出体内。如果一次性摄入300 mg就会引起中毒,当一次性摄入亚硝酸盐的含量大于3 g,就会导致人体死亡。
二、几种常见的高含量亚硝酸盐食物
日常生活中,亚硝酸钠并不少见,亚硝酸钠广泛存在于我们日常的饮食和饮水中,下面介绍几种生活中常见的高含量亚硝酸盐食物。
1.新制腌菜含亚硝酸盐含量较高。
蔬菜在生长的过程中会吸收土壤之中及化肥中的氮元素,氮在蔬菜中主要以硝酸盐的形式存在,在腌制时,细菌会将蔬菜内部的硝酸盐转化为亚硝酸盐。腌菜中的亚硝酸盐含量呈现先升高后降低的过程5,至少需要腌制20天后食用,此时的风味最佳。
2.吃剩后的隔夜菜。未吃完的隔夜菜也会产生亚硝酸盐,这是因为在吃菜时筷子搅来搅去,将菜中的细菌与蔬菜充分混匀,从而能使能够将硝酸盐转化为亚硝酸盐的细菌大量繁殖,因此放的时间越长,产生的亚硝酸盐含量也越高。
3.久煮火锅汤。肉类和蔬菜中的硝酸盐会溶解在汤中,在长时间的滚烫的沸水中硝酸盐很容易转变成为亚硝酸盐,其中的一部分还会和肉、海鲜等中的蛋白质分解产物合成亚硝胺(亚硝胺是强致癌物,是最重要的化学致癌物之一,是四大食品污染物之一,被誉为致癌的“隐形杀手”),从而使汤的危险性增加。
4.粉嫩的熟肉。肉中加入亚硝酸盐后,煮熟后可以让熟肉看起来颜色更加粉嫩红润、口感也更加鲜嫩,同时还可以延长食品保质期。大多数烧烤肉制品、羊肉串等几乎都会加入亚硝酸盐。
三、食品中亚硝酸盐的测定方法
1.高锰酸钾滴定法。
该方法根据高锰酸钾与亚硝酸钠的化学方程式:2KMnO4 +5NaNO2 +3H2SO4 =Na2SO4 +2MnSO4 +5NaNO3+3H2O。在酸性条件下,高锰酸钾可以将亚硝酸钠氧化为硝酸钠,当反应完全后,微微过量的高锰酸钾溶液即可使溶液变红,从而指示终点。依据公式,即可求得其中亚硝酸盐含量。
2.固体格氏试剂快速测定食品的亚硝酸盐。
固体格氏试剂指的是以一定比例的盐酸1-萘胺、对氨基苯磺酸及酒石酸研成的粉末。该方法利用亚硝酸盐在酸性条件下与对氨基苯磺酸发生重氮化反应,生成的重氮化合物进而与α-萘胺耦合,生成一种红色偶氮染料,该偶氮染料的颜色与亚硝酸盐含量成正比。借助分光光度计测量,通过所得的数据进一步线性拟合,通过线性回归方程测量出试样中的亚硝酸盐含量。
3.盐酸萘乙二胺半定量、定量测定食品中亚硝酸盐。
该方法样品首先沉淀蛋白质,除去脂肪后在pH 2.5~3.5(酸性条件下),亚硝酸盐与对氨基苯磺酸发生重氮化后,和盐酸萘乙二胺进行偶合,偶合后呈现偶氮色素的红紫色(如图3), 通过外标法测得亚硝酸盐含量。
运用化学知识,科学合理使用
谢 谢 !
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
