10.1 常见的酸和碱 课件(共53张PPT)人教版 九年级下册
文档属性
| 名称 | 10.1 常见的酸和碱 课件(共53张PPT)人教版 九年级下册 |  | |
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-31 17:31:28 | ||
图片预览





文档简介
(共53张PPT)
第十单元 酸和碱
10.1 常见的酸和碱
知识点
1
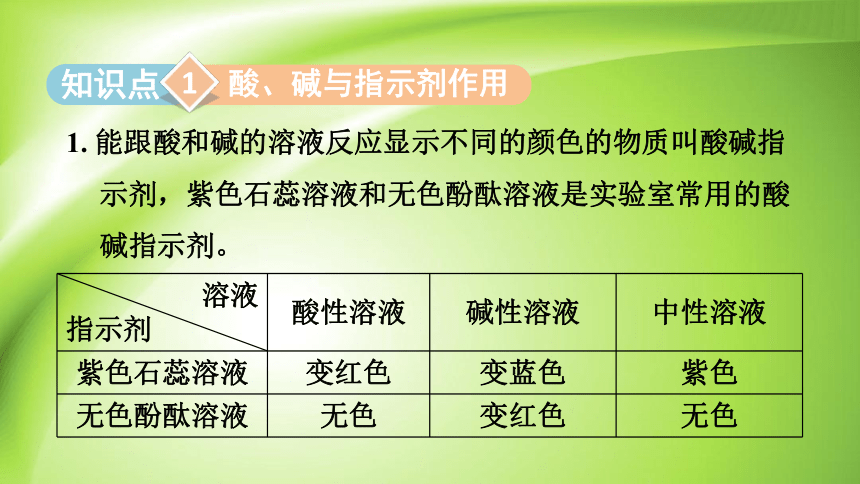
1. 能跟酸和碱的溶液反应显示不同的颜色的物质叫酸碱指示剂,紫色石蕊溶液和无色酚酞溶液是实验室常用的酸碱指示剂。
酸、碱与指示剂作用
溶液 指示剂 酸性溶液 碱性溶液 中性溶液
紫色石蕊溶液 变红色 变蓝色 紫色
无色酚酞溶液 无色 变红色 无色
2. 酸碱指示剂可用来鉴别溶液的酸碱性,如使紫色石蕊溶液变红的溶液呈酸性,使石蕊变蓝的溶液呈碱性,不变色的为中性溶液;使无色酚酞溶液变红的溶液呈碱性,不变色的不一定是酸性溶液,还可能是中性溶液。
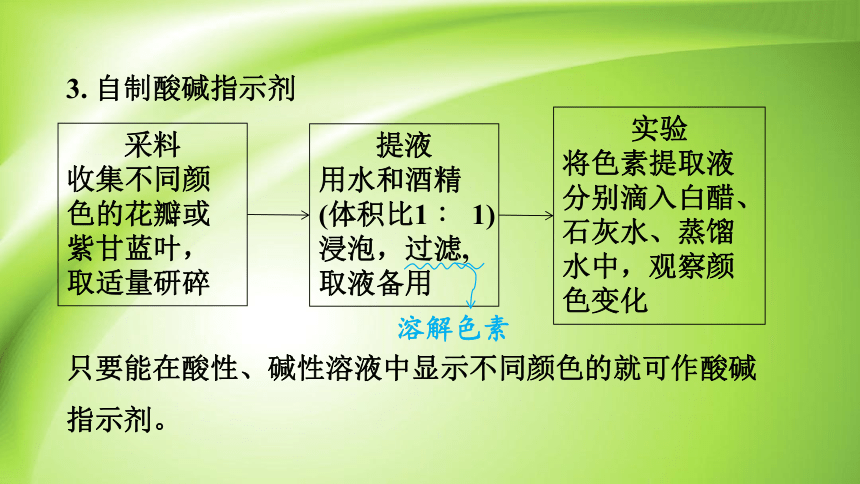
3. 自制酸碱指示剂
采料
收集不同颜色的花瓣或紫甘蓝叶,取适量研碎
提液
用水和酒精(体积比1 ∶ 1)浸泡,过滤, 取液备用
实验
将色素提取液分别滴入白醋、石灰水、蒸馏水中,观察颜色变化
只要能在酸性、碱性溶液中显示不同颜色的就可作酸碱
指示剂。
溶解色素
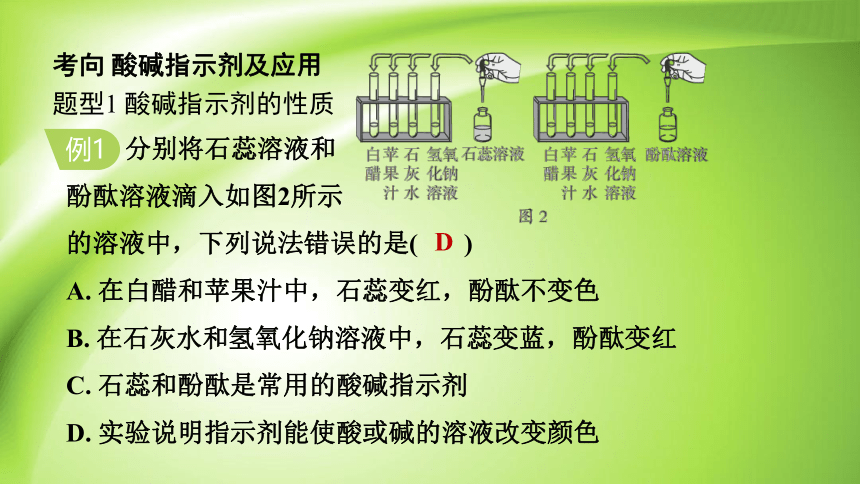
分别将石蕊溶液和
酚酞溶液滴入如图2所示
的溶液中,下列说法错误的是( )
A. 在白醋和苹果汁中,石蕊变红,酚酞不变色
B. 在石灰水和氢氧化钠溶液中,石蕊变蓝,酚酞变红
C. 石蕊和酚酞是常用的酸碱指示剂
D. 实验说明指示剂能使酸或碱的溶液改变颜色
例1
D
考向 酸碱指示剂及应用
题型1 酸碱指示剂的性质
解题秘方:根据酸碱指示剂遇酸性和碱性
溶液时的变色情况解答。
解:白醋和苹果汁呈酸性,能使石蕊溶液变红,酚酞溶液不变色,A 正确;石灰水和氢氧化钠溶液呈碱性,能使石蕊溶液变蓝,酚酞溶液变红,B 正确;石蕊溶液和酚酞溶液在遇酸性和碱性溶液时显示不同颜色,是常用的酸碱指示剂,C 正确;酸碱指示剂与酸溶液或碱溶液混合时,变色的是指示剂,而不是酸溶液或碱溶液,D 错误。
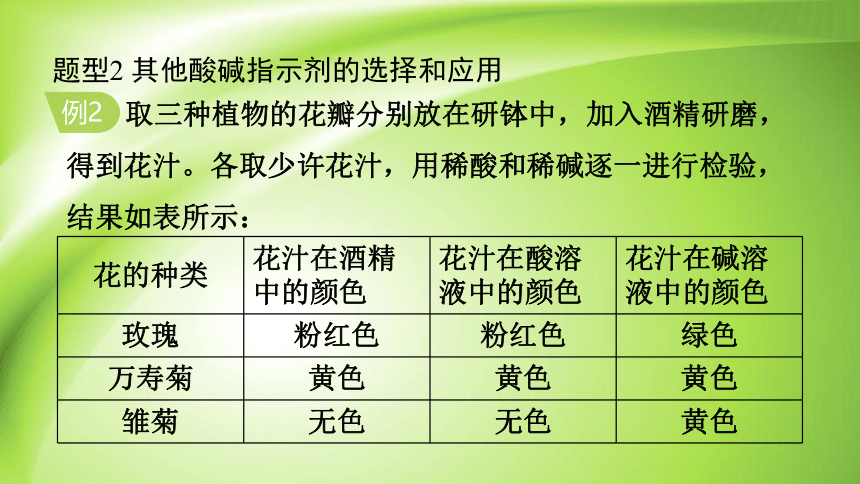
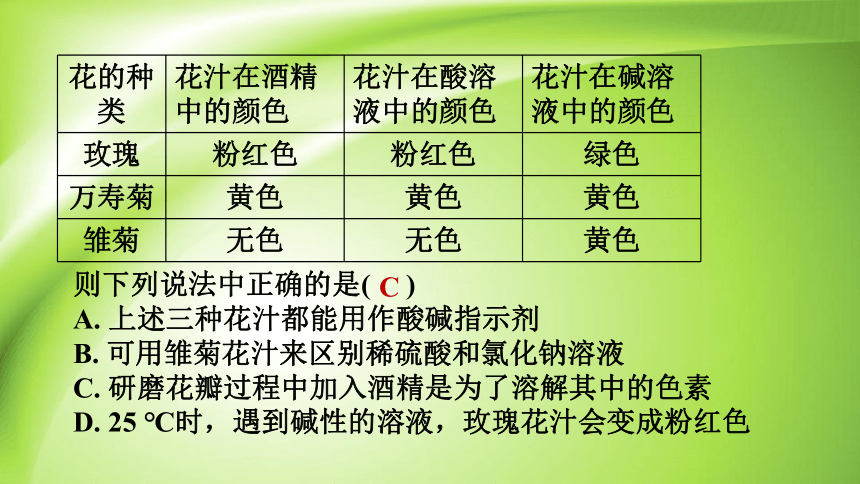
取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁。各取少许花汁,用稀酸和稀碱逐一进行检验,结果如表所示:
例2
题型2 其他酸碱指示剂的选择和应用
花的种类 花汁在酒精中的颜色 花汁在酸溶液中的颜色 花汁在碱溶液中的颜色
玫瑰 粉红色 粉红色 绿色
万寿菊 黄色 黄色 黄色
雏菊 无色 无色 黄色
则下列说法中正确的是( )
A. 上述三种花汁都能用作酸碱指示剂
B. 可用雏菊花汁来区别稀硫酸和氯化钠溶液
C. 研磨花瓣过程中加入酒精是为了溶解其中的色素
D. 25 ℃时,遇到碱性的溶液,玫瑰花汁会变成粉红色
C
花的种类 花汁在酒精中的颜色 花汁在酸溶液中的颜色 花汁在碱溶液中的颜色
玫瑰 粉红色 粉红色 绿色
万寿菊 黄色 黄色 黄色
雏菊 无色 无色 黄色
解题秘方:根据酸碱指示剂的定义来判断。
解:根据表中信息可知,万寿菊的花汁在酸性溶液和碱性溶液中呈现相同的颜色,不能作酸碱指示剂,玫瑰花汁与雏菊花汁在酸性和碱性溶液中能显示不同的颜色,可作酸碱指示剂;雏菊花汁在酸性和中性溶液中的颜色相同,不能鉴别酸性的稀硫酸和中性的氯化钠溶液;酒精可以溶解色素,C 正确;玫瑰花汁在碱性溶液中变成绿色,D 错误。
知识点
2
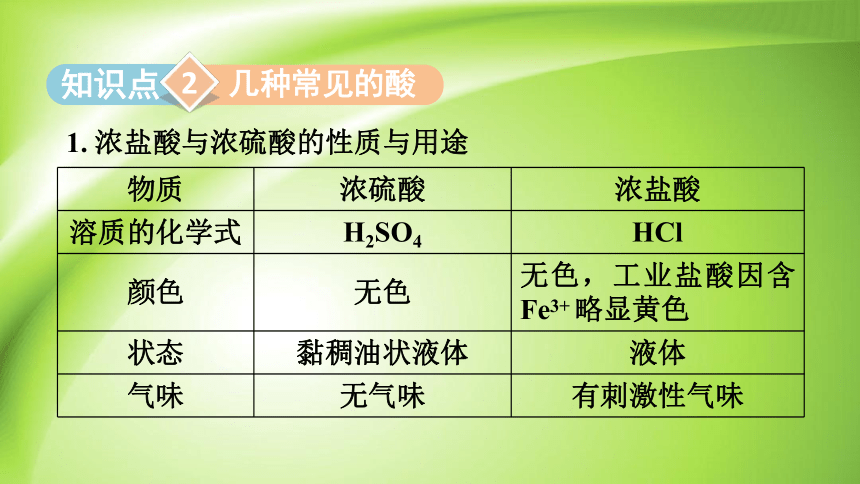
1. 浓盐酸与浓硫酸的性质与用途
几种常见的酸
物质 浓硫酸 浓盐酸
溶质的化学式 H2SO4 HCl
颜色 无色 无色,工业盐酸因含Fe3+ 略显黄色
状态 黏稠油状液体 液体
气味 无气味 有刺激性气味
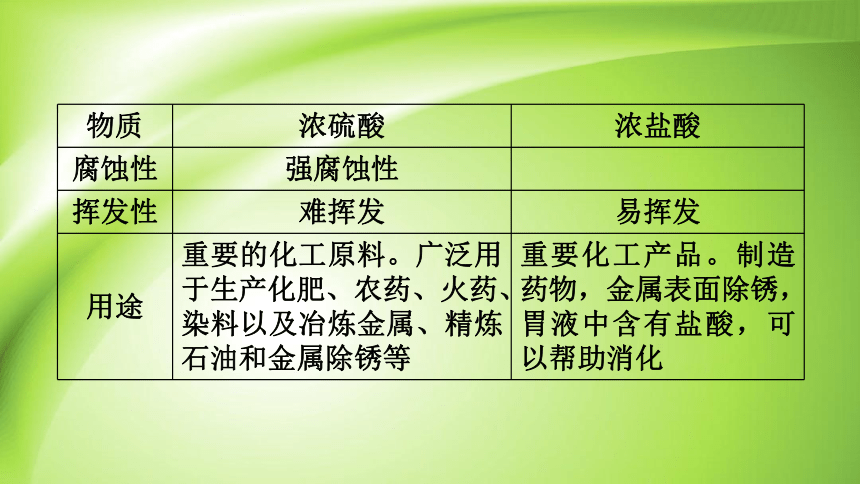
物质 浓硫酸 浓盐酸
腐蚀性 强腐蚀性
挥发性 难挥发 易挥发
用途 重要的化工原料。广泛用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等 重要化工产品。制造药物,金属表面除锈,胃液中含有盐酸,可以帮助消化
浓盐酸敞口放置在空气中,因具有挥发性,所以溶质、溶液质量减少,溶质质量分数减小;浓硫酸具有吸水性,敞口放置一段时间后,溶质质量不变,溶剂、溶液质量增大,溶质质量分数也减小。因此浓盐酸与浓硫酸都应密封保存。
2. 浓硫酸的特性
(1) 脱水性:能将蔗糖、纸张、棉布等物质里的氢、氧元素按原子个数比2 ∶ 1(水的组成比)脱去,使这些物质炭化,这种作用叫脱水作用。
(2) 强烈的腐蚀性:会伤害人体,使用时要特别小心,严格遵守安全操作规则,确保安全。若浓硫酸不小心溅到皮肤上,应立即用大量的水冲洗,最后涂上3%~5% 的NaHCO3溶液。
(3)吸水性:能吸收空气中的水分,可用作某些气体的干燥剂。
装置
可干燥的气体 CO2、HCl、O2、H2
不能干燥的气体 NH3 等
3. 浓硫酸的稀释
稀释浓硫酸时,应将浓硫酸沿着容器内壁慢慢注入水中,并用玻璃棒不断搅拌。反之,若将水倒入浓硫酸中,由于水的密度小,浮在浓硫酸上面,硫酸溶于水时放出的热量使水沸腾,导致硫酸液滴向四周飞溅。
巧记:“酸入水,沿器壁,缓慢倒,不断搅”
下列有关酸的性质说法正确的是( )
A. 浓盐酸、浓硫酸都能使纸张炭化
B. 浓盐酸和浓硫酸都具有强烈的腐蚀性
C. 浓盐酸、浓硫酸都可用于干燥氧气
D. 打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
例3
B
考向 浓盐酸和浓硫酸的性质
题型1 浓盐酸与浓硫酸的比较
解:浓硫酸具有脱水性,能使纸张炭化;浓盐酸不具有脱水性,不能使纸张炭化,A 错误;浓硫酸具有吸水性,可用于干燥氧气;而浓盐酸不具有吸水性,不能用于干燥氧气,C 错误;浓盐酸具有挥发性,打开试剂瓶瓶塞,在瓶口有白雾出现;浓硫酸具有吸水性,但不具有挥发性,打开试剂瓶瓶塞,瓶口上方无明显现象,D 错误。
[中考·滨州]将浓硫酸和浓盐酸敞口放置在空气中一段时间后,下列说法正确的是( )
A. 溶质的质量分数都变小
B. 溶液的质量都增大
C. 溶质的质量分数都变大
D. 溶质的质量分数前者变大,后者变小
例4
A
题型2 酸露置在空气中的变化
解题秘方:解答此类题目应明确酸暴露在空气中发生的变化,可结合浓盐酸的挥发性和浓硫酸的吸水性分析。
解:浓硫酸具有吸水性,露置于空气中,溶质质量不变,溶剂质量增加,则溶质的质量分数变小;浓盐酸具有挥发性,露置于空气中,溶质质量变小,溶剂质量不变,则溶质的质量分数变小。故选A。
知识点
3
1. 稀盐酸、稀硫酸的化学性质
酸的化学性质
反应 现象 原理(或化学方程式)
与指示剂作用 紫色石蕊溶液遇酸变为红色,无色酚酞溶液遇酸不变色 反应 现象 原理(或化学方程式) 与金属反应 镁 剧烈反应,产生大量气泡 Mg+2HCl====MgCl2+H2 ↑
Mg+H2SO4====MgSO4+H2 ↑
锌 反应较快,有大量气泡产生 Zn+2HCl====ZnCl2+H2 ↑
Zn+H2SO4====ZnSO4+H2 ↑
铁 有气泡产生,溶液由无色变成浅绿色 Fe+2HCl====FeCl2+H2 ↑
Fe+H2SO4====FeSO4+H2 ↑
反应 现象 原理(或化学方程式) 与金属氧化物反应 铁锈 铁锈溶解,溶液由无色变成黄色 Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4====Fe2(SO4)3 +3H2O
氧化 铜 固体溶解,溶液由无色变成蓝色 CuO+2HCl====CuCl2+H2O
CuO+H2SO4====CuSO4+H2O
2. 酸的通性
(1) 酸能与酸碱指示剂反应,如能使紫色石蕊溶液变红,使无色酚酞溶液不变色。
(2)酸能与活泼金属反应,产生氢气。
(3)酸能与金属氧化物反应,生成水。
拓展:酸还能与其他物质反应,如:
2HCl+CaCO3 ====CaCl2+H2O+CO2 ↑
Na2CO3+2HCl ====2NaCl+H2O+CO2 ↑,
HCl+AgNO3 ====AgCl ↓ +HNO3(产生白色沉淀),
H2SO4+BaCl2 ====BaSO4 ↓ +2HCl(产生白色沉淀)。
特别提醒:
1. 酸与金属反应产生氢气时,必须满足两个条件:
(1) 参加反应的金属必须是金属活动性顺序中排在氢前的金属;
(2) 酸不能是强氧化性酸,如不能是浓硫酸、硝酸。
2. 利用稀盐酸或稀硫酸除铁锈时:注意不能将铁制品久置在足量的酸溶液中,因为铁锈除尽后,过量的酸还能与铁反应,腐蚀金属。
3. 铁与酸发生置换反应时:生成的化合物中铁元素都显+2 价,得到浅绿色的溶液;氧化铁与酸反应,生成的化合物中铁元素都显+3 价,得到黄色溶液。
[中考·重庆] 学会识图能发展科学思维。一小块未打磨的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图3 所示。下列猜想正确的有( )
① O ~ t1 阶段,可能是铝表面有层氧化膜
② t1 ~ t2 阶段,可能是铝和稀盐酸反应放出热量
③ t3 时刻,可能是稀盐酸过量
④ t3 时刻,可能是稀盐酸不足
A. 1 项 B. 2 项 C. 3 项 D. 4 项
例5
D
考向 酸的化学性质
解题秘方:结合铝的化学性质(氢前金属及表面形成致密的氧化膜)和酸的化学性质(能与金属、金属氧化物反应)来解题。
解:① O ~ t1 阶段,没有气泡产生,说明铝和稀盐酸还没有反应,可能是铝表面有层氧化膜,①猜想正确;② t1 ~ t2 阶段,产生气泡变快,可能是铝和稀盐酸反应且放出热量,②猜想正确;③ t2 时刻以后产生气泡的速率下降,是因为稀盐酸的浓度降低,t3 时刻,刚好不再产生气泡,则可能是稀盐酸过量,③猜想正确;④ t3 时刻,也可能是稀盐酸不足,④猜想正确;故选D。
知识点
4
1. 氢氧化钠、氢氧化钙的物理性质和用途
几种常见的碱
物质 氢氧化钠 氢氧化钙
俗名 苛性钠、火碱、烧碱 熟石灰、消石灰
颜色、状态 白色固体 白色粉末状固体
溶解性 易溶于水,溶解时放热 微溶于水
物质 氢氧化钠 氢氧化钙
吸水性 易潮解 不易吸水
用途 化工原料,广泛用于制取肥皂,以及石油、造纸、纺织和印染等工业;生活中用于除油污等 用于建筑工业,制漂白粉,保护树木,改良酸性土壤,配制农药波尔多液
密封保存
物理变化
2. 氢氧化钠使用注意事项
氢氧化钠具有强烈的腐蚀性,使用时必须十分小心,要防止进入眼睛,沾到皮肤或衣服上。如果不慎将碱液沾到皮肤上,应立即用大量的水冲洗,然后涂上硼酸溶液。
不能放在纸上称量,应放在玻璃器皿如烧杯
或表面皿中称量,以防腐蚀托盘
3. 石灰石(主要成分CaCO3)、生石灰(主要成分
CaO)、熟石灰[Ca(OH)2]之间的转化关系
图示
碳酸钙
氧化钙
氢氧化钙
①高温
② + 水
③ +CO2
化学 方程式 ① CaCO3====CaO+CO2 ↑
② CaO+H2O ====Ca(OH)2
③ CO2+Ca(OH)2 ====CaCO3 ↓ +H2O
知识 链接 ①氧化钙与水的反应是放热反应
②生石灰因能和水反应生成氢氧化钙,因此可作干燥剂,一般食品里的干燥剂就是生石灰
高温
下列选项中物质的化学名称、俗名、化学式完全一致的是( )
A. 冰、干冰、CO2
B. 氢氧化钙、消石灰、Ca(OH)2
C. 氧化钙、熟石灰、CaO
D. 氢氧化钠、烧碱、Na2CO3
例6
B
考向 常见的碱
题型1 常见物质的俗名及化学式
干冰不是冰( 是固态CO2)
俗称生石灰
纯碱、苏打
下列有关氢氧化钠和氢氧化钙的说法不正确的是( )
A. 可用水来区分氢氧化钠和氢氧化钙
B. 都可作干燥剂
C. 氢氧化钠可作炉具清洁剂,氢氧化钙可用于配制波尔多液
D. 都具有腐蚀性
例7
B
题型2 氢氧化钠、氢氧化钙的物理性质与用途
解题秘方:根据两种碱的性质和用途来辨别。
解:氢氧化钠易溶于水且放热,溶液温度升高,氢氧化钙微溶于水,溶液温度无明显变化,因此可用水来鉴别这两种碱;氢氧化钠易潮解,可用作干燥剂,氢氧化钙不能作干燥剂,B不正确;氢氧化钠能与油脂反应,可作炉具清洁剂,氢氧化钙可用于配制波尔多液,这两种碱都有一定的腐蚀性。
知识点
5
一、氢氧化钠、氢氧化钙的化学性质
1. 与酸碱指示剂作用
常见碱的化学性质
物质 无色酚酞溶液 紫色石蕊溶液
氢氧化钠溶液 变红 变蓝
氢氧化钙溶液 变红 变蓝
2. 与某些非金属氧化物反应
非金属氧化物 氢氧化钠溶液氢 氧化钙溶液
CO2 2NaOH+CO2=== Na2CO3+H2O Ca(OH)2+CO2====
CaCO3 ↓ +H2O
SO2 2NaOH+SO2 === Na2SO3+H2O Ca(OH)2+SO2====
CaSO3 ↓ +H2O
SO3 2NaOH+SO3=== Na2SO4+H2O Ca(OH)2+SO3====
CaSO4 ↓ +H2O
二、碱的通性
1. 碱能使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
2. 碱能与某些非金属氧化物反应生成水。
实验是学习化学的重要途径,小亮在学习酸碱盐的化学性质时做了如下实验,请你和他一起完成实验活动。
例8
考向 碱的化学性质
(1)实验A 中1、3 孔的现象是 _________________,该实验的目的是___________________________。
石蕊溶液变蓝
探究碱与指示剂的作用
知5-练
感悟新知
(2)在实验B 的试管中,滴加少量的氢氧化钠溶液,看到的现象是___________________,反应的化学方程式是 ________________________________________。
有蓝色沉淀生成
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
知5-练
感悟新知
(3)小张用实验C 验证二氧化碳与氢氧化钠溶液反应,看到的现象是 ___________,写出反应的化学方程式: __________________________________ 。
气球胀大
2NaOH+CO2====Na2CO3+H2O
解:(1)紫色石蕊遇酸变红色,遇碱变蓝色,所以实验A中1、3 孔的现象是石蕊溶液变蓝,该实验的目的是探究碱与指示剂的作用。(2)氢氧化钠溶液和硫酸铜溶液反应会生成氢氧化铜沉淀,看到的现象是有蓝色沉淀生成。(3)氢氧化钠溶液与二氧化碳反应,导致集气瓶内的气压减小,所以看到的现象是气球胀大。
知识点
6
1. 溶液的导电性
溶液能够导电是因为溶液中含有自由移动的离子,如盐酸中含有H+ 和Cl-,氢氧化钠溶液中有Na+ 和OH-,氯化钠溶液中含有Na+ 和Cl-。
酸溶液或碱溶液化学性质相似的原因
2. 酸或碱溶液化学性质相似的原因
(1) 酸:由于不同酸溶液中都含有氢离子,所以酸具有一些相似的化学性质。
(2) 碱:由于不同碱溶液中都含有氢氧根离子,所以碱都具有一些相似的化学性质。
[中考·海南] 小宇
同学做了如下家庭小
实验,实验记录如下:
(1)写出做实验①的目的 _________________________;
例9
作为实验②、③的对照实验
考向 微观探溶液
题型1 溶液的导电性
序号 液体 现象
① 纯净水 小灯泡不亮
② 蔗糖水 小灯泡不亮
③ 食盐水 小灯泡亮
(2) 请从微观角度解释蔗糖水不导电,食盐水能导电的原因。
蔗糖水中的蔗糖以蔗糖分子的形式存在,不能形成自由移动的离子,因此蔗糖水不导电;食盐水中存在自由移动的钠离子和氯离子,所以食盐水能导电。
解题秘方:溶液能导电的条件是有能自由移动的离子。
解:(1)②和③均为溶液,①是水,该实验的目的是作为实验②、③的对照实验,证明导电性与水无关。(2)若溶液中存在着大量能够自由移动的阴、阳离子,则该溶液能导电。蔗糖水中的蔗糖是以蔗糖分子的形式存在的,因此蔗糖水很难导电。
稀盐酸和稀硫酸具有相似的化学性质,其本质原因是( )
A. 都能与指示剂作用 B. 都能解离出酸根离子
C. 溶液中的阳离子都是氢离子 D. 都含有氢元素
例10
C
题型2 酸或碱具有相似化学性质的原因及应用
解题秘方:根据酸、碱的通性来分析。
解:酸(或碱)溶液中含有相同的H+(或OH-),所以化学性质相似。
课堂小结
酸
金属
金属
氧化物
酸碱
指示剂
非金属
氧化物
碱
第十单元 酸和碱
10.1 常见的酸和碱
知识点
1
1. 能跟酸和碱的溶液反应显示不同的颜色的物质叫酸碱指示剂,紫色石蕊溶液和无色酚酞溶液是实验室常用的酸碱指示剂。
酸、碱与指示剂作用
溶液 指示剂 酸性溶液 碱性溶液 中性溶液
紫色石蕊溶液 变红色 变蓝色 紫色
无色酚酞溶液 无色 变红色 无色
2. 酸碱指示剂可用来鉴别溶液的酸碱性,如使紫色石蕊溶液变红的溶液呈酸性,使石蕊变蓝的溶液呈碱性,不变色的为中性溶液;使无色酚酞溶液变红的溶液呈碱性,不变色的不一定是酸性溶液,还可能是中性溶液。
3. 自制酸碱指示剂
采料
收集不同颜色的花瓣或紫甘蓝叶,取适量研碎
提液
用水和酒精(体积比1 ∶ 1)浸泡,过滤, 取液备用
实验
将色素提取液分别滴入白醋、石灰水、蒸馏水中,观察颜色变化
只要能在酸性、碱性溶液中显示不同颜色的就可作酸碱
指示剂。
溶解色素
分别将石蕊溶液和
酚酞溶液滴入如图2所示
的溶液中,下列说法错误的是( )
A. 在白醋和苹果汁中,石蕊变红,酚酞不变色
B. 在石灰水和氢氧化钠溶液中,石蕊变蓝,酚酞变红
C. 石蕊和酚酞是常用的酸碱指示剂
D. 实验说明指示剂能使酸或碱的溶液改变颜色
例1
D
考向 酸碱指示剂及应用
题型1 酸碱指示剂的性质
解题秘方:根据酸碱指示剂遇酸性和碱性
溶液时的变色情况解答。
解:白醋和苹果汁呈酸性,能使石蕊溶液变红,酚酞溶液不变色,A 正确;石灰水和氢氧化钠溶液呈碱性,能使石蕊溶液变蓝,酚酞溶液变红,B 正确;石蕊溶液和酚酞溶液在遇酸性和碱性溶液时显示不同颜色,是常用的酸碱指示剂,C 正确;酸碱指示剂与酸溶液或碱溶液混合时,变色的是指示剂,而不是酸溶液或碱溶液,D 错误。
取三种植物的花瓣分别放在研钵中,加入酒精研磨,得到花汁。各取少许花汁,用稀酸和稀碱逐一进行检验,结果如表所示:
例2
题型2 其他酸碱指示剂的选择和应用
花的种类 花汁在酒精中的颜色 花汁在酸溶液中的颜色 花汁在碱溶液中的颜色
玫瑰 粉红色 粉红色 绿色
万寿菊 黄色 黄色 黄色
雏菊 无色 无色 黄色
则下列说法中正确的是( )
A. 上述三种花汁都能用作酸碱指示剂
B. 可用雏菊花汁来区别稀硫酸和氯化钠溶液
C. 研磨花瓣过程中加入酒精是为了溶解其中的色素
D. 25 ℃时,遇到碱性的溶液,玫瑰花汁会变成粉红色
C
花的种类 花汁在酒精中的颜色 花汁在酸溶液中的颜色 花汁在碱溶液中的颜色
玫瑰 粉红色 粉红色 绿色
万寿菊 黄色 黄色 黄色
雏菊 无色 无色 黄色
解题秘方:根据酸碱指示剂的定义来判断。
解:根据表中信息可知,万寿菊的花汁在酸性溶液和碱性溶液中呈现相同的颜色,不能作酸碱指示剂,玫瑰花汁与雏菊花汁在酸性和碱性溶液中能显示不同的颜色,可作酸碱指示剂;雏菊花汁在酸性和中性溶液中的颜色相同,不能鉴别酸性的稀硫酸和中性的氯化钠溶液;酒精可以溶解色素,C 正确;玫瑰花汁在碱性溶液中变成绿色,D 错误。
知识点
2
1. 浓盐酸与浓硫酸的性质与用途
几种常见的酸
物质 浓硫酸 浓盐酸
溶质的化学式 H2SO4 HCl
颜色 无色 无色,工业盐酸因含Fe3+ 略显黄色
状态 黏稠油状液体 液体
气味 无气味 有刺激性气味
物质 浓硫酸 浓盐酸
腐蚀性 强腐蚀性
挥发性 难挥发 易挥发
用途 重要的化工原料。广泛用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等 重要化工产品。制造药物,金属表面除锈,胃液中含有盐酸,可以帮助消化
浓盐酸敞口放置在空气中,因具有挥发性,所以溶质、溶液质量减少,溶质质量分数减小;浓硫酸具有吸水性,敞口放置一段时间后,溶质质量不变,溶剂、溶液质量增大,溶质质量分数也减小。因此浓盐酸与浓硫酸都应密封保存。
2. 浓硫酸的特性
(1) 脱水性:能将蔗糖、纸张、棉布等物质里的氢、氧元素按原子个数比2 ∶ 1(水的组成比)脱去,使这些物质炭化,这种作用叫脱水作用。
(2) 强烈的腐蚀性:会伤害人体,使用时要特别小心,严格遵守安全操作规则,确保安全。若浓硫酸不小心溅到皮肤上,应立即用大量的水冲洗,最后涂上3%~5% 的NaHCO3溶液。
(3)吸水性:能吸收空气中的水分,可用作某些气体的干燥剂。
装置
可干燥的气体 CO2、HCl、O2、H2
不能干燥的气体 NH3 等
3. 浓硫酸的稀释
稀释浓硫酸时,应将浓硫酸沿着容器内壁慢慢注入水中,并用玻璃棒不断搅拌。反之,若将水倒入浓硫酸中,由于水的密度小,浮在浓硫酸上面,硫酸溶于水时放出的热量使水沸腾,导致硫酸液滴向四周飞溅。
巧记:“酸入水,沿器壁,缓慢倒,不断搅”
下列有关酸的性质说法正确的是( )
A. 浓盐酸、浓硫酸都能使纸张炭化
B. 浓盐酸和浓硫酸都具有强烈的腐蚀性
C. 浓盐酸、浓硫酸都可用于干燥氧气
D. 打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
例3
B
考向 浓盐酸和浓硫酸的性质
题型1 浓盐酸与浓硫酸的比较
解:浓硫酸具有脱水性,能使纸张炭化;浓盐酸不具有脱水性,不能使纸张炭化,A 错误;浓硫酸具有吸水性,可用于干燥氧气;而浓盐酸不具有吸水性,不能用于干燥氧气,C 错误;浓盐酸具有挥发性,打开试剂瓶瓶塞,在瓶口有白雾出现;浓硫酸具有吸水性,但不具有挥发性,打开试剂瓶瓶塞,瓶口上方无明显现象,D 错误。
[中考·滨州]将浓硫酸和浓盐酸敞口放置在空气中一段时间后,下列说法正确的是( )
A. 溶质的质量分数都变小
B. 溶液的质量都增大
C. 溶质的质量分数都变大
D. 溶质的质量分数前者变大,后者变小
例4
A
题型2 酸露置在空气中的变化
解题秘方:解答此类题目应明确酸暴露在空气中发生的变化,可结合浓盐酸的挥发性和浓硫酸的吸水性分析。
解:浓硫酸具有吸水性,露置于空气中,溶质质量不变,溶剂质量增加,则溶质的质量分数变小;浓盐酸具有挥发性,露置于空气中,溶质质量变小,溶剂质量不变,则溶质的质量分数变小。故选A。
知识点
3
1. 稀盐酸、稀硫酸的化学性质
酸的化学性质
反应 现象 原理(或化学方程式)
与指示剂作用 紫色石蕊溶液遇酸变为红色,无色酚酞溶液遇酸不变色 反应 现象 原理(或化学方程式) 与金属反应 镁 剧烈反应,产生大量气泡 Mg+2HCl====MgCl2+H2 ↑
Mg+H2SO4====MgSO4+H2 ↑
锌 反应较快,有大量气泡产生 Zn+2HCl====ZnCl2+H2 ↑
Zn+H2SO4====ZnSO4+H2 ↑
铁 有气泡产生,溶液由无色变成浅绿色 Fe+2HCl====FeCl2+H2 ↑
Fe+H2SO4====FeSO4+H2 ↑
反应 现象 原理(或化学方程式) 与金属氧化物反应 铁锈 铁锈溶解,溶液由无色变成黄色 Fe2O3+6HCl===2FeCl3+3H2O
Fe2O3+3H2SO4====Fe2(SO4)3 +3H2O
氧化 铜 固体溶解,溶液由无色变成蓝色 CuO+2HCl====CuCl2+H2O
CuO+H2SO4====CuSO4+H2O
2. 酸的通性
(1) 酸能与酸碱指示剂反应,如能使紫色石蕊溶液变红,使无色酚酞溶液不变色。
(2)酸能与活泼金属反应,产生氢气。
(3)酸能与金属氧化物反应,生成水。
拓展:酸还能与其他物质反应,如:
2HCl+CaCO3 ====CaCl2+H2O+CO2 ↑
Na2CO3+2HCl ====2NaCl+H2O+CO2 ↑,
HCl+AgNO3 ====AgCl ↓ +HNO3(产生白色沉淀),
H2SO4+BaCl2 ====BaSO4 ↓ +2HCl(产生白色沉淀)。
特别提醒:
1. 酸与金属反应产生氢气时,必须满足两个条件:
(1) 参加反应的金属必须是金属活动性顺序中排在氢前的金属;
(2) 酸不能是强氧化性酸,如不能是浓硫酸、硝酸。
2. 利用稀盐酸或稀硫酸除铁锈时:注意不能将铁制品久置在足量的酸溶液中,因为铁锈除尽后,过量的酸还能与铁反应,腐蚀金属。
3. 铁与酸发生置换反应时:生成的化合物中铁元素都显+2 价,得到浅绿色的溶液;氧化铁与酸反应,生成的化合物中铁元素都显+3 价,得到黄色溶液。
[中考·重庆] 学会识图能发展科学思维。一小块未打磨的铝片和一定质量的稀盐酸反应,产生气泡的快慢和反应时间的关系如图3 所示。下列猜想正确的有( )
① O ~ t1 阶段,可能是铝表面有层氧化膜
② t1 ~ t2 阶段,可能是铝和稀盐酸反应放出热量
③ t3 时刻,可能是稀盐酸过量
④ t3 时刻,可能是稀盐酸不足
A. 1 项 B. 2 项 C. 3 项 D. 4 项
例5
D
考向 酸的化学性质
解题秘方:结合铝的化学性质(氢前金属及表面形成致密的氧化膜)和酸的化学性质(能与金属、金属氧化物反应)来解题。
解:① O ~ t1 阶段,没有气泡产生,说明铝和稀盐酸还没有反应,可能是铝表面有层氧化膜,①猜想正确;② t1 ~ t2 阶段,产生气泡变快,可能是铝和稀盐酸反应且放出热量,②猜想正确;③ t2 时刻以后产生气泡的速率下降,是因为稀盐酸的浓度降低,t3 时刻,刚好不再产生气泡,则可能是稀盐酸过量,③猜想正确;④ t3 时刻,也可能是稀盐酸不足,④猜想正确;故选D。
知识点
4
1. 氢氧化钠、氢氧化钙的物理性质和用途
几种常见的碱
物质 氢氧化钠 氢氧化钙
俗名 苛性钠、火碱、烧碱 熟石灰、消石灰
颜色、状态 白色固体 白色粉末状固体
溶解性 易溶于水,溶解时放热 微溶于水
物质 氢氧化钠 氢氧化钙
吸水性 易潮解 不易吸水
用途 化工原料,广泛用于制取肥皂,以及石油、造纸、纺织和印染等工业;生活中用于除油污等 用于建筑工业,制漂白粉,保护树木,改良酸性土壤,配制农药波尔多液
密封保存
物理变化
2. 氢氧化钠使用注意事项
氢氧化钠具有强烈的腐蚀性,使用时必须十分小心,要防止进入眼睛,沾到皮肤或衣服上。如果不慎将碱液沾到皮肤上,应立即用大量的水冲洗,然后涂上硼酸溶液。
不能放在纸上称量,应放在玻璃器皿如烧杯
或表面皿中称量,以防腐蚀托盘
3. 石灰石(主要成分CaCO3)、生石灰(主要成分
CaO)、熟石灰[Ca(OH)2]之间的转化关系
图示
碳酸钙
氧化钙
氢氧化钙
①高温
② + 水
③ +CO2
化学 方程式 ① CaCO3====CaO+CO2 ↑
② CaO+H2O ====Ca(OH)2
③ CO2+Ca(OH)2 ====CaCO3 ↓ +H2O
知识 链接 ①氧化钙与水的反应是放热反应
②生石灰因能和水反应生成氢氧化钙,因此可作干燥剂,一般食品里的干燥剂就是生石灰
高温
下列选项中物质的化学名称、俗名、化学式完全一致的是( )
A. 冰、干冰、CO2
B. 氢氧化钙、消石灰、Ca(OH)2
C. 氧化钙、熟石灰、CaO
D. 氢氧化钠、烧碱、Na2CO3
例6
B
考向 常见的碱
题型1 常见物质的俗名及化学式
干冰不是冰( 是固态CO2)
俗称生石灰
纯碱、苏打
下列有关氢氧化钠和氢氧化钙的说法不正确的是( )
A. 可用水来区分氢氧化钠和氢氧化钙
B. 都可作干燥剂
C. 氢氧化钠可作炉具清洁剂,氢氧化钙可用于配制波尔多液
D. 都具有腐蚀性
例7
B
题型2 氢氧化钠、氢氧化钙的物理性质与用途
解题秘方:根据两种碱的性质和用途来辨别。
解:氢氧化钠易溶于水且放热,溶液温度升高,氢氧化钙微溶于水,溶液温度无明显变化,因此可用水来鉴别这两种碱;氢氧化钠易潮解,可用作干燥剂,氢氧化钙不能作干燥剂,B不正确;氢氧化钠能与油脂反应,可作炉具清洁剂,氢氧化钙可用于配制波尔多液,这两种碱都有一定的腐蚀性。
知识点
5
一、氢氧化钠、氢氧化钙的化学性质
1. 与酸碱指示剂作用
常见碱的化学性质
物质 无色酚酞溶液 紫色石蕊溶液
氢氧化钠溶液 变红 变蓝
氢氧化钙溶液 变红 变蓝
2. 与某些非金属氧化物反应
非金属氧化物 氢氧化钠溶液氢 氧化钙溶液
CO2 2NaOH+CO2=== Na2CO3+H2O Ca(OH)2+CO2====
CaCO3 ↓ +H2O
SO2 2NaOH+SO2 === Na2SO3+H2O Ca(OH)2+SO2====
CaSO3 ↓ +H2O
SO3 2NaOH+SO3=== Na2SO4+H2O Ca(OH)2+SO3====
CaSO4 ↓ +H2O
二、碱的通性
1. 碱能使紫色石蕊溶液变蓝,使无色酚酞溶液变红。
2. 碱能与某些非金属氧化物反应生成水。
实验是学习化学的重要途径,小亮在学习酸碱盐的化学性质时做了如下实验,请你和他一起完成实验活动。
例8
考向 碱的化学性质
(1)实验A 中1、3 孔的现象是 _________________,该实验的目的是___________________________。
石蕊溶液变蓝
探究碱与指示剂的作用
知5-练
感悟新知
(2)在实验B 的试管中,滴加少量的氢氧化钠溶液,看到的现象是___________________,反应的化学方程式是 ________________________________________。
有蓝色沉淀生成
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
知5-练
感悟新知
(3)小张用实验C 验证二氧化碳与氢氧化钠溶液反应,看到的现象是 ___________,写出反应的化学方程式: __________________________________ 。
气球胀大
2NaOH+CO2====Na2CO3+H2O
解:(1)紫色石蕊遇酸变红色,遇碱变蓝色,所以实验A中1、3 孔的现象是石蕊溶液变蓝,该实验的目的是探究碱与指示剂的作用。(2)氢氧化钠溶液和硫酸铜溶液反应会生成氢氧化铜沉淀,看到的现象是有蓝色沉淀生成。(3)氢氧化钠溶液与二氧化碳反应,导致集气瓶内的气压减小,所以看到的现象是气球胀大。
知识点
6
1. 溶液的导电性
溶液能够导电是因为溶液中含有自由移动的离子,如盐酸中含有H+ 和Cl-,氢氧化钠溶液中有Na+ 和OH-,氯化钠溶液中含有Na+ 和Cl-。
酸溶液或碱溶液化学性质相似的原因
2. 酸或碱溶液化学性质相似的原因
(1) 酸:由于不同酸溶液中都含有氢离子,所以酸具有一些相似的化学性质。
(2) 碱:由于不同碱溶液中都含有氢氧根离子,所以碱都具有一些相似的化学性质。
[中考·海南] 小宇
同学做了如下家庭小
实验,实验记录如下:
(1)写出做实验①的目的 _________________________;
例9
作为实验②、③的对照实验
考向 微观探溶液
题型1 溶液的导电性
序号 液体 现象
① 纯净水 小灯泡不亮
② 蔗糖水 小灯泡不亮
③ 食盐水 小灯泡亮
(2) 请从微观角度解释蔗糖水不导电,食盐水能导电的原因。
蔗糖水中的蔗糖以蔗糖分子的形式存在,不能形成自由移动的离子,因此蔗糖水不导电;食盐水中存在自由移动的钠离子和氯离子,所以食盐水能导电。
解题秘方:溶液能导电的条件是有能自由移动的离子。
解:(1)②和③均为溶液,①是水,该实验的目的是作为实验②、③的对照实验,证明导电性与水无关。(2)若溶液中存在着大量能够自由移动的阴、阳离子,则该溶液能导电。蔗糖水中的蔗糖是以蔗糖分子的形式存在的,因此蔗糖水很难导电。
稀盐酸和稀硫酸具有相似的化学性质,其本质原因是( )
A. 都能与指示剂作用 B. 都能解离出酸根离子
C. 溶液中的阳离子都是氢离子 D. 都含有氢元素
例10
C
题型2 酸或碱具有相似化学性质的原因及应用
解题秘方:根据酸、碱的通性来分析。
解:酸(或碱)溶液中含有相同的H+(或OH-),所以化学性质相似。
课堂小结
酸
金属
金属
氧化物
酸碱
指示剂
非金属
氧化物
碱
同课章节目录
