实验活动6 酸、碱的化学性质 课件(共18张PPT)人教版 九年级下册
文档属性
| 名称 | 实验活动6 酸、碱的化学性质 课件(共18张PPT)人教版 九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-31 17:36:20 | ||
图片预览


文档简介
(共18张PPT)
第十单元 酸和碱
实验活动6
酸、碱的化学性质
点实验
1
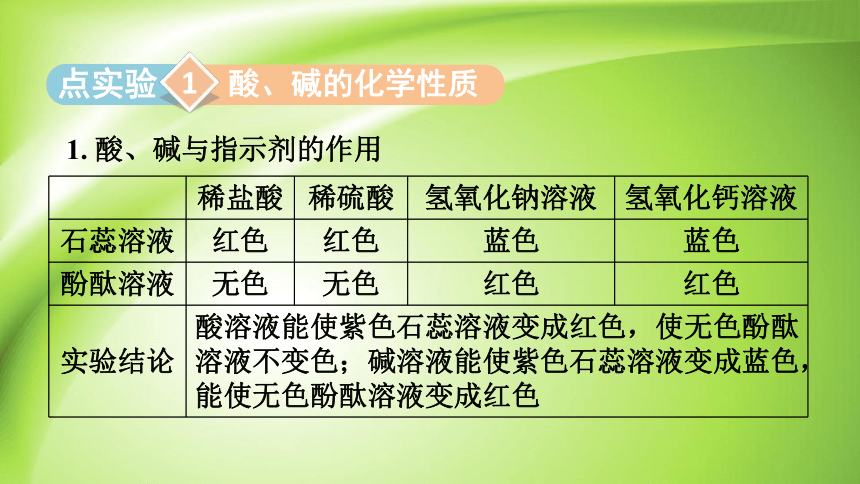
1. 酸、碱与指示剂的作用
酸、碱的化学性质
稀盐酸 稀硫酸 氢氧化钠溶液 氢氧化钙溶液
石蕊溶液 红色 红色 蓝色 蓝色
酚酞溶液 无色 无色 红色 红色
实验结论 酸溶液能使紫色石蕊溶液变成红色,使无色酚酞溶液不变色;碱溶液能使紫色石蕊溶液变成蓝色,能使无色酚酞溶液变成红色 2. 酸与金属单质、金属氧化物反应
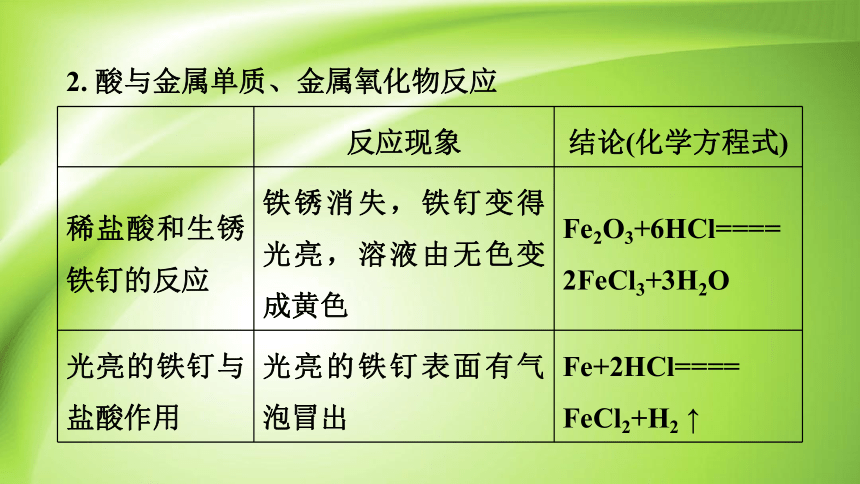
反应现象 结论(化学方程式)
稀盐酸和生锈铁钉的反应 铁锈消失,铁钉变得光亮,溶液由无色变成黄色 Fe2O3+6HCl====
2FeCl3+3H2O
光亮的铁钉与盐酸作用 光亮的铁钉表面有气泡冒出 Fe+2HCl====
FeCl2+H2 ↑
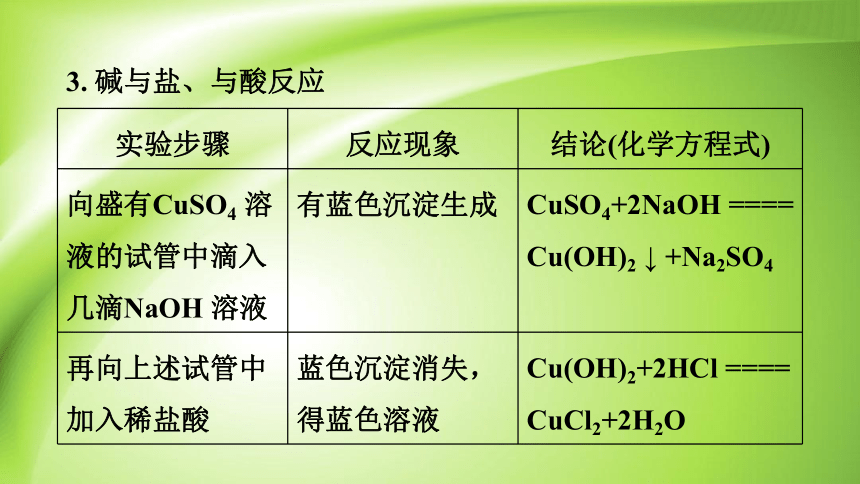
3. 碱与盐、与酸反应
实验步骤 反应现象 结论(化学方程式)
向盛有CuSO4 溶 液的试管中滴入 几滴NaOH 溶液 有蓝色沉淀生成 CuSO4+2NaOH ==== Cu(OH)2 ↓ +Na2SO4
再向上述试管中 加入稀盐酸 蓝色沉淀消失,得蓝色溶液 Cu(OH)2+2HCl ==== CuCl2+2H2O
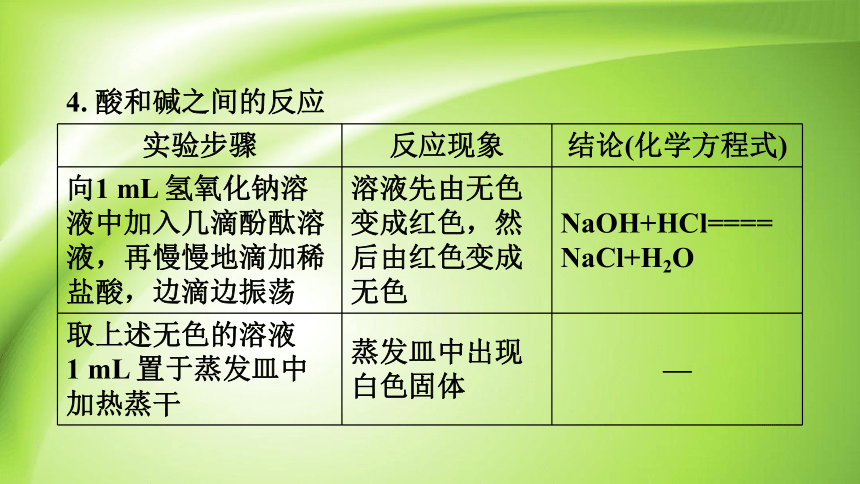
4. 酸和碱之间的反应
实验步骤 反应现象 结论(化学方程式)
向1 mL 氢氧化钠溶液中加入几滴酚酞溶液,再慢慢地滴加稀盐酸,边滴边振荡 溶液先由无色变成红色,然后由红色变成无色 NaOH+HCl====
NaCl+H2O
取上述无色的溶液 1 mL 置于蒸发皿中加热蒸干 蒸发皿中出现白色固体 —
5. 探究氢氧化钙的性质
实验步骤 反应现象 结论(化学方程式)
取两支试管,分别加入等量的氢氧化钙粉末,各加入1 mL 水,振荡,再滴入1~2 滴酚酞溶液 试管中出现红色 浑浊液体 氢氧化钙微溶于水,水溶液显碱性
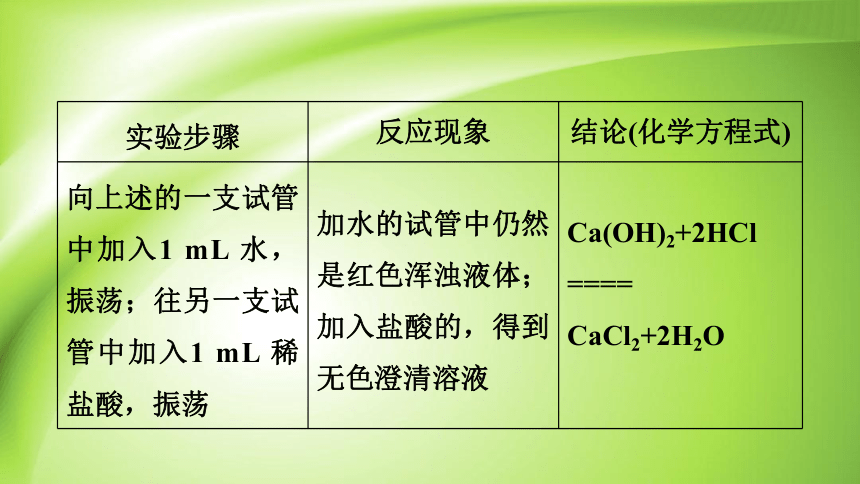
实验步骤 反应现象 结论(化学方程式)
向上述的一支试管中加入1 mL 水,振荡;往另一支试管中加入1 mL 稀盐酸,振荡 加水的试管中仍然是红色浑浊液体;加入盐酸的,得到无色澄清溶液 Ca(OH)2+2HCl
====
CaCl2+2H2O
实验提示:
1. 实验中滴加指示剂的量一般1 ~ 2 滴即可,实验时NaOH 溶液的浓度不能过大。
2. 酸碱有腐蚀性,实验时注意不要沾到皮肤和衣服上,特别不要溅到眼睛里。万一沾到皮肤、衣服上或溅到眼睛里,应立即用大量水冲洗。
3. 往滴有酚酞的氢氧化钠溶液中滴加盐酸时,要控制滴加酸的节奏,且不停振荡,使红色刚好消失,防止酸过量。
4. 加热蒸干溶液时,要注意用玻璃棒搅拌,当蒸发皿中出现较多量固体时停止加热,防止固体迸溅。
5. 实验后的废液不能倒入下水道中,以免腐蚀管道,需集中处理。
[改编·烟台] 某化学兴趣小组为探究盐酸的化学性质,进行了如下实验(所加稀盐酸均过量)。
(1)试管A 中观察
到紫色石蕊溶
液变 ______色。
例1
考向 酸、碱的化学性质
题型1 酸的化学性质
红
(2)试管B 中观察到溶液由无色逐渐变成黄色,是因为反应生成了______ (填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式 _______________________。
FeCl3
Fe+2HCl===FeCl2+H2↑
(3)试管C 中发生反应的化学方程式为 __________________________________________。
(4)试管D 中观察到的现象是 ____________________。
Na2CO3+2HCl===2NaCl+H2O+CO2↑
产生白色沉淀
解:(1)酸能使紫色石蕊溶液变成红色,所以试管A 中观察到紫色石蕊溶液变红色。(2)铁锈的主要成分是氧化铁,氧化铁与稀盐酸反应生成氯化铁和水,所以试管B 中观察到溶液由无色逐渐变成黄色,是因为反应生成了FeCl3,一段时间后有气泡产生,是由于铁锈反应完了,铁与稀盐酸反应生成了氯化亚铁和氢气,所以产生气泡的化学方程式是Fe+2HCl ====FeCl2+H2 ↑。
(3)试管C 中发生的反应是碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,化学方程式是Na2CO3+2HCl ====2NaCl +H2O+CO2 ↑。(4)稀盐酸与硝酸银溶液反应生成氯化银白色沉淀。
归纳总结是学习化学的重要方法,小明同学总结了NaOH 的四条化学性质(即NaOH 与四类物质能够发生化学反应),如图2 所示。
例2
题型2 碱的化学性质
(1)为了验证反应①,小明将紫色石蕊溶液滴入
NaOH 溶液中,溶液变成 ______色。
(2)反应②说明NaOH 溶液在空气中易变质,其化学方程式为 ________________________________________。
蓝
CO2+2NaOH====Na2CO3+H2O
(3) 为了验证反应③ 能够发生, 你选择的物质是
_______(填字母)。
A. K2CO3 B. 盐酸
C. CuSO4 D. MgCl2
(4)为了验证反应④,
小明向NaOH 溶液中滴入一定量
FeCl3 溶液,该反应的现象是 ____________________。
B
产生红褐色沉淀
解题秘方:根据NaOH 的化学性质对号入座。
解:(1)氢氧化钠能与酸碱指示剂反应,如使紫色石蕊溶液变蓝;
(2)氢氧化钠因与空气中的二氧化碳反应生成碳酸钠和水而变质;
(3)③是指氢氧化钠与酸反应,盐酸属于酸,K2CO3、CuSO4、MgCl2 属于盐,选B;
(4) 氢氧化钠与氯化铁反应生成红褐色沉淀, 即FeCl3+3NaOH====Fe(OH)3 ↓ +3NaCl。
第十单元 酸和碱
实验活动6
酸、碱的化学性质
点实验
1
1. 酸、碱与指示剂的作用
酸、碱的化学性质
稀盐酸 稀硫酸 氢氧化钠溶液 氢氧化钙溶液
石蕊溶液 红色 红色 蓝色 蓝色
酚酞溶液 无色 无色 红色 红色
实验结论 酸溶液能使紫色石蕊溶液变成红色,使无色酚酞溶液不变色;碱溶液能使紫色石蕊溶液变成蓝色,能使无色酚酞溶液变成红色 2. 酸与金属单质、金属氧化物反应
反应现象 结论(化学方程式)
稀盐酸和生锈铁钉的反应 铁锈消失,铁钉变得光亮,溶液由无色变成黄色 Fe2O3+6HCl====
2FeCl3+3H2O
光亮的铁钉与盐酸作用 光亮的铁钉表面有气泡冒出 Fe+2HCl====
FeCl2+H2 ↑
3. 碱与盐、与酸反应
实验步骤 反应现象 结论(化学方程式)
向盛有CuSO4 溶 液的试管中滴入 几滴NaOH 溶液 有蓝色沉淀生成 CuSO4+2NaOH ==== Cu(OH)2 ↓ +Na2SO4
再向上述试管中 加入稀盐酸 蓝色沉淀消失,得蓝色溶液 Cu(OH)2+2HCl ==== CuCl2+2H2O
4. 酸和碱之间的反应
实验步骤 反应现象 结论(化学方程式)
向1 mL 氢氧化钠溶液中加入几滴酚酞溶液,再慢慢地滴加稀盐酸,边滴边振荡 溶液先由无色变成红色,然后由红色变成无色 NaOH+HCl====
NaCl+H2O
取上述无色的溶液 1 mL 置于蒸发皿中加热蒸干 蒸发皿中出现白色固体 —
5. 探究氢氧化钙的性质
实验步骤 反应现象 结论(化学方程式)
取两支试管,分别加入等量的氢氧化钙粉末,各加入1 mL 水,振荡,再滴入1~2 滴酚酞溶液 试管中出现红色 浑浊液体 氢氧化钙微溶于水,水溶液显碱性
实验步骤 反应现象 结论(化学方程式)
向上述的一支试管中加入1 mL 水,振荡;往另一支试管中加入1 mL 稀盐酸,振荡 加水的试管中仍然是红色浑浊液体;加入盐酸的,得到无色澄清溶液 Ca(OH)2+2HCl
====
CaCl2+2H2O
实验提示:
1. 实验中滴加指示剂的量一般1 ~ 2 滴即可,实验时NaOH 溶液的浓度不能过大。
2. 酸碱有腐蚀性,实验时注意不要沾到皮肤和衣服上,特别不要溅到眼睛里。万一沾到皮肤、衣服上或溅到眼睛里,应立即用大量水冲洗。
3. 往滴有酚酞的氢氧化钠溶液中滴加盐酸时,要控制滴加酸的节奏,且不停振荡,使红色刚好消失,防止酸过量。
4. 加热蒸干溶液时,要注意用玻璃棒搅拌,当蒸发皿中出现较多量固体时停止加热,防止固体迸溅。
5. 实验后的废液不能倒入下水道中,以免腐蚀管道,需集中处理。
[改编·烟台] 某化学兴趣小组为探究盐酸的化学性质,进行了如下实验(所加稀盐酸均过量)。
(1)试管A 中观察
到紫色石蕊溶
液变 ______色。
例1
考向 酸、碱的化学性质
题型1 酸的化学性质
红
(2)试管B 中观察到溶液由无色逐渐变成黄色,是因为反应生成了______ (填化学式),一段时间后有气泡产生,写出产生气泡的化学方程式 _______________________。
FeCl3
Fe+2HCl===FeCl2+H2↑
(3)试管C 中发生反应的化学方程式为 __________________________________________。
(4)试管D 中观察到的现象是 ____________________。
Na2CO3+2HCl===2NaCl+H2O+CO2↑
产生白色沉淀
解:(1)酸能使紫色石蕊溶液变成红色,所以试管A 中观察到紫色石蕊溶液变红色。(2)铁锈的主要成分是氧化铁,氧化铁与稀盐酸反应生成氯化铁和水,所以试管B 中观察到溶液由无色逐渐变成黄色,是因为反应生成了FeCl3,一段时间后有气泡产生,是由于铁锈反应完了,铁与稀盐酸反应生成了氯化亚铁和氢气,所以产生气泡的化学方程式是Fe+2HCl ====FeCl2+H2 ↑。
(3)试管C 中发生的反应是碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,化学方程式是Na2CO3+2HCl ====2NaCl +H2O+CO2 ↑。(4)稀盐酸与硝酸银溶液反应生成氯化银白色沉淀。
归纳总结是学习化学的重要方法,小明同学总结了NaOH 的四条化学性质(即NaOH 与四类物质能够发生化学反应),如图2 所示。
例2
题型2 碱的化学性质
(1)为了验证反应①,小明将紫色石蕊溶液滴入
NaOH 溶液中,溶液变成 ______色。
(2)反应②说明NaOH 溶液在空气中易变质,其化学方程式为 ________________________________________。
蓝
CO2+2NaOH====Na2CO3+H2O
(3) 为了验证反应③ 能够发生, 你选择的物质是
_______(填字母)。
A. K2CO3 B. 盐酸
C. CuSO4 D. MgCl2
(4)为了验证反应④,
小明向NaOH 溶液中滴入一定量
FeCl3 溶液,该反应的现象是 ____________________。
B
产生红褐色沉淀
解题秘方:根据NaOH 的化学性质对号入座。
解:(1)氢氧化钠能与酸碱指示剂反应,如使紫色石蕊溶液变蓝;
(2)氢氧化钠因与空气中的二氧化碳反应生成碳酸钠和水而变质;
(3)③是指氢氧化钠与酸反应,盐酸属于酸,K2CO3、CuSO4、MgCl2 属于盐,选B;
(4) 氢氧化钠与氯化铁反应生成红褐色沉淀, 即FeCl3+3NaOH====Fe(OH)3 ↓ +3NaCl。
同课章节目录
