7.3.1乙醇 课件(共34张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 7.3.1乙醇 课件(共34张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 26.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2023-12-31 18:01:59 | ||
图片预览







文档简介
(共34张PPT)
酒文化博大精深,源远流长,早在几千年前,人类就掌握了发酵法酿酒的技术。
古代许多文人墨客也非常爱饮酒,有的借酒浇愁;有的激发灵感;有的以酒会友…..
互动游戏
【小游戏】说出带“酒”字的诗句。
新课导入
无水乙醇
乙醇体积分数>99.5%
白酒
乙醇体积分数25%-68%
啤酒
乙醇体积分数3%-5%
必修2教材 77-79页
第一课时:乙 醇
第三节 乙醇与乙酸
一、乙醇的物理性质
乙醇(俗称酒精)
颜色:
状态:
气味:
密度:
挥发性:
溶解性:
无色透明
特殊香味
液体
比水小 (20℃时,密度是0.7893g/cm3)
跟水以任意比互溶;
能够溶解多种有机物,是重要的有机溶剂。
易挥发(沸点低,沸点为78.5℃)
思考:以下说法或事实体现了乙醇哪些物理性质?
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深。
4.酒精灯用完后为什么要盖上灯帽
5.用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(易挥发)
(良好的有机溶剂)
小试牛刀
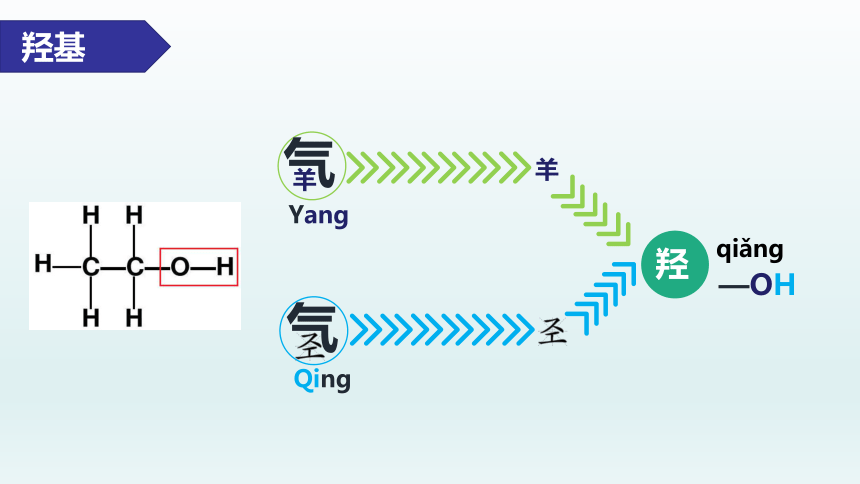
二、乙醇的组成与结构
分子式:
H H
H―C―C―O―H
H H
结构式:
CH3CH2OH或C2H5OH
结构简式:
C2H6O
球棍模型:
空间填充模型:
Yang
气
Qing
羊
—OH
羟
qiǎng
羊
气
羟基
烃的衍生物
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
C—C
H
H
H
H
H
羟基
H
—
—O—H
其它原子或原子团:包含C、H之外的其它元素的原子或原子团
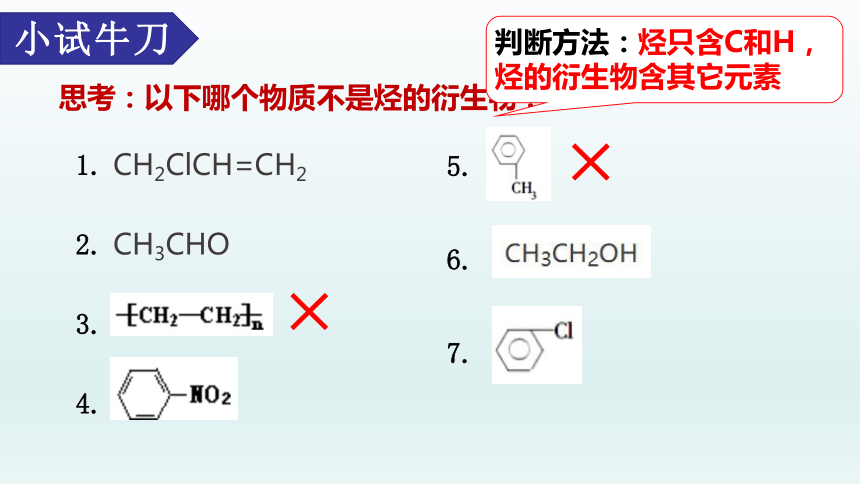
思考:以下哪个物质不是烃的衍生物?
小试牛刀
1. CH2ClCH=CH2
2. CH3CHO
3.
4.
5.
6.
7.
判断方法:烃只含C和H,烃的衍生物含其它元素
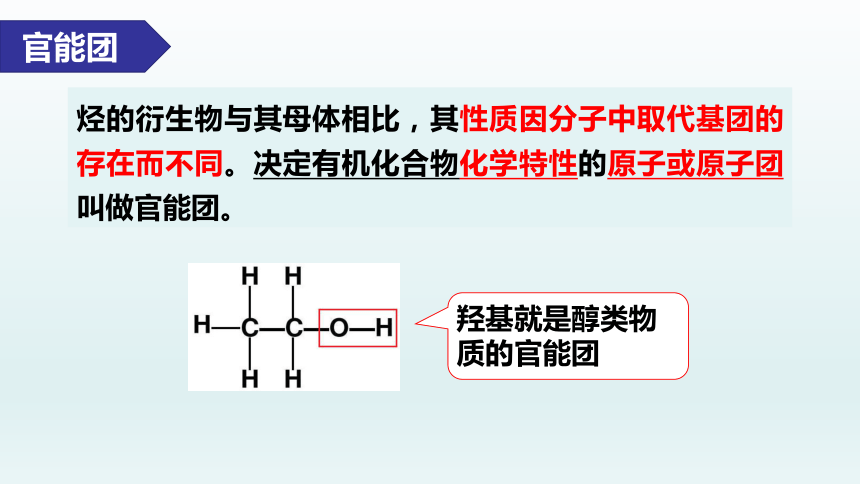
官能团
烃的衍生物与其母体相比,其性质因分子中取代基团的存在而不同。决定有机化合物化学特性的原子或原子团叫做官能团。
羟基就是醇类物质的官能团
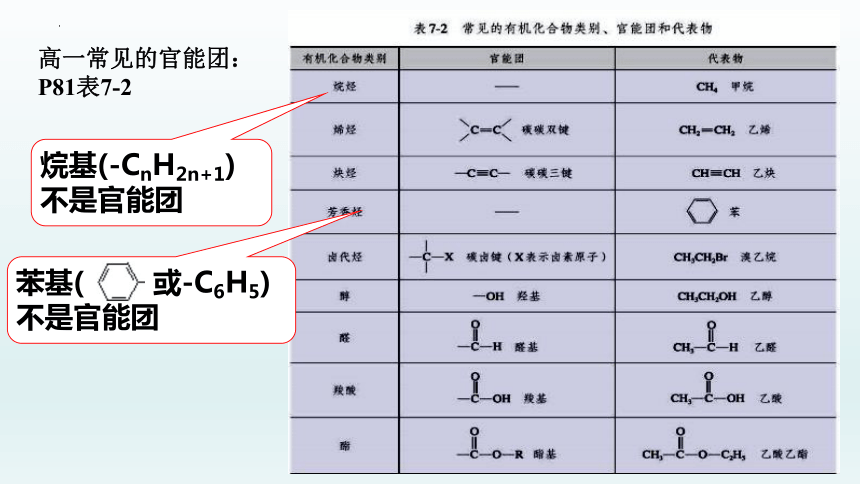
高一常见的官能团:
P81表7-2
烷基(-CnH2n+1)不是官能团
苯基( 或-C6H5)不是官能团
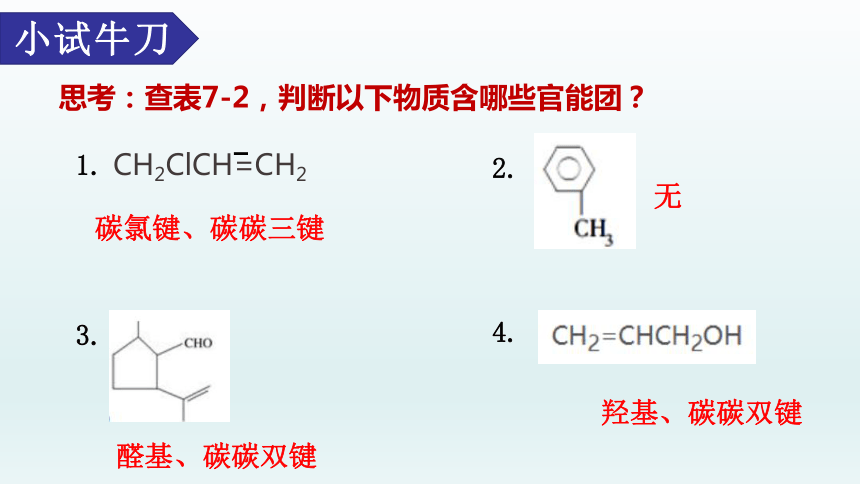
思考:查表7-2,判断以下物质含哪些官能团?
小试牛刀
1. CH2ClCH=CH2
2.
3.
4.
碳氯键、碳碳三键
醛基、碳碳双键
羟基、碳碳双键
无
三、乙醇的化学性质
结构决定性质
乙醇有哪些化学性质呢?
三、乙醇的化学性质 —— 1.乙醇与钠的反应
乙醇的-OH 和 水的OH-
很相似
H
O
H
三、乙醇的化学性质 —— 1.乙醇与钠的反应
钠与乙醇的反应:
三、乙醇的化学性质 —— 1.乙醇与钠的反应
观察演示实验【钠与乙醇的反应】
注意:
金属钠与乙醇反应时金属钠的位置;
点燃气体时干燥烧杯的变化;
加入澄清石灰水的变化。
根据这些现象,可以得出什么结论。
现象 描述 结论
结论
三、乙醇的化学性质 —— 1.乙醇与钠的反应
钠与乙醇的反应的实验现象:
产生的气体是氢气
钠开始沉于试管底部,有无色无味气泡产生,后来钠被气体带着上浮,慢慢变小直至消失
钠的密度大于乙醇的密度;反应产生了气体
干燥烧杯内壁出现白雾
白雾的主要成分是水蒸气,说明气体中含有氢元素
点燃,火焰呈淡蓝色
产生的气体可燃
加入澄清石灰水未变浑浊
说明气体中不含CO2
三、乙醇的化学性质 —— 1.乙醇与钠的反应
任务1:思考以下问题
(1)乙醇中有与碳相连的H和与氧相连的H,反应产生的氢气是来自哪种H呢?
(2)乙醇与钠反应断键位置?
任务2:请尝试写出乙醇与钠的反应的化学方程式
2CH3CH2OH + 2Na →
2CH3CH2ONa +H2↑
三、乙醇的化学性质 —— 1.乙醇与钠的反应
2CH3CH2OH + 2Na →
2CH3CH2ONa + H2↑
注意事项:
(1)不能写乙醇的分子式,要写出官能团“羟基”
(2)有机反应用箭头表示,不用等号
(3)重要数量关系:
1mol –OH ~ 1mol Na ~ 0.5mol H2
三、乙醇的化学性质 —— 1.乙醇与钠的反应
任务3:将乙醇和钠的反应与水和钠的反应进行比较,同时思考根据实验现象可以得出什么结论?
三、乙醇的化学性质 —— 1.乙醇与钠的反应
钠与乙醇 VS 钠与水的反应:
观察:
钠的位置;剧烈程度。
根据这些现象,可以得出什么结论。
三、乙醇的化学性质 —— 1.乙醇与钠的反应
钠与水 钠与乙醇
实验现象
剧烈程度
化学方程式
反应实质
浮、熔、游、响、红
钠块开始沉于试管底部,后浮上来,未熔化,最终慢慢消失。若加入酚酞,溶液变红
剧烈
缓慢
乙醇分子中羟基上的氢原子被置换
水中的氢原子被置换
氢原子的活泼性: O-H(醇)< O-H(水)
2Na+2H2O=2NaOH+H2↑
2CH3CH2OH + 2Na →
2CH3CH2ONa +H2↑
密度:ρ(水) > ρ(Na) > ρ(醇)
三、乙醇的化学性质 —— 2.乙醇的氧化反应
1、乙醇的燃烧反应
三、乙醇的化学性质 —— 2.乙醇的氧化反应
1、乙醇的燃烧反应
2CO2 +3H2O
C2H5OH + 3O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
思考:乙醇与氧气的反应,如果改变条件会发生怎样的变化?[实验7-5,课本P78]
三、乙醇的化学性质 —— 2.乙醇的氧化反应
2、乙醇的催化氧化
实验操作
实验现象
化学方程式
红色铜丝
加热
铜丝变为黑色
插入乙醇中
铜丝又变为红色,反复几次,闻到试管中的液体有刺激性气味
2 Cu + O2 2CuO
△
C2H5OH + CuO Cu + CH3CHO + H2O
△
2C2H5OH + O2 2CH3CHO + 2H2O
催化剂
△
总:
铜在这个反应中有没有参与反应?
发挥了什么作用?
认识乙醛
2C2H5OH + O2 2CH3CHO + 2H2O
催化剂
△
乙醛
物理性质:无色,有刺激性气味的液体
乙醛在一定条件下与氧气进一步氧化成乙酸(CH3COOH)。
思考
乙醇的催化氧化反应,断键发生在哪个位置呢?
2C2H5OH + O2 2CH3CHO + 2H2O
催化剂
△
三、乙醇的化学性质 —— 2.乙醇的氧化反应
3、与强氧化剂反应
CH3CH2OH CH3COOH
酸性重铬酸钾溶液
Cr2(SO4)3硫酸铬
(绿色)
K2Cr2O7重铬酸钾
(橙色)
酸性高锰酸钾溶液
K2MnO4高锰酸钾
(紫红)
褪色
乙醇能被强氧化剂如酸性KMnO4 、K2Cr2O7 溶液直接氧化为乙酸
1.作内燃机的燃料,实验室里也常用它作为燃料
2.重要的有机化工原料和溶剂,用于生产医药、香料、化妆品、涂料等
3.医疗上常用75%(体积分数)的乙醇溶液作消毒剂
四、乙醇的应用
性质决定用途
【思考】为什么有人“千杯不醉”,有人“一杯倒”,乙醇在人体内会发生哪些化学变化?(阅读课本79页资料卡片)
知识拓展
知识拓展
乙醇
1.物理性质
2.结构
3.化学性质
官能团 -OH 羟基
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
CH3CH2OH + 3O2
2CO2 + 3H2O
点燃
2CH3CH2OH + O2
2CH3CHO + 2H2O
Cu或Ag
△
氧化
反应
4.用途
五、总结升华
无色透明
特殊香味
液体
跟水以任意比互溶,能够溶解多种有机物
易挥发
与Na
CH3CH2OH CH3COOH
强氧化剂
五、总结升华
燃烧
催化氧化
与Na
酒文化博大精深,源远流长,早在几千年前,人类就掌握了发酵法酿酒的技术。
古代许多文人墨客也非常爱饮酒,有的借酒浇愁;有的激发灵感;有的以酒会友…..
互动游戏
【小游戏】说出带“酒”字的诗句。
新课导入
无水乙醇
乙醇体积分数>99.5%
白酒
乙醇体积分数25%-68%
啤酒
乙醇体积分数3%-5%
必修2教材 77-79页
第一课时:乙 醇
第三节 乙醇与乙酸
一、乙醇的物理性质
乙醇(俗称酒精)
颜色:
状态:
气味:
密度:
挥发性:
溶解性:
无色透明
特殊香味
液体
比水小 (20℃时,密度是0.7893g/cm3)
跟水以任意比互溶;
能够溶解多种有机物,是重要的有机溶剂。
易挥发(沸点低,沸点为78.5℃)
思考:以下说法或事实体现了乙醇哪些物理性质?
1.病人发烧通常用酒精擦拭全身,用此法降温。
2.衣服上沾上少许汽油用酒精可以去除。
3.酒香不怕巷子深。
4.酒精灯用完后为什么要盖上灯帽
5.用酒泡中药(药酒)—如泡枸杞
(易挥发)
(良好的有机溶剂)
(易挥发、有特殊香味)
(易挥发)
(良好的有机溶剂)
小试牛刀
二、乙醇的组成与结构
分子式:
H H
H―C―C―O―H
H H
结构式:
CH3CH2OH或C2H5OH
结构简式:
C2H6O
球棍模型:
空间填充模型:
Yang
气
Qing
羊
—OH
羟
qiǎng
羊
气
羟基
烃的衍生物
烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。
C—C
H
H
H
H
H
羟基
H
—
—O—H
其它原子或原子团:包含C、H之外的其它元素的原子或原子团
思考:以下哪个物质不是烃的衍生物?
小试牛刀
1. CH2ClCH=CH2
2. CH3CHO
3.
4.
5.
6.
7.
判断方法:烃只含C和H,烃的衍生物含其它元素
官能团
烃的衍生物与其母体相比,其性质因分子中取代基团的存在而不同。决定有机化合物化学特性的原子或原子团叫做官能团。
羟基就是醇类物质的官能团
高一常见的官能团:
P81表7-2
烷基(-CnH2n+1)不是官能团
苯基( 或-C6H5)不是官能团
思考:查表7-2,判断以下物质含哪些官能团?
小试牛刀
1. CH2ClCH=CH2
2.
3.
4.
碳氯键、碳碳三键
醛基、碳碳双键
羟基、碳碳双键
无
三、乙醇的化学性质
结构决定性质
乙醇有哪些化学性质呢?
三、乙醇的化学性质 —— 1.乙醇与钠的反应
乙醇的-OH 和 水的OH-
很相似
H
O
H
三、乙醇的化学性质 —— 1.乙醇与钠的反应
钠与乙醇的反应:
三、乙醇的化学性质 —— 1.乙醇与钠的反应
观察演示实验【钠与乙醇的反应】
注意:
金属钠与乙醇反应时金属钠的位置;
点燃气体时干燥烧杯的变化;
加入澄清石灰水的变化。
根据这些现象,可以得出什么结论。
现象 描述 结论
结论
三、乙醇的化学性质 —— 1.乙醇与钠的反应
钠与乙醇的反应的实验现象:
产生的气体是氢气
钠开始沉于试管底部,有无色无味气泡产生,后来钠被气体带着上浮,慢慢变小直至消失
钠的密度大于乙醇的密度;反应产生了气体
干燥烧杯内壁出现白雾
白雾的主要成分是水蒸气,说明气体中含有氢元素
点燃,火焰呈淡蓝色
产生的气体可燃
加入澄清石灰水未变浑浊
说明气体中不含CO2
三、乙醇的化学性质 —— 1.乙醇与钠的反应
任务1:思考以下问题
(1)乙醇中有与碳相连的H和与氧相连的H,反应产生的氢气是来自哪种H呢?
(2)乙醇与钠反应断键位置?
任务2:请尝试写出乙醇与钠的反应的化学方程式
2CH3CH2OH + 2Na →
2CH3CH2ONa +H2↑
三、乙醇的化学性质 —— 1.乙醇与钠的反应
2CH3CH2OH + 2Na →
2CH3CH2ONa + H2↑
注意事项:
(1)不能写乙醇的分子式,要写出官能团“羟基”
(2)有机反应用箭头表示,不用等号
(3)重要数量关系:
1mol –OH ~ 1mol Na ~ 0.5mol H2
三、乙醇的化学性质 —— 1.乙醇与钠的反应
任务3:将乙醇和钠的反应与水和钠的反应进行比较,同时思考根据实验现象可以得出什么结论?
三、乙醇的化学性质 —— 1.乙醇与钠的反应
钠与乙醇 VS 钠与水的反应:
观察:
钠的位置;剧烈程度。
根据这些现象,可以得出什么结论。
三、乙醇的化学性质 —— 1.乙醇与钠的反应
钠与水 钠与乙醇
实验现象
剧烈程度
化学方程式
反应实质
浮、熔、游、响、红
钠块开始沉于试管底部,后浮上来,未熔化,最终慢慢消失。若加入酚酞,溶液变红
剧烈
缓慢
乙醇分子中羟基上的氢原子被置换
水中的氢原子被置换
氢原子的活泼性: O-H(醇)< O-H(水)
2Na+2H2O=2NaOH+H2↑
2CH3CH2OH + 2Na →
2CH3CH2ONa +H2↑
密度:ρ(水) > ρ(Na) > ρ(醇)
三、乙醇的化学性质 —— 2.乙醇的氧化反应
1、乙醇的燃烧反应
三、乙醇的化学性质 —— 2.乙醇的氧化反应
1、乙醇的燃烧反应
2CO2 +3H2O
C2H5OH + 3O2
点燃
现象:产生淡蓝色火焰,同时放出大量热。
思考:乙醇与氧气的反应,如果改变条件会发生怎样的变化?[实验7-5,课本P78]
三、乙醇的化学性质 —— 2.乙醇的氧化反应
2、乙醇的催化氧化
实验操作
实验现象
化学方程式
红色铜丝
加热
铜丝变为黑色
插入乙醇中
铜丝又变为红色,反复几次,闻到试管中的液体有刺激性气味
2 Cu + O2 2CuO
△
C2H5OH + CuO Cu + CH3CHO + H2O
△
2C2H5OH + O2 2CH3CHO + 2H2O
催化剂
△
总:
铜在这个反应中有没有参与反应?
发挥了什么作用?
认识乙醛
2C2H5OH + O2 2CH3CHO + 2H2O
催化剂
△
乙醛
物理性质:无色,有刺激性气味的液体
乙醛在一定条件下与氧气进一步氧化成乙酸(CH3COOH)。
思考
乙醇的催化氧化反应,断键发生在哪个位置呢?
2C2H5OH + O2 2CH3CHO + 2H2O
催化剂
△
三、乙醇的化学性质 —— 2.乙醇的氧化反应
3、与强氧化剂反应
CH3CH2OH CH3COOH
酸性重铬酸钾溶液
Cr2(SO4)3硫酸铬
(绿色)
K2Cr2O7重铬酸钾
(橙色)
酸性高锰酸钾溶液
K2MnO4高锰酸钾
(紫红)
褪色
乙醇能被强氧化剂如酸性KMnO4 、K2Cr2O7 溶液直接氧化为乙酸
1.作内燃机的燃料,实验室里也常用它作为燃料
2.重要的有机化工原料和溶剂,用于生产医药、香料、化妆品、涂料等
3.医疗上常用75%(体积分数)的乙醇溶液作消毒剂
四、乙醇的应用
性质决定用途
【思考】为什么有人“千杯不醉”,有人“一杯倒”,乙醇在人体内会发生哪些化学变化?(阅读课本79页资料卡片)
知识拓展
知识拓展
乙醇
1.物理性质
2.结构
3.化学性质
官能团 -OH 羟基
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
CH3CH2OH + 3O2
2CO2 + 3H2O
点燃
2CH3CH2OH + O2
2CH3CHO + 2H2O
Cu或Ag
△
氧化
反应
4.用途
五、总结升华
无色透明
特殊香味
液体
跟水以任意比互溶,能够溶解多种有机物
易挥发
与Na
CH3CH2OH CH3COOH
强氧化剂
五、总结升华
燃烧
催化氧化
与Na
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
