第三章 烃的衍生物 测试题(含解析) 2023-2024学年高二下学期人教版(2019)化学选择性必修3
文档属性
| 名称 | 第三章 烃的衍生物 测试题(含解析) 2023-2024学年高二下学期人教版(2019)化学选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 656.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
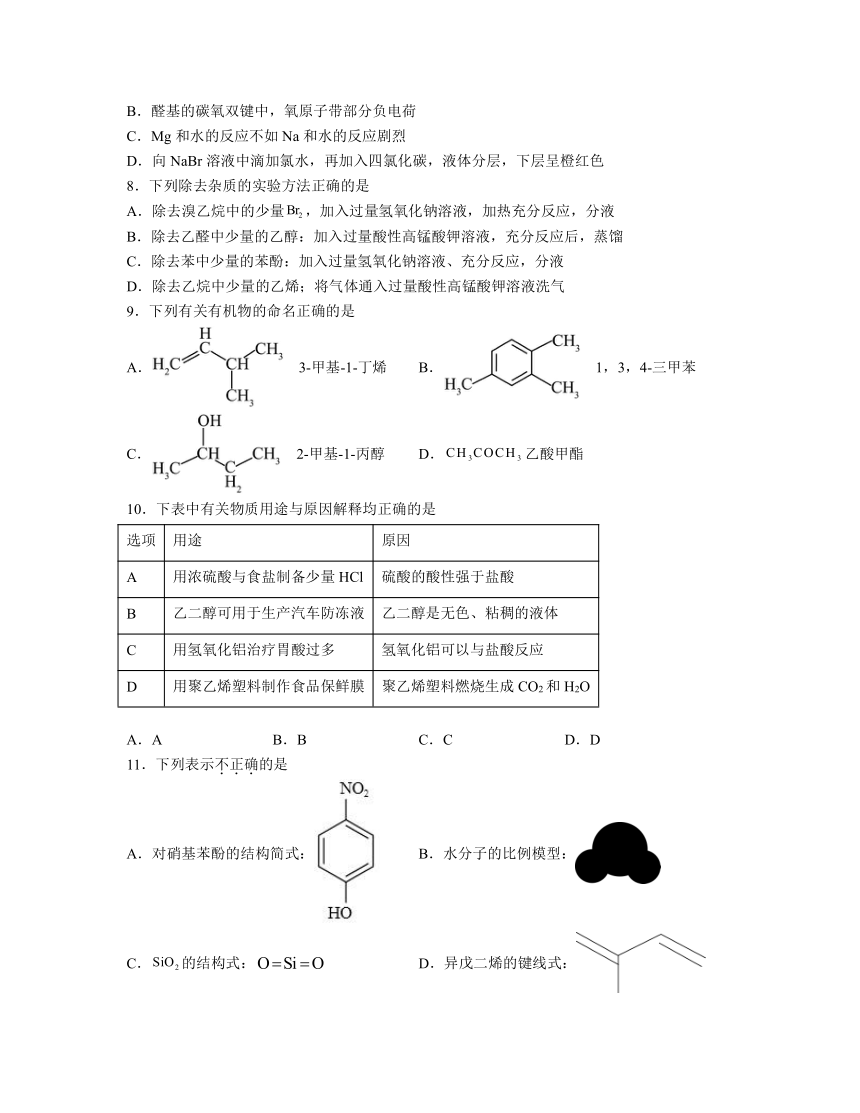
| 科目 | 化学 | ||
| 更新时间 | 2023-12-31 21:31:12 | ||
图片预览



文档简介
第三章 烃的衍生物 测试题
一、选择题
1.新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140nm,化学知识在新冠肺炎的疫情防控中发挥着重要作用,下列说法正确的是
A.新冠病毒都属于胶体
B.84消毒液和医用酒精均可杀灭新冠病毒,二者消毒原理不同
C.医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,它能使溴水褪色
D.40%的甲醛溶液可做公共餐具消毒剂
2.3,4—二羟基肉桂酸是一种有机酸,可作为染料助剂,结构如下。下列关于这种有机酸的说法错误的是
A.分子式为
B.可能发生加成反应、氧化反应、取代反应
C.可溶于水,不溶于苯和乙醇
D.分子中的所有原子可能处于一个平面
3.有机物M是合成抗过敏药物色甘酸钠的中间体,结构简式如图。下列关于该有机物的说法正确的是
A.分子中只含有醚键、酯基两种官能团
B.能与NaOH溶液反应
C.苯环上的一氯取代物有4种
D.所有碳原子不可能共平面
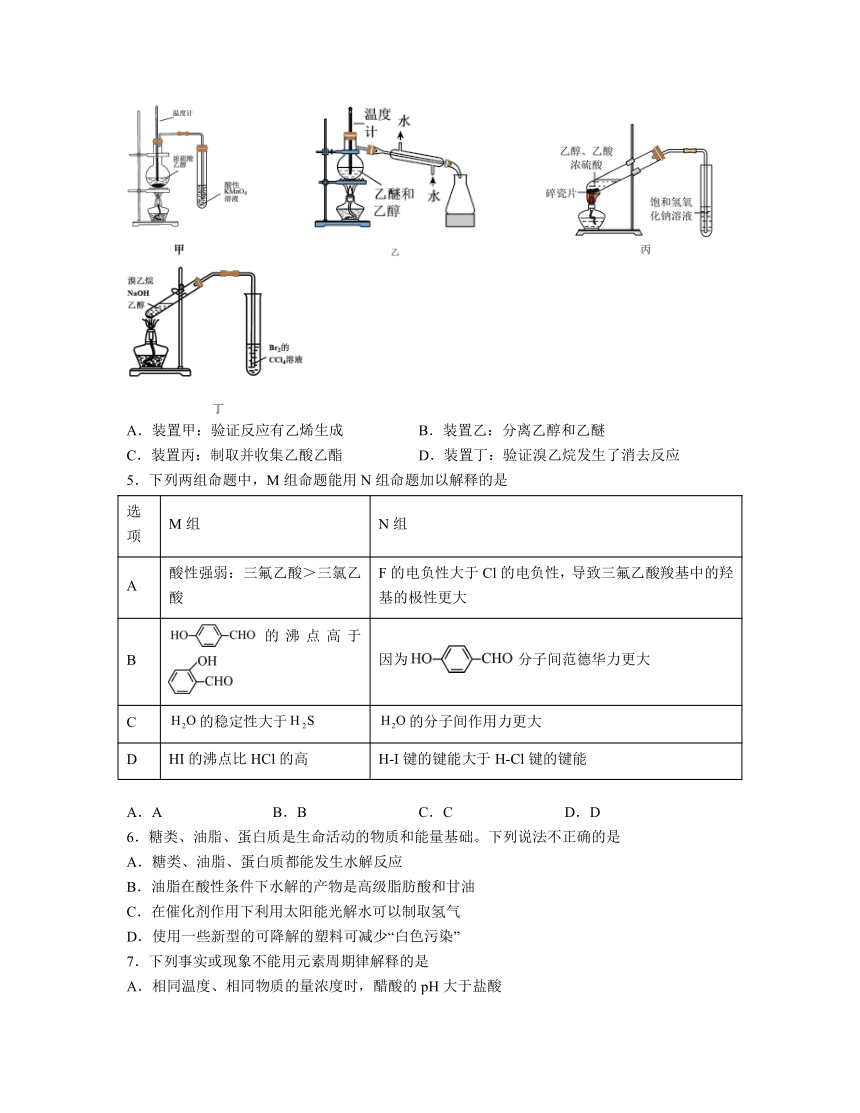
4.下列实验原理或装置能达到实验目的的是
A.装置甲:验证反应有乙烯生成 B.装置乙:分离乙醇和乙醚
C.装置丙:制取并收集乙酸乙酯 D.装置丁:验证溴乙烷发生了消去反应
5.下列两组命题中,M组命题能用N组命题加以解释的是
选项 M组 N组
A 酸性强弱:三氟乙酸>三氯乙酸 F的电负性大于Cl的电负性,导致三氟乙酸羧基中的羟基的极性更大
B 的沸点高于 因为分子间范德华力更大
C 的稳定性大于 的分子间作用力更大
D HI的沸点比HCl的高 H-I键的键能大于H-Cl键的键能
A.A B.B C.C D.D
6.糖类、油脂、蛋白质是生命活动的物质和能量基础。下列说法不正确的是
A.糖类、油脂、蛋白质都能发生水解反应
B.油脂在酸性条件下水解的产物是高级脂肪酸和甘油
C.在催化剂作用下利用太阳能光解水可以制取氢气
D.使用一些新型的可降解的塑料可减少“白色污染”
7.下列事实或现象不能用元素周期律解释的是
A.相同温度、相同物质的量浓度时,醋酸的pH大于盐酸
B.醛基的碳氧双键中,氧原子带部分负电荷
C.Mg和水的反应不如Na和水的反应剧烈
D.向NaBr溶液中滴加氯水,再加入四氯化碳,液体分层,下层呈橙红色
8.下列除去杂质的实验方法正确的是
A.除去溴乙烷中的少量,加入过量氢氧化钠溶液,加热充分反应,分液
B.除去乙醛中少量的乙醇:加入过量酸性高锰酸钾溶液,充分反应后,蒸馏
C.除去苯中少量的苯酚:加入过量氢氧化钠溶液、充分反应,分液
D.除去乙烷中少量的乙烯;将气体通入过量酸性高锰酸钾溶液洗气
9.下列有关有机物的命名正确的是
A. 3-甲基-1-丁烯 B. 1,3,4-三甲苯
C. 2-甲基-1-丙醇 D.乙酸甲酯
10.下表中有关物质用途与原因解释均正确的是
选项 用途 原因
A 用浓硫酸与食盐制备少量HCl 硫酸的酸性强于盐酸
B 乙二醇可用于生产汽车防冻液 乙二醇是无色、粘稠的液体
C 用氢氧化铝治疗胃酸过多 氢氧化铝可以与盐酸反应
D 用聚乙烯塑料制作食品保鲜膜 聚乙烯塑料燃烧生成CO2和H2O
A.A B.B C.C D.D
11.下列表示不正确的是
A.对硝基苯酚的结构简式: B.水分子的比例模型:
C.的结构式: D.异戊二烯的键线式:
12.维生素D含量越高,老年大脑认知功能越好,目前已知的维生素D至少有10种分子,维生素D3是其中重要的一种(结构如图),下列有关说法正确的是
A.维生素D3是一种水溶性维生素
B.维生素D3分子式为
C.维生素D3中的羟基能被催化氧化生成醛基
D.维生素D3分子中虚线框内所含碳原子不可能共平面
13.下列实验操作、现象、解释或结论都正确的是
选项 实验 现象 结论
A 向某卤代烃中加入氢氧化钠水溶液加热后,向其中加入硝酸银溶液 产生白色沉淀 此有机物为氯代烃
B 向苯当中加入少量的浓溴水,静置 产生白色沉淀 苯与溴发生取代反应,产生溴苯
C 将电石和饱和食盐水反应生成的气体通入酸性高锰酸钾溶液中 高锰酸钾溶液紫色褪去 电石和水反应生成了乙炔
D 分别取2mL 0.5mol/L的溶液加入两支试管中,将其中的一支试管先加热,然后置于冷水中,与另一支试管进行对比 加热试管,溶液变为黄绿色:置于冷水中溶液由黄绿色变为蓝绿色 升温平衡正移,黄色的增多,降温平衡逆移,蓝色的增多
A.A B.B C.C D.D
14.下面反应:①由乙炔制氯乙烯 ②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色
④乙烯使酸性高锰酸钾溶液褪色 ⑤由乙烯制聚乙烯 ⑥乙烷与氯气在光照的条件下反应 ⑦溴乙烷和氢氧化钠乙醇溶液共热;⑧溴乙烷和氢氧化钠溶液共热; 其中属于取代反应的是( )
A.⑥⑧ B.②④ C.①③ D.⑦⑧
15.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物。它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)
A.3 B.4 C.5 D.6
二、填空题
16.咖啡酸是某种抗氧化剂的成分之一,其结构简式如图,请回答:
(1)咖啡酸的分子式为____。
(2)咖啡酸可以发生的反应是____(填写序号)。
①氧化反应 ②加成反应 ③酯化反应 ④加聚反应 ⑤消去反应
(3)写出咖啡酸与足量NaHCO3溶液反应的化学方程式:____。
(4)写出咖啡酸在一定条件下通过加聚反应生成高分子化合物的方程式____。
17.现有下列六种有机物:① ② ③ ④ ⑤⑥,请回答:
(1)有机物①④⑥熔沸点最高的是___________(填序号)。
(2)有机物②中有___________个手性碳原子。
(3)有机物⑤的系统名称为___________。
(4)写出有机物③与足量的NaOH溶液反应的化学方程式___________。
18.在NaOH溶液中加入适量CuSO4溶液,再滴加甲醛溶液,加热,可观察到的现象是____________,加热时反应的化学方程式是___________________________________,此反应可用于检验____________的存在。
19.按要求填空
(1)用系统法将下列物质命名
①___________
②___________
(2)写出下列物质的结构简式
①2,2-二甲基丙烷___________
②2,3,5-三甲基-3,4-二乙基庚烷___________
(3)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填在横线上
①乙烷(乙烯)___________
②乙炔(H2S)___________
20.卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应,其实质是带负电的原子团(例如OH-等阴离子)取代卤代烃中的卤原子。例如:CH3CH2CH2Br+OH-(或NaOH)→CH3CH2CH2—OH+Br-(或NaBr)
写出下列反应的化学方程式:
(1)溴乙烷跟NaHS反应_____________________。
(2)碘甲烷跟CH3COONa反应_____________________。
(3)由碘甲烷、无水乙醇和金属钠合成甲乙醚(CH3—O—CH2CH3)。_______;_______。
21.概念与分类
(1)概念:烃分子中氢原子被___________原子取代后生成的化合物。
(2)分类:
①按分子中卤素原子个数分:___________和___________;
②按所含卤素原子种类分:___________、___________、___________、___________;
③按烃基种类分:饱和卤代烃和不饱和卤代烃;
④按是否含苯环分:脂肪卤代烃和芳香卤代烃。
22.以某有机物X为原料可合成高分子塑料G,X的相对分子质量小于100,1 mol有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2 112 L,且X分子中含有羰基和羟基。X能发生如图所示的转化:
已知:在HIO4、加热条件下生成RCHO和R'CHO。回答下列问题:
(1)X的结构简式为___________。
(2)E→F的反应条件是___________。
(3)写出F→G的化学方程式:___________,该反应的反应类型为___________。
(4)A→D的化学方程式为___________,该反应的反应类型为___________。
(5)Y是X的同分异构体,1molY与足量的Na反应可生成1 mol H2,且Y不能使溴的CCl4溶液褪色,Y分子中的官能团连在相邻的碳原子上。Y的核磁共振氢谱图中有3组峰,峰面积之比为2:1:1。Y的结构简式为___________。
23.1,2-二氯乙烷是制备杀菌剂和植物生长调节剂的中间体,在农业上可用作粮食、谷物的熏蒸剂、土壤消毒剂等,已知其沸点为83.5℃,熔点为-35℃。下图为实验室中制备1,2-二氯乙烷的装置,其中加热和夹持装置已略去。装置A中的无水乙醇的密度约为0.8 g/cm3。
(1)装置A中还缺少的一种必要仪器是_______,使用冷凝管的目的是_______;
装置A中发生主要反应的化学方程式为_______;
(2)装置B中应加入的最佳试剂为_______;
(3)D中a、c两个导气管进入仪器中的长度不同,其优点是_______;还可用如下图所示装置替代装置D,则装置D中最适宜的试剂为_______;
(4)实验结束后收集得到0.24mol 1,2-二氯乙烷,则乙醇的利用率为_______%。
【参考答案】
一、选择题
1.B
解析:A.新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140nm,胶体分散质直径在1~100nm,则超过100nm的新冠病毒扩散到空气中不能形成胶体,故A错误;
B.84消毒液为次氯酸钠水溶液,次氯酸钠中氯元素的化合价为+1价,具有强氧化性,医用酒精主要成分是乙醇,乙醇能够使蛋白质变性,失去活性,从而杀死细菌,并非是利用乙醇的氧化性,二者消毒原理不同,故B正确;
C.聚丙烯不含有碳碳双键,不能使溴水褪色,故C错误;
D.40%的甲醛溶液有毒,不可做公共餐具消毒剂,故D错误;
答案选:B。
2.C
解析:A.分子式为,A项正确;
B.苯环、碳碳双键可以发生加成反应,苯环上氢原子可以发生取代反应,大多数有机物可以发生氧化反应,B项正确;
C.该有机物可溶于水、苯和乙醇,C项错误;
D.苯环、碳碳双键和羧基为平面结构,单键可以旋转,分子中的所有原子可能处于一个平面,D项正确;
故选C。
3.B
解析:A.分子中含有醚键、酯基、碳碳双键3种官能团,A错误;
B.该物质分子中含有酯基,因此能与NaOH溶液反应,B正确;
C.根据物质结构简式可知:在苯环上含有3种不同位置的H原子,处于苯环上的一氯取代物有3种,C错误;
D.苯分子是平面分子,-OCH3的O取代苯分子中H原子的位置,单键可以旋转,可能处于同一平面上;乙烯分子是平面分子,-CH3及酯基的C原子取代乙烯分子中H原子的位置,在乙烯分子的平面上,乙烯平面与苯分子平面共直线,由于碳碳单键可以旋转,则该分子中所有碳原子可能共平面,D错误;
故选B。
4.D
解析:A.乙醇和浓硫酸的混合物加热到170℃可制得乙烯,由于乙醇具有挥发性,挥发出来的乙醇也能使酸性高锰酸钾溶液褪色,故装置甲不能验证反应有乙烯生成,A不合题意;
B.乙醇和乙醚互溶,沸点不同可以用蒸馏操作来分离,但装置乙中温度计水银球应位于蒸馏烧瓶的支管口处,B不合题意;
C.乙酸乙酯在NaOH溶液中能够发生完全水解生成乙酸钠和乙醇,故用装置丙可以制取乙酸乙酯,但不能用于收集乙酸乙酯,C不合题意;
D.溴乙烷在NaOH醇溶液中共热,发生消去反应生成乙烯,由于挥发出的乙醇不能使Br2的CCl4溶液褪色,故装置丁能实现验证溴乙烷发生了消去反应的目的,D符合题意;
故答案为:D。
5.A
解析:A.由于F的电负性大于Cl的电负性,所以三氟乙酸羧基中的羟基的极性更大,即三氟乙酸的酸性强于三氯乙酸,A项正确;
B.易形成分子间氢键,熔沸点较高,易形成分子内氢键,熔沸点降低,所以的沸点高于,B项错误;
C.由于O的非金属性强于S,所以的稳定性大于,C项错误;
D.HI和HCl均为分子晶体,且HI的相对分子质量大,分子间作用力更强,所以HI的沸点比HCl的高,D项错误;
故答案选A。
6.A
解析:A.单糖不能水解,A错误;
B.油脂属于酯类,酸性环境下水解生成对应的高级脂肪酸和甘油,B正确;
C.利用太阳能转化为化学能,可以在催化剂条件下光解水,C正确;
D. 治理白色污染的一条途径就是利用可降解塑料,D正确;
故选A。
7.A
解析:A.相同温度、相同物质的量浓度时,醋酸是弱酸未完成电离,故醋酸的pH大于盐酸,不能用元素周期律解释,A符合题意;
B.同周期元素随原子序数的递增电负性增强,故醛基的碳氧双键中,氧原子带部分负电荷,B不符合题意;
C.同周期元素随原子序数的递增金属性减弱,故Mg和水的反应不如Na和水的反应剧烈,C不符合题意;
D.同主族元素从上到下非金属性越来越弱,氯气氧化性强于溴单质,故向NaBr溶液中滴加氯水,可以置换出溴单质,溴单质在四氯化碳中溶解度比水的大,液体分层,下层呈橙红色,D不符合题意;
故选A。
8.C
解析:A.加入过量氢氧化钠溶液加热,溴乙烷会水解生成乙醇,A错误;
B.加入过量酸性高锰酸钾后,乙醛也会被酸性高锰酸钾氧化,B错误;
C.苯酚与氢氧化钠反应生成苯酚钠溶于水,苯不溶于水且不与氢氧化钠反应,苯在上层,分液后可除去苯中含有的少量苯酚,C正确;
D.乙烯被酸性高锰酸钾氧化生成二氧化碳,又引入了新的杂质,D错误;
故答案选C。
9.A
解析:A.该物质主链为丁烯,官能团碳碳双键在1号碳上,甲基取代在3号碳,命名为3-甲基-1-丁烯,A正确;
B.取代基编号和最小原则,正确的命名为1,2,4-三甲苯,B错误;
C.选含羟基最长碳链为主链即为丙醇,甲基取代在1号碳上,命名为1-甲基-1-丙醇,C错误;
D.该物质含有酮羰基,不是酯基,命名为丙酮,D错误;
故选:A。
10.C
解析:A.微热时氯化钠固体和浓硫酸生成硫酸氢钠和氯化氢气体,强热时氯化钠固体和浓硫酸生成硫酸钠和氯化氢气体,是利用不挥发性酸制取挥发性酸,A错误;
B.乙二醇可用于生产汽车防冻液,是因为乙二醇水溶液的凝固点可达-50°C,B错误;
C.氢氧化铝是不溶于水的具有弱碱性的两性氢氧化物、可以与盐酸反应,故用氢氧化铝治疗胃酸过多,C正确;
D.聚乙烯塑料无毒、用聚乙烯塑料制作食品保鲜膜,D错误;
答案选C。
11.C
解析:A.对硝基苯酚中,硝基和酚羟基处于苯环对位,对应结构简式为,A正确;
B.水分子空间构型为V形,氢原子半径比氧原子半径小,对应比例模型为,B正确;
C.SiO2为原子晶体,由原子构成,其中硅原子和氧原子以共价键相互连接形成立体网状结构,C错误;
D.异戊二烯中含有两个碳碳双键,2号碳原子上连有支链甲基,对应键线式为: ,D正确;
故答案选C。
12.B
解析:A.由结构可知维生素D3中烃基基团较大,烃基属于憎水基,因此维生素D3不易溶水,属于脂溶性维生素,故A错误;
B.由结构简式可知维生素D3分子式为,故B正确;
C.该结构中羟基所连碳上只有一个氢,催化氧化产物为酮,故C错误;
D.虚线框内的碳元素均处于碳碳双键的平面上,两平面可重合,所有碳原子可以共面,故D错误;
故选:B。
13.D
解析:A.向某卤代烃中加入氢氧化钠水溶液加热后,卤代烃发生水解反应,要证明其中含有氯元素,因此先向水解后的溶液中加入硝酸酸化,中和过量的NaOH,然后再向其中加入硝酸银溶液,若此时产生白色沉淀,就证明水解产生了Cl-,原来的卤代烃为卤代烃,否则反应后过量OH-与Ag+也会反应产生白色沉淀,干扰Cl-的检验,A错误;
B.苯与溴水会发生萃取作用导致溴水颜色变浅,要证明苯会发生取代反应,应该向苯中加入液溴,同时加入催化剂铁粉,该实验操作不能达到实验目的,B错误;
C.电石中含有的杂质CaS与水反应产生H2S具有还原性,也会被酸性KMnO4溶液氧化而使溶液褪色,因此不能证明电石和水反应生成了乙炔气体,C错误;
D.两个试管对比只有温度不同,升高温度,溶液颜色变为黄绿色,说明溶液中存在平衡:,升温后化学平衡正向移动,导致黄色的增多;降低温度,化学平衡逆向移动,使溶液中蓝色的增多,因此说明该反应的正反应是吸热反应,故△H>0,D正确;
故合理选项是D。
14.A
解析:①乙炔和氯化氢发生加成反应生成氯乙烯,属于加成反应;②乙烷在空气中燃烧生成二氧化碳和水,属于氧化反应;③乙烯和溴的四氯化碳溶液发生加成反应生成1,2-二溴乙烷,属于加成反应;④乙烯使酸性高锰酸钾溶液褪色,属于氧化反应;⑤乙烯发生加聚反应生成聚乙烯,属于加聚反应;⑥乙烷与氯气在光照的条件下反应生成氯乙烷和氯化氢,属于取代反应; ⑦溴乙烷和氢氧化钠乙醇溶液共热生成乙烯、溴化钠、水,属于消去反应;⑧溴乙烷和氢氧化钠溶液共热生成乙醇、溴化钠,属于取代反应;属于取代反应的是⑥⑧,选A。
15.B
解析:C2HF3ClBr可以可知乙烷中的5个H原子分别为1个Cl、1个Br、3个F原子取代,乙烷只有一种结构,氯原子、溴原子、氟原子连在碳原子上,调节位置,有CF3CHBrCl、BrCF2CHClF、ClCF2CHBrF、HCF2CFClBr,共有4种。
故选B。
二、填空题
16.(1)C9H8O2
(2)①②③④
(3)+ NaHCO3→CO2+H2O+
(4)
解析:(1)根据咖啡酸的结构简式,可知其分子式为C9H8O2。
(2)①该分子含有酚羟基、碳碳双键,可以发生氧化反应,故正确;
②该分子含有碳碳双键,可以加成反应,故正确;
③该分子含有酚羟基,可以酯化反应,故正确;
④该分子含有碳碳双键,可以加聚反应,故正确;
⑤该分子含有酚羟基、碳碳双键、羧基,不能发生消去反应,故错误;综上所述咖啡酸可以发生的反应是①②③④。
(3)咖啡酸含有羧基,与足量NaHCO3溶液反应的化学方程式为+ NaHCO3→CO2+H2O+ 。
(4)咖啡酸含有碳碳双键,在一定条件下通过加聚反应生成高分子化合物的方程式为。
17.(1)④
(2)1
(3)1,2,4-三甲基苯(或1,2,4-三甲苯)
(4)
解析:(1)烷烃分子中碳原子数越多熔沸点越高,碳原子数相同,支链越多熔沸点越低,有机物①④⑥熔沸点最高的是,选④。
(2)中有1个手性碳原子(*标出)。
(3)根据位置和最小原则,的系统名称为1,2,4-三甲苯。
(4)中羧基、酚羟基、酯基都能与氢氧化钠反应,反应方程式为。
18. 产生红色沉淀 HCHO+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O(或HCHO+2Cu(OH)2+NaOHHCOONa+Cu2O↓+3H2O) 醛基
【分析】反应的实质是新制的Cu(OH)2浊液将醛基氧化,而自身被还原为Cu2O红色沉淀。
解析:醛基把新制Cu(OH)2还原为Cu2O红色沉淀;由于HCHO可以看作含有两个醛基,根据新制Cu(OH)2的量,可以发生一次氧化,也可以发生两次氧化,所以反应的化学方程式为HCHO+2Cu(OH)2+NaOHHCOONa+Cu2O↓+3H2O(或HCHO+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O);由于反应现象具有特征性,所以可用来检验醛基的存在。
19.(1) 2-甲基-1,3-丁二烯 2-丁醇
(2)
(3) 溴水 硫酸铜溶液
解析:(1)①选择含碳碳双键的最长碳链为主链,然后依次使双键的位置、支链位置最小,则 命名为2-甲基-1,3-丁二烯;
②使与-OH相连的C序数较小,则 命名为2-丁醇;
(2)先确定主链为丙烷,2号C有二个甲基,2,2-二甲基丙烷的结构简式为 ;
②先确定主链有7个C,2,3,5号C上有3个甲基,3,4号C上有2个乙基,则2,3,5-三甲基-3,4-二乙基庚烷的结构简式为 ;
(3)①乙烯能和溴水反应而被吸收,乙烷不能,故用溴水;
②硫化氢能和硫酸铜反应而被吸收,乙炔不能,故用硫酸铜溶液。
20. CH3CH2Br+NaHS→CH3CH2SH+NaBr CH3I+ CH3COONa→CH3COOCH3+NaI 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ CH3I+CH3CH2ONa→CH3OCH2CH3+NaI
解析:(1)NaHS中阴离子是HS-,所以根据题中的信息可知,反应的化学方程式是CH3CH2Br+NaHS→CH3CH2SH+NaBr。
(2)醋酸钠中阴离子是醋酸根离子,所以该反应的化学方程式是CH3I+ CH3COONa→CH3COOCH3+NaI。
(3)金属钠能和乙醇作用生成乙醇钠,进而乙醇钠和碘甲烷发生取代反应,生成甲乙醚,反应的化学方程式是2CH3CH2OH+2Na→2CH3CH2ONa+H2↑、CH3I+CH3CH2ONa→CH3OCH2CH3+NaI。
21.卤素 单卤代烃 多卤代烃 氟代烃 氯代烃 溴代烃 碘代烃
解析:略
22.(1)
(2)NaOH醇溶液、加热
(3) n CH2=CH-COCH3 加聚反应
(4) n +nHOOCCOOH+(2n-1)H2O 缩聚反应
(5)
解析:1 mol有机物X完全燃烧生成等物质的量的CO2和H2O,则有机物中C、H原子个数之比为1:2。1 mol有机物燃烧消耗标准状况下112 L的O2,其物质的量n(O2)==5 mol。X的相对分子质量小于100,且X分子中含有羰基和羟基,则X结构简式为。厨房酸味剂C是CH3COOH,B能够与银氨溶液发生反应,逆推B是CH3CHO,X与H2发生加成反应产生A,A与HIO4发生氧化反应产生B,则A是CH3CH (OH)CH (OH)CH3。A是二元醇,A与乙二酸发生酯化反应生成高分子化合物D,D为。结合信息可知A与HBr在一定条件下发生-OH的取代反应产生E,则E为CH3COCHBrCH3,E与NaOH的乙醇溶液共热发生消去反应产生F,E→F应为卤代烃的消去反应,则F为CH2=CH-COCH3,F分子中含有不饱和的碳碳双键,在一定条件下发生加聚反应产生G为,然后结合有机物的结构和性质进行解答。
(1)根据上述分析可知X结构简式是:。
(2)E是CH3COCHBrCH3,F为CH2=CH-COCH3,E与NaOH的乙醇溶液共热发生消去反应产生F,故E→F的反应条件是NaOH醇溶液、加热。
(3)F为CH2=CH-COCH3,分子中含有不饱和的碳碳双键,在一定条件下发生加聚反应产生G为,反应方程式为:nCH2=CH-COCH3,该反应的类型是加聚反应。
(4)A是CH3CH (OH)CH (OH)CH3,A与乙二酸发生缩聚反应生成高分子化合物D,则D为,同时产生水,则A→D的化学方程式为n +nHOOCCOOH+(2n-1)H2O。
(5)X是,Y是X的同分异构体,1 mol Y与足量的Na反应可生成1 mol H2,说明其分子中含有2个-OH;且Y不能使溴的CCl4溶液褪色,说明Y分子中不含有碳碳双键,Y分子中含有1个环状结构,Y分子中的官能团连在相邻的碳原子上,Y的核磁共振氢谱图中有3组峰,峰面积之比为2:1:1,则Y的结构简式为。
23.(1) 温度计 使乙醇冷凝回流,提高原料利用率 CH3CH2OHCH2=CH2↑+H2O
(2)NaOH溶液
(3)有利于Cl2、C2H4充分混合反应 CH2ClCH2Cl
(4)69
解析:实验室制备1,2-二氯乙烷时,通常采用乙烯与氯气加成,乙烯来自乙醇的消去反应,此时乙醇中常混有CO2、SO2等酸性气体,尤其是SO2,在水溶液中会与氯气发生反应,所以应使用碱液吸收。
(1)装置A中,在浓硫酸的作用下,乙醇在170℃左右发生消去反应,所以还缺少控制温度的仪器,该仪器是温度计,乙醇易挥发,从而导致利用率下降,所以使用冷凝管的目的是使乙醇冷凝回流,提高原料利用率,装置A中,乙醇发生消去反应,生成乙烯和水,发生主要反应的化学方程式为CH3CH2OHCH2=CH2↑+H2O。答案为:温度计;使乙醇冷凝回流,提高原料利用率;CH3CH2OHCH2=CH2↑+H2O;
(2)因为有少部分乙醇被浓硫酸氧化为二氧化碳等,同时浓硫酸被乙醇还原为二氧化硫,二者都混在乙烯气体中,所以装置B中应加入的最佳试剂为NaOH溶液。答案为:NaOH溶液;
(3)为提高乙烯与氯气的利用率,两气体应充分接触,则D中a、c两个导气管进入仪器中的长度不同,其优点是有利于Cl2、C2H4充分混合反应;还可用图示装置替代装置D,装置D中,为增大乙烯与氯气的接触面积,应加入能溶解二种气体的溶剂,但不能引入杂质,所以最适宜的试剂为CH2ClCH2Cl。答案为:有利于Cl2、C2H4充分混合反应;CH2ClCH2Cl;
(4)n(乙醇)=,实验结束后收集得到0.24mol 1,2-二氯乙烷,则生成乙烯的物质的量为0.24mol,参加反应的乙醇为0.24mol,从而得出乙醇的利用率为≈69%。答案为:69。
【点睛】作为溶剂,应不影响产品的纯度,所以用产品作为溶剂,效果最佳
一、选择题
1.新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140nm,化学知识在新冠肺炎的疫情防控中发挥着重要作用,下列说法正确的是
A.新冠病毒都属于胶体
B.84消毒液和医用酒精均可杀灭新冠病毒,二者消毒原理不同
C.医用外科口罩和防护服所用的熔喷布是一种聚丙烯材料,它能使溴水褪色
D.40%的甲醛溶液可做公共餐具消毒剂
2.3,4—二羟基肉桂酸是一种有机酸,可作为染料助剂,结构如下。下列关于这种有机酸的说法错误的是
A.分子式为
B.可能发生加成反应、氧化反应、取代反应
C.可溶于水,不溶于苯和乙醇
D.分子中的所有原子可能处于一个平面
3.有机物M是合成抗过敏药物色甘酸钠的中间体,结构简式如图。下列关于该有机物的说法正确的是
A.分子中只含有醚键、酯基两种官能团
B.能与NaOH溶液反应
C.苯环上的一氯取代物有4种
D.所有碳原子不可能共平面
4.下列实验原理或装置能达到实验目的的是
A.装置甲:验证反应有乙烯生成 B.装置乙:分离乙醇和乙醚
C.装置丙:制取并收集乙酸乙酯 D.装置丁:验证溴乙烷发生了消去反应
5.下列两组命题中,M组命题能用N组命题加以解释的是
选项 M组 N组
A 酸性强弱:三氟乙酸>三氯乙酸 F的电负性大于Cl的电负性,导致三氟乙酸羧基中的羟基的极性更大
B 的沸点高于 因为分子间范德华力更大
C 的稳定性大于 的分子间作用力更大
D HI的沸点比HCl的高 H-I键的键能大于H-Cl键的键能
A.A B.B C.C D.D
6.糖类、油脂、蛋白质是生命活动的物质和能量基础。下列说法不正确的是
A.糖类、油脂、蛋白质都能发生水解反应
B.油脂在酸性条件下水解的产物是高级脂肪酸和甘油
C.在催化剂作用下利用太阳能光解水可以制取氢气
D.使用一些新型的可降解的塑料可减少“白色污染”
7.下列事实或现象不能用元素周期律解释的是
A.相同温度、相同物质的量浓度时,醋酸的pH大于盐酸
B.醛基的碳氧双键中,氧原子带部分负电荷
C.Mg和水的反应不如Na和水的反应剧烈
D.向NaBr溶液中滴加氯水,再加入四氯化碳,液体分层,下层呈橙红色
8.下列除去杂质的实验方法正确的是
A.除去溴乙烷中的少量,加入过量氢氧化钠溶液,加热充分反应,分液
B.除去乙醛中少量的乙醇:加入过量酸性高锰酸钾溶液,充分反应后,蒸馏
C.除去苯中少量的苯酚:加入过量氢氧化钠溶液、充分反应,分液
D.除去乙烷中少量的乙烯;将气体通入过量酸性高锰酸钾溶液洗气
9.下列有关有机物的命名正确的是
A. 3-甲基-1-丁烯 B. 1,3,4-三甲苯
C. 2-甲基-1-丙醇 D.乙酸甲酯
10.下表中有关物质用途与原因解释均正确的是
选项 用途 原因
A 用浓硫酸与食盐制备少量HCl 硫酸的酸性强于盐酸
B 乙二醇可用于生产汽车防冻液 乙二醇是无色、粘稠的液体
C 用氢氧化铝治疗胃酸过多 氢氧化铝可以与盐酸反应
D 用聚乙烯塑料制作食品保鲜膜 聚乙烯塑料燃烧生成CO2和H2O
A.A B.B C.C D.D
11.下列表示不正确的是
A.对硝基苯酚的结构简式: B.水分子的比例模型:
C.的结构式: D.异戊二烯的键线式:
12.维生素D含量越高,老年大脑认知功能越好,目前已知的维生素D至少有10种分子,维生素D3是其中重要的一种(结构如图),下列有关说法正确的是
A.维生素D3是一种水溶性维生素
B.维生素D3分子式为
C.维生素D3中的羟基能被催化氧化生成醛基
D.维生素D3分子中虚线框内所含碳原子不可能共平面
13.下列实验操作、现象、解释或结论都正确的是
选项 实验 现象 结论
A 向某卤代烃中加入氢氧化钠水溶液加热后,向其中加入硝酸银溶液 产生白色沉淀 此有机物为氯代烃
B 向苯当中加入少量的浓溴水,静置 产生白色沉淀 苯与溴发生取代反应,产生溴苯
C 将电石和饱和食盐水反应生成的气体通入酸性高锰酸钾溶液中 高锰酸钾溶液紫色褪去 电石和水反应生成了乙炔
D 分别取2mL 0.5mol/L的溶液加入两支试管中,将其中的一支试管先加热,然后置于冷水中,与另一支试管进行对比 加热试管,溶液变为黄绿色:置于冷水中溶液由黄绿色变为蓝绿色 升温平衡正移,黄色的增多,降温平衡逆移,蓝色的增多
A.A B.B C.C D.D
14.下面反应:①由乙炔制氯乙烯 ②乙烷在空气中燃烧③乙烯使溴的四氯化碳溶液褪色
④乙烯使酸性高锰酸钾溶液褪色 ⑤由乙烯制聚乙烯 ⑥乙烷与氯气在光照的条件下反应 ⑦溴乙烷和氢氧化钠乙醇溶液共热;⑧溴乙烷和氢氧化钠溶液共热; 其中属于取代反应的是( )
A.⑥⑧ B.②④ C.①③ D.⑦⑧
15.氟烷(分子式C2HF3ClBr)可以看作乙烷中的H原子被F、Br、Cl等原子取代的产物。它是一种全身麻醉药,根据你所学知识判断,它的同分异构体数目为(不考虑立体异构)
A.3 B.4 C.5 D.6
二、填空题
16.咖啡酸是某种抗氧化剂的成分之一,其结构简式如图,请回答:
(1)咖啡酸的分子式为____。
(2)咖啡酸可以发生的反应是____(填写序号)。
①氧化反应 ②加成反应 ③酯化反应 ④加聚反应 ⑤消去反应
(3)写出咖啡酸与足量NaHCO3溶液反应的化学方程式:____。
(4)写出咖啡酸在一定条件下通过加聚反应生成高分子化合物的方程式____。
17.现有下列六种有机物:① ② ③ ④ ⑤⑥,请回答:
(1)有机物①④⑥熔沸点最高的是___________(填序号)。
(2)有机物②中有___________个手性碳原子。
(3)有机物⑤的系统名称为___________。
(4)写出有机物③与足量的NaOH溶液反应的化学方程式___________。
18.在NaOH溶液中加入适量CuSO4溶液,再滴加甲醛溶液,加热,可观察到的现象是____________,加热时反应的化学方程式是___________________________________,此反应可用于检验____________的存在。
19.按要求填空
(1)用系统法将下列物质命名
①___________
②___________
(2)写出下列物质的结构简式
①2,2-二甲基丙烷___________
②2,3,5-三甲基-3,4-二乙基庚烷___________
(3)下列括号内的物质为杂质,将除去下列各组混合物中杂质所需的试剂填在横线上
①乙烷(乙烯)___________
②乙炔(H2S)___________
20.卤代烃在氢氧化钠存在的条件下水解,这是一个典型的取代反应,其实质是带负电的原子团(例如OH-等阴离子)取代卤代烃中的卤原子。例如:CH3CH2CH2Br+OH-(或NaOH)→CH3CH2CH2—OH+Br-(或NaBr)
写出下列反应的化学方程式:
(1)溴乙烷跟NaHS反应_____________________。
(2)碘甲烷跟CH3COONa反应_____________________。
(3)由碘甲烷、无水乙醇和金属钠合成甲乙醚(CH3—O—CH2CH3)。_______;_______。
21.概念与分类
(1)概念:烃分子中氢原子被___________原子取代后生成的化合物。
(2)分类:
①按分子中卤素原子个数分:___________和___________;
②按所含卤素原子种类分:___________、___________、___________、___________;
③按烃基种类分:饱和卤代烃和不饱和卤代烃;
④按是否含苯环分:脂肪卤代烃和芳香卤代烃。
22.以某有机物X为原料可合成高分子塑料G,X的相对分子质量小于100,1 mol有机物X完全燃烧生成等物质的量的CO2和H2O,同时消耗标准状况下的O2 112 L,且X分子中含有羰基和羟基。X能发生如图所示的转化:
已知:在HIO4、加热条件下生成RCHO和R'CHO。回答下列问题:
(1)X的结构简式为___________。
(2)E→F的反应条件是___________。
(3)写出F→G的化学方程式:___________,该反应的反应类型为___________。
(4)A→D的化学方程式为___________,该反应的反应类型为___________。
(5)Y是X的同分异构体,1molY与足量的Na反应可生成1 mol H2,且Y不能使溴的CCl4溶液褪色,Y分子中的官能团连在相邻的碳原子上。Y的核磁共振氢谱图中有3组峰,峰面积之比为2:1:1。Y的结构简式为___________。
23.1,2-二氯乙烷是制备杀菌剂和植物生长调节剂的中间体,在农业上可用作粮食、谷物的熏蒸剂、土壤消毒剂等,已知其沸点为83.5℃,熔点为-35℃。下图为实验室中制备1,2-二氯乙烷的装置,其中加热和夹持装置已略去。装置A中的无水乙醇的密度约为0.8 g/cm3。
(1)装置A中还缺少的一种必要仪器是_______,使用冷凝管的目的是_______;
装置A中发生主要反应的化学方程式为_______;
(2)装置B中应加入的最佳试剂为_______;
(3)D中a、c两个导气管进入仪器中的长度不同,其优点是_______;还可用如下图所示装置替代装置D,则装置D中最适宜的试剂为_______;
(4)实验结束后收集得到0.24mol 1,2-二氯乙烷,则乙醇的利用率为_______%。
【参考答案】
一、选择题
1.B
解析:A.新冠病毒由蛋白质外壳和单链核酸组成,直径大约在60~140nm,胶体分散质直径在1~100nm,则超过100nm的新冠病毒扩散到空气中不能形成胶体,故A错误;
B.84消毒液为次氯酸钠水溶液,次氯酸钠中氯元素的化合价为+1价,具有强氧化性,医用酒精主要成分是乙醇,乙醇能够使蛋白质变性,失去活性,从而杀死细菌,并非是利用乙醇的氧化性,二者消毒原理不同,故B正确;
C.聚丙烯不含有碳碳双键,不能使溴水褪色,故C错误;
D.40%的甲醛溶液有毒,不可做公共餐具消毒剂,故D错误;
答案选:B。
2.C
解析:A.分子式为,A项正确;
B.苯环、碳碳双键可以发生加成反应,苯环上氢原子可以发生取代反应,大多数有机物可以发生氧化反应,B项正确;
C.该有机物可溶于水、苯和乙醇,C项错误;
D.苯环、碳碳双键和羧基为平面结构,单键可以旋转,分子中的所有原子可能处于一个平面,D项正确;
故选C。
3.B
解析:A.分子中含有醚键、酯基、碳碳双键3种官能团,A错误;
B.该物质分子中含有酯基,因此能与NaOH溶液反应,B正确;
C.根据物质结构简式可知:在苯环上含有3种不同位置的H原子,处于苯环上的一氯取代物有3种,C错误;
D.苯分子是平面分子,-OCH3的O取代苯分子中H原子的位置,单键可以旋转,可能处于同一平面上;乙烯分子是平面分子,-CH3及酯基的C原子取代乙烯分子中H原子的位置,在乙烯分子的平面上,乙烯平面与苯分子平面共直线,由于碳碳单键可以旋转,则该分子中所有碳原子可能共平面,D错误;
故选B。
4.D
解析:A.乙醇和浓硫酸的混合物加热到170℃可制得乙烯,由于乙醇具有挥发性,挥发出来的乙醇也能使酸性高锰酸钾溶液褪色,故装置甲不能验证反应有乙烯生成,A不合题意;
B.乙醇和乙醚互溶,沸点不同可以用蒸馏操作来分离,但装置乙中温度计水银球应位于蒸馏烧瓶的支管口处,B不合题意;
C.乙酸乙酯在NaOH溶液中能够发生完全水解生成乙酸钠和乙醇,故用装置丙可以制取乙酸乙酯,但不能用于收集乙酸乙酯,C不合题意;
D.溴乙烷在NaOH醇溶液中共热,发生消去反应生成乙烯,由于挥发出的乙醇不能使Br2的CCl4溶液褪色,故装置丁能实现验证溴乙烷发生了消去反应的目的,D符合题意;
故答案为:D。
5.A
解析:A.由于F的电负性大于Cl的电负性,所以三氟乙酸羧基中的羟基的极性更大,即三氟乙酸的酸性强于三氯乙酸,A项正确;
B.易形成分子间氢键,熔沸点较高,易形成分子内氢键,熔沸点降低,所以的沸点高于,B项错误;
C.由于O的非金属性强于S,所以的稳定性大于,C项错误;
D.HI和HCl均为分子晶体,且HI的相对分子质量大,分子间作用力更强,所以HI的沸点比HCl的高,D项错误;
故答案选A。
6.A
解析:A.单糖不能水解,A错误;
B.油脂属于酯类,酸性环境下水解生成对应的高级脂肪酸和甘油,B正确;
C.利用太阳能转化为化学能,可以在催化剂条件下光解水,C正确;
D. 治理白色污染的一条途径就是利用可降解塑料,D正确;
故选A。
7.A
解析:A.相同温度、相同物质的量浓度时,醋酸是弱酸未完成电离,故醋酸的pH大于盐酸,不能用元素周期律解释,A符合题意;
B.同周期元素随原子序数的递增电负性增强,故醛基的碳氧双键中,氧原子带部分负电荷,B不符合题意;
C.同周期元素随原子序数的递增金属性减弱,故Mg和水的反应不如Na和水的反应剧烈,C不符合题意;
D.同主族元素从上到下非金属性越来越弱,氯气氧化性强于溴单质,故向NaBr溶液中滴加氯水,可以置换出溴单质,溴单质在四氯化碳中溶解度比水的大,液体分层,下层呈橙红色,D不符合题意;
故选A。
8.C
解析:A.加入过量氢氧化钠溶液加热,溴乙烷会水解生成乙醇,A错误;
B.加入过量酸性高锰酸钾后,乙醛也会被酸性高锰酸钾氧化,B错误;
C.苯酚与氢氧化钠反应生成苯酚钠溶于水,苯不溶于水且不与氢氧化钠反应,苯在上层,分液后可除去苯中含有的少量苯酚,C正确;
D.乙烯被酸性高锰酸钾氧化生成二氧化碳,又引入了新的杂质,D错误;
故答案选C。
9.A
解析:A.该物质主链为丁烯,官能团碳碳双键在1号碳上,甲基取代在3号碳,命名为3-甲基-1-丁烯,A正确;
B.取代基编号和最小原则,正确的命名为1,2,4-三甲苯,B错误;
C.选含羟基最长碳链为主链即为丙醇,甲基取代在1号碳上,命名为1-甲基-1-丙醇,C错误;
D.该物质含有酮羰基,不是酯基,命名为丙酮,D错误;
故选:A。
10.C
解析:A.微热时氯化钠固体和浓硫酸生成硫酸氢钠和氯化氢气体,强热时氯化钠固体和浓硫酸生成硫酸钠和氯化氢气体,是利用不挥发性酸制取挥发性酸,A错误;
B.乙二醇可用于生产汽车防冻液,是因为乙二醇水溶液的凝固点可达-50°C,B错误;
C.氢氧化铝是不溶于水的具有弱碱性的两性氢氧化物、可以与盐酸反应,故用氢氧化铝治疗胃酸过多,C正确;
D.聚乙烯塑料无毒、用聚乙烯塑料制作食品保鲜膜,D错误;
答案选C。
11.C
解析:A.对硝基苯酚中,硝基和酚羟基处于苯环对位,对应结构简式为,A正确;
B.水分子空间构型为V形,氢原子半径比氧原子半径小,对应比例模型为,B正确;
C.SiO2为原子晶体,由原子构成,其中硅原子和氧原子以共价键相互连接形成立体网状结构,C错误;
D.异戊二烯中含有两个碳碳双键,2号碳原子上连有支链甲基,对应键线式为: ,D正确;
故答案选C。
12.B
解析:A.由结构可知维生素D3中烃基基团较大,烃基属于憎水基,因此维生素D3不易溶水,属于脂溶性维生素,故A错误;
B.由结构简式可知维生素D3分子式为,故B正确;
C.该结构中羟基所连碳上只有一个氢,催化氧化产物为酮,故C错误;
D.虚线框内的碳元素均处于碳碳双键的平面上,两平面可重合,所有碳原子可以共面,故D错误;
故选:B。
13.D
解析:A.向某卤代烃中加入氢氧化钠水溶液加热后,卤代烃发生水解反应,要证明其中含有氯元素,因此先向水解后的溶液中加入硝酸酸化,中和过量的NaOH,然后再向其中加入硝酸银溶液,若此时产生白色沉淀,就证明水解产生了Cl-,原来的卤代烃为卤代烃,否则反应后过量OH-与Ag+也会反应产生白色沉淀,干扰Cl-的检验,A错误;
B.苯与溴水会发生萃取作用导致溴水颜色变浅,要证明苯会发生取代反应,应该向苯中加入液溴,同时加入催化剂铁粉,该实验操作不能达到实验目的,B错误;
C.电石中含有的杂质CaS与水反应产生H2S具有还原性,也会被酸性KMnO4溶液氧化而使溶液褪色,因此不能证明电石和水反应生成了乙炔气体,C错误;
D.两个试管对比只有温度不同,升高温度,溶液颜色变为黄绿色,说明溶液中存在平衡:,升温后化学平衡正向移动,导致黄色的增多;降低温度,化学平衡逆向移动,使溶液中蓝色的增多,因此说明该反应的正反应是吸热反应,故△H>0,D正确;
故合理选项是D。
14.A
解析:①乙炔和氯化氢发生加成反应生成氯乙烯,属于加成反应;②乙烷在空气中燃烧生成二氧化碳和水,属于氧化反应;③乙烯和溴的四氯化碳溶液发生加成反应生成1,2-二溴乙烷,属于加成反应;④乙烯使酸性高锰酸钾溶液褪色,属于氧化反应;⑤乙烯发生加聚反应生成聚乙烯,属于加聚反应;⑥乙烷与氯气在光照的条件下反应生成氯乙烷和氯化氢,属于取代反应; ⑦溴乙烷和氢氧化钠乙醇溶液共热生成乙烯、溴化钠、水,属于消去反应;⑧溴乙烷和氢氧化钠溶液共热生成乙醇、溴化钠,属于取代反应;属于取代反应的是⑥⑧,选A。
15.B
解析:C2HF3ClBr可以可知乙烷中的5个H原子分别为1个Cl、1个Br、3个F原子取代,乙烷只有一种结构,氯原子、溴原子、氟原子连在碳原子上,调节位置,有CF3CHBrCl、BrCF2CHClF、ClCF2CHBrF、HCF2CFClBr,共有4种。
故选B。
二、填空题
16.(1)C9H8O2
(2)①②③④
(3)+ NaHCO3→CO2+H2O+
(4)
解析:(1)根据咖啡酸的结构简式,可知其分子式为C9H8O2。
(2)①该分子含有酚羟基、碳碳双键,可以发生氧化反应,故正确;
②该分子含有碳碳双键,可以加成反应,故正确;
③该分子含有酚羟基,可以酯化反应,故正确;
④该分子含有碳碳双键,可以加聚反应,故正确;
⑤该分子含有酚羟基、碳碳双键、羧基,不能发生消去反应,故错误;综上所述咖啡酸可以发生的反应是①②③④。
(3)咖啡酸含有羧基,与足量NaHCO3溶液反应的化学方程式为+ NaHCO3→CO2+H2O+ 。
(4)咖啡酸含有碳碳双键,在一定条件下通过加聚反应生成高分子化合物的方程式为。
17.(1)④
(2)1
(3)1,2,4-三甲基苯(或1,2,4-三甲苯)
(4)
解析:(1)烷烃分子中碳原子数越多熔沸点越高,碳原子数相同,支链越多熔沸点越低,有机物①④⑥熔沸点最高的是,选④。
(2)中有1个手性碳原子(*标出)。
(3)根据位置和最小原则,的系统名称为1,2,4-三甲苯。
(4)中羧基、酚羟基、酯基都能与氢氧化钠反应,反应方程式为。
18. 产生红色沉淀 HCHO+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O(或HCHO+2Cu(OH)2+NaOHHCOONa+Cu2O↓+3H2O) 醛基
【分析】反应的实质是新制的Cu(OH)2浊液将醛基氧化,而自身被还原为Cu2O红色沉淀。
解析:醛基把新制Cu(OH)2还原为Cu2O红色沉淀;由于HCHO可以看作含有两个醛基,根据新制Cu(OH)2的量,可以发生一次氧化,也可以发生两次氧化,所以反应的化学方程式为HCHO+2Cu(OH)2+NaOHHCOONa+Cu2O↓+3H2O(或HCHO+4Cu(OH)2+2NaOHNa2CO3+2Cu2O↓+6H2O);由于反应现象具有特征性,所以可用来检验醛基的存在。
19.(1) 2-甲基-1,3-丁二烯 2-丁醇
(2)
(3) 溴水 硫酸铜溶液
解析:(1)①选择含碳碳双键的最长碳链为主链,然后依次使双键的位置、支链位置最小,则 命名为2-甲基-1,3-丁二烯;
②使与-OH相连的C序数较小,则 命名为2-丁醇;
(2)先确定主链为丙烷,2号C有二个甲基,2,2-二甲基丙烷的结构简式为 ;
②先确定主链有7个C,2,3,5号C上有3个甲基,3,4号C上有2个乙基,则2,3,5-三甲基-3,4-二乙基庚烷的结构简式为 ;
(3)①乙烯能和溴水反应而被吸收,乙烷不能,故用溴水;
②硫化氢能和硫酸铜反应而被吸收,乙炔不能,故用硫酸铜溶液。
20. CH3CH2Br+NaHS→CH3CH2SH+NaBr CH3I+ CH3COONa→CH3COOCH3+NaI 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ CH3I+CH3CH2ONa→CH3OCH2CH3+NaI
解析:(1)NaHS中阴离子是HS-,所以根据题中的信息可知,反应的化学方程式是CH3CH2Br+NaHS→CH3CH2SH+NaBr。
(2)醋酸钠中阴离子是醋酸根离子,所以该反应的化学方程式是CH3I+ CH3COONa→CH3COOCH3+NaI。
(3)金属钠能和乙醇作用生成乙醇钠,进而乙醇钠和碘甲烷发生取代反应,生成甲乙醚,反应的化学方程式是2CH3CH2OH+2Na→2CH3CH2ONa+H2↑、CH3I+CH3CH2ONa→CH3OCH2CH3+NaI。
21.卤素 单卤代烃 多卤代烃 氟代烃 氯代烃 溴代烃 碘代烃
解析:略
22.(1)
(2)NaOH醇溶液、加热
(3) n CH2=CH-COCH3 加聚反应
(4) n +nHOOCCOOH+(2n-1)H2O 缩聚反应
(5)
解析:1 mol有机物X完全燃烧生成等物质的量的CO2和H2O,则有机物中C、H原子个数之比为1:2。1 mol有机物燃烧消耗标准状况下112 L的O2,其物质的量n(O2)==5 mol。X的相对分子质量小于100,且X分子中含有羰基和羟基,则X结构简式为。厨房酸味剂C是CH3COOH,B能够与银氨溶液发生反应,逆推B是CH3CHO,X与H2发生加成反应产生A,A与HIO4发生氧化反应产生B,则A是CH3CH (OH)CH (OH)CH3。A是二元醇,A与乙二酸发生酯化反应生成高分子化合物D,D为。结合信息可知A与HBr在一定条件下发生-OH的取代反应产生E,则E为CH3COCHBrCH3,E与NaOH的乙醇溶液共热发生消去反应产生F,E→F应为卤代烃的消去反应,则F为CH2=CH-COCH3,F分子中含有不饱和的碳碳双键,在一定条件下发生加聚反应产生G为,然后结合有机物的结构和性质进行解答。
(1)根据上述分析可知X结构简式是:。
(2)E是CH3COCHBrCH3,F为CH2=CH-COCH3,E与NaOH的乙醇溶液共热发生消去反应产生F,故E→F的反应条件是NaOH醇溶液、加热。
(3)F为CH2=CH-COCH3,分子中含有不饱和的碳碳双键,在一定条件下发生加聚反应产生G为,反应方程式为:nCH2=CH-COCH3,该反应的类型是加聚反应。
(4)A是CH3CH (OH)CH (OH)CH3,A与乙二酸发生缩聚反应生成高分子化合物D,则D为,同时产生水,则A→D的化学方程式为n +nHOOCCOOH+(2n-1)H2O。
(5)X是,Y是X的同分异构体,1 mol Y与足量的Na反应可生成1 mol H2,说明其分子中含有2个-OH;且Y不能使溴的CCl4溶液褪色,说明Y分子中不含有碳碳双键,Y分子中含有1个环状结构,Y分子中的官能团连在相邻的碳原子上,Y的核磁共振氢谱图中有3组峰,峰面积之比为2:1:1,则Y的结构简式为。
23.(1) 温度计 使乙醇冷凝回流,提高原料利用率 CH3CH2OHCH2=CH2↑+H2O
(2)NaOH溶液
(3)有利于Cl2、C2H4充分混合反应 CH2ClCH2Cl
(4)69
解析:实验室制备1,2-二氯乙烷时,通常采用乙烯与氯气加成,乙烯来自乙醇的消去反应,此时乙醇中常混有CO2、SO2等酸性气体,尤其是SO2,在水溶液中会与氯气发生反应,所以应使用碱液吸收。
(1)装置A中,在浓硫酸的作用下,乙醇在170℃左右发生消去反应,所以还缺少控制温度的仪器,该仪器是温度计,乙醇易挥发,从而导致利用率下降,所以使用冷凝管的目的是使乙醇冷凝回流,提高原料利用率,装置A中,乙醇发生消去反应,生成乙烯和水,发生主要反应的化学方程式为CH3CH2OHCH2=CH2↑+H2O。答案为:温度计;使乙醇冷凝回流,提高原料利用率;CH3CH2OHCH2=CH2↑+H2O;
(2)因为有少部分乙醇被浓硫酸氧化为二氧化碳等,同时浓硫酸被乙醇还原为二氧化硫,二者都混在乙烯气体中,所以装置B中应加入的最佳试剂为NaOH溶液。答案为:NaOH溶液;
(3)为提高乙烯与氯气的利用率,两气体应充分接触,则D中a、c两个导气管进入仪器中的长度不同,其优点是有利于Cl2、C2H4充分混合反应;还可用图示装置替代装置D,装置D中,为增大乙烯与氯气的接触面积,应加入能溶解二种气体的溶剂,但不能引入杂质,所以最适宜的试剂为CH2ClCH2Cl。答案为:有利于Cl2、C2H4充分混合反应;CH2ClCH2Cl;
(4)n(乙醇)=,实验结束后收集得到0.24mol 1,2-二氯乙烷,则生成乙烯的物质的量为0.24mol,参加反应的乙醇为0.24mol,从而得出乙醇的利用率为≈69%。答案为:69。
【点睛】作为溶剂,应不影响产品的纯度,所以用产品作为溶剂,效果最佳
