11.1 生活中常见的盐 课件(共37张PPT)人教版 九年级下册
文档属性
| 名称 | 11.1 生活中常见的盐 课件(共37张PPT)人教版 九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-01 00:00:00 | ||
图片预览









文档简介
(共37张PPT)
第十一单元 盐 化肥
11.1 生活中常见的盐
知识点
1
1. 盐的定义 是指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
2. 几种常见的盐
生活中常见的盐
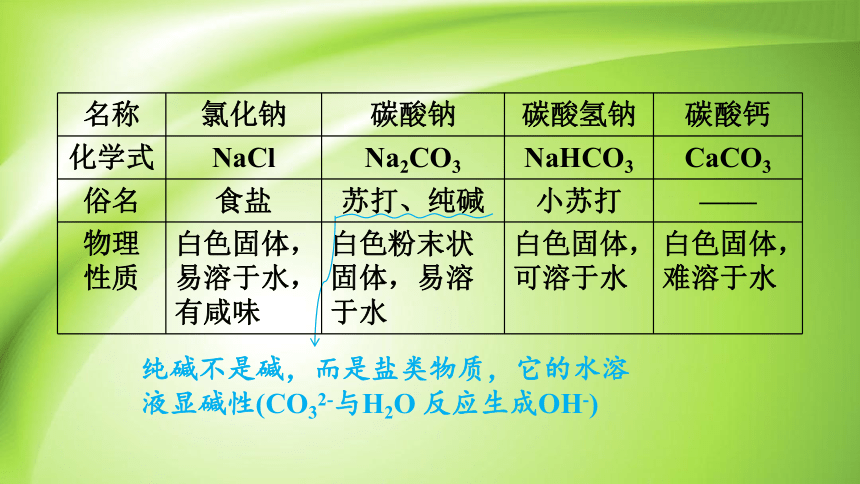
纯碱不是碱,而是盐类物质,它的水溶
液显碱性(CO32-与H2O 反应生成OH-)
名称 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式 NaCl Na2CO3 NaHCO3 CaCO3
俗名 食盐 苏打、纯碱 小苏打 ——
物理 性质 白色固体,易溶于水,有咸味 白色粉末状固体,易溶于水 白色固体, 可溶于水 白色固体,
难溶于水
名称 氯化钠 碳酸钠
化学性质 与硝酸银反应 NaCl+ AgNO3 ====AgCl ↓ + NaNO3 1. 水溶液呈碱性
2. 与酸反应
Na2CO3+2HCl====2NaCl+H2O+CO2 ↑
3. 与碱反应
Na2CO3+Ca(OH)2====2NaOH+
CaCO3 ↓
(工业制烧碱原理)
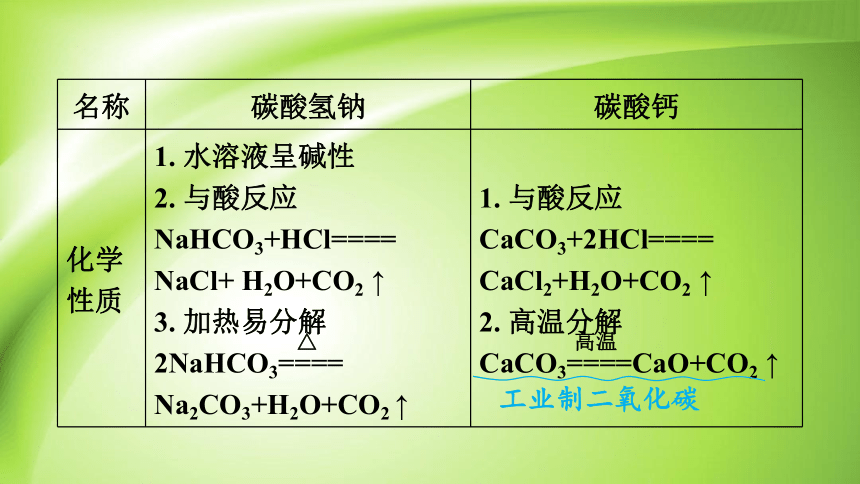
名称 碳酸氢钠 碳酸钙
化学性质 1. 水溶液呈碱性 2. 与酸反应 NaHCO3+HCl==== NaCl+ H2O+CO2 ↑ 3. 加热易分解 2NaHCO3==== Na2CO3+H2O+CO2 ↑ 1. 与酸反应
CaCO3+2HCl==== CaCl2+H2O+CO2 ↑
2. 高温分解
CaCO3====CaO+CO2 ↑
高温
△
工业制二氧化碳
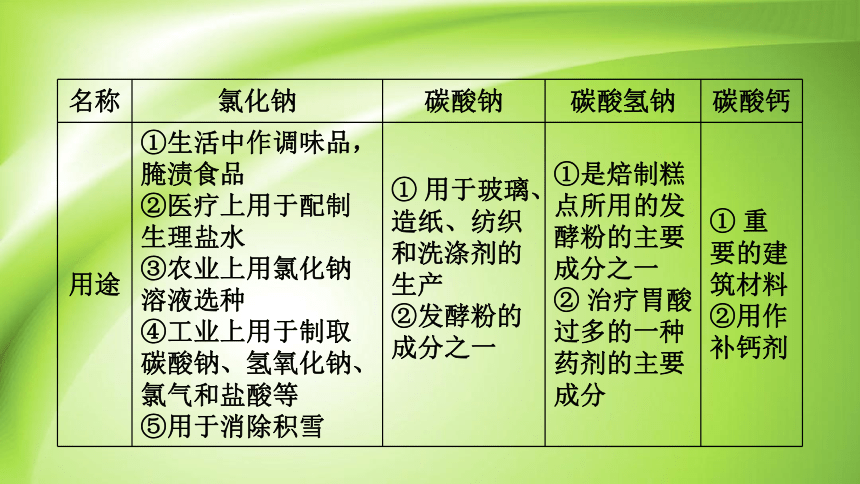
名称 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
用途 ①生活中作调味品,腌渍食品 ②医疗上用于配制生理盐水 ③农业上用氯化钠溶液选种 ④工业上用于制取碳酸钠、氢氧化钠、氯气和盐酸等 ⑤用于消除积雪 ① 用于玻璃、造纸、纺织和洗涤剂的生产 ②发酵粉的成分之一 ①是焙制糕点所用的发酵粉的主要成分之一 ② 治疗胃酸过多的一种药剂的主要成分 ① 重要的建筑材料
②用作补钙剂
3. (1) 含有碳酸根离子(CO32-)或碳酸氢根离子
(HCO3-)的盐都能与酸反应产生二氧化碳气体,如K2CO3+2HCl ====2KCl+H2O+CO2 ↑,Ca(HCO3)2+2HCl==== CaCl2+2H2O+2CO2 ↑。
(2)碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的检验:取样,加入适量的稀盐酸,并将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,则该物质中含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)。
4. 氯化钠的制取
特别提醒:
1. 盐中不一定都含有金属元素,如:氯化铵中只含非金属元素。
2. 食盐是盐,但盐不都能食用,如工业盐中含有的亚硝酸钠有毒,不能用于烹饪食物,CuSO4、BaCl2 等重金属盐也有毒。
3. 检验碳酸根离子或碳酸氢根离子时,要选用稀盐酸和澄清石灰水两种物质,因为能与盐酸反应产生气泡的不一定是碳酸盐,氢前金属也能与酸反应产生气体。
4. 侯德榜发明了联合制碱法,为纯碱和氮肥工业技术的发展作出了重要的贡献,是我国制碱工业的先驱。
[中考·郴州] 有关酸碱盐的性质和用途,下列说法错误的是( )
A. 氯化钠解离出的阳离子是氯离子,氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用
B. 硫酸厂的污水中含有硫酸等物质,可以用熟石灰进行中和处理
C. 盐酸与镁反应时,除生成气体外还会放出热量
D. 碳酸氢钠在医疗上是治疗胃酸过多症的一种药剂
例1
A
考向 常见盐的性质与用途
题型1 常见盐的用途
解:氯化钠解离出的阴离子是氯离子,氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用,A 错误;硫酸厂的污水中含有硫酸等物质,硫酸能与熟石灰发生中和反应,因此可以用熟石灰进行中和处理,B 正确;盐酸与镁反应时,除生成气体外,还会放出热量,C 正确;碳酸氢钠能与胃液中的盐酸反应,因此在医疗上是治疗胃酸过多症的一种药剂,D 正确。
某同学在家中找到一种白色粉末,到学校实验室进行实验,实验过程与现象如图1 所示:
例2
题型2 碳酸盐或碳酸氢盐的检验
对此粉末成分判断正确的是( )
A. 该粉末可能是碳酸钙
B. 该粉末可能是碳酸钠或碳酸氢钠
C. 该粉末一定是一种碱
D. 该粉末中一定只含有碳酸根离子
B
解题秘方:结合实验设计原理抓住特征现象进
行推理,如 “无色溶液”“变红”“气体”“白色沉淀”。
解:白色粉末加水形成溶液,则该粉末一定溶于水,碳酸钙不溶于水,所以A 错误;溶于水所得的无色溶液使酚酞变红色,说明溶液呈碱性,可能是碱溶液,也可能是某种盐溶液;能与盐酸反应产生使澄清石灰水变浑浊的气体,该物质可能含有碳酸根离子或碳酸氢根离子,如碳酸钠和盐酸反应可以生成二氧化碳气体,碳酸氢钠也可与盐酸反应生成CO2 气体。
知识点
2
1. 复分解反应
复分解反应
复分解反应 概念 由两种化合物互相交换成分,生成另外两种化合物的反应叫做复分解反应
表达式 AB+CD→AD+CB
特点 双交换,价不变
在复分解反应中,反应前后各元素或原子团的化合价不变
正价在前,负价在后
2. 复分解反应发生的条件
某些物质之间能否发生复分解反应还要考虑反应物是否符合条件。
反应物类别 反应物条件 举例
酸+ 碱 一种可溶即可 (一般酸可溶) 难溶碱也能与酸反应, 如
Cu(OH)2+H2SO4 ==== CuSO4+2H2O
反应物类别 反应物条件 举例
酸+ 盐 酸可溶 难溶碳酸盐也能与酸反应, 如BaCO3+2HCl ==== BaCl2+H2O+CO2 ↑
酸+ 金属氧 化物 酸可溶 如CaO+2HNO3 ==== Ca(NO3)2+H2O
CuO+H2SO4 ==== CuSO4+H2O
反应物类别 反应物条件 举例
碱+ 盐 两者皆可溶 CuSO4 和 Fe(OH)3 不反应, 因为Fe(OH)3 难溶于水
盐1+ 盐2 两者皆可溶 BaCO3 和 CaCl2 不能反应, 因为BaCO3难溶于水;Na2CO3 可溶于水,Na2CO3能与CaCl2 反应,Na2CO3+CaCl2====CaCO3 ↓ +2NaCl
3. 常见酸、碱、盐的溶解性
常见酸、碱、盐的溶解性 酸 几种常见的酸都能溶于水
碱 氢氧化钠、氢氧化钾、氢氧化钡、氨水可溶于水,氢氧化钙微溶于水,其余难溶于水
盐 钠盐、钾盐、铵盐、硝酸盐:全溶
盐酸盐:氯化银不溶,其余全溶
硫酸盐:硫酸钡、硫酸铅不溶,
硫酸钙和硫酸银微溶,其余全溶
碳酸盐:碳酸钾、碳酸钠、碳酸
铵可溶,碳酸镁微溶,其余全不溶
盐的溶解性顺口溜:
钾钠铵硝皆可溶,
盐酸盐不溶银亚汞;
硫酸盐不溶钡和铅,
碳磷酸盐多不溶,
可溶只有钾钠铵。
4. 四种基本反应类型的比较
基本反应类型 反应表达式 特征 实例 化合价变化
化合 反应 A+B+…→ X 多变一 2Mg +O2==== 2MgO 可能变,也可能不变
分解 反应 X → A+B+… 一变多 2H2O2==== 2H2O+O2 ↑ MnO2
点燃
基本反应类型 反应表达式 特征 实例 化合价变化
置换 反应 A+ BC → B+ AC 单换单 Zn + 2HCl==== ZnCl2+ H2 ↑ 一定 改变
复分解反应 AB +CD → AD + CB 双交换,价不变 NaOH + HCl==== NaCl +H2O 一定 不变
下列属于复分解反应的是( )
A. 2NaOH+CO2 ==== Na2CO3+H2O
B. Ba(NO3)2+Na2CO3 ==== BaCO3 ↓ +2NaNO3
C. H2O+3NO2 ==== 2HNO3+NO
D. CO+CuO ==== Cu+CO2
例3
B
考向 复分解反应
题型1 判断复分解反应
△
解题秘方:根据复分解反应的定义来判断,即两种化合物互相交换成分,生成另外两种化合物的反应。
解:A 中是两种化合物反应生成另外两种化合物,但不是交换成分得到的,不是复分解反应;同理C 也不正确;D 中有单质生成,不是复分解反应。
[中考·株洲]下列物质间不能发生复分解反应的是( )
A. 碳酸钠溶液和氯化钙溶液
B. 氢氧化钠溶液和氯化钾溶液
C. 碳酸钾溶液和盐酸
D. 硫酸铜溶液和氯化钡溶液
例4
B
题型2 复分解反应发生的条件
解题秘方:两种化合物相互交换成分后有沉
淀、气体或水生成的能发生复分解反应。
解:碳酸钠溶液和氯化钙溶液相互交换成分生成碳酸钙沉淀和氯化钠,A 能发生复分解反应;氢氧化钠溶液和氯化钾溶液相互交换成分没有沉淀、气体或水生成,B 不能发生复分解反应;碳酸钾溶液和盐酸相互交换成分生成氯化钾、水和二氧化碳,C 能发生复分解反应;硫酸铜溶液和氯化钡溶液相互交换成分生成硫酸钡沉淀和氯化铜,D 能发生复分解反应。
知识点
3
盐的化学性质
性质 反应发生的条件 实例
盐+ 金属→新盐+新金属 ①金属在金属活动性顺序中排在盐溶液中金属的前面; ②盐要可溶于水; ③ K、Ca、Na 除外。可简记为:前置后,盐可溶,K、Ca、Na除外 Fe+CuSO4==== Cu+FeSO4
2Al+3CuSO4 ==== 3Cu+Al2(SO4)3
Cu+2AgNO3 ==== 2Ag+Cu(NO3)2
性质 反应发生的条件 实例
盐+ 酸→新盐+新酸 符合复分解反应发生的条件 Na2CO3+2HCl====
2NaCl+H2O+CO2 ↑
AgNO3+HCl ==== AgCl ↓ +HNO3
BaCl2+H2SO4 ==== BaSO4 ↓ +2HCl
性质 反应发生的条件 实例
盐+ 碱→新盐+新碱 ①反应物都溶于水; ②符合复分解反应 发生的条件 Na2CO3+Ca(OH)2====
2NaOH+CaCO3 ↓
CuSO4+Ba(OH)2====
BaSO4 ↓ +Cu(OH)2 ↓
盐+ 盐→两种新盐 ①反应物都溶于水; ②生成物中有沉淀 BaCl2+Na2CO3 ==== BaCO3 ↓ +2NaCl
NaCl+AgNO3 ==== NaNO3+AgCl ↓
[中考·宁夏] 及时归纳是学好化学的主要方法之一。利用如图2所示的结构图归纳盐的四个方面的化学性质 (图中编号① ~ ④),请归纳有关知识。
(1)如果反应①中金属
为铝,选用的盐是
_________________
(填化学式)。
例5
考向 盐的化学性质
ZnCl2(或CuSO4等)
(2)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物
质,它们在溶液中相互反应时产生的现象是 ____________,化学方程式为 ______________________________________。若选用硫酸钾与氢氧化钠溶液,________ (填“能”或“不 能”)反应,理由是
_________________
_________________。
产生蓝色沉淀
CuSO4+2NaOH ====Cu(OH)2↓+Na2SO4
不能
没有沉淀或气体
或水生成
(3)在性质③中,X 代表 _______类物质,写出一个有沉淀生成的反应的化学方程式____________________________________________________________________________________
酸
HCl+AgNO3 ====AgCl ↓ +HNO3
(或BaCl2+H2SO4====BaSO4 ↓ +2HCl)
知3-练
感悟新知
NaCl
(4)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式 _________ (写一个) (合理即可)。
解题秘方:根据盐的化学性质结合反应条件来分析。
解:(1)盐与金属反应的条件是:活动性强的金属一般能将活动性弱的金属从它的盐溶液中置换出来,铝可以与锌、铁、铜、银的盐溶液反应,如硫酸锌、硫酸亚铁、硫酸铜、硝酸银等的溶液。
(2)硫酸铜溶液和氢氧化钠溶液反应产生蓝色沉淀,化学方程式为CuSO4+2NaOH ==== Cu(OH)2 ↓ +Na2SO4;硫酸钾与氢氧化钠相互交换成分后没有沉淀或气体或水生成,不符合复分解反应的条件,不能发生反应。(3)盐除了能和某些金属、某些碱、某些盐反应,还可以和某些酸反应,故在性质③中,X 代表酸类物质。
课堂小结
盐
概念
条件
复分解
反应
生活中常见的盐
盐的化学性质
盐+金属→置换反应
盐+酸
盐+碱
盐+盐
第十一单元 盐 化肥
11.1 生活中常见的盐
知识点
1
1. 盐的定义 是指一类组成里含有金属离子(或铵根离子)和酸根离子的化合物。
2. 几种常见的盐
生活中常见的盐
纯碱不是碱,而是盐类物质,它的水溶
液显碱性(CO32-与H2O 反应生成OH-)
名称 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式 NaCl Na2CO3 NaHCO3 CaCO3
俗名 食盐 苏打、纯碱 小苏打 ——
物理 性质 白色固体,易溶于水,有咸味 白色粉末状固体,易溶于水 白色固体, 可溶于水 白色固体,
难溶于水
名称 氯化钠 碳酸钠
化学性质 与硝酸银反应 NaCl+ AgNO3 ====AgCl ↓ + NaNO3 1. 水溶液呈碱性
2. 与酸反应
Na2CO3+2HCl====2NaCl+H2O+CO2 ↑
3. 与碱反应
Na2CO3+Ca(OH)2====2NaOH+
CaCO3 ↓
(工业制烧碱原理)
名称 碳酸氢钠 碳酸钙
化学性质 1. 水溶液呈碱性 2. 与酸反应 NaHCO3+HCl==== NaCl+ H2O+CO2 ↑ 3. 加热易分解 2NaHCO3==== Na2CO3+H2O+CO2 ↑ 1. 与酸反应
CaCO3+2HCl==== CaCl2+H2O+CO2 ↑
2. 高温分解
CaCO3====CaO+CO2 ↑
高温
△
工业制二氧化碳
名称 氯化钠 碳酸钠 碳酸氢钠 碳酸钙
用途 ①生活中作调味品,腌渍食品 ②医疗上用于配制生理盐水 ③农业上用氯化钠溶液选种 ④工业上用于制取碳酸钠、氢氧化钠、氯气和盐酸等 ⑤用于消除积雪 ① 用于玻璃、造纸、纺织和洗涤剂的生产 ②发酵粉的成分之一 ①是焙制糕点所用的发酵粉的主要成分之一 ② 治疗胃酸过多的一种药剂的主要成分 ① 重要的建筑材料
②用作补钙剂
3. (1) 含有碳酸根离子(CO32-)或碳酸氢根离子
(HCO3-)的盐都能与酸反应产生二氧化碳气体,如K2CO3+2HCl ====2KCl+H2O+CO2 ↑,Ca(HCO3)2+2HCl==== CaCl2+2H2O+2CO2 ↑。
(2)碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)的检验:取样,加入适量的稀盐酸,并将产生的气体通入澄清石灰水中,澄清石灰水变浑浊,则该物质中含有碳酸根离子(CO32-)或碳酸氢根离子(HCO3-)。
4. 氯化钠的制取
特别提醒:
1. 盐中不一定都含有金属元素,如:氯化铵中只含非金属元素。
2. 食盐是盐,但盐不都能食用,如工业盐中含有的亚硝酸钠有毒,不能用于烹饪食物,CuSO4、BaCl2 等重金属盐也有毒。
3. 检验碳酸根离子或碳酸氢根离子时,要选用稀盐酸和澄清石灰水两种物质,因为能与盐酸反应产生气泡的不一定是碳酸盐,氢前金属也能与酸反应产生气体。
4. 侯德榜发明了联合制碱法,为纯碱和氮肥工业技术的发展作出了重要的贡献,是我国制碱工业的先驱。
[中考·郴州] 有关酸碱盐的性质和用途,下列说法错误的是( )
A. 氯化钠解离出的阳离子是氯离子,氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用
B. 硫酸厂的污水中含有硫酸等物质,可以用熟石灰进行中和处理
C. 盐酸与镁反应时,除生成气体外还会放出热量
D. 碳酸氢钠在医疗上是治疗胃酸过多症的一种药剂
例1
A
考向 常见盐的性质与用途
题型1 常见盐的用途
解:氯化钠解离出的阴离子是氯离子,氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用,A 错误;硫酸厂的污水中含有硫酸等物质,硫酸能与熟石灰发生中和反应,因此可以用熟石灰进行中和处理,B 正确;盐酸与镁反应时,除生成气体外,还会放出热量,C 正确;碳酸氢钠能与胃液中的盐酸反应,因此在医疗上是治疗胃酸过多症的一种药剂,D 正确。
某同学在家中找到一种白色粉末,到学校实验室进行实验,实验过程与现象如图1 所示:
例2
题型2 碳酸盐或碳酸氢盐的检验
对此粉末成分判断正确的是( )
A. 该粉末可能是碳酸钙
B. 该粉末可能是碳酸钠或碳酸氢钠
C. 该粉末一定是一种碱
D. 该粉末中一定只含有碳酸根离子
B
解题秘方:结合实验设计原理抓住特征现象进
行推理,如 “无色溶液”“变红”“气体”“白色沉淀”。
解:白色粉末加水形成溶液,则该粉末一定溶于水,碳酸钙不溶于水,所以A 错误;溶于水所得的无色溶液使酚酞变红色,说明溶液呈碱性,可能是碱溶液,也可能是某种盐溶液;能与盐酸反应产生使澄清石灰水变浑浊的气体,该物质可能含有碳酸根离子或碳酸氢根离子,如碳酸钠和盐酸反应可以生成二氧化碳气体,碳酸氢钠也可与盐酸反应生成CO2 气体。
知识点
2
1. 复分解反应
复分解反应
复分解反应 概念 由两种化合物互相交换成分,生成另外两种化合物的反应叫做复分解反应
表达式 AB+CD→AD+CB
特点 双交换,价不变
在复分解反应中,反应前后各元素或原子团的化合价不变
正价在前,负价在后
2. 复分解反应发生的条件
某些物质之间能否发生复分解反应还要考虑反应物是否符合条件。
反应物类别 反应物条件 举例
酸+ 碱 一种可溶即可 (一般酸可溶) 难溶碱也能与酸反应, 如
Cu(OH)2+H2SO4 ==== CuSO4+2H2O
反应物类别 反应物条件 举例
酸+ 盐 酸可溶 难溶碳酸盐也能与酸反应, 如BaCO3+2HCl ==== BaCl2+H2O+CO2 ↑
酸+ 金属氧 化物 酸可溶 如CaO+2HNO3 ==== Ca(NO3)2+H2O
CuO+H2SO4 ==== CuSO4+H2O
反应物类别 反应物条件 举例
碱+ 盐 两者皆可溶 CuSO4 和 Fe(OH)3 不反应, 因为Fe(OH)3 难溶于水
盐1+ 盐2 两者皆可溶 BaCO3 和 CaCl2 不能反应, 因为BaCO3难溶于水;Na2CO3 可溶于水,Na2CO3能与CaCl2 反应,Na2CO3+CaCl2====CaCO3 ↓ +2NaCl
3. 常见酸、碱、盐的溶解性
常见酸、碱、盐的溶解性 酸 几种常见的酸都能溶于水
碱 氢氧化钠、氢氧化钾、氢氧化钡、氨水可溶于水,氢氧化钙微溶于水,其余难溶于水
盐 钠盐、钾盐、铵盐、硝酸盐:全溶
盐酸盐:氯化银不溶,其余全溶
硫酸盐:硫酸钡、硫酸铅不溶,
硫酸钙和硫酸银微溶,其余全溶
碳酸盐:碳酸钾、碳酸钠、碳酸
铵可溶,碳酸镁微溶,其余全不溶
盐的溶解性顺口溜:
钾钠铵硝皆可溶,
盐酸盐不溶银亚汞;
硫酸盐不溶钡和铅,
碳磷酸盐多不溶,
可溶只有钾钠铵。
4. 四种基本反应类型的比较
基本反应类型 反应表达式 特征 实例 化合价变化
化合 反应 A+B+…→ X 多变一 2Mg +O2==== 2MgO 可能变,也可能不变
分解 反应 X → A+B+… 一变多 2H2O2==== 2H2O+O2 ↑ MnO2
点燃
基本反应类型 反应表达式 特征 实例 化合价变化
置换 反应 A+ BC → B+ AC 单换单 Zn + 2HCl==== ZnCl2+ H2 ↑ 一定 改变
复分解反应 AB +CD → AD + CB 双交换,价不变 NaOH + HCl==== NaCl +H2O 一定 不变
下列属于复分解反应的是( )
A. 2NaOH+CO2 ==== Na2CO3+H2O
B. Ba(NO3)2+Na2CO3 ==== BaCO3 ↓ +2NaNO3
C. H2O+3NO2 ==== 2HNO3+NO
D. CO+CuO ==== Cu+CO2
例3
B
考向 复分解反应
题型1 判断复分解反应
△
解题秘方:根据复分解反应的定义来判断,即两种化合物互相交换成分,生成另外两种化合物的反应。
解:A 中是两种化合物反应生成另外两种化合物,但不是交换成分得到的,不是复分解反应;同理C 也不正确;D 中有单质生成,不是复分解反应。
[中考·株洲]下列物质间不能发生复分解反应的是( )
A. 碳酸钠溶液和氯化钙溶液
B. 氢氧化钠溶液和氯化钾溶液
C. 碳酸钾溶液和盐酸
D. 硫酸铜溶液和氯化钡溶液
例4
B
题型2 复分解反应发生的条件
解题秘方:两种化合物相互交换成分后有沉
淀、气体或水生成的能发生复分解反应。
解:碳酸钠溶液和氯化钙溶液相互交换成分生成碳酸钙沉淀和氯化钠,A 能发生复分解反应;氢氧化钠溶液和氯化钾溶液相互交换成分没有沉淀、气体或水生成,B 不能发生复分解反应;碳酸钾溶液和盐酸相互交换成分生成氯化钾、水和二氧化碳,C 能发生复分解反应;硫酸铜溶液和氯化钡溶液相互交换成分生成硫酸钡沉淀和氯化铜,D 能发生复分解反应。
知识点
3
盐的化学性质
性质 反应发生的条件 实例
盐+ 金属→新盐+新金属 ①金属在金属活动性顺序中排在盐溶液中金属的前面; ②盐要可溶于水; ③ K、Ca、Na 除外。可简记为:前置后,盐可溶,K、Ca、Na除外 Fe+CuSO4==== Cu+FeSO4
2Al+3CuSO4 ==== 3Cu+Al2(SO4)3
Cu+2AgNO3 ==== 2Ag+Cu(NO3)2
性质 反应发生的条件 实例
盐+ 酸→新盐+新酸 符合复分解反应发生的条件 Na2CO3+2HCl====
2NaCl+H2O+CO2 ↑
AgNO3+HCl ==== AgCl ↓ +HNO3
BaCl2+H2SO4 ==== BaSO4 ↓ +2HCl
性质 反应发生的条件 实例
盐+ 碱→新盐+新碱 ①反应物都溶于水; ②符合复分解反应 发生的条件 Na2CO3+Ca(OH)2====
2NaOH+CaCO3 ↓
CuSO4+Ba(OH)2====
BaSO4 ↓ +Cu(OH)2 ↓
盐+ 盐→两种新盐 ①反应物都溶于水; ②生成物中有沉淀 BaCl2+Na2CO3 ==== BaCO3 ↓ +2NaCl
NaCl+AgNO3 ==== NaNO3+AgCl ↓
[中考·宁夏] 及时归纳是学好化学的主要方法之一。利用如图2所示的结构图归纳盐的四个方面的化学性质 (图中编号① ~ ④),请归纳有关知识。
(1)如果反应①中金属
为铝,选用的盐是
_________________
(填化学式)。
例5
考向 盐的化学性质
ZnCl2(或CuSO4等)
(2)在归纳性质②时,选取了硫酸铜和氢氧化钠两种物
质,它们在溶液中相互反应时产生的现象是 ____________,化学方程式为 ______________________________________。若选用硫酸钾与氢氧化钠溶液,________ (填“能”或“不 能”)反应,理由是
_________________
_________________。
产生蓝色沉淀
CuSO4+2NaOH ====Cu(OH)2↓+Na2SO4
不能
没有沉淀或气体
或水生成
(3)在性质③中,X 代表 _______类物质,写出一个有沉淀生成的反应的化学方程式____________________________________________________________________________________
酸
HCl+AgNO3 ====AgCl ↓ +HNO3
(或BaCl2+H2SO4====BaSO4 ↓ +2HCl)
知3-练
感悟新知
NaCl
(4)在归纳性质④时,从“某些盐”中选取了硝酸银,写出与硝酸银反应的物质的化学式 _________ (写一个) (合理即可)。
解题秘方:根据盐的化学性质结合反应条件来分析。
解:(1)盐与金属反应的条件是:活动性强的金属一般能将活动性弱的金属从它的盐溶液中置换出来,铝可以与锌、铁、铜、银的盐溶液反应,如硫酸锌、硫酸亚铁、硫酸铜、硝酸银等的溶液。
(2)硫酸铜溶液和氢氧化钠溶液反应产生蓝色沉淀,化学方程式为CuSO4+2NaOH ==== Cu(OH)2 ↓ +Na2SO4;硫酸钾与氢氧化钠相互交换成分后没有沉淀或气体或水生成,不符合复分解反应的条件,不能发生反应。(3)盐除了能和某些金属、某些碱、某些盐反应,还可以和某些酸反应,故在性质③中,X 代表酸类物质。
课堂小结
盐
概念
条件
复分解
反应
生活中常见的盐
盐的化学性质
盐+金属→置换反应
盐+酸
盐+碱
盐+盐
同课章节目录
