中考化学专题复习-专题-气体的实验室制取 课件(共23张PPT)
文档属性
| 名称 | 中考化学专题复习-专题-气体的实验室制取 课件(共23张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-01 21:03:11 | ||
图片预览



文档简介
(共23张PPT)
专题:常见气体的制取
1.学会O2、 CO2 、H2的实验室制法、注意事项。
2.通过对O2、CO2 、H2实验室制法的学习,掌握 实验室制取气体的思路和方法。
3. 学会探究一些气体的实验室制法及气体的进化和除杂。
4.掌握中考实验题的解答。
本节课的复习目标
实验室制取气体的一般思路:
本节课的复习内容
药品及反应原理
发生装置
收集装置
检验并验满
①
多孔隔板
⑤
④
③
②
思考:
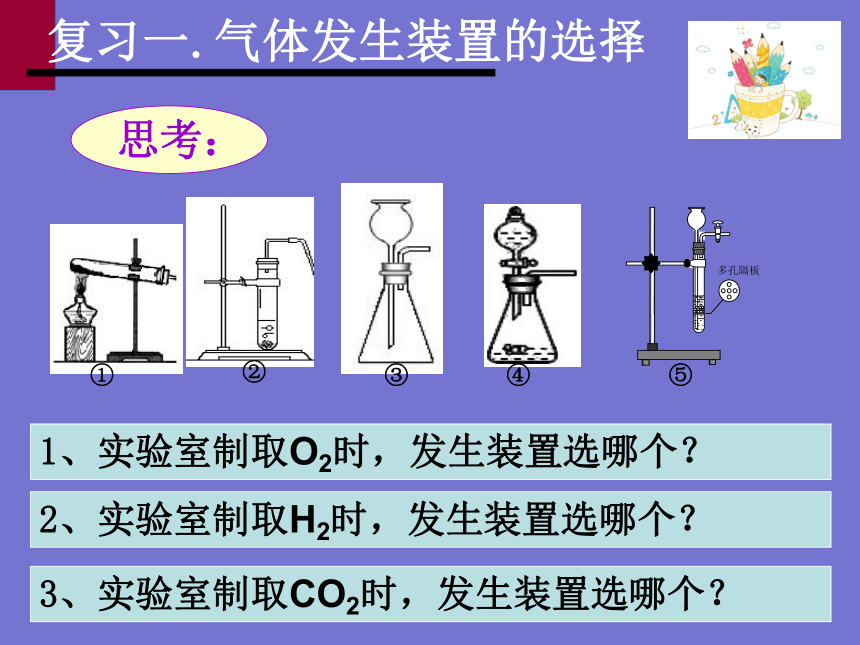
3、实验室制取CO2时,发生装置选哪个?
2、实验室制取H2时,发生装置选哪个?
1、实验室制取O2时,发生装置选哪个?
复习一.气体发生装置的选择
气体
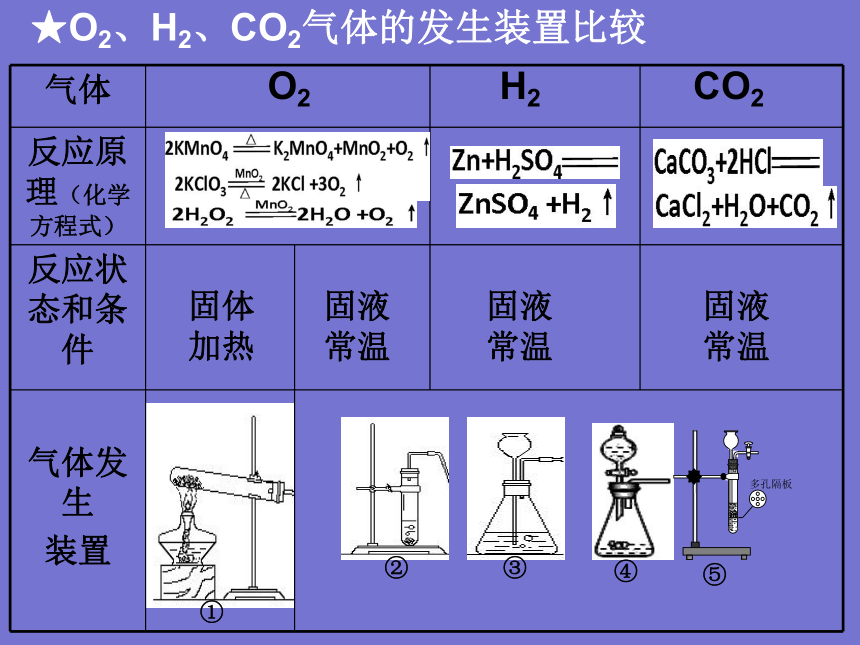
反应原理(化学方程式)
反应状态和条件
气体发生 装置 O2
H2
CO2
固体加热
固液常温
固液常温
固液常温
★O2、H2、CO2气体的发生装置比较
①
②
③
④
多孔隔板
⑤
制气 装置
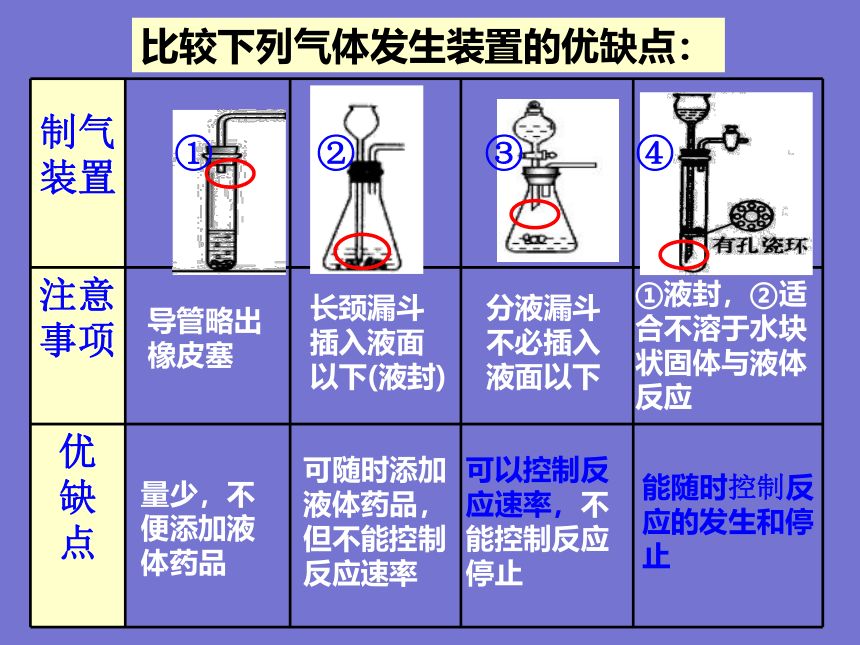
注意事项
优 缺 点
量少,不便添加液体药品
可随时添加液体药品,但不能控制反应速率
可以控制反应速率,不能控制反应停止
能随时控制反应的发生和停止
长颈漏斗
插入液面
以下(液封)
分液漏斗
不必插入
液面以下
导管略出
橡皮塞
比较下列气体发生装置的优缺点:
①液封,②适合不溶于水块状固体与液体反应
① ② ③ ④
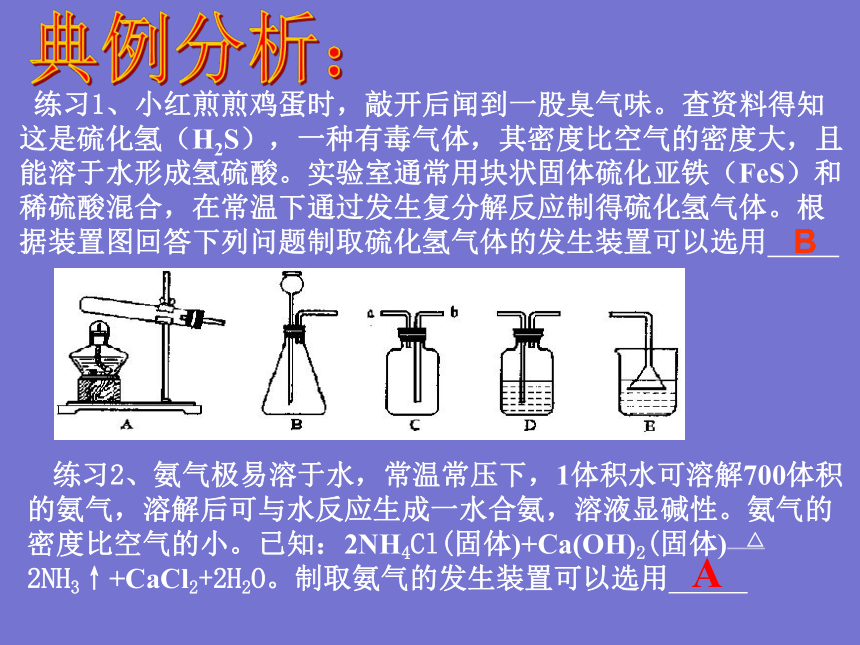
练习1、小红煎煎鸡蛋时,敲开后闻到一股臭气味。查资料得知这是硫化氢(H2S),一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。根据装置图回答下列问题制取硫化氢气体的发生装置可以选用
B
典例分析:
练习2、氨气极易溶于水,常温常压下,1体积水可溶解700体积的氨气,溶解后可与水反应生成一水合氨,溶液显碱性。氨气的密度比空气的小。已知:2NH4Cl(固体)+Ca(OH)2(固体) △ 2NH3↑+CaCl2+2H2O。制取氨气的发生装置可以选用
A
实验室制取气体时选择收集装置的依据是什么?
气体的密度
是否溶于水是否与水反应
收集装置
思考:
基本类型:
1)排水法
3)向下排空气法
2)向上排空气法
收集的气体不溶或难溶于水,
且不与水反应
气体密度大于空气,无毒
且不与空气中的成分反应
气体密度小于空气,无毒
且不与空气中的成分反应
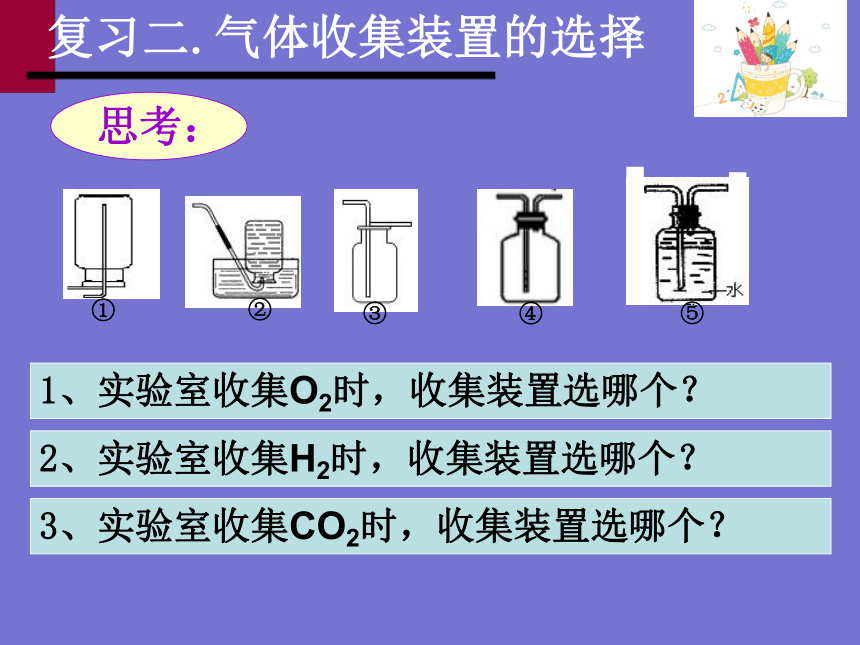
①
②
③
④
⑤
3、实验室收集CO2时,收集装置选哪个?
2、实验室收集H2时,收集装置选哪个?
1、实验室收集O2时,收集装置选哪个?
复习二.气体收集装置的选择
思考:
气体 O2 H2 CO2
密度与溶解性
收集方法 及装置
不易溶于水、
密度比空气大
难溶于水、
密度比空气小
易溶于水、
密度比空气大
①
②
③
④
⑤
②
④
⑤
④
③
上小下大,“尖”字诀
复习二.气体收集装置的选择
练习3、氨气密度比空气小,极易溶于水,以下收集氨气的方法正确的是( )
B
典例分析:
O2 CO2
检验方法
验满方法
带火星的木条伸入集气瓶内,复燃则为O2
1.带火星木条靠近集气瓶口,复燃则满
2.当集气瓶内水全部排尽且有大气泡从瓶口冒出时则满
倒入澄清石灰
水,振荡,变
浑浊则为CO2
燃着木条靠近集气瓶口,熄灭则满
复习三.气体的检验与验满
装置 气密性检查
夹紧橡皮管,向长颈漏斗中注
水至漏斗内液面高于锥形瓶中
液面,一段时间后液面不下降,证明气密性良好。(注水法)
将导管没入水中;手紧握试管(或用酒精灯微热试管),导管口有气泡产生,冷却后导管内形成一段水柱。(手捂法)
复习四.装置气密性检查
练习4、用推拉注射器活塞的方法可以检查下图装置的气密性。当缓慢拉动活塞时,如果装置气密性良好,则能观察到 ( )
A.注射器内有液体
B.瓶中液面明显上升
C.长颈漏斗内液面上升
D.长颈漏斗下端管口产生气泡
D
典例分析:
原则
将不纯净的气体中的杂质气体除去得到较纯净的气体的过程。
1、选择的试剂要能吸收杂质气体
2、被净化的气体不能与除杂试剂反应
复习五.气体的净化
H2中混有HCl
CO中混有CO2
将混合气体通过碱液(NaOH)等
CO2中混有CO、H2
(将混合气体通过灼热的CuO)
CO2中混有O2
(将混合气体通过灼热的Cu网)
例:
复习五.气体的净化
常见的干燥剂
生石灰、固体NaOH(不能干燥CO2、HCl等酸性气体)
浓硫酸、无水硫酸铜、无水氯化钙(不能干燥NH3等碱性气体)
复习六.气体的干燥
所用装置
1、液体试剂
(如烧碱溶液、浓硫酸)
原则:“长进短出”
2、固态试剂
如:固体NaOH、生石灰CaO和无水硫酸铜、无水CaCl2等
大进小出
复习六.气体的干燥
小组讨论:
分析右图装置有哪些作用?气体的通入方向?
1、净化、干燥气体
2、收集气体(密度比空气大)
4、排水集气法收集气体
3、收集气体(密度比空气小)
练习5、下图是实验室常用的装置。请据图回答:
(1)写出仪器①的名称 。收集某气体只能采用E装置,由此推测该气体具有的性质 ;
(2)用高锰酸钾制取氧气的装置组合是 (填序号),反应的化学方程式为 ;
(3)实验室制得的CO2气体中常含有HCl和水蒸气。为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项)。
A.a→b→c→d B.b→a→c→d C.c→d→a→b D.d→c→b→a
长颈漏斗
气体密度小于空气,无毒,可能与水发生反应 或者溶于水
2KMnO4 K2MnO4+MnO2+O2↑
BC或BD
C
典例分析:
注意:净化气体时,先除杂后干燥
而检验气体时,先验水再验杂
(1)首先研究生成该气体的化学反应原理;
(2)然后根据 和
选择并安装实验仪器,而且一定要检查 ;
(3)根据 确定气体的收集方法。
实验室制取气体的一般思路:
反应物状态
装置的气密性
气体的性质
反应条件
小结:
下面的实验仪器省去了固定装置,请根据要求回答问题:
(1)甲图中仪器①的名称为 。
(2)乙图中的微型装置H可用于实验室制备CO2,此微型装置在操作上的优点是 ;在甲图中可选择 (填序号)装配与装置H功能相同的装置。
(3)装配KClO3制备O2的发生装置,甲图中除固定装置外还差的仪器是 (写名称);该反应的化学方程式为 ;
长颈漏斗
可控制反应速率
ADEF (或BDGE)
酒精灯
2KClO3 2KCl+3O2↑
练习:
谢谢大家!
专题:常见气体的制取
1.学会O2、 CO2 、H2的实验室制法、注意事项。
2.通过对O2、CO2 、H2实验室制法的学习,掌握 实验室制取气体的思路和方法。
3. 学会探究一些气体的实验室制法及气体的进化和除杂。
4.掌握中考实验题的解答。
本节课的复习目标
实验室制取气体的一般思路:
本节课的复习内容
药品及反应原理
发生装置
收集装置
检验并验满
①
多孔隔板
⑤
④
③
②
思考:
3、实验室制取CO2时,发生装置选哪个?
2、实验室制取H2时,发生装置选哪个?
1、实验室制取O2时,发生装置选哪个?
复习一.气体发生装置的选择
气体
反应原理(化学方程式)
反应状态和条件
气体发生 装置 O2
H2
CO2
固体加热
固液常温
固液常温
固液常温
★O2、H2、CO2气体的发生装置比较
①
②
③
④
多孔隔板
⑤
制气 装置
注意事项
优 缺 点
量少,不便添加液体药品
可随时添加液体药品,但不能控制反应速率
可以控制反应速率,不能控制反应停止
能随时控制反应的发生和停止
长颈漏斗
插入液面
以下(液封)
分液漏斗
不必插入
液面以下
导管略出
橡皮塞
比较下列气体发生装置的优缺点:
①液封,②适合不溶于水块状固体与液体反应
① ② ③ ④
练习1、小红煎煎鸡蛋时,敲开后闻到一股臭气味。查资料得知这是硫化氢(H2S),一种有毒气体,其密度比空气的密度大,且能溶于水形成氢硫酸。实验室通常用块状固体硫化亚铁(FeS)和稀硫酸混合,在常温下通过发生复分解反应制得硫化氢气体。根据装置图回答下列问题制取硫化氢气体的发生装置可以选用
B
典例分析:
练习2、氨气极易溶于水,常温常压下,1体积水可溶解700体积的氨气,溶解后可与水反应生成一水合氨,溶液显碱性。氨气的密度比空气的小。已知:2NH4Cl(固体)+Ca(OH)2(固体) △ 2NH3↑+CaCl2+2H2O。制取氨气的发生装置可以选用
A
实验室制取气体时选择收集装置的依据是什么?
气体的密度
是否溶于水是否与水反应
收集装置
思考:
基本类型:
1)排水法
3)向下排空气法
2)向上排空气法
收集的气体不溶或难溶于水,
且不与水反应
气体密度大于空气,无毒
且不与空气中的成分反应
气体密度小于空气,无毒
且不与空气中的成分反应
①
②
③
④
⑤
3、实验室收集CO2时,收集装置选哪个?
2、实验室收集H2时,收集装置选哪个?
1、实验室收集O2时,收集装置选哪个?
复习二.气体收集装置的选择
思考:
气体 O2 H2 CO2
密度与溶解性
收集方法 及装置
不易溶于水、
密度比空气大
难溶于水、
密度比空气小
易溶于水、
密度比空气大
①
②
③
④
⑤
②
④
⑤
④
③
上小下大,“尖”字诀
复习二.气体收集装置的选择
练习3、氨气密度比空气小,极易溶于水,以下收集氨气的方法正确的是( )
B
典例分析:
O2 CO2
检验方法
验满方法
带火星的木条伸入集气瓶内,复燃则为O2
1.带火星木条靠近集气瓶口,复燃则满
2.当集气瓶内水全部排尽且有大气泡从瓶口冒出时则满
倒入澄清石灰
水,振荡,变
浑浊则为CO2
燃着木条靠近集气瓶口,熄灭则满
复习三.气体的检验与验满
装置 气密性检查
夹紧橡皮管,向长颈漏斗中注
水至漏斗内液面高于锥形瓶中
液面,一段时间后液面不下降,证明气密性良好。(注水法)
将导管没入水中;手紧握试管(或用酒精灯微热试管),导管口有气泡产生,冷却后导管内形成一段水柱。(手捂法)
复习四.装置气密性检查
练习4、用推拉注射器活塞的方法可以检查下图装置的气密性。当缓慢拉动活塞时,如果装置气密性良好,则能观察到 ( )
A.注射器内有液体
B.瓶中液面明显上升
C.长颈漏斗内液面上升
D.长颈漏斗下端管口产生气泡
D
典例分析:
原则
将不纯净的气体中的杂质气体除去得到较纯净的气体的过程。
1、选择的试剂要能吸收杂质气体
2、被净化的气体不能与除杂试剂反应
复习五.气体的净化
H2中混有HCl
CO中混有CO2
将混合气体通过碱液(NaOH)等
CO2中混有CO、H2
(将混合气体通过灼热的CuO)
CO2中混有O2
(将混合气体通过灼热的Cu网)
例:
复习五.气体的净化
常见的干燥剂
生石灰、固体NaOH(不能干燥CO2、HCl等酸性气体)
浓硫酸、无水硫酸铜、无水氯化钙(不能干燥NH3等碱性气体)
复习六.气体的干燥
所用装置
1、液体试剂
(如烧碱溶液、浓硫酸)
原则:“长进短出”
2、固态试剂
如:固体NaOH、生石灰CaO和无水硫酸铜、无水CaCl2等
大进小出
复习六.气体的干燥
小组讨论:
分析右图装置有哪些作用?气体的通入方向?
1、净化、干燥气体
2、收集气体(密度比空气大)
4、排水集气法收集气体
3、收集气体(密度比空气小)
练习5、下图是实验室常用的装置。请据图回答:
(1)写出仪器①的名称 。收集某气体只能采用E装置,由此推测该气体具有的性质 ;
(2)用高锰酸钾制取氧气的装置组合是 (填序号),反应的化学方程式为 ;
(3)实验室制得的CO2气体中常含有HCl和水蒸气。为了得到纯净、干燥的CO2气体,除杂装置的导管气流方向连接顺序是 (填选项)。
A.a→b→c→d B.b→a→c→d C.c→d→a→b D.d→c→b→a
长颈漏斗
气体密度小于空气,无毒,可能与水发生反应 或者溶于水
2KMnO4 K2MnO4+MnO2+O2↑
BC或BD
C
典例分析:
注意:净化气体时,先除杂后干燥
而检验气体时,先验水再验杂
(1)首先研究生成该气体的化学反应原理;
(2)然后根据 和
选择并安装实验仪器,而且一定要检查 ;
(3)根据 确定气体的收集方法。
实验室制取气体的一般思路:
反应物状态
装置的气密性
气体的性质
反应条件
小结:
下面的实验仪器省去了固定装置,请根据要求回答问题:
(1)甲图中仪器①的名称为 。
(2)乙图中的微型装置H可用于实验室制备CO2,此微型装置在操作上的优点是 ;在甲图中可选择 (填序号)装配与装置H功能相同的装置。
(3)装配KClO3制备O2的发生装置,甲图中除固定装置外还差的仪器是 (写名称);该反应的化学方程式为 ;
长颈漏斗
可控制反应速率
ADEF (或BDGE)
酒精灯
2KClO3 2KCl+3O2↑
练习:
谢谢大家!
同课章节目录
