云南省昭通市市直中学联考2023-2024学年高一上学期12月第二次月考化学试题(含答案)
文档属性
| 名称 | 云南省昭通市市直中学联考2023-2024学年高一上学期12月第二次月考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 846.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-02 09:08:24 | ||
图片预览



文档简介
昭通市市直中学2023年秋季学期高一年级联考第二次月考
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1页至第6页,第Ⅱ卷第6页至第8页。考试结束后,请将本试卷和答题卡一并交回。满分100分,考试用时90分钟。
第Ⅰ卷(选择题,共60分)
注意事项:
1.答题前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号在答题卡上填写清楚。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。在试题卷上作答无效。
以下数据可供解题时参考。
可能用到的相对原子质量:
一、选择题(本大题共20小题,每小题3分,共60分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.2023年2月20日,北京大学科研工作者在《Nano Research Energy》上发表的文章中全面介绍了高纯度半导体碳纳米管;美国科学家用某有机分子和球形笼状分子制成了“纳米车”,每辆“纳米车”是由一个有机分子和4个分子构成,直径约6到9纳米。下列说法正确的是( )
A.和碳纳米管均属于新型化合物 B.“纳米车”中的有机分子是电解质
C.该“纳米车”分散到蒸馏水中可以形成胶体 D.与碳纳米管不是同素异形体
2.下列材料中所涉及的合金不属于新型合金的是( )
A.飞机窝扇用的是耐高温的合金材料 B.“中国天眼”使用的碳化硅 C.“蛟龙”号载人舱是用钛合金制的 D.新能源汽车储氢材料
3.杭州亚运会打造“绿色建筑”,亚运场馆大量使用了碲化镉()发电玻璃。下列说法正确的是( )
A.和的核外电子数之差为2
B.的中子数比质子数多14个
C.的原子结构示意图为
D.与互为同位素
4.一种以太阳能聚热驱动制备CO和的过程如图1所示,是总反应的催化剂,下列说法不正确的是( )
A.既能与盐酸反应又能与氢氧化钠溶液反应
B.吸氮反应中为氧化产物
C.整个过程的总反应为
D.释氮反应中消耗3mol 可释放出44.8L的氨气
5.下列各组物质的转化关系不能均由一步反应实现的是( )
A.
B.
C.
D.
6.“铁肥”(如图2所示,主要含)常用于解决植物叶面变黄问题,通过溶于水配制成溶液喷施在叶面上。下列有关“铁肥”说法错误的是( )
A.可用溶液检验“铁肥”是否完全失效
B.属于纯净物
C.“铁肥”易因保存不当被空气氧化变质
D.为保证“铁肥”的效果,可向配制后的溶液中加入少量铁粉
7.下列表示对应化学反应的离子方程式正确的是( )
A.用溶液腐蚀铜箔制造印刷电路板:
B.与氢氧化钠溶液反应:
C.碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:
D.向溶液中通入:
8.在下列条件的溶液中,一定能大量共存的离子组是( )
A.在含大量的溶液中:、、、
B.澄清透明的溶液中:、、、
C.使无色酚酞试液呈红色的溶液中:、、、
D.加入铝粉放出的溶液中:、、、
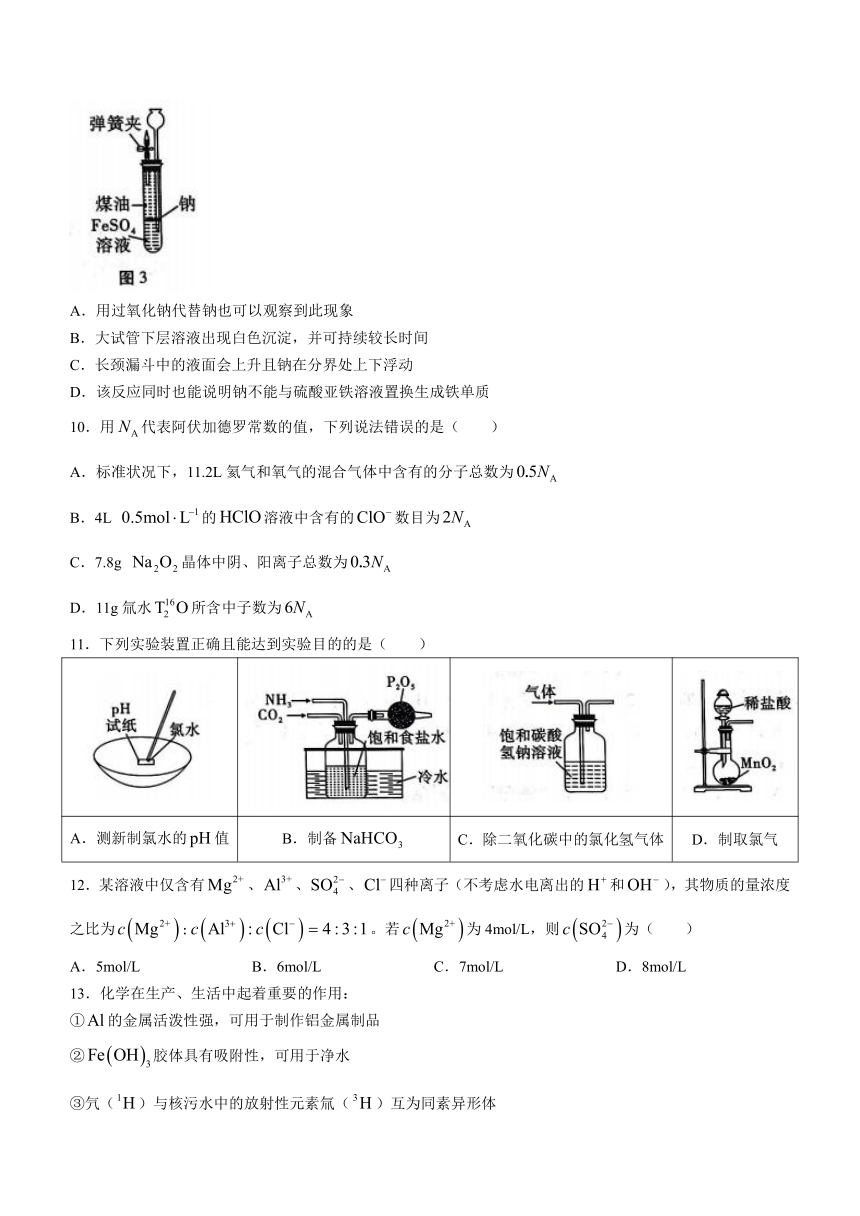
9.有人设计出一种在隔绝空气条件下让钠与溶液反应,观察颜色的实验。实验时,往100mL的大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入溶液(不含)使煤油的液面至橡胶塞,并夹紧弹簧夹(如图3所示)。下列说法错误的是( )
A.用过氧化钠代替钠也可以观察到此现象
B.大试管下层溶液出现白色沉淀,并可持续较长时间
C.长颈漏斗中的液面会上升且钠在分界处上下浮动
D.该反应同时也能说明钠不能与硫酸亚铁溶液置换生成铁单质
10.用代表阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,11.2L氦气和氧气的混合气体中含有的分子总数为
B.4L 的溶液中含有的数目为
C.7.8g 晶体中阴、阳离子总数为
D.11g氚水所含中子数为
11.下列实验装置正确且能达到实验目的的是( )
A.测新制氯水的值 B.制备 C.除二氧化碳中的氯化氢气体 D.制取氯气
12.某溶液中仅含有、、、四种离子(不考虑水电离出的和),其物质的量浓度之比为。若为4mol/L,则为( )
A.5mol/L B.6mol/L C.7mol/L D.8mol/L
13.化学在生产、生活中起着重要的作用:
①的金属活泼性强,可用于制作铝金属制品
②胶体具有吸附性,可用于净水
③氕()与核污水中的放射性元素氚()互为同素异形体
④维生素可用作水果罐头的抗氧化剂是由于其具有还原性
⑤大力发展风能发电与实现“碳达峰、碳中和”理念相违背
⑥用盐酸除铁锈,是因为溶于水后,其溶液显碱性
其中叙述正确的个数有( )
A.1项 B.2项 C.3项 D.4项
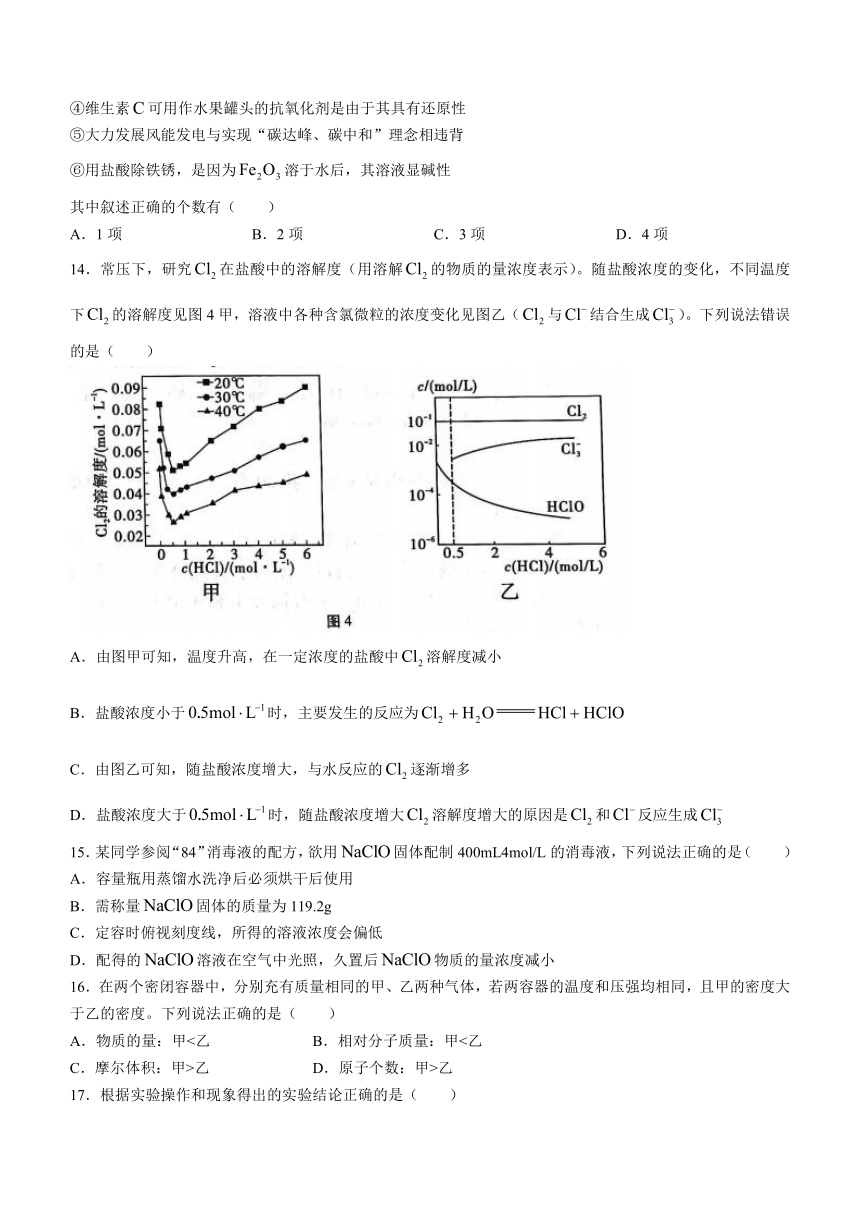
14.常压下,研究在盐酸中的溶解度(用溶解的物质的量浓度表示)。随盐酸浓度的变化,不同温度下的溶解度见图4甲,溶液中各种含氯微粒的浓度变化见图乙(与结合生成)。下列说法错误的是( )
A.由图甲可知,温度升高,在一定浓度的盐酸中溶解度减小
B.盐酸浓度小于时,主要发生的反应为
C.由图乙可知,随盐酸浓度增大,与水反应的逐渐增多
D.盐酸浓度大于时,随盐酸浓度增大溶解度增大的原因是和反应生成
15.某同学参阅“84”消毒液的配方,欲用固体配制400mL4mol/L的消毒液,下列说法正确的是( )
A.容量瓶用蒸馏水洗净后必须烘干后使用
B.需称量固体的质量为119.2g
C.定容时俯视刻度线,所得的溶液浓度会偏低
D.配得的溶液在空气中光照,久置后物质的量浓度减小
16.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度。下列说法正确的是( )
A.物质的量:甲<乙 B.相对分子质量:甲<乙
C.摩尔体积:甲>乙 D.原子个数:甲>乙
17.根据实验操作和现象得出的实验结论正确的是( )
选项 实验操作和现象 实验结论
A 用铂丝蘸取少量某溶液进行焰色试验,有黄色火焰,透过蓝色钴玻璃显紫色 该溶液中一定含有钠盐和钾盐
B 向某溶液中滴加几滴新制氯水,振荡,再加入少量溶液,溶液变为红色 溶液中一定含有
C 向某溶液中加入几滴溶液,产生白色沉淀 该溶液中一定含有
D 将未打磨的薄铝片放在火焰上加热,晃动铝片,内部有液态物质流动,但没熔融下滴 氧化铝熔点高于金属铝
18.少量与溶液能发生如下反应(方程式未配平),设为阿伏加德罗常数的值,下列说法正确的是( )
A.每生成1mol ,转移的电子数为
B. 溶液含的数目为
C.用含1mol 的饱和溶液制备胶体可制得的胶粒数为
D.生成的与物质的量之比为1:1
19.某同学欲用图5所示实验装置完成一些物质性质的检验,下列有关说法不正确的是( )
A.欲验证能还原,⑤中应放无水硫酸铜,⑤之后再接一个干燥装置
B.若在④中验证氯气和铁的反应,③中应放碱石灰
C.若在④中验证氧气能和氧化亚铁反应,①中应放双氧水
D.欲验证和反应能生成氧气,还需要在⑤后放置一个带火星的木条
20.某同学将一定量的加热分解,发生反应的化学方程式为,测得生成的和的质量分别为10.2g和32.4g,则的数值和反应产生的的物质的量分别为( )
A.9 0.3mol B.18 0.3mol
C.9 0.6mol D.18 0.6mol
第Ⅱ卷(非选择题,共40分)
注意事项:
第Ⅱ卷用黑色碳素笔在答题卡上各题的答题区域内作答,在试题卷上作答无效。
二、填空题(本大题共3小题,共40分)
21.(14分)回答下列问题:
(1)如图6为五个椭圆交叉构成的图案,其中五个椭圆内分别写了((乙醇)、、、、,图中相连的物质均可归为一类,相交部分、、、为相应的分类标准代号。
①相连的两种物质都是电解质的是______(填分类标准代号)。
②中的结构示意图是______。
(2)分类方法应用广泛,属于同一类的物质具有相似性。
①、都属于酸性氧化物,,可得出与反应的化学方程式为_____________________________________________________。
②已知钾元素位于元素周期表中第四周期第ⅠA族,性质与钠相似,钾的原子序数为______。钾单质与反应的离子方程式为___________________________________________________。
(3)某实验小组测定铁的氧化物的化学式,已知该氧化物中铁元素只有+2和+3两种价态,实验步骤如图7所示:
①为证明步骤②中已反应完全,可选择下列的试剂有______(填序号)。
A.铁氰化钾溶液 B.酸性溶液
C.溶液 D.溶液
②该氧化物的化学式为______。
22.(14分)海洋是一个巨大的化学资源宝库,其中钠元素和氯元素是海洋中含量较高的元素。生活中也有很多含钠、含氯的化合物。请结合所学化学知识,回答下列问题:
(1)过氧化钠可以在潜水艇和消防员的呼吸面具中作为氧气来源。若只考虑过氧化钠与二氧化碳反应,每生成1mol氧气,反应转移电子数约为______。
(2)①现实验室需要480mL 的溶液,某同学用固体配制该物质的量浓度的溶液。应用托盘天平称取固体______g。配制溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、______。
②如图8所示是溶液配制的过程:
观察图示判断,其中不正确的操作有______(填序号)。
③实验时遇到下列情况,会导致溶液物质的量浓度偏低的是______(填序号)。
A.容量瓶内壁附有水珠而未干燥处理
B.称量使用的砝码已生锈
C.溶解时使用的烧杯及玻璃棒未洗涤
D.称量时间过长,固体部分已潮解
E.定容时仰视刻度线
F.摇匀后发现液面低于刻度线后未做处理
(3)纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。现将0.01mol和0.01mol 混合并配成溶液,向溶液中滴加稀盐酸。下列图像能正确表示加入盐酸的体积和生成的物质的量的关系的是______(填序号)。
(4)若称取16.8g纯净的固体,充分加热后,剩余固体的质量为10.6g。如果把剩余的固体全部加入100mL 的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度______(设溶液的体积变化及盐酸的挥发忽略不计)。
23.(12分)铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的两位同学为测定某铝镁合金(不含其他元素)中铝的质量分数,设计下列两种不同实验方案进行探究。填写下列空白:
探究一
实验方案:
(1)铝镁合金测定剩余固体质量。实验中发生反应的化学方程式是____________。称取5.4g铝镁合金粉末样品,投入体积为、浓度为4.0mol/L的溶液中,充分反应。为保证合金充分反应,溶液的体积______mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将______(填“偏大”或“偏小”)。
探究二
实验方案:称取3.9g铝镁合金测定生成气体的体积(实验装置如图9所示)。
(3)盛装盐酸的仪器名称为______。
(4)为使测定结果尽可能精确,实验中应注意的问题有______(填序号)。
A.检查装置的气密性
B.加入足量盐酸
C.调整量气管的高度,使中液面与中液面相平
D.待冷却至室温再读体积
(5)经测定生成的气体体积为4.48L(已折算为标准状况下的体积),计算该铝镁合金中铝的质量分数为______。(保留到小数点后1位)
昭通市市直中学2023年秋季学期高一年级联考第二次月考
化学参考答案
第Ⅰ卷(选择题,共60分)
一、选择题(本大题共20小题,每小题3分,共60分。在每小题给出的四个选项中,只有一项是符合题目要求的)
题号 1 2 3 4 5 6 7 8 9 10
答案 C B C D D A B B A B
题号 11 12 13 14 15 16 17 18 19 20
答案 C D B C D A D A B C
第Ⅱ卷(非选择题,共40分)
二、填空题(本大题共3小题,共40分)
21.(每空2分,共14分)
(1)①CD ②
(2)① ②19
(3)①A ②
22.(每空2分,共14分)
(1)
(2)①4.0 500mL容量瓶
②BE
③CDE
(3)D
(4)1mol/L
23.(每空2分,共12分)
(1) 50
(2)偏小
(3)分液漏斗
(4)ABCD
(5)69.2%
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1页至第6页,第Ⅱ卷第6页至第8页。考试结束后,请将本试卷和答题卡一并交回。满分100分,考试用时90分钟。
第Ⅰ卷(选择题,共60分)
注意事项:
1.答题前,考生务必用黑色碳素笔将自己的姓名、准考证号、考场号、座位号在答题卡上填写清楚。
2.每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。在试题卷上作答无效。
以下数据可供解题时参考。
可能用到的相对原子质量:
一、选择题(本大题共20小题,每小题3分,共60分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.2023年2月20日,北京大学科研工作者在《Nano Research Energy》上发表的文章中全面介绍了高纯度半导体碳纳米管;美国科学家用某有机分子和球形笼状分子制成了“纳米车”,每辆“纳米车”是由一个有机分子和4个分子构成,直径约6到9纳米。下列说法正确的是( )
A.和碳纳米管均属于新型化合物 B.“纳米车”中的有机分子是电解质
C.该“纳米车”分散到蒸馏水中可以形成胶体 D.与碳纳米管不是同素异形体
2.下列材料中所涉及的合金不属于新型合金的是( )
A.飞机窝扇用的是耐高温的合金材料 B.“中国天眼”使用的碳化硅 C.“蛟龙”号载人舱是用钛合金制的 D.新能源汽车储氢材料
3.杭州亚运会打造“绿色建筑”,亚运场馆大量使用了碲化镉()发电玻璃。下列说法正确的是( )
A.和的核外电子数之差为2
B.的中子数比质子数多14个
C.的原子结构示意图为
D.与互为同位素
4.一种以太阳能聚热驱动制备CO和的过程如图1所示,是总反应的催化剂,下列说法不正确的是( )
A.既能与盐酸反应又能与氢氧化钠溶液反应
B.吸氮反应中为氧化产物
C.整个过程的总反应为
D.释氮反应中消耗3mol 可释放出44.8L的氨气
5.下列各组物质的转化关系不能均由一步反应实现的是( )
A.
B.
C.
D.
6.“铁肥”(如图2所示,主要含)常用于解决植物叶面变黄问题,通过溶于水配制成溶液喷施在叶面上。下列有关“铁肥”说法错误的是( )
A.可用溶液检验“铁肥”是否完全失效
B.属于纯净物
C.“铁肥”易因保存不当被空气氧化变质
D.为保证“铁肥”的效果,可向配制后的溶液中加入少量铁粉
7.下列表示对应化学反应的离子方程式正确的是( )
A.用溶液腐蚀铜箔制造印刷电路板:
B.与氢氧化钠溶液反应:
C.碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:
D.向溶液中通入:
8.在下列条件的溶液中,一定能大量共存的离子组是( )
A.在含大量的溶液中:、、、
B.澄清透明的溶液中:、、、
C.使无色酚酞试液呈红色的溶液中:、、、
D.加入铝粉放出的溶液中:、、、
9.有人设计出一种在隔绝空气条件下让钠与溶液反应,观察颜色的实验。实验时,往100mL的大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入溶液(不含)使煤油的液面至橡胶塞,并夹紧弹簧夹(如图3所示)。下列说法错误的是( )
A.用过氧化钠代替钠也可以观察到此现象
B.大试管下层溶液出现白色沉淀,并可持续较长时间
C.长颈漏斗中的液面会上升且钠在分界处上下浮动
D.该反应同时也能说明钠不能与硫酸亚铁溶液置换生成铁单质
10.用代表阿伏加德罗常数的值,下列说法错误的是( )
A.标准状况下,11.2L氦气和氧气的混合气体中含有的分子总数为
B.4L 的溶液中含有的数目为
C.7.8g 晶体中阴、阳离子总数为
D.11g氚水所含中子数为
11.下列实验装置正确且能达到实验目的的是( )
A.测新制氯水的值 B.制备 C.除二氧化碳中的氯化氢气体 D.制取氯气
12.某溶液中仅含有、、、四种离子(不考虑水电离出的和),其物质的量浓度之比为。若为4mol/L,则为( )
A.5mol/L B.6mol/L C.7mol/L D.8mol/L
13.化学在生产、生活中起着重要的作用:
①的金属活泼性强,可用于制作铝金属制品
②胶体具有吸附性,可用于净水
③氕()与核污水中的放射性元素氚()互为同素异形体
④维生素可用作水果罐头的抗氧化剂是由于其具有还原性
⑤大力发展风能发电与实现“碳达峰、碳中和”理念相违背
⑥用盐酸除铁锈,是因为溶于水后,其溶液显碱性
其中叙述正确的个数有( )
A.1项 B.2项 C.3项 D.4项
14.常压下,研究在盐酸中的溶解度(用溶解的物质的量浓度表示)。随盐酸浓度的变化,不同温度下的溶解度见图4甲,溶液中各种含氯微粒的浓度变化见图乙(与结合生成)。下列说法错误的是( )
A.由图甲可知,温度升高,在一定浓度的盐酸中溶解度减小
B.盐酸浓度小于时,主要发生的反应为
C.由图乙可知,随盐酸浓度增大,与水反应的逐渐增多
D.盐酸浓度大于时,随盐酸浓度增大溶解度增大的原因是和反应生成
15.某同学参阅“84”消毒液的配方,欲用固体配制400mL4mol/L的消毒液,下列说法正确的是( )
A.容量瓶用蒸馏水洗净后必须烘干后使用
B.需称量固体的质量为119.2g
C.定容时俯视刻度线,所得的溶液浓度会偏低
D.配得的溶液在空气中光照,久置后物质的量浓度减小
16.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度。下列说法正确的是( )
A.物质的量:甲<乙 B.相对分子质量:甲<乙
C.摩尔体积:甲>乙 D.原子个数:甲>乙
17.根据实验操作和现象得出的实验结论正确的是( )
选项 实验操作和现象 实验结论
A 用铂丝蘸取少量某溶液进行焰色试验,有黄色火焰,透过蓝色钴玻璃显紫色 该溶液中一定含有钠盐和钾盐
B 向某溶液中滴加几滴新制氯水,振荡,再加入少量溶液,溶液变为红色 溶液中一定含有
C 向某溶液中加入几滴溶液,产生白色沉淀 该溶液中一定含有
D 将未打磨的薄铝片放在火焰上加热,晃动铝片,内部有液态物质流动,但没熔融下滴 氧化铝熔点高于金属铝
18.少量与溶液能发生如下反应(方程式未配平),设为阿伏加德罗常数的值,下列说法正确的是( )
A.每生成1mol ,转移的电子数为
B. 溶液含的数目为
C.用含1mol 的饱和溶液制备胶体可制得的胶粒数为
D.生成的与物质的量之比为1:1
19.某同学欲用图5所示实验装置完成一些物质性质的检验,下列有关说法不正确的是( )
A.欲验证能还原,⑤中应放无水硫酸铜,⑤之后再接一个干燥装置
B.若在④中验证氯气和铁的反应,③中应放碱石灰
C.若在④中验证氧气能和氧化亚铁反应,①中应放双氧水
D.欲验证和反应能生成氧气,还需要在⑤后放置一个带火星的木条
20.某同学将一定量的加热分解,发生反应的化学方程式为,测得生成的和的质量分别为10.2g和32.4g,则的数值和反应产生的的物质的量分别为( )
A.9 0.3mol B.18 0.3mol
C.9 0.6mol D.18 0.6mol
第Ⅱ卷(非选择题,共40分)
注意事项:
第Ⅱ卷用黑色碳素笔在答题卡上各题的答题区域内作答,在试题卷上作答无效。
二、填空题(本大题共3小题,共40分)
21.(14分)回答下列问题:
(1)如图6为五个椭圆交叉构成的图案,其中五个椭圆内分别写了((乙醇)、、、、,图中相连的物质均可归为一类,相交部分、、、为相应的分类标准代号。
①相连的两种物质都是电解质的是______(填分类标准代号)。
②中的结构示意图是______。
(2)分类方法应用广泛,属于同一类的物质具有相似性。
①、都属于酸性氧化物,,可得出与反应的化学方程式为_____________________________________________________。
②已知钾元素位于元素周期表中第四周期第ⅠA族,性质与钠相似,钾的原子序数为______。钾单质与反应的离子方程式为___________________________________________________。
(3)某实验小组测定铁的氧化物的化学式,已知该氧化物中铁元素只有+2和+3两种价态,实验步骤如图7所示:
①为证明步骤②中已反应完全,可选择下列的试剂有______(填序号)。
A.铁氰化钾溶液 B.酸性溶液
C.溶液 D.溶液
②该氧化物的化学式为______。
22.(14分)海洋是一个巨大的化学资源宝库,其中钠元素和氯元素是海洋中含量较高的元素。生活中也有很多含钠、含氯的化合物。请结合所学化学知识,回答下列问题:
(1)过氧化钠可以在潜水艇和消防员的呼吸面具中作为氧气来源。若只考虑过氧化钠与二氧化碳反应,每生成1mol氧气,反应转移电子数约为______。
(2)①现实验室需要480mL 的溶液,某同学用固体配制该物质的量浓度的溶液。应用托盘天平称取固体______g。配制溶液时需用的主要仪器有托盘天平、药匙、烧杯、量筒、玻璃棒、胶头滴管、______。
②如图8所示是溶液配制的过程:
观察图示判断,其中不正确的操作有______(填序号)。
③实验时遇到下列情况,会导致溶液物质的量浓度偏低的是______(填序号)。
A.容量瓶内壁附有水珠而未干燥处理
B.称量使用的砝码已生锈
C.溶解时使用的烧杯及玻璃棒未洗涤
D.称量时间过长,固体部分已潮解
E.定容时仰视刻度线
F.摇匀后发现液面低于刻度线后未做处理
(3)纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。现将0.01mol和0.01mol 混合并配成溶液,向溶液中滴加稀盐酸。下列图像能正确表示加入盐酸的体积和生成的物质的量的关系的是______(填序号)。
(4)若称取16.8g纯净的固体,充分加热后,剩余固体的质量为10.6g。如果把剩余的固体全部加入100mL 的盐酸中充分反应。求溶液中剩余的盐酸的物质的量浓度______(设溶液的体积变化及盐酸的挥发忽略不计)。
23.(12分)铝镁合金已成为轮船制造、化工生产等行业的重要材料。某研究性学习小组的两位同学为测定某铝镁合金(不含其他元素)中铝的质量分数,设计下列两种不同实验方案进行探究。填写下列空白:
探究一
实验方案:
(1)铝镁合金测定剩余固体质量。实验中发生反应的化学方程式是____________。称取5.4g铝镁合金粉末样品,投入体积为、浓度为4.0mol/L的溶液中,充分反应。为保证合金充分反应,溶液的体积______mL。
(2)过滤、洗涤、干燥、称量固体。该步骤中若未洗涤固体,测得铝的质量分数将______(填“偏大”或“偏小”)。
探究二
实验方案:称取3.9g铝镁合金测定生成气体的体积(实验装置如图9所示)。
(3)盛装盐酸的仪器名称为______。
(4)为使测定结果尽可能精确,实验中应注意的问题有______(填序号)。
A.检查装置的气密性
B.加入足量盐酸
C.调整量气管的高度,使中液面与中液面相平
D.待冷却至室温再读体积
(5)经测定生成的气体体积为4.48L(已折算为标准状况下的体积),计算该铝镁合金中铝的质量分数为______。(保留到小数点后1位)
昭通市市直中学2023年秋季学期高一年级联考第二次月考
化学参考答案
第Ⅰ卷(选择题,共60分)
一、选择题(本大题共20小题,每小题3分,共60分。在每小题给出的四个选项中,只有一项是符合题目要求的)
题号 1 2 3 4 5 6 7 8 9 10
答案 C B C D D A B B A B
题号 11 12 13 14 15 16 17 18 19 20
答案 C D B C D A D A B C
第Ⅱ卷(非选择题,共40分)
二、填空题(本大题共3小题,共40分)
21.(每空2分,共14分)
(1)①CD ②
(2)① ②19
(3)①A ②
22.(每空2分,共14分)
(1)
(2)①4.0 500mL容量瓶
②BE
③CDE
(3)D
(4)1mol/L
23.(每空2分,共12分)
(1) 50
(2)偏小
(3)分液漏斗
(4)ABCD
(5)69.2%
同课章节目录
