化学人教版(2019)必修第一册4.1.4卤族元素(共29张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.1.4卤族元素(共29张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-02 09:17:02 | ||
图片预览







文档简介
(共29张PPT)
第四章
物质结构 元素周期律
第一节 原子结构与元素周期表
课时4 卤族元素
学习目标
1. 了解卤族元素在周期表中的位置及原子结构特征。
2. 了解卤族元素性质的相似性和递变性。
3. 初步学会根据原子结构的特点,推测元素的化学性质。
1.卤族元素的物理性质
根据教材p102表4-3中的信息,思考卤族元素单质的物理性质有什么相同点和递变性?
1.都有颜色,但从F2→Cl2→Br2→I2颜色逐渐加深
2.状态:气—液—固,常温下Br2是唯一的液态非金属单质
3.熔点和沸点逐渐升高 (与碱金属的熔沸点变化规律相反),密度逐渐增大
(Br2易挥发,I2易升华,碘蒸气为紫色)
4.溶解性:除F2外,卤素单质在水中溶解度都很小,但易溶于乙醇、苯、CCl4等有机溶剂
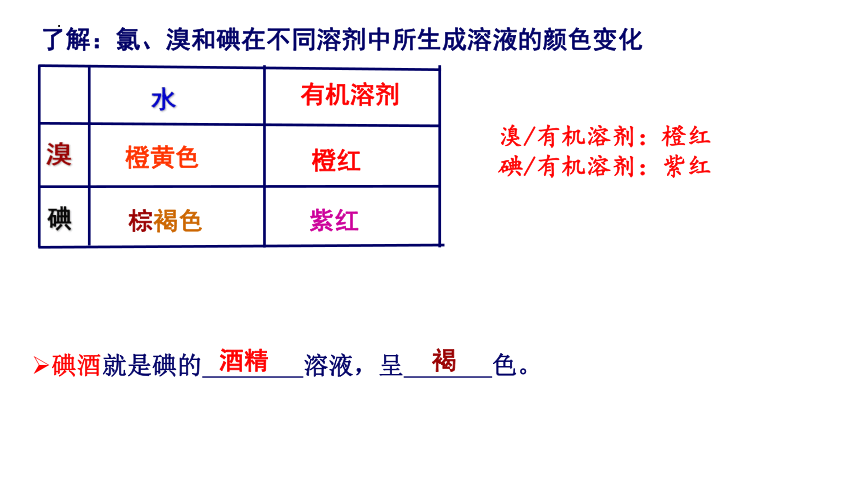
了解:氯、溴和碘在不同溶剂中所生成溶液的颜色变化
碘酒就是碘的 溶液,呈 色。
酒精
棕褐色
水
溴
碘
橙黄色
橙红
紫红
褐
溴/有机溶剂:橙红
碘/有机溶剂:紫红
有机溶剂
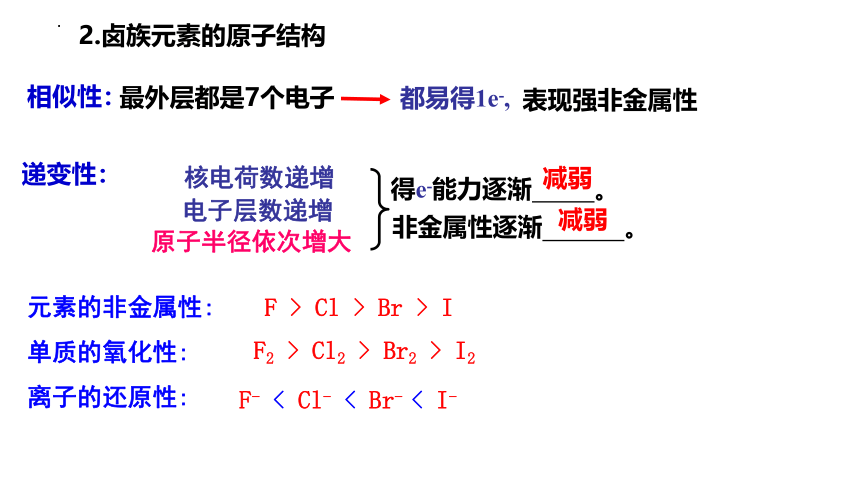
相似性:
最外层都是7个电子
都易得1e-,
表现强非金属性
递变性:
核电荷数递增
电子层数递增
原子半径依次增大
得e-能力逐渐 。
非金属性逐渐 。
元素的非金属性:
单质的氧化性:
离子的还原性:
F > Cl > Br > I
F2 > Cl2 > Br2 > I2
F- < Cl- < Br- < I-
2.卤族元素的原子结构
减弱
减弱
3.卤素单质的化学性质
1)与金属单质(除金、铂外)反应
2)与某些非金属单质(如H2、P、C等)反应
3)与水反应
4)与碱液反应【制漂白粉、漂白液等】
5) 与一些还原性物质反应
Fe2+\ SO32-\ SO2\ I- \ Br- \ S2- \
回忆:氯气的化学性质
根据原子结构特点,试推测F2、Cl2、Br2、I2在化学性质上所表现的相似性和递变性。
(I2的氧化能力弱,跟变价金属反应时,生成低价态)
1).卤素与金属单质的反应
③特殊地:
[注意: 与氯气性质对比]
②3X2+2Fe == 2FeX3
I2 +Fe == FeI2
∴ 氧化性: F2 > Cl2 > Br2 > I2
①F2可与所有金属单质反应 (它甚至可与惰性气体反应)
(X=F、Cl、Br)
+3
3.卤素单质的化学性质
F2+H2 = 2HF
I2+H2 2HI
Br2+H2 2HBr
Cl2+H2 2HCl
点燃或光照
500℃
△
[冷暗处,极易爆炸]
[持续加热,反应可逆]
(1)单质的氧化性:F2 Cl2 Br2 I2
>
>
>
2).卤素与氢气的反应
F2
Cl2
Br2
I2
反应越来越难
(2)生成的HX稳定性关系:HF > HCl > HBr > HI
【教材P97 表4-4】
阴离子的还原性呢?
Cl–
Br–
I–
F–
< < <
Br2+ H2O HBr+HBrO
反应越来越难
2F2+2H2O=4HF+O2
3).卤素与水反应
I2 +H2O HI+HIO
Cl2 + H2O HCl+HClO
(能反应)
(极弱)
(很弱)
(很剧烈)
F2的特殊性
通式:X2 + H2O = HX + HXO (X:Cl、Br、I)
4)、卤素单质与碱反应?:
X2 + 2NaOH = NaX + NaXO + H2O
所以,NaOH可使氯水、溴水、碘水褪色
F2特殊
(X=Cl、Br、I)
5)卤素间的置换反应?
〖思考〗F2与氯、溴、碘的盐溶液可以置换出相应的卤素单质吗?
(P98 实验4-1)
①氯水与KBr溶液混合
③溴水与KI溶液混合
②氯水与KI溶液混合
Cl2 + 2KI =I2 + 2KCl
Cl2+ 2KBr=2KCl+Br2
Br2+ 2KI = 2KBr + I2
5)卤素间的置换反应?
〖思考〗F2与氯、溴、碘的盐溶液可以置换出相应的卤素单质吗?
(Cl2可使湿润的淀粉KI试纸变蓝)
不可以
①氯水与KBr溶液混合
③溴水与KI溶液混合
(P98 实验4-1)
证明氧化性:Cl2>Br2>I2
②氯水与KI溶液混合
溶液由无色变为橙黄色
溶液由无色变为棕褐色
溶液由无色变为棕黄色
①最高价氧化物对应水化物的酸性强弱:
元素非金属性强弱判断依据
归纳总结:
(P97 注释②)
②非金属元素单质与H2化合的难易程度:
化合越容易,非金属性越强
③形成气态氢化物的稳定性:
气态氢化物越稳定,元素的非金属性越强
④单质间的置换反应
⑤对应阴离子的还原性:
阴离子的还原性越强,元素的非金属性越弱
酸性越强,对应非金属元素非金属性越强
(最高价含氧酸)
下列事实能说明氯元素的非金属性比硫元素强的是 。
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S大
④HCl的还原性比H2S弱
⑤HClO4的酸性比H2SO4强
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧还原性:Cl-<S2-
③④⑤⑥⑦⑧
×
√
×
√
√
√
√
√
[小结]
至此我们可以看到同一主族元素,无论是金属还是非金属在性质方面都具有一定的相似性和递变性。
金属性逐渐增强
失电子的能力逐渐增强
非金属性逐渐减弱
得电子的能力逐渐减弱
还原性逐渐增强
氧化性逐渐减弱
最高价氧化物对应
的水化物碱性增强
最高价氧化物对应
的水化物酸性减弱
6)卤素离子与硝酸银反应
Ag+ + Cl– = AgCl ↓ 白色
Ag+ + Br– = AgBr ↓ 浅黄色
Ag+ + I– = AgI↓ 黄色
溶解度逐渐减小,颜色越来越深。
F - + Ag+ _____ (无变化)
①除AgF外,均有感光性, 其中AgBr作感光材料,可用于照相。
②AgI可进行人工降雨。
AgX的用途:
2AgBr ==== 2Ag + Br2
光/△
【卤素元素性质补充】
[补充]:卤素单质及其化合物的特性
(1)氟
①F无正价和含氧酸,非金属性最强。
②氟气
③HF是弱酸,有毒;能腐蚀玻璃,保存在铅制器皿或塑料瓶中;
甚至可与某些稀有气体反应
2F2+2H2O=4HF+O2
F2+H2 = 2HF
[冷暗处,极易爆炸]
3F2+Xe ======= XeF6
一定条件
在HX中HF沸点最高。 (HF常温下为液态)
④AgF易溶于水,CaF2(萤石)难溶。
F2可氧化所有的金属
HF的制备:
CaF2 +H2SO4(浓) = CaSO4 + 2HF↑
② 易挥发。
(2)溴
① Br2是深红棕色液体(常温下唯一的液态非金属单质)
④ Br2易溶于有机溶剂。
③ Br2会腐蚀橡胶、皮肤。
→→ 玻璃塞
→→ “加水液封”
液溴(Br2)
(深红棕色)
橙黄色
(红棕色)
玻璃塞
溴蒸气→
溴水→
液溴→
[补充]:卤素单质及其化合物的特性
(3)碘
① I2遇淀粉变蓝色
②I2易升华(可用来分离I2与沙子、食盐晶体等)
③ I2易溶于有机溶剂。
④食盐中加入KIO3可防治甲状腺肿大。
(用于鉴定I2的存在)
加热法:分离提纯碘
I2和河沙
[补充]:卤素单质及其化合物的特性
→紫黑色固体,碘的蒸气呈紫色
卤素单质及其化合物的用途
1. 碘单质(I2)被用于制作碘酊(别名:碘酒)
用于一般皮肤消毒和手术前手术局部皮肤的消毒 。
2. 溴化银(AgBr)被用于制作感光胶卷和变色玻璃。
感光胶卷
变色眼镜
3. 碘化银(AgⅠ)被用于人工降雨
(1)氟元素无正价,无含氧酸。F-的还原性极弱。
(2)X2+H2O===HX+HXO 而 2F2+2H2O===4HF+O2。
(3)Br2在常温下是唯一的一种 液态 非金属单质。
(4)碘为紫黑色固体,易升华,淀粉遇 I2 变蓝色。
(5)氢氟酸为弱酸,而盐酸、氢溴酸、氢碘酸为强酸。
(6)除氟化银外,其余卤化银均为沉淀。氟化银、氯化银为白色,溴化银为淡黄色,碘化银为黄色。
拓展:卤素的特性
(1)相似性(用X代表卤族元素):
化合物→最高价氧化物对应水化物(除氟外)都为强酸
小结
卤素单质化学性质的相似性和递变性
(2)卤族元素原子结构和性质的递变性
结构及性质 规律
原子半径
单质的氧化性
阴离子的还原性
与H2化合的难易程度
氢化物的稳定性
最高价氧化物对 应水化物的酸性
1. 判断正误:
(1)卤素单质都是双原子分子( )
(2)单质At2是白色固体( )
(3)同主族元素从上至下非金属性逐渐增强( )
(4)第ⅡA族的锶的硫酸盐(SrSO4)是易溶于水的白色固体( )
(5)随核电荷数的增加,碱金属元素和卤素单质的熔沸点都逐渐降低( )
×
√
×
×
×
2. 含有元素硒(Se)的保健品已开始进入市场。已知它是第四周期ⅥA族元素。则下列关于硒的叙述中,正确的是( )
A.非金属性比硫强 B.气态氢化物的化学式为H2Se
C.稳定性:H2Se>H2O D.最高价氧化物的化学式是SeO2
B
3. 部分卤族元素的某种性质A随核电荷数的变化趋势如图,A可能表示( )
A.原子半径 B.氢化物的稳定性
C.原子的电子层数 D.单质的密度
B
4. 下列各组物质性质的比较中,正确的是( )
A.还原性:HF>HCl>HBr>HI
B.稳定性:HFC.与水反应由易到难:Cl2>Br2>I2>F2
D.氧化性:F2>Cl2>Br2>I2
D
5. 依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物 NH3、H2O、HF的稳定性
C.碱金属单质 Li、Na、K与水反应的剧烈程度
D.1 mol Na、Mg、Al分别与足量盐酸反应时失去电子数的多少
D
同主族元素的原子结构与性质的关系
【思维建模】
第四章
物质结构 元素周期律
第一节 原子结构与元素周期表
课时4 卤族元素
学习目标
1. 了解卤族元素在周期表中的位置及原子结构特征。
2. 了解卤族元素性质的相似性和递变性。
3. 初步学会根据原子结构的特点,推测元素的化学性质。
1.卤族元素的物理性质
根据教材p102表4-3中的信息,思考卤族元素单质的物理性质有什么相同点和递变性?
1.都有颜色,但从F2→Cl2→Br2→I2颜色逐渐加深
2.状态:气—液—固,常温下Br2是唯一的液态非金属单质
3.熔点和沸点逐渐升高 (与碱金属的熔沸点变化规律相反),密度逐渐增大
(Br2易挥发,I2易升华,碘蒸气为紫色)
4.溶解性:除F2外,卤素单质在水中溶解度都很小,但易溶于乙醇、苯、CCl4等有机溶剂
了解:氯、溴和碘在不同溶剂中所生成溶液的颜色变化
碘酒就是碘的 溶液,呈 色。
酒精
棕褐色
水
溴
碘
橙黄色
橙红
紫红
褐
溴/有机溶剂:橙红
碘/有机溶剂:紫红
有机溶剂
相似性:
最外层都是7个电子
都易得1e-,
表现强非金属性
递变性:
核电荷数递增
电子层数递增
原子半径依次增大
得e-能力逐渐 。
非金属性逐渐 。
元素的非金属性:
单质的氧化性:
离子的还原性:
F > Cl > Br > I
F2 > Cl2 > Br2 > I2
F- < Cl- < Br- < I-
2.卤族元素的原子结构
减弱
减弱
3.卤素单质的化学性质
1)与金属单质(除金、铂外)反应
2)与某些非金属单质(如H2、P、C等)反应
3)与水反应
4)与碱液反应【制漂白粉、漂白液等】
5) 与一些还原性物质反应
Fe2+\ SO32-\ SO2\ I- \ Br- \ S2- \
回忆:氯气的化学性质
根据原子结构特点,试推测F2、Cl2、Br2、I2在化学性质上所表现的相似性和递变性。
(I2的氧化能力弱,跟变价金属反应时,生成低价态)
1).卤素与金属单质的反应
③特殊地:
[注意: 与氯气性质对比]
②3X2+2Fe == 2FeX3
I2 +Fe == FeI2
∴ 氧化性: F2 > Cl2 > Br2 > I2
①F2可与所有金属单质反应 (它甚至可与惰性气体反应)
(X=F、Cl、Br)
+3
3.卤素单质的化学性质
F2+H2 = 2HF
I2+H2 2HI
Br2+H2 2HBr
Cl2+H2 2HCl
点燃或光照
500℃
△
[冷暗处,极易爆炸]
[持续加热,反应可逆]
(1)单质的氧化性:F2 Cl2 Br2 I2
>
>
>
2).卤素与氢气的反应
F2
Cl2
Br2
I2
反应越来越难
(2)生成的HX稳定性关系:HF > HCl > HBr > HI
【教材P97 表4-4】
阴离子的还原性呢?
Cl–
Br–
I–
F–
< < <
Br2+ H2O HBr+HBrO
反应越来越难
2F2+2H2O=4HF+O2
3).卤素与水反应
I2 +H2O HI+HIO
Cl2 + H2O HCl+HClO
(能反应)
(极弱)
(很弱)
(很剧烈)
F2的特殊性
通式:X2 + H2O = HX + HXO (X:Cl、Br、I)
4)、卤素单质与碱反应?:
X2 + 2NaOH = NaX + NaXO + H2O
所以,NaOH可使氯水、溴水、碘水褪色
F2特殊
(X=Cl、Br、I)
5)卤素间的置换反应?
〖思考〗F2与氯、溴、碘的盐溶液可以置换出相应的卤素单质吗?
(P98 实验4-1)
①氯水与KBr溶液混合
③溴水与KI溶液混合
②氯水与KI溶液混合
Cl2 + 2KI =I2 + 2KCl
Cl2+ 2KBr=2KCl+Br2
Br2+ 2KI = 2KBr + I2
5)卤素间的置换反应?
〖思考〗F2与氯、溴、碘的盐溶液可以置换出相应的卤素单质吗?
(Cl2可使湿润的淀粉KI试纸变蓝)
不可以
①氯水与KBr溶液混合
③溴水与KI溶液混合
(P98 实验4-1)
证明氧化性:Cl2>Br2>I2
②氯水与KI溶液混合
溶液由无色变为橙黄色
溶液由无色变为棕褐色
溶液由无色变为棕黄色
①最高价氧化物对应水化物的酸性强弱:
元素非金属性强弱判断依据
归纳总结:
(P97 注释②)
②非金属元素单质与H2化合的难易程度:
化合越容易,非金属性越强
③形成气态氢化物的稳定性:
气态氢化物越稳定,元素的非金属性越强
④单质间的置换反应
⑤对应阴离子的还原性:
阴离子的还原性越强,元素的非金属性越弱
酸性越强,对应非金属元素非金属性越强
(最高价含氧酸)
下列事实能说明氯元素的非金属性比硫元素强的是 。
①HCl的溶解度比H2S大
②HCl的酸性比H2S强
③HCl的稳定性比H2S大
④HCl的还原性比H2S弱
⑤HClO4的酸性比H2SO4强
⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS
⑦Cl2能与H2S反应生成S
⑧还原性:Cl-<S2-
③④⑤⑥⑦⑧
×
√
×
√
√
√
√
√
[小结]
至此我们可以看到同一主族元素,无论是金属还是非金属在性质方面都具有一定的相似性和递变性。
金属性逐渐增强
失电子的能力逐渐增强
非金属性逐渐减弱
得电子的能力逐渐减弱
还原性逐渐增强
氧化性逐渐减弱
最高价氧化物对应
的水化物碱性增强
最高价氧化物对应
的水化物酸性减弱
6)卤素离子与硝酸银反应
Ag+ + Cl– = AgCl ↓ 白色
Ag+ + Br– = AgBr ↓ 浅黄色
Ag+ + I– = AgI↓ 黄色
溶解度逐渐减小,颜色越来越深。
F - + Ag+ _____ (无变化)
①除AgF外,均有感光性, 其中AgBr作感光材料,可用于照相。
②AgI可进行人工降雨。
AgX的用途:
2AgBr ==== 2Ag + Br2
光/△
【卤素元素性质补充】
[补充]:卤素单质及其化合物的特性
(1)氟
①F无正价和含氧酸,非金属性最强。
②氟气
③HF是弱酸,有毒;能腐蚀玻璃,保存在铅制器皿或塑料瓶中;
甚至可与某些稀有气体反应
2F2+2H2O=4HF+O2
F2+H2 = 2HF
[冷暗处,极易爆炸]
3F2+Xe ======= XeF6
一定条件
在HX中HF沸点最高。 (HF常温下为液态)
④AgF易溶于水,CaF2(萤石)难溶。
F2可氧化所有的金属
HF的制备:
CaF2 +H2SO4(浓) = CaSO4 + 2HF↑
② 易挥发。
(2)溴
① Br2是深红棕色液体(常温下唯一的液态非金属单质)
④ Br2易溶于有机溶剂。
③ Br2会腐蚀橡胶、皮肤。
→→ 玻璃塞
→→ “加水液封”
液溴(Br2)
(深红棕色)
橙黄色
(红棕色)
玻璃塞
溴蒸气→
溴水→
液溴→
[补充]:卤素单质及其化合物的特性
(3)碘
① I2遇淀粉变蓝色
②I2易升华(可用来分离I2与沙子、食盐晶体等)
③ I2易溶于有机溶剂。
④食盐中加入KIO3可防治甲状腺肿大。
(用于鉴定I2的存在)
加热法:分离提纯碘
I2和河沙
[补充]:卤素单质及其化合物的特性
→紫黑色固体,碘的蒸气呈紫色
卤素单质及其化合物的用途
1. 碘单质(I2)被用于制作碘酊(别名:碘酒)
用于一般皮肤消毒和手术前手术局部皮肤的消毒 。
2. 溴化银(AgBr)被用于制作感光胶卷和变色玻璃。
感光胶卷
变色眼镜
3. 碘化银(AgⅠ)被用于人工降雨
(1)氟元素无正价,无含氧酸。F-的还原性极弱。
(2)X2+H2O===HX+HXO 而 2F2+2H2O===4HF+O2。
(3)Br2在常温下是唯一的一种 液态 非金属单质。
(4)碘为紫黑色固体,易升华,淀粉遇 I2 变蓝色。
(5)氢氟酸为弱酸,而盐酸、氢溴酸、氢碘酸为强酸。
(6)除氟化银外,其余卤化银均为沉淀。氟化银、氯化银为白色,溴化银为淡黄色,碘化银为黄色。
拓展:卤素的特性
(1)相似性(用X代表卤族元素):
化合物→最高价氧化物对应水化物(除氟外)都为强酸
小结
卤素单质化学性质的相似性和递变性
(2)卤族元素原子结构和性质的递变性
结构及性质 规律
原子半径
单质的氧化性
阴离子的还原性
与H2化合的难易程度
氢化物的稳定性
最高价氧化物对 应水化物的酸性
1. 判断正误:
(1)卤素单质都是双原子分子( )
(2)单质At2是白色固体( )
(3)同主族元素从上至下非金属性逐渐增强( )
(4)第ⅡA族的锶的硫酸盐(SrSO4)是易溶于水的白色固体( )
(5)随核电荷数的增加,碱金属元素和卤素单质的熔沸点都逐渐降低( )
×
√
×
×
×
2. 含有元素硒(Se)的保健品已开始进入市场。已知它是第四周期ⅥA族元素。则下列关于硒的叙述中,正确的是( )
A.非金属性比硫强 B.气态氢化物的化学式为H2Se
C.稳定性:H2Se>H2O D.最高价氧化物的化学式是SeO2
B
3. 部分卤族元素的某种性质A随核电荷数的变化趋势如图,A可能表示( )
A.原子半径 B.氢化物的稳定性
C.原子的电子层数 D.单质的密度
B
4. 下列各组物质性质的比较中,正确的是( )
A.还原性:HF>HCl>HBr>HI
B.稳定性:HF
D.氧化性:F2>Cl2>Br2>I2
D
5. 依据下列说法来判断相应元素的金属性、非金属性强弱,不合理的是( )
A.卤素单质Cl2、Br2、I2的氧化性强弱
B.气态氢化物 NH3、H2O、HF的稳定性
C.碱金属单质 Li、Na、K与水反应的剧烈程度
D.1 mol Na、Mg、Al分别与足量盐酸反应时失去电子数的多少
D
同主族元素的原子结构与性质的关系
【思维建模】
