化学人教版(2019)必修第一册1.1.2物质的转化(共24张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1.2物质的转化(共24张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 9.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-02 09:18:36 | ||
图片预览





文档简介
(共24张PPT)
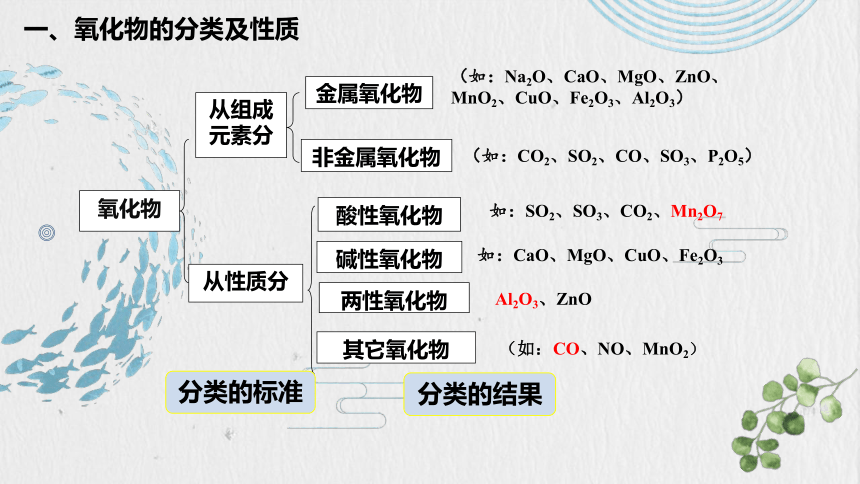
氧化物
从组成元素分
从性质分
金属氧化物
非金属氧化物
酸性氧化物
碱性氧化物
两性氧化物
其它氧化物
(如:Na2O、CaO、MgO、ZnO、MnO2、CuO、Fe2O3、Al2O3)
(如:CO2、SO2、CO、SO3、P2O5)
如:SO2、SO3、CO2、Mn2O7
如:CaO、MgO、CuO、Fe2O3
Al2O3、ZnO
(如:CO、NO、MnO2)
分类的标准
分类的结果
一、氧化物的分类及性质
学习评价1
所有的酸性氧化物都是非金属氧化物
所有的非金属氧化物都是酸性氧化物
所有的碱性氧化物都是金属氧化物
所有的金属氧化物都是碱性氧化物
概念辨析-判断对错
×
Mn2O7
×
×
Mn2O7
NO、CO
预测陌生物质的性质——如何吸收烟气中的SO2?
SO2
依据酸性氧化物共性
酸性氧化物
类比CO2性质
预测SO2的性质
SO2+H2O H2SO3
SO2+CaO CaSO3
SO2+2NaOH(过量) Na2SO3 +H2O
Na2SO3 +H2O+SO2 2NaHSO3
SO2+CaCO3 CaSO3+CO2
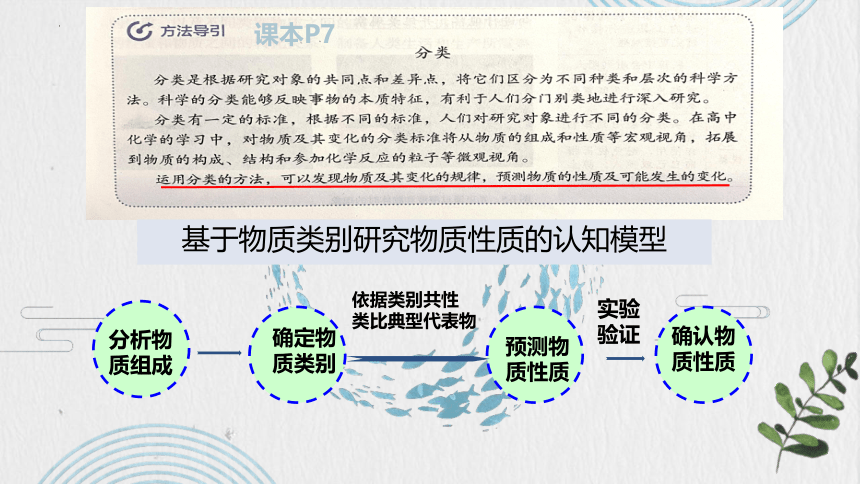
课本P7
能与水反应的常见金属氧化物有4种:
CaO、Na2O、K2O、BaO。
课本P7
基于物质类别研究物质性质的认知模型
依据类别共性
类比典型代表物
实验
验证
预测物质性质
确认物质性质
分析物质组成
确定物质类别
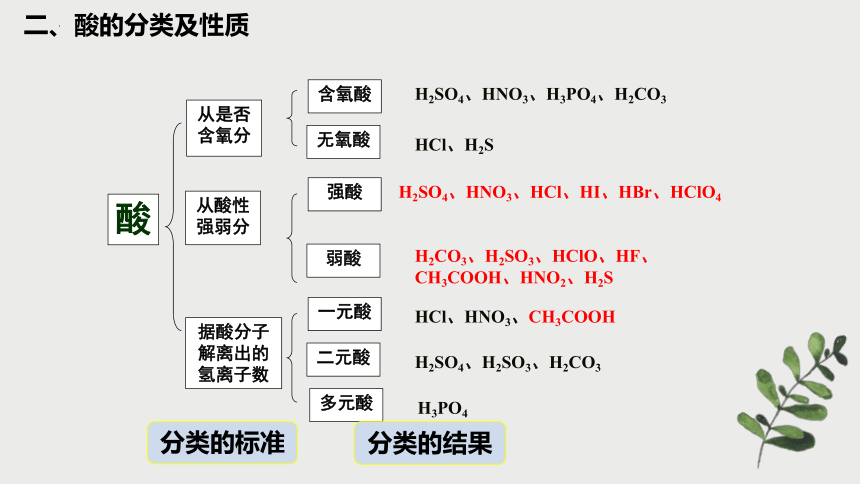
酸
从是否含氧分
从酸性强弱分
无氧酸
弱酸
一元酸
H2SO4、HNO3、H3PO4、H2CO3
HCl、H2S
H2SO4、HNO3、HCl、HI、HBr、HClO4
H2CO3、H2SO3、HClO、HF、CH3COOH、HNO2、H2S
含氧酸
据酸分子解离出的氢离子数
强酸
多元酸
二元酸
HCl、HNO3、CH3COOH
H2SO4、H2SO3、H2CO3
H3PO4
分类的标准
分类的结果
二、酸的分类及性质
问题1:工业上用电解熔融氯化镁的方法制得金属Mg,你知道有多少反应可以生成MgCl2吗?
我们发现有4个反应都涉及到了盐酸,回顾酸有哪些化学通性?
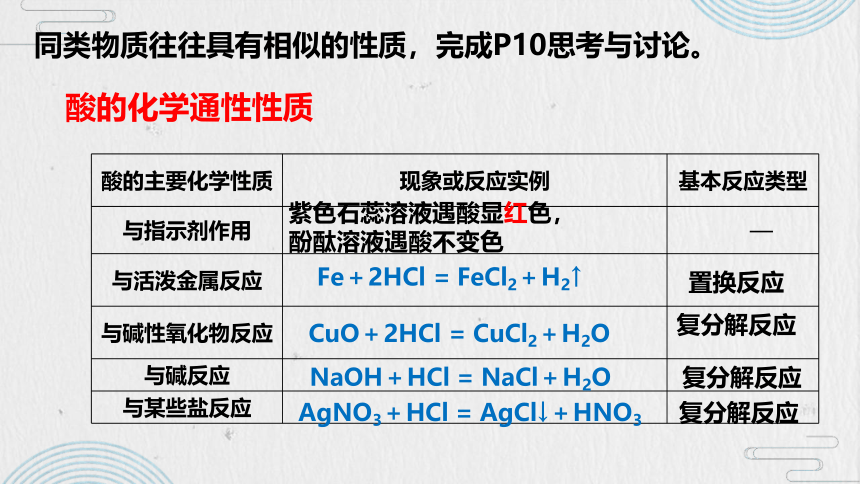
酸的主要化学性质 现象或反应实例 基本反应类型
与指示剂作用 —
与活泼金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
Fe+2HCl = FeCl2+H2↑
CuO+2HCl = CuCl2+H2O
NaOH+HCl = NaCl+H2O
AgNO3+HCl = AgCl↓+HNO3
紫色石蕊溶液遇酸显红色,
酚酞溶液遇酸不变色
置换反应
复分解反应
复分解反应
复分解反应
酸的化学通性性质
同类物质往往具有相似的性质,完成P10思考与讨论。
问题1:工业上用电解熔融氯化镁的方法制得金属Mg,你知道有多少反应可以生成MgCl2吗?
哪些反应有生产MgCl2的价值?
问题2:海水中有大量的MgCl2,如何利用海水提取MgCl2 ?
碱的主要化学性质 现象或反应实例 基本反应类型
与指示剂作用 —
与酸性氧化物反应
与碱反应
与某些盐反应
NaOH+HCl=NaCl+H2O
紫色石蕊溶液遇碱显蓝色,
酚酞溶液遇碱显红色
CO2+2NaOH=Na2CO3+H2O
FeCl3+3NaOH =Fe(OH)3↓+3NaCl
复分解反应
复分解反应
复分解反应
碱的化学性质
三、碱的分类及性质
碱
从是否溶于水分
从碱性强弱分
据碱分子解离出的氢氧根离子数
可溶碱
难溶碱
NaOH、KOH、Ba(OH)2、NH3·H2O
Cu(OH)2、Mg(OH)2、Fe(OH) 3
强碱
弱碱
NaOH、KOH、Ca(OH) 2、Ba(OH)2
NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3
一元碱
二元碱
多元碱
NH3·H2O 、 NaOH、KOH、
Cu(OH)2、Mg(OH)2、Fe(OH) 2
Ca(OH) 2、Ba(OH)2、
Fe(OH) 3
微溶碱
Ca(OH) 2
三、碱的分类及性质
四、盐的分类及性质
复分解反应(AB+CD=AD+BC)由两种化合物互相交换成分,生成另外两种化合物的反应,发生条件:生成沉淀、气体、水;满足强酸制弱酸;满足难挥发酸制易挥发酸。
金属单质与盐溶液能够发生置换反应的条件是:活泼性强的金属置换活泼性弱的金属,前提条件是该活泼金属不与水反应。
五、物质的转化及应用
1.现有一单质钠,你能利用本节课所学知识,将其转化为碳酸钠吗?
Na →Na2O→NaOH→Na2CO3
4Na+O2=2Na2O
Na2O+H2O=2NaOH
2NaOH+CO2=Na2CO3+ H2O
金属
单质
碱性氧化物
碱
盐
酸或酸性氧化物
化合反应
O2
H2O
化合反应
或酸
酸性氧化物
Na2O+CO2=Na2CO3
五、物质的转化及应用
2.现有一单质硫,你能利用本节课所学知识,将其转化为硫酸铜吗?
C→CO2→H2CO3 →CaCO3
C + O2 = CO2
CO2+ H2O =H2CO3
H2CO3+ Ca(OH)2= CaCO3↓+ 2H2O
非金属
单质
酸性氧化物
酸
盐
化合反应
O2
H2O
化合反应
或碱
碱性氧化物
碱或碱性氧化物
3.要制取氢氧化钠可以采用哪些方法
(1)碱性氧化物与水反应
Na2O + H2O = 2NaOH
(2)用盐与另一种碱反应
(3)电解饱和食盐水
Na2CO3 + Ca(OH)2 ═ CaCO3 + 2NaOH
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
工业生产除要考虑反应进行的可能性外,还要考虑原料来源、成本高低和设备要求等因素。
一般不采用反应Na2O+H2O = 2NaOH,原因是Na2O来源少、成本高。
五、物质的转化及应用
物质的转化及应用
阅读教材P11页第二自然段,思考如何利用物质间的转化关系制备所需要的物质?
物质制备方法
①碱性氧化物与水反应②盐与另一种碱反应
①金属单质与非金属单质反应 ②盐与盐反应
③酸性氧化物与碱性氧化物反应 ④酸与盐反应
⑤碱与盐反应。
①酸性氧化物与水反
②应盐与另一种酸反应
酸
碱
盐
单质、氧化物、酸、碱、盐之间的转化关系
归纳总结
随堂演练
1.以下表示的是碳及其化合物的转化关系,
其中涉及的基本反应类型依次是( )
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
D
随堂演练
2.如图所示,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B KCl K2CO3 KOH HCl
C O2 CO C CuO
D Fe CuCl2 Zn HCl
D
随堂演练
3.硫酸、碳酸钠、二氧化碳、铜片、氧氧化钡、氢氧化钠、铁片、生石灰和木炭粉9种物质中的几种存在如图所示关系,选择适当的物质,使连线的两种物质能发生反应(酸、碱、盐均配制成稀溶液)。
(1)判断出它们的化学式分别为
① ;② ;③ ;④ ;⑤ 。
Fe
H2SO4
CO2
Ba(OH)2
Na2CO3
随堂演练
(2)写出下列序号对应物质之间发生反应的化学方程式:
①和②: ;
②和④: ;
②和⑤: ;
④和⑤: 。
Fe+H2SO4===FeSO4+H2↑
H2SO4+Ba(OH)2===BaSO4↓+2H2O
H2SO4+Na2CO3===Na2SO4+H2O+CO2↑
Ba(OH)2+Na2CO3===BaCO3↓+2NaOH
Fe
H2SO4
CO2
Ba(OH)2
Na2CO3
氧化物
从组成元素分
从性质分
金属氧化物
非金属氧化物
酸性氧化物
碱性氧化物
两性氧化物
其它氧化物
(如:Na2O、CaO、MgO、ZnO、MnO2、CuO、Fe2O3、Al2O3)
(如:CO2、SO2、CO、SO3、P2O5)
如:SO2、SO3、CO2、Mn2O7
如:CaO、MgO、CuO、Fe2O3
Al2O3、ZnO
(如:CO、NO、MnO2)
分类的标准
分类的结果
一、氧化物的分类及性质
学习评价1
所有的酸性氧化物都是非金属氧化物
所有的非金属氧化物都是酸性氧化物
所有的碱性氧化物都是金属氧化物
所有的金属氧化物都是碱性氧化物
概念辨析-判断对错
×
Mn2O7
×
×
Mn2O7
NO、CO
预测陌生物质的性质——如何吸收烟气中的SO2?
SO2
依据酸性氧化物共性
酸性氧化物
类比CO2性质
预测SO2的性质
SO2+H2O H2SO3
SO2+CaO CaSO3
SO2+2NaOH(过量) Na2SO3 +H2O
Na2SO3 +H2O+SO2 2NaHSO3
SO2+CaCO3 CaSO3+CO2
课本P7
能与水反应的常见金属氧化物有4种:
CaO、Na2O、K2O、BaO。
课本P7
基于物质类别研究物质性质的认知模型
依据类别共性
类比典型代表物
实验
验证
预测物质性质
确认物质性质
分析物质组成
确定物质类别
酸
从是否含氧分
从酸性强弱分
无氧酸
弱酸
一元酸
H2SO4、HNO3、H3PO4、H2CO3
HCl、H2S
H2SO4、HNO3、HCl、HI、HBr、HClO4
H2CO3、H2SO3、HClO、HF、CH3COOH、HNO2、H2S
含氧酸
据酸分子解离出的氢离子数
强酸
多元酸
二元酸
HCl、HNO3、CH3COOH
H2SO4、H2SO3、H2CO3
H3PO4
分类的标准
分类的结果
二、酸的分类及性质
问题1:工业上用电解熔融氯化镁的方法制得金属Mg,你知道有多少反应可以生成MgCl2吗?
我们发现有4个反应都涉及到了盐酸,回顾酸有哪些化学通性?
酸的主要化学性质 现象或反应实例 基本反应类型
与指示剂作用 —
与活泼金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
Fe+2HCl = FeCl2+H2↑
CuO+2HCl = CuCl2+H2O
NaOH+HCl = NaCl+H2O
AgNO3+HCl = AgCl↓+HNO3
紫色石蕊溶液遇酸显红色,
酚酞溶液遇酸不变色
置换反应
复分解反应
复分解反应
复分解反应
酸的化学通性性质
同类物质往往具有相似的性质,完成P10思考与讨论。
问题1:工业上用电解熔融氯化镁的方法制得金属Mg,你知道有多少反应可以生成MgCl2吗?
哪些反应有生产MgCl2的价值?
问题2:海水中有大量的MgCl2,如何利用海水提取MgCl2 ?
碱的主要化学性质 现象或反应实例 基本反应类型
与指示剂作用 —
与酸性氧化物反应
与碱反应
与某些盐反应
NaOH+HCl=NaCl+H2O
紫色石蕊溶液遇碱显蓝色,
酚酞溶液遇碱显红色
CO2+2NaOH=Na2CO3+H2O
FeCl3+3NaOH =Fe(OH)3↓+3NaCl
复分解反应
复分解反应
复分解反应
碱的化学性质
三、碱的分类及性质
碱
从是否溶于水分
从碱性强弱分
据碱分子解离出的氢氧根离子数
可溶碱
难溶碱
NaOH、KOH、Ba(OH)2、NH3·H2O
Cu(OH)2、Mg(OH)2、Fe(OH) 3
强碱
弱碱
NaOH、KOH、Ca(OH) 2、Ba(OH)2
NH3·H2O 、Cu(OH)2、Mg(OH)2、Fe(OH) 3
一元碱
二元碱
多元碱
NH3·H2O 、 NaOH、KOH、
Cu(OH)2、Mg(OH)2、Fe(OH) 2
Ca(OH) 2、Ba(OH)2、
Fe(OH) 3
微溶碱
Ca(OH) 2
三、碱的分类及性质
四、盐的分类及性质
复分解反应(AB+CD=AD+BC)由两种化合物互相交换成分,生成另外两种化合物的反应,发生条件:生成沉淀、气体、水;满足强酸制弱酸;满足难挥发酸制易挥发酸。
金属单质与盐溶液能够发生置换反应的条件是:活泼性强的金属置换活泼性弱的金属,前提条件是该活泼金属不与水反应。
五、物质的转化及应用
1.现有一单质钠,你能利用本节课所学知识,将其转化为碳酸钠吗?
Na →Na2O→NaOH→Na2CO3
4Na+O2=2Na2O
Na2O+H2O=2NaOH
2NaOH+CO2=Na2CO3+ H2O
金属
单质
碱性氧化物
碱
盐
酸或酸性氧化物
化合反应
O2
H2O
化合反应
或酸
酸性氧化物
Na2O+CO2=Na2CO3
五、物质的转化及应用
2.现有一单质硫,你能利用本节课所学知识,将其转化为硫酸铜吗?
C→CO2→H2CO3 →CaCO3
C + O2 = CO2
CO2+ H2O =H2CO3
H2CO3+ Ca(OH)2= CaCO3↓+ 2H2O
非金属
单质
酸性氧化物
酸
盐
化合反应
O2
H2O
化合反应
或碱
碱性氧化物
碱或碱性氧化物
3.要制取氢氧化钠可以采用哪些方法
(1)碱性氧化物与水反应
Na2O + H2O = 2NaOH
(2)用盐与另一种碱反应
(3)电解饱和食盐水
Na2CO3 + Ca(OH)2 ═ CaCO3 + 2NaOH
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
工业生产除要考虑反应进行的可能性外,还要考虑原料来源、成本高低和设备要求等因素。
一般不采用反应Na2O+H2O = 2NaOH,原因是Na2O来源少、成本高。
五、物质的转化及应用
物质的转化及应用
阅读教材P11页第二自然段,思考如何利用物质间的转化关系制备所需要的物质?
物质制备方法
①碱性氧化物与水反应②盐与另一种碱反应
①金属单质与非金属单质反应 ②盐与盐反应
③酸性氧化物与碱性氧化物反应 ④酸与盐反应
⑤碱与盐反应。
①酸性氧化物与水反
②应盐与另一种酸反应
酸
碱
盐
单质、氧化物、酸、碱、盐之间的转化关系
归纳总结
随堂演练
1.以下表示的是碳及其化合物的转化关系,
其中涉及的基本反应类型依次是( )
A.化合、置换、分解、复分解
B.置换、复分解、化合、分解
C.置换、化合、分解、复分解
D.置换、化合、复分解、分解
D
随堂演练
2.如图所示,“——”表示相连的物质间在一定条件下可以反应,“―→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
选项 甲 乙 丙 丁
A H2SO4 Na2SO4 NaOH NaCl
B KCl K2CO3 KOH HCl
C O2 CO C CuO
D Fe CuCl2 Zn HCl
D
随堂演练
3.硫酸、碳酸钠、二氧化碳、铜片、氧氧化钡、氢氧化钠、铁片、生石灰和木炭粉9种物质中的几种存在如图所示关系,选择适当的物质,使连线的两种物质能发生反应(酸、碱、盐均配制成稀溶液)。
(1)判断出它们的化学式分别为
① ;② ;③ ;④ ;⑤ 。
Fe
H2SO4
CO2
Ba(OH)2
Na2CO3
随堂演练
(2)写出下列序号对应物质之间发生反应的化学方程式:
①和②: ;
②和④: ;
②和⑤: ;
④和⑤: 。
Fe+H2SO4===FeSO4+H2↑
H2SO4+Ba(OH)2===BaSO4↓+2H2O
H2SO4+Na2CO3===Na2SO4+H2O+CO2↑
Ba(OH)2+Na2CO3===BaCO3↓+2NaOH
Fe
H2SO4
CO2
Ba(OH)2
Na2CO3
