第九单元溶液 单元训练题(含答案)-2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 第九单元溶液 单元训练题(含答案)-2023-2024学年九年级化学人教版下册 |  | |
| 格式 | docx | ||
| 文件大小 | 647.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-02 12:27:14 | ||
图片预览


文档简介
第九单元 溶液 单元训练题
一、选择题
1.鉴别、检验、除杂与分离是化学研究的重要方法。下列实验方案可行的是
选项 实验目的 实验方案
A 除去铁粉中的少量铜粉 加入过量稀盐酸,过滤
B 除去ZnSO4溶液中的少量FeSO4 加入过量的镁,过滤
C 除去饱和氯化钠溶液中的少量硝酸钾 蒸发结晶,过滤
D 鉴别真假黄金 看颜色
A.A B.B C.C D.D
2.下列有关实验的叙述中不正确的是
A.用红磷燃烧探究空气中氧气含量的实验中,红磷质量太少会影响实验结果
B.配制10%的氯化钠溶液时,量水时仰视读数,导致溶质质量分数偏小
C.工业制氧气是利用各组分沸点的不同将其分离
D.硝酸铵固体溶于水形成溶液时,仅发生扩散吸热过程
3.下列与“水”相关的说法正确的是
A.除去水中的色素和异味可以向水中加入焦炭 B.电解水可以探究水是由氢气和氧气组成的
C.用洗涤剂和汽油除油污都是乳化作用 D.用肥皂水区分硬水和软水,产生泡沫多的是软水
4.下列依据实验目的所设计的实验操作中,不正确的是
选项 实验目的 实验操作
A 鉴别水和过氧化氢溶液 分别加入少量二氧化锰
B 鉴别硝酸铵和氢氧化钠 分别加入适量的水
C 除去铁粉中的铜粉 加入足量的稀盐酸,过滤
D 除去二氧化碳中的一氧化碳 通过灼热的氧化铜
A.A B.B C.C D.D
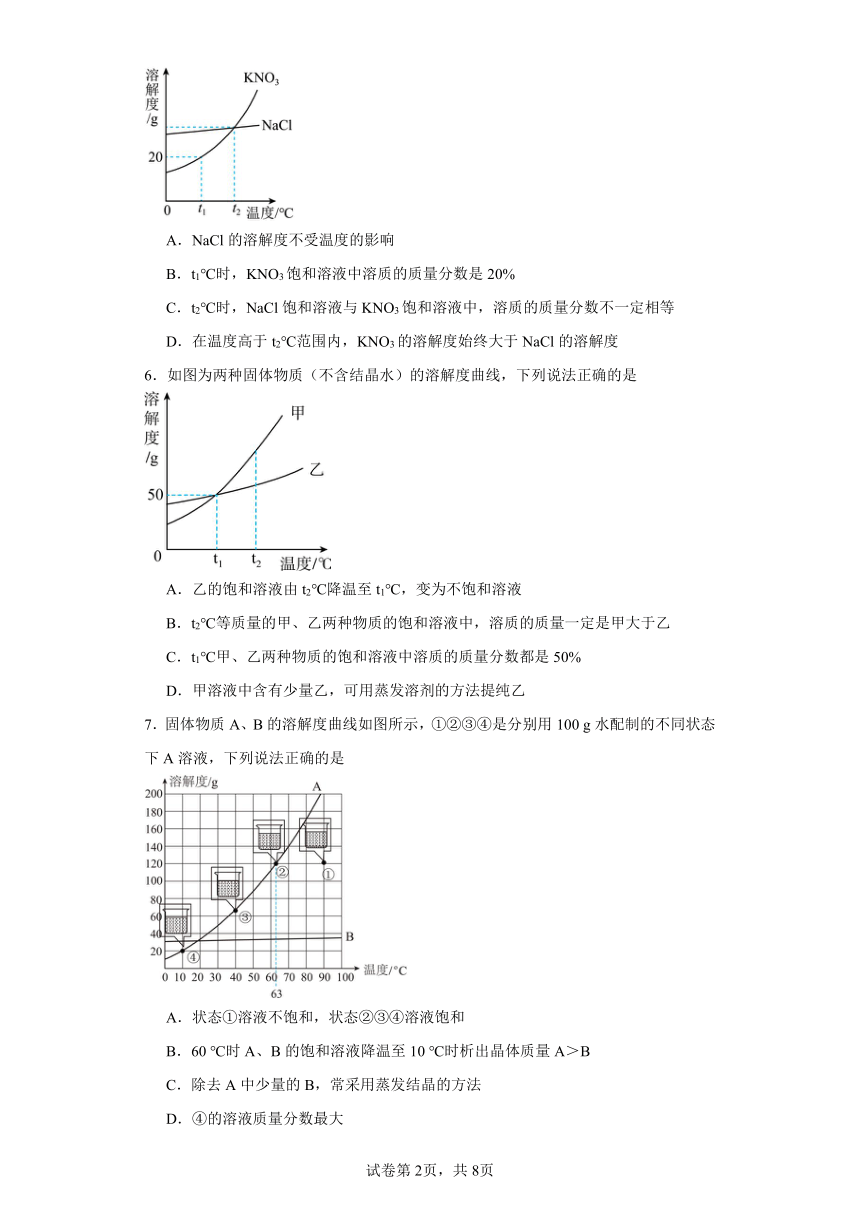
5.如图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
A.NaCl的溶解度不受温度的影响
B.t1℃时,KNO3饱和溶液中溶质的质量分数是20%
C.t2℃时,NaCl饱和溶液与KNO3饱和溶液中,溶质的质量分数不一定相等
D.在温度高于t2℃范围内,KNO3的溶解度始终大于NaCl的溶解度
6.如图为两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是
A.乙的饱和溶液由t2℃降温至t1℃,变为不饱和溶液
B.t2℃等质量的甲、乙两种物质的饱和溶液中,溶质的质量一定是甲大于乙
C.t1℃甲、乙两种物质的饱和溶液中溶质的质量分数都是50%
D.甲溶液中含有少量乙,可用蒸发溶剂的方法提纯乙
7.固体物质A、B的溶解度曲线如图所示,①②③④是分别用100 g水配制的不同状态下A溶液,下列说法正确的是
A.状态①溶液不饱和,状态②③④溶液饱和
B.60 ℃时A、B的饱和溶液降温至10 ℃时析出晶体质量A>B
C.除去A中少量的B,常采用蒸发结晶的方法
D.④的溶液质量分数最大
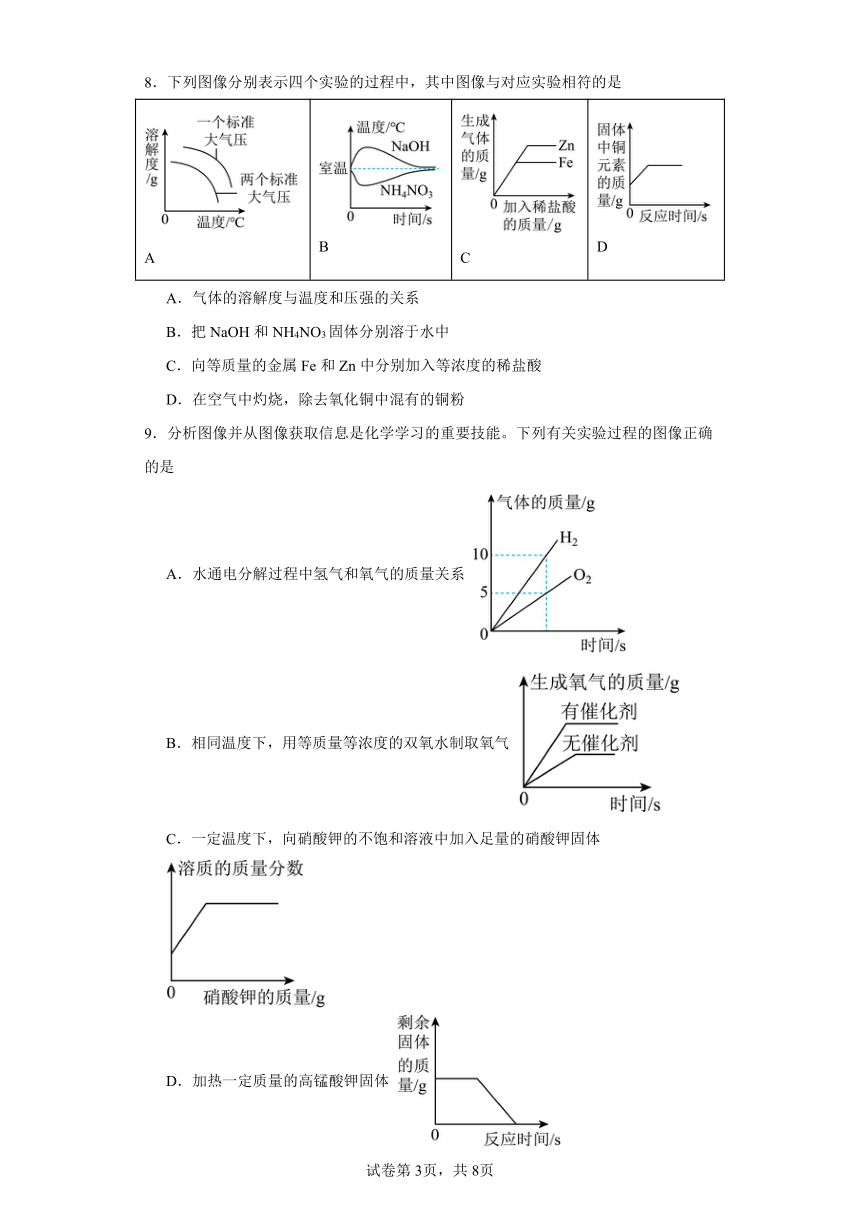
8.下列图像分别表示四个实验的过程中,其中图像与对应实验相符的是
A B C D
A.气体的溶解度与温度和压强的关系
B.把NaOH和NH4NO3固体分别溶于水中
C.向等质量的金属Fe和Zn中分别加入等浓度的稀盐酸
D.在空气中灼烧,除去氧化铜中混有的铜粉
9.分析图像并从图像获取信息是化学学习的重要技能。下列有关实验过程的图像正确的是
A.水通电分解过程中氢气和氧气的质量关系
B.相同温度下,用等质量等浓度的双氧水制取氧气
C.一定温度下,向硝酸钾的不饱和溶液中加入足量的硝酸钾固体
D.加热一定质量的高锰酸钾固体
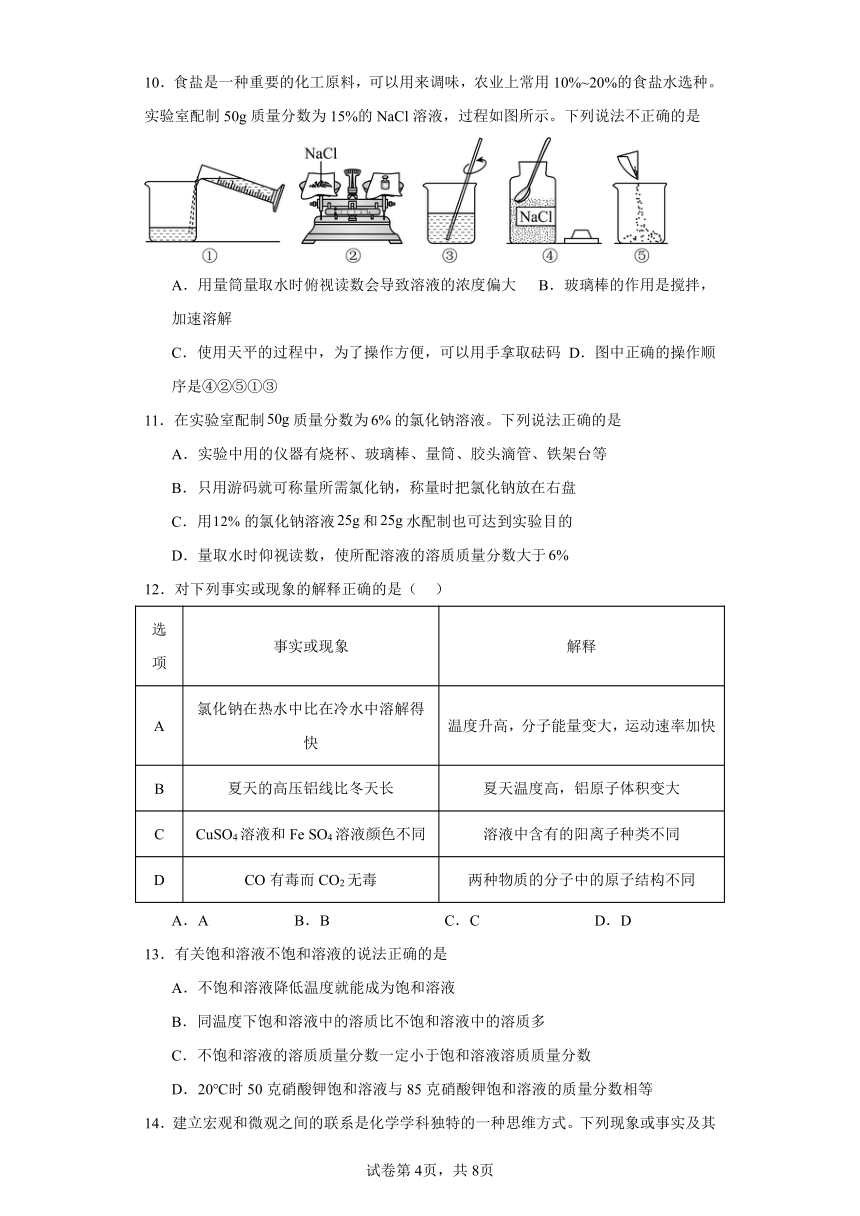
10.食盐是一种重要的化工原料,可以用来调味,农业上常用10%~20%的食盐水选种。实验室配制50g质量分数为15%的NaCl溶液,过程如图所示。下列说法不正确的是
A.用量筒量取水时俯视读数会导致溶液的浓度偏大 B.玻璃棒的作用是搅拌,加速溶解
C.使用天平的过程中,为了操作方便,可以用手拿取砝码 D.图中正确的操作顺序是④②⑤①③
11.在实验室配制质量分数为的氯化钠溶液。下列说法正确的是
A.实验中用的仪器有烧杯、玻璃棒、量筒、胶头滴管、铁架台等
B.只用游码就可称量所需氯化钠,称量时把氯化钠放在右盘
C.用的氯化钠溶液和水配制也可达到实验目的
D.量取水时仰视读数,使所配溶液的溶质质量分数大于
12.对下列事实或现象的解释正确的是( )
选项 事实或现象 解释
A 氯化钠在热水中比在冷水中溶解得快 温度升高,分子能量变大,运动速率加快
B 夏天的高压铝线比冬天长 夏天温度高,铝原子体积变大
C CuSO4溶液和Fe SO4溶液颜色不同 溶液中含有的阳离子种类不同
D CO有毒而CO2无毒 两种物质的分子中的原子结构不同
A.A B.B C.C D.D
13.有关饱和溶液不饱和溶液的说法正确的是
A.不饱和溶液降低温度就能成为饱和溶液
B.同温度下饱和溶液中的溶质比不饱和溶液中的溶质多
C.不饱和溶液的溶质质量分数一定小于饱和溶液溶质质量分数
D.20℃时50克硝酸钾饱和溶液与85克硝酸钾饱和溶液的质量分数相等
14.建立宏观和微观之间的联系是化学学科独特的一种思维方式。下列现象或事实及其解释,其中正确的是
选项 现象或事实 解释
A 金刚石和石墨的物理性质不同 碳原子的结构不同
B 氯化钠固体溶解于水不见了 氯化钠分子运动到水分子中间去了
C 固体药品配成溶液后反应速率更快 参加反应的粒子在溶液中接触机会比在固体中多
D 水银体温计测量病人的体温,示数上升 原子体积受热时增大
A.A B.B C.C D.D
二、填空与简答
15.下列数据是氯化钠和氯化钾固体在不同温度时的溶解度。
温度/℃ 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KCl 27.6 34.0 40.0 45.5 51.1 56.7
(1)在0~20℃时,KCl的溶解度 (填“>”或“<”)NaCl的溶解度;
(2)20℃时,向100g水中加入25g氯化钠,充分溶解后,得到的溶液为 (填“饱和”或“不饱和”)溶液,溶液中溶质质量分数为 ;
(3)20℃时,进行如下图所示的实验。
①A~E中,溶液中溶质质量分数相同的是 ;
②下列操作能使E溶液中溶质质量分数变小的是 (填字母序号)。
a.加入2g KCl b.加入100g 100℃的水 c.降温至40℃
16.化学源于生活,生活中蕴含着许多化学知识。
(1)用洗洁精洗油污,是利用了洗洁精的 作用。
(2)大枣含有蛋白质、糖类及维生素等营养素,其中起到调节人体新陈代谢、预防疾病作用的是 。
(3)青少年处于生长发育期,为预防患佝偻病,可以多吃奶制品、虾皮等食物,补充人体需要的 元素。
(4)生活中将硬水转化为软水常用的方法是 ,生活中要鉴别羊毛衫和合成纤维,可通过 的方法。
(5)炒菜时油锅中的油不慎着火,可用锅盖盖灭,其灭火原理为 。
(6)日常生活中经常接触的金属材料多数是合金,当金属制成合金后,性能会发生改变。如黄铜制的钥匙能在纯铜板上划出痕迹,说明合金的硬度一般 组成它的纯金属(填“大于”、“小于”或“等于”)。
(7)铝的化学性质很活泼,但家里用了很久的铝壶很少出现腐蚀,请用化学方程式表明其中的原理 。
17.病人在医院接受静脉注射或滴注时,常用到生理盐水(即氯化钠注射液) 。如图是某药业公司生产的氯化钠注射液包装标签上的部分文字说明。
请回答:
(1)该注射液里的溶质是 (填化学式),溶质质量分数为 (该注射液的密度为 1g/mL)。
(2)常温下一瓶合格的氯化钠注射液密封放置一段时间后,不会出现浑浊现象的原因是 。
(3)有一瓶注射液敞口放置一段时间后液体减少为 50mL,从 100mL 变至50mL 的过程 中 , 如 图 2 能 正确反 映溶质质量 分数 的变化情况 的是 (填字母)。
A. B. C. D.
18.在一定温度下,某固态物质在100克溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质的溶解度。已知,20℃时,硝酸钾()的溶解度是31.6克。水是重要的物质,在实验室中常用于溶解物质配制溶液,向50mL水(密度为1g/mL)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象回答。
(1)A、B、C中一定是饱和溶液的是 (填字母)。
(2)A图烧杯中溶质质量分数 C图烧杯中溶质质量分数(填“<”或“>”或“=”)。
(3)当 g时,B中恰好没有固体剩余。
三、计算题
19.过氧化氢溶液俗称双氧水,具有清除厌氧菌等作用,可以用于治疗中耳炎、文森口腔炎及清洁伤口等。某同学从家庭小药箱中取68g某医用双氧水溶液放入烧杯中,然后加入1g二氧化锰,每隔一分钟观察一次并记录烧杯中物质的质量如表所示,直到实验结束。请回答下列问题:
称量时间/min 0 1 2 3 4 5
烧杯中物质的质量/g 69.0 68.3 67.9 67.6 67.4 67.4
(1)该实验生成氧气的总质量为 g。
(2)请计算该双氧水中过氧化氢的质量分数(写出具体计算过程)。
20.黄铜是一种重要的金属材料,它是铜和锌的合金,外观很像黄金。为了测定黄铜样品的组成,某兴趣小组取五份样品分别加稀硫酸反应,其实验数据记录如表。
样品 第1份 第2份 第3份 第4份 第5份
黄铜样品质量/g 20 20 20 20 20
稀硫酸质量/g 25 50 75 100 125
产生气体质量/g 0.1 0.2 0.3 0.4 0.4
按要求完成下列问题:
(1)根据实验数据分析,第5份样品, 有剩余。
(2)该样品中铜的质量为 g。
(3)恰好完全反应时所得溶液中溶质的质量分数为 。(精确到0.1%)
(4)计算实验所用稀硫酸的溶质质量分数。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.C
5.D
6.B
7.A
8.B
9.C
10.C
11.C
12.C
13.D
14.C
15.(1)<
(2) 不饱和 20%
(3) C和D bc
16.(1)乳化
(2)维生素
(3)钙/Ca
(4) 煮沸 灼烧闻气味
(5)隔绝空气或氧气
(6)大于
(7)4Al+3O2=2Al2O3
17.(1) NaCl 0.9%
(2)溶液具有均一性、稳定性
(3)D
18.(1)B
(2)<
(3)5.8
19.(1)1.6
(2)解:设参加反应的过氧化氢的质量为x。
则双氧水中过氧化氢的质量分数=
答:该双氧水中过氧化氢的质量分数是5%。
20.(1)稀硫酸
(2)7
(3)28.6%
(4)由表中数据可知,第3份样品中,锌过量,硫酸完全反应,设硫酸的质量分数为z,
,解得z=19.6%。
答:实验所用稀硫酸的溶质质量分数为19.6%。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.鉴别、检验、除杂与分离是化学研究的重要方法。下列实验方案可行的是
选项 实验目的 实验方案
A 除去铁粉中的少量铜粉 加入过量稀盐酸,过滤
B 除去ZnSO4溶液中的少量FeSO4 加入过量的镁,过滤
C 除去饱和氯化钠溶液中的少量硝酸钾 蒸发结晶,过滤
D 鉴别真假黄金 看颜色
A.A B.B C.C D.D
2.下列有关实验的叙述中不正确的是
A.用红磷燃烧探究空气中氧气含量的实验中,红磷质量太少会影响实验结果
B.配制10%的氯化钠溶液时,量水时仰视读数,导致溶质质量分数偏小
C.工业制氧气是利用各组分沸点的不同将其分离
D.硝酸铵固体溶于水形成溶液时,仅发生扩散吸热过程
3.下列与“水”相关的说法正确的是
A.除去水中的色素和异味可以向水中加入焦炭 B.电解水可以探究水是由氢气和氧气组成的
C.用洗涤剂和汽油除油污都是乳化作用 D.用肥皂水区分硬水和软水,产生泡沫多的是软水
4.下列依据实验目的所设计的实验操作中,不正确的是
选项 实验目的 实验操作
A 鉴别水和过氧化氢溶液 分别加入少量二氧化锰
B 鉴别硝酸铵和氢氧化钠 分别加入适量的水
C 除去铁粉中的铜粉 加入足量的稀盐酸,过滤
D 除去二氧化碳中的一氧化碳 通过灼热的氧化铜
A.A B.B C.C D.D
5.如图是KNO3和NaCl的溶解度曲线。下列说法中正确的是
A.NaCl的溶解度不受温度的影响
B.t1℃时,KNO3饱和溶液中溶质的质量分数是20%
C.t2℃时,NaCl饱和溶液与KNO3饱和溶液中,溶质的质量分数不一定相等
D.在温度高于t2℃范围内,KNO3的溶解度始终大于NaCl的溶解度
6.如图为两种固体物质(不含结晶水)的溶解度曲线,下列说法正确的是
A.乙的饱和溶液由t2℃降温至t1℃,变为不饱和溶液
B.t2℃等质量的甲、乙两种物质的饱和溶液中,溶质的质量一定是甲大于乙
C.t1℃甲、乙两种物质的饱和溶液中溶质的质量分数都是50%
D.甲溶液中含有少量乙,可用蒸发溶剂的方法提纯乙
7.固体物质A、B的溶解度曲线如图所示,①②③④是分别用100 g水配制的不同状态下A溶液,下列说法正确的是
A.状态①溶液不饱和,状态②③④溶液饱和
B.60 ℃时A、B的饱和溶液降温至10 ℃时析出晶体质量A>B
C.除去A中少量的B,常采用蒸发结晶的方法
D.④的溶液质量分数最大
8.下列图像分别表示四个实验的过程中,其中图像与对应实验相符的是
A B C D
A.气体的溶解度与温度和压强的关系
B.把NaOH和NH4NO3固体分别溶于水中
C.向等质量的金属Fe和Zn中分别加入等浓度的稀盐酸
D.在空气中灼烧,除去氧化铜中混有的铜粉
9.分析图像并从图像获取信息是化学学习的重要技能。下列有关实验过程的图像正确的是
A.水通电分解过程中氢气和氧气的质量关系
B.相同温度下,用等质量等浓度的双氧水制取氧气
C.一定温度下,向硝酸钾的不饱和溶液中加入足量的硝酸钾固体
D.加热一定质量的高锰酸钾固体
10.食盐是一种重要的化工原料,可以用来调味,农业上常用10%~20%的食盐水选种。实验室配制50g质量分数为15%的NaCl溶液,过程如图所示。下列说法不正确的是
A.用量筒量取水时俯视读数会导致溶液的浓度偏大 B.玻璃棒的作用是搅拌,加速溶解
C.使用天平的过程中,为了操作方便,可以用手拿取砝码 D.图中正确的操作顺序是④②⑤①③
11.在实验室配制质量分数为的氯化钠溶液。下列说法正确的是
A.实验中用的仪器有烧杯、玻璃棒、量筒、胶头滴管、铁架台等
B.只用游码就可称量所需氯化钠,称量时把氯化钠放在右盘
C.用的氯化钠溶液和水配制也可达到实验目的
D.量取水时仰视读数,使所配溶液的溶质质量分数大于
12.对下列事实或现象的解释正确的是( )
选项 事实或现象 解释
A 氯化钠在热水中比在冷水中溶解得快 温度升高,分子能量变大,运动速率加快
B 夏天的高压铝线比冬天长 夏天温度高,铝原子体积变大
C CuSO4溶液和Fe SO4溶液颜色不同 溶液中含有的阳离子种类不同
D CO有毒而CO2无毒 两种物质的分子中的原子结构不同
A.A B.B C.C D.D
13.有关饱和溶液不饱和溶液的说法正确的是
A.不饱和溶液降低温度就能成为饱和溶液
B.同温度下饱和溶液中的溶质比不饱和溶液中的溶质多
C.不饱和溶液的溶质质量分数一定小于饱和溶液溶质质量分数
D.20℃时50克硝酸钾饱和溶液与85克硝酸钾饱和溶液的质量分数相等
14.建立宏观和微观之间的联系是化学学科独特的一种思维方式。下列现象或事实及其解释,其中正确的是
选项 现象或事实 解释
A 金刚石和石墨的物理性质不同 碳原子的结构不同
B 氯化钠固体溶解于水不见了 氯化钠分子运动到水分子中间去了
C 固体药品配成溶液后反应速率更快 参加反应的粒子在溶液中接触机会比在固体中多
D 水银体温计测量病人的体温,示数上升 原子体积受热时增大
A.A B.B C.C D.D
二、填空与简答
15.下列数据是氯化钠和氯化钾固体在不同温度时的溶解度。
温度/℃ 0 20 40 60 80 100
溶解度/g NaCl 35.7 36.0 36.6 37.3 38.4 39.8
KCl 27.6 34.0 40.0 45.5 51.1 56.7
(1)在0~20℃时,KCl的溶解度 (填“>”或“<”)NaCl的溶解度;
(2)20℃时,向100g水中加入25g氯化钠,充分溶解后,得到的溶液为 (填“饱和”或“不饱和”)溶液,溶液中溶质质量分数为 ;
(3)20℃时,进行如下图所示的实验。
①A~E中,溶液中溶质质量分数相同的是 ;
②下列操作能使E溶液中溶质质量分数变小的是 (填字母序号)。
a.加入2g KCl b.加入100g 100℃的水 c.降温至40℃
16.化学源于生活,生活中蕴含着许多化学知识。
(1)用洗洁精洗油污,是利用了洗洁精的 作用。
(2)大枣含有蛋白质、糖类及维生素等营养素,其中起到调节人体新陈代谢、预防疾病作用的是 。
(3)青少年处于生长发育期,为预防患佝偻病,可以多吃奶制品、虾皮等食物,补充人体需要的 元素。
(4)生活中将硬水转化为软水常用的方法是 ,生活中要鉴别羊毛衫和合成纤维,可通过 的方法。
(5)炒菜时油锅中的油不慎着火,可用锅盖盖灭,其灭火原理为 。
(6)日常生活中经常接触的金属材料多数是合金,当金属制成合金后,性能会发生改变。如黄铜制的钥匙能在纯铜板上划出痕迹,说明合金的硬度一般 组成它的纯金属(填“大于”、“小于”或“等于”)。
(7)铝的化学性质很活泼,但家里用了很久的铝壶很少出现腐蚀,请用化学方程式表明其中的原理 。
17.病人在医院接受静脉注射或滴注时,常用到生理盐水(即氯化钠注射液) 。如图是某药业公司生产的氯化钠注射液包装标签上的部分文字说明。
请回答:
(1)该注射液里的溶质是 (填化学式),溶质质量分数为 (该注射液的密度为 1g/mL)。
(2)常温下一瓶合格的氯化钠注射液密封放置一段时间后,不会出现浑浊现象的原因是 。
(3)有一瓶注射液敞口放置一段时间后液体减少为 50mL,从 100mL 变至50mL 的过程 中 , 如 图 2 能 正确反 映溶质质量 分数 的变化情况 的是 (填字母)。
A. B. C. D.
18.在一定温度下,某固态物质在100克溶剂中达到饱和状态时所溶解的溶质的质量,叫做这种物质的溶解度。已知,20℃时,硝酸钾()的溶解度是31.6克。水是重要的物质,在实验室中常用于溶解物质配制溶液,向50mL水(密度为1g/mL)中溶解一定量硝酸钾固体的操作如下,请根据如图实验现象回答。
(1)A、B、C中一定是饱和溶液的是 (填字母)。
(2)A图烧杯中溶质质量分数 C图烧杯中溶质质量分数(填“<”或“>”或“=”)。
(3)当 g时,B中恰好没有固体剩余。
三、计算题
19.过氧化氢溶液俗称双氧水,具有清除厌氧菌等作用,可以用于治疗中耳炎、文森口腔炎及清洁伤口等。某同学从家庭小药箱中取68g某医用双氧水溶液放入烧杯中,然后加入1g二氧化锰,每隔一分钟观察一次并记录烧杯中物质的质量如表所示,直到实验结束。请回答下列问题:
称量时间/min 0 1 2 3 4 5
烧杯中物质的质量/g 69.0 68.3 67.9 67.6 67.4 67.4
(1)该实验生成氧气的总质量为 g。
(2)请计算该双氧水中过氧化氢的质量分数(写出具体计算过程)。
20.黄铜是一种重要的金属材料,它是铜和锌的合金,外观很像黄金。为了测定黄铜样品的组成,某兴趣小组取五份样品分别加稀硫酸反应,其实验数据记录如表。
样品 第1份 第2份 第3份 第4份 第5份
黄铜样品质量/g 20 20 20 20 20
稀硫酸质量/g 25 50 75 100 125
产生气体质量/g 0.1 0.2 0.3 0.4 0.4
按要求完成下列问题:
(1)根据实验数据分析,第5份样品, 有剩余。
(2)该样品中铜的质量为 g。
(3)恰好完全反应时所得溶液中溶质的质量分数为 。(精确到0.1%)
(4)计算实验所用稀硫酸的溶质质量分数。(写出计算过程)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.D
3.D
4.C
5.D
6.B
7.A
8.B
9.C
10.C
11.C
12.C
13.D
14.C
15.(1)<
(2) 不饱和 20%
(3) C和D bc
16.(1)乳化
(2)维生素
(3)钙/Ca
(4) 煮沸 灼烧闻气味
(5)隔绝空气或氧气
(6)大于
(7)4Al+3O2=2Al2O3
17.(1) NaCl 0.9%
(2)溶液具有均一性、稳定性
(3)D
18.(1)B
(2)<
(3)5.8
19.(1)1.6
(2)解:设参加反应的过氧化氢的质量为x。
则双氧水中过氧化氢的质量分数=
答:该双氧水中过氧化氢的质量分数是5%。
20.(1)稀硫酸
(2)7
(3)28.6%
(4)由表中数据可知,第3份样品中,锌过量,硫酸完全反应,设硫酸的质量分数为z,
,解得z=19.6%。
答:实验所用稀硫酸的溶质质量分数为19.6%。
答案第1页,共2页
答案第1页,共2页
同课章节目录
