2.2.1烯烃 教学设计 2023-2024学年高二下学期化学人教版(2019)选择性必修3
文档属性
| 名称 | 2.2.1烯烃 教学设计 2023-2024学年高二下学期化学人教版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 358.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-02 00:00:00 | ||
图片预览

文档简介
教学设计 授课教师:
课题 烯烃 课型 新课 授课班级 高二(2)班
教具 多媒体、黑板、球棍模型 课时 1课时 授课时间
核 心 教 学 目 标 一、宏观辨识与微观探析: 结合代表物,认识烯烃的组成和结构特点,理解烯烃的化学性质及应用。 二、证据推理与模型认知: 通过对烯烃官能团、化学键和化学性质的分析,体会结构与性质之间的关系,建立研究烯烃的一般模型。 三、科学态度与社会责任: 通过对烯烃在生产及生活中的应用研究,激发学生的学习兴趣,使学生关注社会,感受科技进步为生活和生产带来的便利。
重点 烯烃的结构与性质
难点 烯烃的加成反应和马氏规则
教学方法 讲授法、合作探究法、练习法
教学过程
导 入 新 课 3分钟 一、导入 展示图片石油化工厂、液化石油气、“西气东输”工程及石蜡的图片。 讲述:在我们生活中,液化石油气很常见,那么同学们知道液化石油气与西气东输的气体有什么不同吗? 引导学生回答。 讲述:二者的组成不同,西气东输的主要成分是甲烷,液化石油气中含有烯烃等重要的化工原料。 过渡:那么我们今天对烯烃进行重点学习。 引导学生关注生活和社会,学会从化学的角度分析问题,确定研究对象。
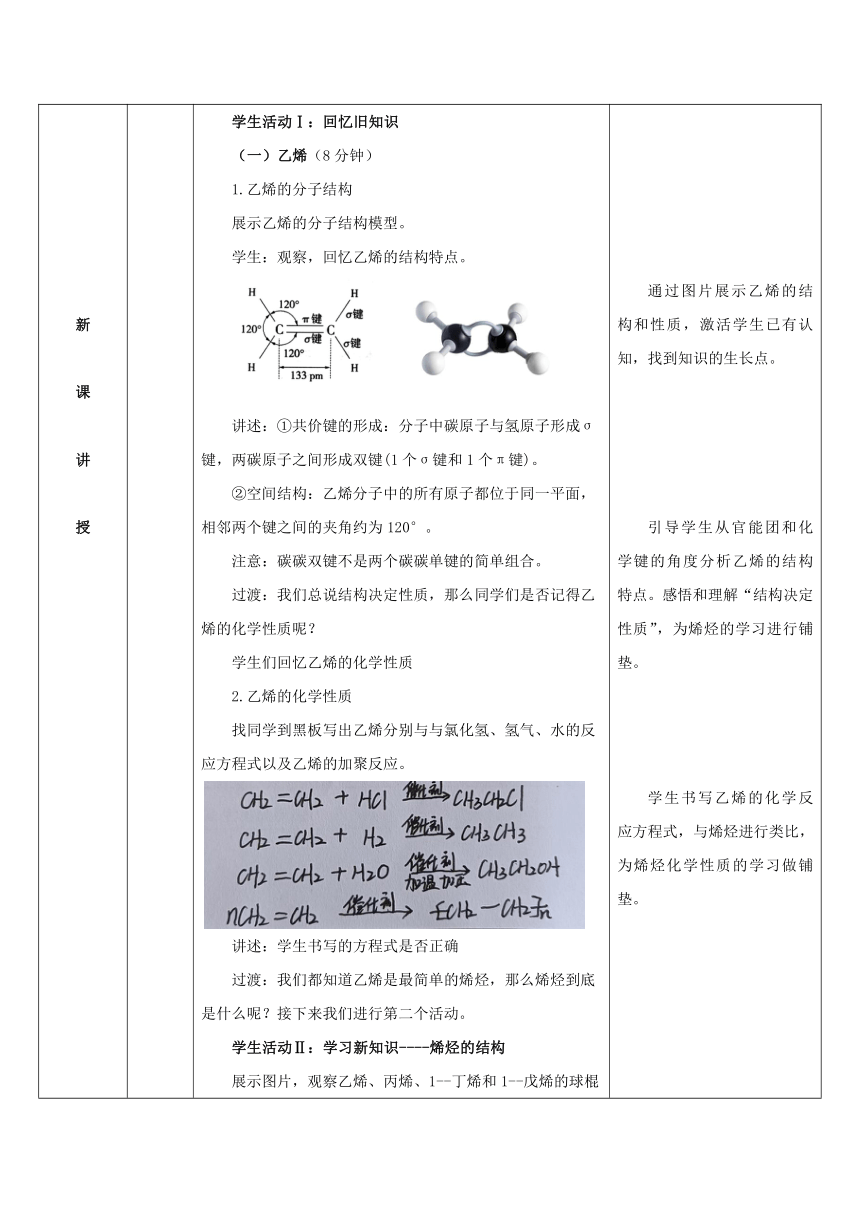
新 课 讲 授 二、学习目标(1分钟) 学生齐读学习目标。 三、新课讲授 学生活动Ⅰ:回忆旧知识 (一)乙烯(8分钟) 1.乙烯的分子结构 展示乙烯的分子结构模型。 学生:观察,回忆乙烯的结构特点。 讲述:①共价键的形成:分子中碳原子与氢原子形成σ键,两碳原子之间形成双键(1个σ键和1个π键)。 ②空间结构:乙烯分子中的所有原子都位于同一平面,相邻两个键之间的夹角约为120°。 注意:碳碳双键不是两个碳碳单键的简单组合。 过渡:我们总说结构决定性质,那么同学们是否记得乙烯的化学性质呢? 学生们回忆乙烯的化学性质 2.乙烯的化学性质 找同学到黑板写出乙烯分别与与氯化氢、氢气、水的反应方程式以及乙烯的加聚反应。 讲述:学生书写的方程式是否正确 过渡:我们都知道乙烯是最简单的烯烃,那么烯烃到底是什么呢?接下来我们进行第二个活动。 学生活动Ⅱ:学习新知识----烯烃的结构 展示图片,观察乙烯、丙烯、1--丁烯和1--戊烯的球棍模型。 提问:这几种烃在结构上有什么相同之处? 找学生回答 讲述:都含有一个“碳碳双键”。 (二)、烯烃的结构(3分钟) 1.概念:含有一个碳碳双键的烃类化合物。 2. 官能团:名称为碳碳双键,结构简式为 3. 通式:CnH2n 过渡:同学们会写简单的烯烃,比如乙烯、丙烯。掌握烯烃的结构,同时结合乙烯的化学性质,推测烯烃具有怎样的性质。接下来我们进行第三个活动。 学生活动Ⅲ:学习新知识----烯烃的化学性质 (三)、烯烃的化学性质(21分钟) 1.氧化反应 (1)可燃性:完全燃烧产生CO2和H2O 烯烃都能使酸性高锰酸钾溶液褪色 加成反应 讲述:回顾乙烯与溴单质加成的机理,并用动态图演示。 【合作探究】 小组讨论:写出丙烯与下列物质反应的化学方程式(反应可能有两种产物),并说明反应中官能团和化学键的变化 试剂乙烯丙烯溴CH2===CH2+Br2→CH2Br—CH2Br 氯化氢CH2===CH2+HClCH3CH2Cl 水CH2===CH2+H2OCH3CH2OH
学生动手构建: 请各小组首先模拟丙烯与溴单质的加成反应,并请学生到黑板写出化学反应方程式。 其次模拟丙烯与氯化氢的加成反应,并请学生到黑板写出化学反应方程式。 最后模拟丙烯与水的加成反应,并请学生到黑板写出化学反应方程式。 试剂乙烯丙烯溴CH2===CH2+Br2→CH2Br—CH2BrCH3CH===CH2+Br2→ CH3CHBrCH2Br 氯化氢CH2===CH2+HClCH3CH2ClCH3CH===CH2+HCl CH3CH2CH2ClCH3CH===CH2+HBr CH3CHClCH3 水CH2===CH2+H2OCH3CH2OHCH3—CH===CH2+H2O CH3CH2CH2OH
简单讲解方程式 讲述:在此加深一下加成反应的理解,既然有两种产物,肯定含量不同。 讲述:大量实验事实表明:丙烯与氯化氢、水的加成产物有两种时,一般情况下不对称烯烃和HX、H2O加成时,氢加在含氢较多的双键碳上。也就是马氏规则。 过渡:我们学过的乙烯、丙烯中都含有一个碳碳双键,那么分子中含有两个碳碳双键的是什么呢?我们称为二烯烃。比较简单且常见的是1,3--丁二烯,它也同样能发生加成反应。 尝试分析:1mol CH2=CH-CH=CH2与1mol Cl2的加成产物。 请同学们用球棍模型,手动操作做,得到结果。 讲述:用PPT展示答案,在黑板上用不同颜色的粉笔讲解。 练习:写出1mol CH2=CH-CH=CH2与足量的 Cl2发生加成反应的方程式。 让学生了解本节课的学习目标。 通过图片展示乙烯的结构和性质,激活学生已有认知,找到知识的生长点。 引导学生从官能团和化学键的角度分析乙烯的结构特点。感悟和理解“结构决定性质”,为烯烃的学习进行铺垫。 学生书写乙烯的化学反应方程式,与烯烃进行类比,为烯烃化学性质的学习做铺垫。 通过对简单烯烃的对比,大胆推测烯烃的通性,加深对“结构决定性质”的理解。 学生学习烯烃的结构特点。 用动态图使得加成反应的原理更加形象,激发学生的学习兴趣。 通过实际动手操作和结论进行表述,体会科学研究中寻找证据的过程。 通过书写化学方程式,体会烯烃的化学性质,培养严谨的科学态度。 引导学生体验“发现问题、分析问题、解决问题”的过程,进一步建立科学研究的一般思路。 通过手动操作模型,提高学生的学习兴趣,使微观结构形象化,突破难点。 使学生感受“微观”“宏观”和符号之间的联系,提高书写的准确性。
课堂小结 2分钟 课堂小结 根据板书与学生共同回顾本节课内容 巩固已学知识
当堂检测 6分钟 课堂练习 多媒体呈现练习题 检验学习成果
作业布置 1分钟 作业 课本42页 练习与应用
板 书 设 计 2.2.1 烯烃 一、回忆乙烯 二、探究烯烃 结构 化学性质 氧化反应 加成反应
课题 烯烃 课型 新课 授课班级 高二(2)班
教具 多媒体、黑板、球棍模型 课时 1课时 授课时间
核 心 教 学 目 标 一、宏观辨识与微观探析: 结合代表物,认识烯烃的组成和结构特点,理解烯烃的化学性质及应用。 二、证据推理与模型认知: 通过对烯烃官能团、化学键和化学性质的分析,体会结构与性质之间的关系,建立研究烯烃的一般模型。 三、科学态度与社会责任: 通过对烯烃在生产及生活中的应用研究,激发学生的学习兴趣,使学生关注社会,感受科技进步为生活和生产带来的便利。
重点 烯烃的结构与性质
难点 烯烃的加成反应和马氏规则
教学方法 讲授法、合作探究法、练习法
教学过程
导 入 新 课 3分钟 一、导入 展示图片石油化工厂、液化石油气、“西气东输”工程及石蜡的图片。 讲述:在我们生活中,液化石油气很常见,那么同学们知道液化石油气与西气东输的气体有什么不同吗? 引导学生回答。 讲述:二者的组成不同,西气东输的主要成分是甲烷,液化石油气中含有烯烃等重要的化工原料。 过渡:那么我们今天对烯烃进行重点学习。 引导学生关注生活和社会,学会从化学的角度分析问题,确定研究对象。
新 课 讲 授 二、学习目标(1分钟) 学生齐读学习目标。 三、新课讲授 学生活动Ⅰ:回忆旧知识 (一)乙烯(8分钟) 1.乙烯的分子结构 展示乙烯的分子结构模型。 学生:观察,回忆乙烯的结构特点。 讲述:①共价键的形成:分子中碳原子与氢原子形成σ键,两碳原子之间形成双键(1个σ键和1个π键)。 ②空间结构:乙烯分子中的所有原子都位于同一平面,相邻两个键之间的夹角约为120°。 注意:碳碳双键不是两个碳碳单键的简单组合。 过渡:我们总说结构决定性质,那么同学们是否记得乙烯的化学性质呢? 学生们回忆乙烯的化学性质 2.乙烯的化学性质 找同学到黑板写出乙烯分别与与氯化氢、氢气、水的反应方程式以及乙烯的加聚反应。 讲述:学生书写的方程式是否正确 过渡:我们都知道乙烯是最简单的烯烃,那么烯烃到底是什么呢?接下来我们进行第二个活动。 学生活动Ⅱ:学习新知识----烯烃的结构 展示图片,观察乙烯、丙烯、1--丁烯和1--戊烯的球棍模型。 提问:这几种烃在结构上有什么相同之处? 找学生回答 讲述:都含有一个“碳碳双键”。 (二)、烯烃的结构(3分钟) 1.概念:含有一个碳碳双键的烃类化合物。 2. 官能团:名称为碳碳双键,结构简式为 3. 通式:CnH2n 过渡:同学们会写简单的烯烃,比如乙烯、丙烯。掌握烯烃的结构,同时结合乙烯的化学性质,推测烯烃具有怎样的性质。接下来我们进行第三个活动。 学生活动Ⅲ:学习新知识----烯烃的化学性质 (三)、烯烃的化学性质(21分钟) 1.氧化反应 (1)可燃性:完全燃烧产生CO2和H2O 烯烃都能使酸性高锰酸钾溶液褪色 加成反应 讲述:回顾乙烯与溴单质加成的机理,并用动态图演示。 【合作探究】 小组讨论:写出丙烯与下列物质反应的化学方程式(反应可能有两种产物),并说明反应中官能团和化学键的变化 试剂乙烯丙烯溴CH2===CH2+Br2→CH2Br—CH2Br 氯化氢CH2===CH2+HClCH3CH2Cl 水CH2===CH2+H2OCH3CH2OH
学生动手构建: 请各小组首先模拟丙烯与溴单质的加成反应,并请学生到黑板写出化学反应方程式。 其次模拟丙烯与氯化氢的加成反应,并请学生到黑板写出化学反应方程式。 最后模拟丙烯与水的加成反应,并请学生到黑板写出化学反应方程式。 试剂乙烯丙烯溴CH2===CH2+Br2→CH2Br—CH2BrCH3CH===CH2+Br2→ CH3CHBrCH2Br 氯化氢CH2===CH2+HClCH3CH2ClCH3CH===CH2+HCl CH3CH2CH2ClCH3CH===CH2+HBr CH3CHClCH3 水CH2===CH2+H2OCH3CH2OHCH3—CH===CH2+H2O CH3CH2CH2OH
简单讲解方程式 讲述:在此加深一下加成反应的理解,既然有两种产物,肯定含量不同。 讲述:大量实验事实表明:丙烯与氯化氢、水的加成产物有两种时,一般情况下不对称烯烃和HX、H2O加成时,氢加在含氢较多的双键碳上。也就是马氏规则。 过渡:我们学过的乙烯、丙烯中都含有一个碳碳双键,那么分子中含有两个碳碳双键的是什么呢?我们称为二烯烃。比较简单且常见的是1,3--丁二烯,它也同样能发生加成反应。 尝试分析:1mol CH2=CH-CH=CH2与1mol Cl2的加成产物。 请同学们用球棍模型,手动操作做,得到结果。 讲述:用PPT展示答案,在黑板上用不同颜色的粉笔讲解。 练习:写出1mol CH2=CH-CH=CH2与足量的 Cl2发生加成反应的方程式。 让学生了解本节课的学习目标。 通过图片展示乙烯的结构和性质,激活学生已有认知,找到知识的生长点。 引导学生从官能团和化学键的角度分析乙烯的结构特点。感悟和理解“结构决定性质”,为烯烃的学习进行铺垫。 学生书写乙烯的化学反应方程式,与烯烃进行类比,为烯烃化学性质的学习做铺垫。 通过对简单烯烃的对比,大胆推测烯烃的通性,加深对“结构决定性质”的理解。 学生学习烯烃的结构特点。 用动态图使得加成反应的原理更加形象,激发学生的学习兴趣。 通过实际动手操作和结论进行表述,体会科学研究中寻找证据的过程。 通过书写化学方程式,体会烯烃的化学性质,培养严谨的科学态度。 引导学生体验“发现问题、分析问题、解决问题”的过程,进一步建立科学研究的一般思路。 通过手动操作模型,提高学生的学习兴趣,使微观结构形象化,突破难点。 使学生感受“微观”“宏观”和符号之间的联系,提高书写的准确性。
课堂小结 2分钟 课堂小结 根据板书与学生共同回顾本节课内容 巩固已学知识
当堂检测 6分钟 课堂练习 多媒体呈现练习题 检验学习成果
作业布置 1分钟 作业 课本42页 练习与应用
板 书 设 计 2.2.1 烯烃 一、回忆乙烯 二、探究烯烃 结构 化学性质 氧化反应 加成反应
