4.1原子结构与 元素的性质(2课时)(共22页)2023-2024学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1原子结构与 元素的性质(2课时)(共22页)2023-2024学年高一上学期化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-02 21:55:22 | ||
图片预览





文档简介
(共22张PPT)
原子结构与元素的性质
——碱金属元素
(教材P98-P101)
Rb
碱金属元素化学性质活泼,在自然界都以化合态存在,它们的单质都由人工制得。
元素周期表中第IA族除氢外的元素称为碱金属元素,
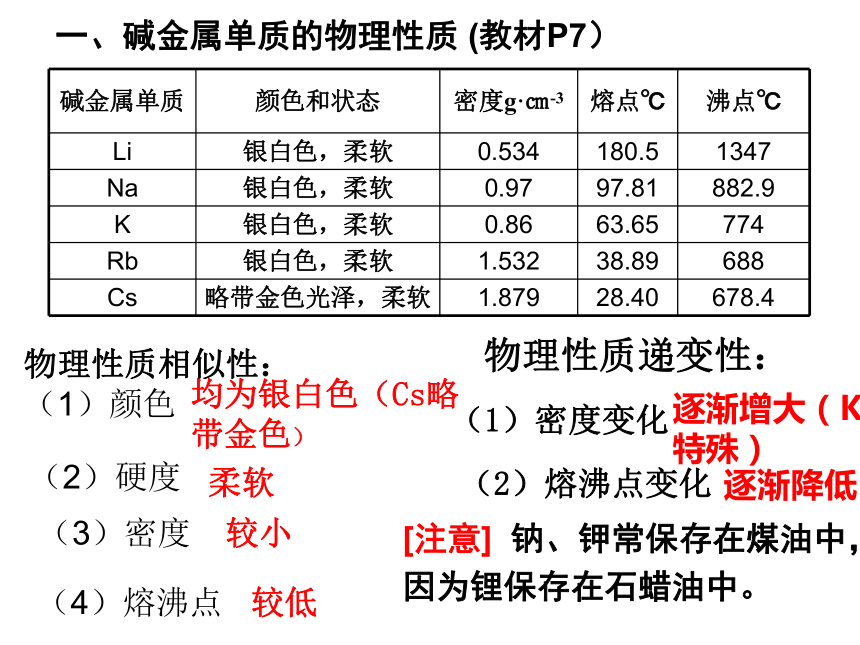
碱金属单质 颜色和状态 密度g·㎝-3 熔点℃ 沸点℃
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金色光泽,柔软 1.879 28.40 678.4
一、碱金属单质的物理性质 (教材P7)
物理性质相似性:
(1)颜色
(2)硬度
(3)密度
(4)熔沸点
均为银白色(Cs略带金色)
柔软
较小
较低
(1)密度变化
(2)熔沸点变化
逐渐增大(K特殊)
逐渐降低
物理性质递变性:
[注意] 钠、钾常保存在煤油中,因为锂保存在石蜡油中。
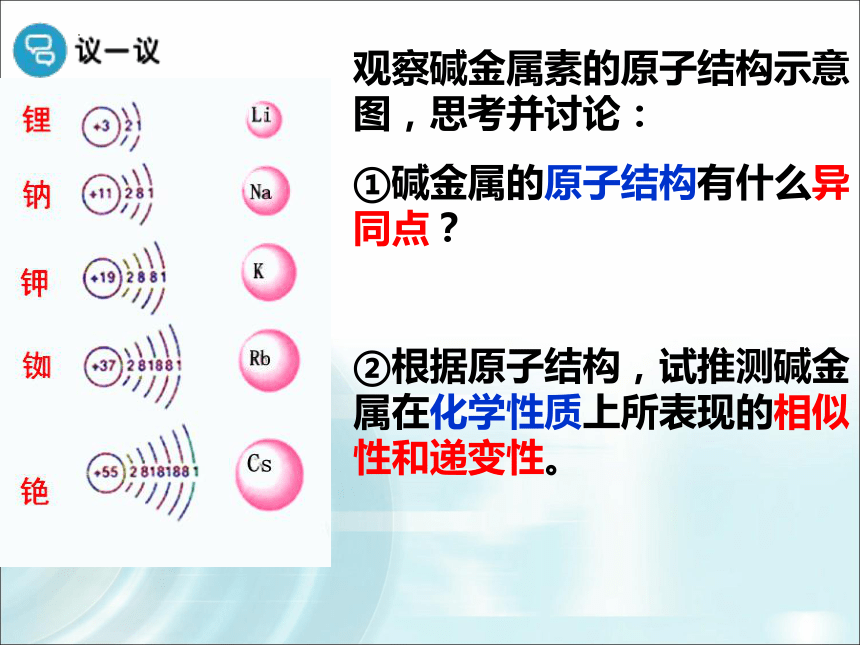
观察碱金属素的原子结构示意图,思考并讨论:
①碱金属的原子结构有什么异同点?
②根据原子结构,试推测碱金属在化学性质上所表现的相似性和递变性。
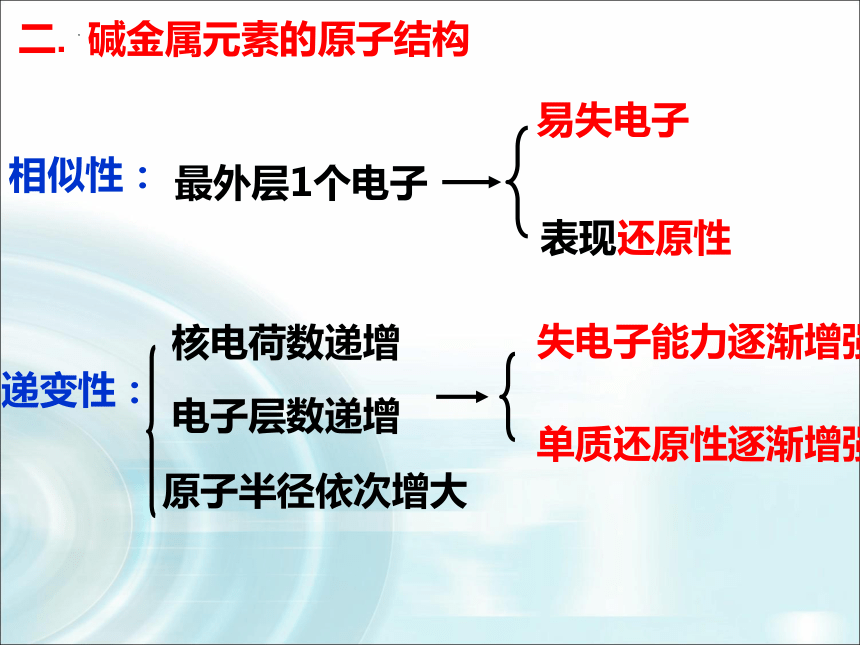
相似性:
递变性:
核电荷数递增
电子层数递增
原子半径依次增大
易失电子
表现还原性
单质还原性逐渐增强
最外层1个电子
失电子能力逐渐增强
二. 碱金属元素的原子结构
递变性:
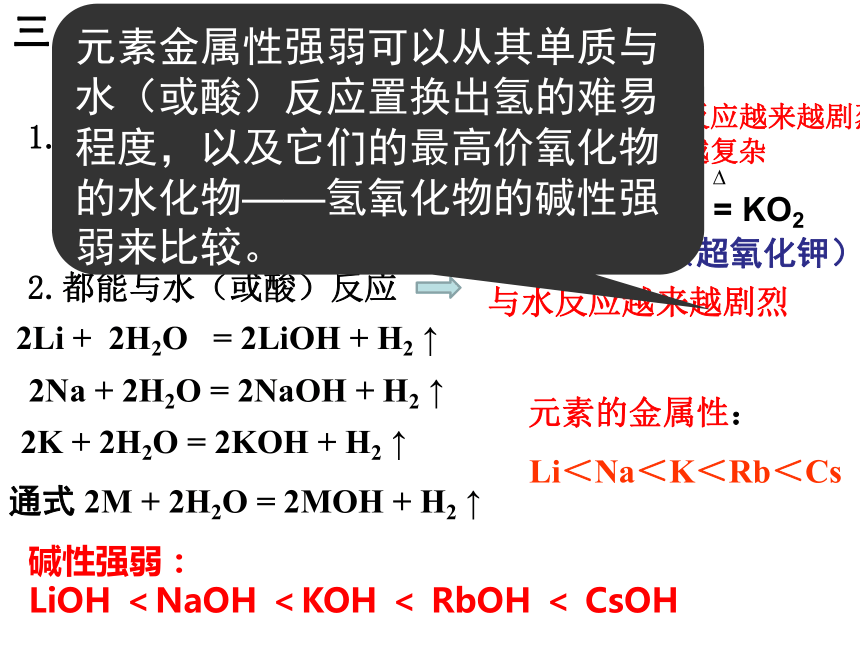
三、碱金属单质的化学性质
2Li+O2 = 2Li2O
2Na+O2 = Na2O2
K+O2 = KO2
1.都能与氧气反应
相似性:
从Li到Cs,与氧气反应越来越剧烈,生成的氧化物越来越复杂
(过氧化钠)
(超氧化钾)
2.都能与水(或酸)反应
与水反应越来越剧烈
2Na + 2H2O = 2NaOH + H2 ↑
2K + 2H2O = 2KOH + H2 ↑
通式 2M + 2H2O = 2MOH + H2 ↑
碱性强弱:
LiOH <NaOH <KOH < RbOH < CsOH
元素的金属性:
Li<Na<K<Rb<Cs
2Li + 2H2O = 2LiOH + H2 ↑
元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来比较。
整理笔记:1、碱金属某些性质的排序
1、单质密度
2、单质熔沸点
3、单质还原性
4、离子氧化性
6、最高价氧化物的水化物的碱性
7、元素的金属性
5、与水反应的剧烈程度
Li<K<Na<Rb<Cs
Li>Na >K>Rb>Cs
Li<Na<K<Rb<Cs
Li+>Na+>K+>Rb+>Cs+
Li<Na<K<Rb<Cs
LiOH <NaOH <KOH < RbOH < CsOH
Li<Na<K<Rb<Cs
整理笔记:
2、什么是金属性,可以用哪些方法判断金属性强弱?
金属性:是指在化学反应中原子失去电子的能力。
1. 与水或酸反应难易程度
2. 最高价氧化物对应水化物碱性强弱。
3. 通过金属活动性顺序表判断。
4. 同主族元素从上到下金属性增强。
原子结构与元素的性质
——卤族元素
(教材P102-P104)
F2
Br2
I2
卤族元素
1、卤族元素是元素周期表中的第____纵行,是第_____族,包括的元素的名称和符号:
17
ⅦA
氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)、(Ts)
2、卤素单质的物理性质(阅读教材P8:资料卡片)
卤素单质均为双原子分子
F2、Cl2、Br2、I2、At2
递变性
(1)颜色:
逐渐加深
(2)状态:
气 →液→固
(3)熔沸点:
依次增高
(4)密度:
逐渐增大
(5)溶解性
除氟气(与水剧烈反应)外,在水中溶解度都较小,且由大→小,都易溶于有机溶剂。
★ 卤素单质物理性质的特殊性:
I2易升华——利用此特性可用于混合物的分离如碘与氯化钠
水 CCl4 汽油(苯)
Cl2 黄绿色 黄绿色 黄绿色
Br2 橙色 橙(红)色 橙(红)色
I2 棕黄色 紫色 紫(红)色
下表列出Cl2、Br2、I2在不同溶剂中的颜色
碘酒就是碘的酒精溶液,呈棕褐色。
Br2是深红棕色液体,是中学阶段唯一一种液态非金属单质
Br2有很强的腐蚀性,易挥发,保存时加少量的水进行“液封”,并用玻璃塞封口(因挥发的溴能腐蚀橡胶)
碘单质保存在棕色广口瓶中
卤族元素元素的性质与原子结构关系(教材P7学与问)
(1)元素的性质与原子最外电子层中的电子数目有密切关系。
(2)随着核电荷数的增加,元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减弱。
※
※
卤族元素原子最外层电子数均为7
在化学反应中易得到电子
卤素单质都体现氧化性
在化学反应中得到电子能力减弱
单质氧化性减弱
离子的还原性:F-< Cl- < Br-<I-
离子还原性增强
氧化性:F2 > Cl2 > Br2 >I2
■单质氧化性减弱,体现递变性
■都能跟氢气反应,体现相似性
与H2反应条件 生成的氢化物的稳定性 单质的氧化性
F2 Cl2 Br2 I2
逐
渐
变
难
逐
渐
减
弱
逐
渐
减
弱
A、HX的稳定性:
B、HX的还原性:
C、HX的水溶液的酸性:
HF > HCl > HBr > HI
HF3、卤素单质化学性质
(1)与H2反应
通式: X2 + H2 = 2HX(反应条件不同)
HF(2)卤素单质与水的反应
2F2 + 2H2O = 4HF + O2 (剧烈反应)
逐渐困难
通式:X2 + H2O = HX + HXO (X=Cl、Br、I 但≠F)
I2 + H2O = HI + HIO
Br2 + H2O = HBr + HBrO
Cl2 + H2O = HCl + HClO
特别注意:F2不能从盐溶液中置换出其他卤素单质。
(3)卤素单质与碱的反应
X2 + 2NaOH== NaX+NaXO+H2O
(X=Cl、Br、I 但≠F )
2F2 + 4NaOH== 4NaF+O2+2H2O
(4)卤素单质与变价金属的反应
3 X2 + 2Fe == 2FeX3
△
△
I2 + Fe == FeI2
(X=F、Cl、Br 但≠I )
氧化性:F2 > Cl2 > Br2 >I2
(5)碘单质的化学特性 遇淀粉变蓝
如何设计实验证明Cl2的氧化性大于Br2?
实验 现象 化学方程式
1、将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡,静置。
2、将少量氯水加入盛有KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡,静置。
3、将少量溴水加入盛有KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡,静置。
溶液分层,
下层橙红色
溶液分层,下层紫红色
2NaBr + Cl2 ==
2NaCl + Br2
2KI + Cl2 ==
2KCl + I2
2KI + Br2==
2KBr + I2
(7)卤素单质之间的置换反应
结论:单质氧化性:
离子还原性:
F2>Cl2>Br2>I2
F-溶液分层,下层紫红色
议一议1:什么是非金属性,可以用哪些方法判断非金属性强弱?
非金属性:是指在化学反应中原子得电子的能力。得电子能力越强的原子其非金属性就越强;反之亦反。
常见判断方法:
1. 与氢气反应难易程度,以及生成氢化物的稳定性。
2. 最高价氧化物对应水化物酸性强弱。
3. 通过非金属单质间的置换反应判断。
4. 同主族元素从上到下非金属性减弱。
议一议2:
1. 已知O、S、Se是VIA的元素,请问:
(1)H2O、H2S、H2Se的稳定性强弱?
(2)H2SO4与H2SeO4的酸性强弱?
2. 已知Cl2通入Na2S溶液中会有淡黄色沉淀生成,请写出相应离子方程式?请问Cl和S的非金属性强弱?HCl和H2S的稳定性?HClO4和H2SO4的酸性强弱?
整理笔记:卤素某些性质的排序
1、单质密度
2、单质熔沸点
3、单质氧化性
4、离子还原性
6、最高价氧化物的水化物的酸性
7、元素的非金属性
5、与氢气反应的难易程度
F2 < Cl2 < Br2<I2
F2 < Cl2 < Br2<I2
F > Cl > Br>I
F-< Cl- < Br-<I-
F2 > Cl2 > Br2 >I2
HClO4> HBrO4>HIO4
F2 > Cl2 > Br2 >I2
非金属性:是指在化学反应中原子得电子的能力。得电子能力越强的原子其非金属性就越强;反之亦反。
常见判断方法:
1. 与氢气反应难易程度,以及生成氢化物的稳定性。
2. 最高价氧化物对应水化物酸性强弱。
3. 通过非金属单质间的置换反应判断。
4. 同主族元素从上到下非金属性减弱。
原子结构与元素的性质
——碱金属元素
(教材P98-P101)
Rb
碱金属元素化学性质活泼,在自然界都以化合态存在,它们的单质都由人工制得。
元素周期表中第IA族除氢外的元素称为碱金属元素,
碱金属单质 颜色和状态 密度g·㎝-3 熔点℃ 沸点℃
Li 银白色,柔软 0.534 180.5 1347
Na 银白色,柔软 0.97 97.81 882.9
K 银白色,柔软 0.86 63.65 774
Rb 银白色,柔软 1.532 38.89 688
Cs 略带金色光泽,柔软 1.879 28.40 678.4
一、碱金属单质的物理性质 (教材P7)
物理性质相似性:
(1)颜色
(2)硬度
(3)密度
(4)熔沸点
均为银白色(Cs略带金色)
柔软
较小
较低
(1)密度变化
(2)熔沸点变化
逐渐增大(K特殊)
逐渐降低
物理性质递变性:
[注意] 钠、钾常保存在煤油中,因为锂保存在石蜡油中。
观察碱金属素的原子结构示意图,思考并讨论:
①碱金属的原子结构有什么异同点?
②根据原子结构,试推测碱金属在化学性质上所表现的相似性和递变性。
相似性:
递变性:
核电荷数递增
电子层数递增
原子半径依次增大
易失电子
表现还原性
单质还原性逐渐增强
最外层1个电子
失电子能力逐渐增强
二. 碱金属元素的原子结构
递变性:
三、碱金属单质的化学性质
2Li+O2 = 2Li2O
2Na+O2 = Na2O2
K+O2 = KO2
1.都能与氧气反应
相似性:
从Li到Cs,与氧气反应越来越剧烈,生成的氧化物越来越复杂
(过氧化钠)
(超氧化钾)
2.都能与水(或酸)反应
与水反应越来越剧烈
2Na + 2H2O = 2NaOH + H2 ↑
2K + 2H2O = 2KOH + H2 ↑
通式 2M + 2H2O = 2MOH + H2 ↑
碱性强弱:
LiOH <NaOH <KOH < RbOH < CsOH
元素的金属性:
Li<Na<K<Rb<Cs
2Li + 2H2O = 2LiOH + H2 ↑
元素金属性强弱可以从其单质与水(或酸)反应置换出氢的难易程度,以及它们的最高价氧化物的水化物——氢氧化物的碱性强弱来比较。
整理笔记:1、碱金属某些性质的排序
1、单质密度
2、单质熔沸点
3、单质还原性
4、离子氧化性
6、最高价氧化物的水化物的碱性
7、元素的金属性
5、与水反应的剧烈程度
Li<K<Na<Rb<Cs
Li>Na >K>Rb>Cs
Li<Na<K<Rb<Cs
Li+>Na+>K+>Rb+>Cs+
Li<Na<K<Rb<Cs
LiOH <NaOH <KOH < RbOH < CsOH
Li<Na<K<Rb<Cs
整理笔记:
2、什么是金属性,可以用哪些方法判断金属性强弱?
金属性:是指在化学反应中原子失去电子的能力。
1. 与水或酸反应难易程度
2. 最高价氧化物对应水化物碱性强弱。
3. 通过金属活动性顺序表判断。
4. 同主族元素从上到下金属性增强。
原子结构与元素的性质
——卤族元素
(教材P102-P104)
F2
Br2
I2
卤族元素
1、卤族元素是元素周期表中的第____纵行,是第_____族,包括的元素的名称和符号:
17
ⅦA
氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)、(Ts)
2、卤素单质的物理性质(阅读教材P8:资料卡片)
卤素单质均为双原子分子
F2、Cl2、Br2、I2、At2
递变性
(1)颜色:
逐渐加深
(2)状态:
气 →液→固
(3)熔沸点:
依次增高
(4)密度:
逐渐增大
(5)溶解性
除氟气(与水剧烈反应)外,在水中溶解度都较小,且由大→小,都易溶于有机溶剂。
★ 卤素单质物理性质的特殊性:
I2易升华——利用此特性可用于混合物的分离如碘与氯化钠
水 CCl4 汽油(苯)
Cl2 黄绿色 黄绿色 黄绿色
Br2 橙色 橙(红)色 橙(红)色
I2 棕黄色 紫色 紫(红)色
下表列出Cl2、Br2、I2在不同溶剂中的颜色
碘酒就是碘的酒精溶液,呈棕褐色。
Br2是深红棕色液体,是中学阶段唯一一种液态非金属单质
Br2有很强的腐蚀性,易挥发,保存时加少量的水进行“液封”,并用玻璃塞封口(因挥发的溴能腐蚀橡胶)
碘单质保存在棕色广口瓶中
卤族元素元素的性质与原子结构关系(教材P7学与问)
(1)元素的性质与原子最外电子层中的电子数目有密切关系。
(2)随着核电荷数的增加,元素原子的电子层数逐渐增多,原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减弱。
※
※
卤族元素原子最外层电子数均为7
在化学反应中易得到电子
卤素单质都体现氧化性
在化学反应中得到电子能力减弱
单质氧化性减弱
离子的还原性:F-< Cl- < Br-<I-
离子还原性增强
氧化性:F2 > Cl2 > Br2 >I2
■单质氧化性减弱,体现递变性
■都能跟氢气反应,体现相似性
与H2反应条件 生成的氢化物的稳定性 单质的氧化性
F2 Cl2 Br2 I2
逐
渐
变
难
逐
渐
减
弱
逐
渐
减
弱
A、HX的稳定性:
B、HX的还原性:
C、HX的水溶液的酸性:
HF > HCl > HBr > HI
HF
(1)与H2反应
通式: X2 + H2 = 2HX(反应条件不同)
HF
2F2 + 2H2O = 4HF + O2 (剧烈反应)
逐渐困难
通式:X2 + H2O = HX + HXO (X=Cl、Br、I 但≠F)
I2 + H2O = HI + HIO
Br2 + H2O = HBr + HBrO
Cl2 + H2O = HCl + HClO
特别注意:F2不能从盐溶液中置换出其他卤素单质。
(3)卤素单质与碱的反应
X2 + 2NaOH== NaX+NaXO+H2O
(X=Cl、Br、I 但≠F )
2F2 + 4NaOH== 4NaF+O2+2H2O
(4)卤素单质与变价金属的反应
3 X2 + 2Fe == 2FeX3
△
△
I2 + Fe == FeI2
(X=F、Cl、Br 但≠I )
氧化性:F2 > Cl2 > Br2 >I2
(5)碘单质的化学特性 遇淀粉变蓝
如何设计实验证明Cl2的氧化性大于Br2?
实验 现象 化学方程式
1、将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡,静置。
2、将少量氯水加入盛有KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡,静置。
3、将少量溴水加入盛有KI溶液的试管中,用力振荡后加入少量四氯化碳,振荡,静置。
溶液分层,
下层橙红色
溶液分层,下层紫红色
2NaBr + Cl2 ==
2NaCl + Br2
2KI + Cl2 ==
2KCl + I2
2KI + Br2==
2KBr + I2
(7)卤素单质之间的置换反应
结论:单质氧化性:
离子还原性:
F2>Cl2>Br2>I2
F-
议一议1:什么是非金属性,可以用哪些方法判断非金属性强弱?
非金属性:是指在化学反应中原子得电子的能力。得电子能力越强的原子其非金属性就越强;反之亦反。
常见判断方法:
1. 与氢气反应难易程度,以及生成氢化物的稳定性。
2. 最高价氧化物对应水化物酸性强弱。
3. 通过非金属单质间的置换反应判断。
4. 同主族元素从上到下非金属性减弱。
议一议2:
1. 已知O、S、Se是VIA的元素,请问:
(1)H2O、H2S、H2Se的稳定性强弱?
(2)H2SO4与H2SeO4的酸性强弱?
2. 已知Cl2通入Na2S溶液中会有淡黄色沉淀生成,请写出相应离子方程式?请问Cl和S的非金属性强弱?HCl和H2S的稳定性?HClO4和H2SO4的酸性强弱?
整理笔记:卤素某些性质的排序
1、单质密度
2、单质熔沸点
3、单质氧化性
4、离子还原性
6、最高价氧化物的水化物的酸性
7、元素的非金属性
5、与氢气反应的难易程度
F2 < Cl2 < Br2<I2
F2 < Cl2 < Br2<I2
F > Cl > Br>I
F-< Cl- < Br-<I-
F2 > Cl2 > Br2 >I2
HClO4> HBrO4>HIO4
F2 > Cl2 > Br2 >I2
非金属性:是指在化学反应中原子得电子的能力。得电子能力越强的原子其非金属性就越强;反之亦反。
常见判断方法:
1. 与氢气反应难易程度,以及生成氢化物的稳定性。
2. 最高价氧化物对应水化物酸性强弱。
3. 通过非金属单质间的置换反应判断。
4. 同主族元素从上到下非金属性减弱。
