第九单元溶液练习题2023-2024学年人教版九年级化学下册(含解析)
文档属性
| 名称 | 第九单元溶液练习题2023-2024学年人教版九年级化学下册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 659.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-03 13:34:50 | ||
图片预览




文档简介
第九单元溶液 练习题
一、单选题
1.下列有关水的说法中,正确的是
A.水结成冰后,水分子间的间隔变大
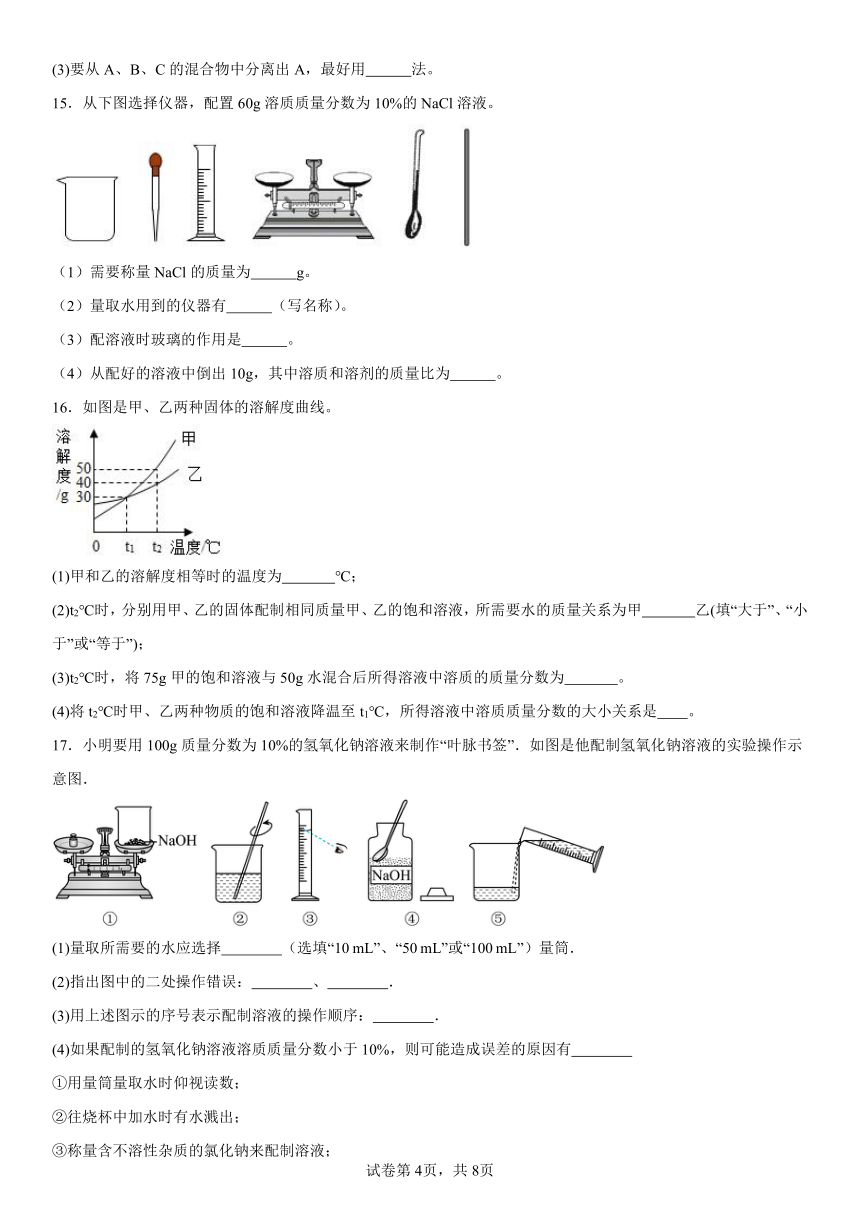
B.电解水时,正极会产生较多氢气
C.水中含有2个氢原子和1个氧原子
D.硝酸铵固体溶水时,溶液温度上升
2.对影响溶质在水中溶解速率的实验探究如图所示。下列说法正确的是
A.对比实验①和②,可探究搅拌对溶质在水中溶解速率的影响
B.对比实验②和③,可探究水的温度对溶质在水中溶解速率的影响
C.对比实验①和④,可探究固体溶质的颗粒大小对溶质在水中溶解速率的影响
D.对比实验③和④,可探究水的质量对溶质在水中溶解速率的影响
3.实验室配制50g溶质质量分数为6%的氯化钠溶液,下列做法正确的是
A.用托盘天平称取5g氯化钠
B.用50mL量筒量取所需水的体积
C.溶解氯化钠时,使用的玻璃仪器有量筒、玻璃棒
D.将配制好的溶液装入广口瓶中,塞好瓶塞并贴上标签
4.下列说法中正确的是
A.均一、稳定且无色的液体都是溶液
B.100g溶质质量分数为20%的溶液中,溶质和溶剂的质量比为1:5
C.同一溶质的饱和溶液一定比它的相同质量的不饱和溶液所含的溶质多
D.某一物质的稀溶液,也可能是该物质在某温度下的饱和溶液
5.KNO3在不同温度下的溶解度如下表所示。下列说法正确的是
温度/℃ 0 10 20 30 40
溶解度/g 13.3 20.9 31.6 45.8 63.9
A.20℃时,KNO3饱和溶液的溶质质量分数为31.6%
B.30℃100gKNO3溶液中溶质的质量比10℃100gKNO3溶液中溶质的质量大
C.将100g40℃时KNO3的饱和溶液降温至10℃时,有43gKNO3晶体析出
D.将 10℃时KNO3的饱和溶液升温至40℃时,KNO3溶液的溶质质量分数不变
6.学过溶液的概念之后,小明想在家用厨房里配制溶液,下列物质分别放入水中,充分搅拌,可形成溶液的是
A.面粉 B.豆油 C.大米 D.白糖
7.用硫酸铜粉末进行如图所示的实验,对所得溶液的分析正确的是
A.三杯溶液颜色一致 B.烧杯中溶液的溶质质量分数:①>②
C.③溶液是不饱和溶液 D.硫酸铜的溶解度随温度升高而增大
8.把少量下列物质分别放入水中,充分搅拌,不能得到溶液的是
A.白糖 B.食盐 C.花生油 D.葡萄糖
9.实验室用NaCl固体配制50g6%NaC1溶液。下列仪器一般不需要用到的是
A.烧杯 B.玻璃棒 C.酒精灯 D.托盘天平
10.下图是甲、乙两种固体物质在水中的溶解度曲线,下列说法不正确的是
A.10℃时,甲、乙两种物质的饱和溶液浓度相同
B.将10℃时的甲、乙两种饱和溶液分别升温至30℃,溶液中溶质的质量分数都增大
C.30℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为80g
D.保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液
11.化学能够帮助我们更好的认识世界,下列有关做法的解释不正确的是()
A.油锅着火时用锅盖盖灭——隔绝空气
B.氮气可做食品保护气——常温下氮气化学性质稳定
C.将铁制成不锈钢可防止锈蚀——改变内部结构
D.用洗涤剂清洗餐具上的油污——洗涤剂能溶解油污
12.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.t1℃时,甲、乙溶液的溶质质量分数相等
B.t2℃时,甲物质的溶解度是50
C.分离甲和乙组成的混合物,可采用降温结晶的方法
D.将t2℃时甲物质的溶液降低温度到t1℃时,一定有晶体析出
13.KNO3、NaNO3、NaCl 的溶解度曲线如图所示,下列说法错误的是
A.三种物质均为易溶物质
B.20℃时,100g NaCl 饱和溶液中含 36g NaCl
C.分别将 60℃的 KNO3、NaNO3、NaCl 饱和溶液降温至 0℃时,三种溶液仍为饱和溶液,且溶质质量分数为NaNO3>NaCl>KNO3
D.KNO3 中混有少量 NaCl 固体,可以用降温结晶的方法提纯 KNO3
二、填空题
14.下图分别表示A、B、C三种物质的溶解度曲线,试答:
(1)通过加溶质、蒸发溶剂、升高温度均可使接近饱和的溶液变为其饱和溶液的物质是 。
(2)等质量的三种饱和溶液从60℃降温至20℃时,其中析出晶体最多的是 。
(3)要从A、B、C的混合物中分离出A,最好用 法。
15.从下图选择仪器,配置60g溶质质量分数为10%的NaCl溶液。
(1)需要称量NaCl的质量为 g。
(2)量取水用到的仪器有 (写名称)。
(3)配溶液时玻璃的作用是 。
(4)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为 。
16.如图是甲、乙两种固体的溶解度曲线。
(1)甲和乙的溶解度相等时的温度为 ℃;
(2)t2℃时,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲 乙(填“大于”、“小于”或“等于”);
(3)t2℃时,将75g甲的饱和溶液与50g水混合后所得溶液中溶质的质量分数为 。
(4)将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数的大小关系是 。
17.小明要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”.如图是他配制氢氧化钠溶液的实验操作示意图.
(1)量取所需要的水应选择 (选填“10 mL”、“50 mL”或“100 mL”)量筒.
(2)指出图中的二处操作错误: 、 .
(3)用上述图示的序号表示配制溶液的操作顺序: .
(4)如果配制的氢氧化钠溶液溶质质量分数小于10%,则可能造成误差的原因有
①用量筒量取水时仰视读数;
②往烧杯中加水时有水溅出;
③称量含不溶性杂质的氯化钠来配制溶液;
④将配制好的溶液往试剂瓶中转移时有少量溅出.
18.如图是A、B、C三种固体物质(固体组成与溶质相同)的溶解度曲线。在t1℃时,将质量为ag的A、B、C三种物质分别加入100g水中,根据图示回答下列问题:
(1)三种物质中,随温度升高溶解度减小的物质是 ;
(2)t1℃时,所得三种物质的溶液中为不饱和溶液的是 ;
(3)若使这三种溶液溶质的质量分数相等,则温度应由t2℃升至 ℃;
(4)若将温度由t1℃至t4℃时,三种溶液中溶质质量分数的大小关系为 。
19.溶解是生活中常见的现象,不同物质在水中的溶解能力不同:下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)。
温度(℃) 0 20 40 60 80 100
KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)20℃时,将40gNaCl放入100g水中,所得溶液是 (填“饱和溶液”或“不饱和溶液”)。
(2)要配制60℃的100gKNO3的饱和溶液,请简要说明配制的步骤和操作 。
20.在“宝石节”期间,我们不仅可以看到丰富的文艺节目、绚烂的宝石,还可以品尝到国内外特色美食。
(1)梧州人爱吃的“酸嘢”可以开胃、助消化。制作“酸嘢”使用的醋酸CH3COOH中碳、氢、氧元素质量比是 。
(2)“宝石节”活动现场,人们闻到烤羊肉香飘四溢的原因是 。
(3)六堡茶展厅聚集了很多爱茶人士。茶叶中富含铁、锌、氟、硒等,这里铁、锌、氟、硒指的是 (“原子;分子;元素”)。
(4)炊具上的油污可用洗洁精清洗,这是利用了洗洁精的 作用。
三、科学探究题
21.某化学兴趣小组的同学为了测定某厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计如下两种实验方案:
(1)方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤、干燥得固体19.70g.通过计算(写出计算过程) 判断该厂的产品是否属于优等品.(杂质可溶于水且不与氯化钡反应)
(2)方案二:用如图所示的装置,通过准确测量排出水的体积,也可计算样品的纯度。该装置中仪使用注射器的优点是 ,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是 .(装置气密性良好)(写一条即可)。
22.我国高铁创造的中国速度令世界瞩目,某学习小组对高铁建设中的钢铁锈蚀进行探究。
【提出问题】铁锈蚀与哪些因素有关。
【查阅资料】碳粉可加快铁的锈蚀,碳粉不与盐酸反应;氧化铁能与盐酸反应,不产生气体。
【设计实验】
实验一:定性探究铁锈蚀的因素
取四枚大小相同的洁净无锈铁钉分别放入试管,进行图1实验,现象如下表。
试管编号 A B C D
一周后铁钉表面现象 有一层铁锈 无明显变化 无明显变化 有较厚铁锈
(1)对比A、B、C试管中实验现象,说明铁锈蚀是与空气中的 发生化学反应。
(2)得到无氧蒸馏水可采用煮沸的方法,是因为氧气在水中的溶解度随温度的升高而 (填“升高”或“降低”)。
(3)对比A和D试管中实验现象,说明铁锈蚀快慢与 有关;
(4)生活中铁制品易生锈而铝制品不易生锈的原因是 。
实验二:定量探究影响铁锈蚀的因素
小组设计了图2装置,检查气密性,将5g铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2mL饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上(此时没有推动注射器活塞),采集数据。
(5)据图3,说明铁生锈是 (填“放热”或“吸热”),t2~t3这段时间反应并未停止但温度却开始降低,原因是 。
(6)据图2图4分析t3时刻后压强突然变大,原因是 。
【反思评价】
(7)小丽同学猜测:铁锈蚀的快慢还可能与氧气的浓度有关,为判断该猜测是否正确,请你设计实验验证小丽同学的猜想,简述实验方案。(实验方案包括操作、现象和结论) 。
23.课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 实验现象 实验结论及解释
Ⅰ. A中无明显现象, B中产生大量能使带火星木条复燃的气体 产生的气体是 ② 红砖粉末能改变过氧化氢分解速率
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 ① 又产生大量能使带火星木条复燃的气体滤渣质量等于ag 红砖粉末的 和 在反应前后均没有发生变化,能作过氧化氢分解的催化剂
Ⅲ. 两试管中均产生气泡且 红砖粉末的催化效果没有二氧化锰粉末好
【拓展应用】已知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气 g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、水结成冰后体积变大,水分子间的间隔变大,故A说法正确,符合题意;
B、电解水时,正极会产生的气体较少是氧气.故B说法不正确,不符合题意;
C、每个水分子中含有2个氢原子和1个氧原子.故C说法不正确,不符合题意;
D、硝酸铵固体溶水时吸热,溶液温度降低.故D说法不正确,不符合题意。
故选A。
2.A
【详解】A、实验①和②中,其它因素相同,而不同的是搅拌,因此可以探究搅拌对溶质溶解速率的影响,故选项说法正确;
B、实验②和③,溶质的形状不同,水的温度也不同,因此无法比较水的质量对溶解速率的影响,故选项说法错误;
C、实验①和④,溶质的形状不同,水的体积也不同,因此无法比较水的质量对溶解速率的影响,故选项说法错误;
D、实验③和④,水的温度也不同,水的体积也不同,因此无法比较水的质量对溶解速率的影响,故选项说法错误。
故选A。
3.B
【详解】A、需要氯化钠的质量为:50g×6%=3g,所以应该用托盘天平称取3g氯化钠,故A错误;B、量筒使用的就近原则,需要水的质量为50g-3g=47g,合47mL,所以用50ml量筒量取所需水的体积,故B正确;C、溶解氯化钠时,使用的玻璃仪器有烧杯、玻璃棒,量筒中不能配制溶液,故C错误;D、液体应该装在细口瓶内,故D错误;故选B。
4.D
【详解】A、均一、稳定且无色的液体不都是溶液,比如水是均一、稳定且无色的液体,是纯净物,故不符合题意;
B、100g溶质质量分数为20%的溶液中,溶质和溶剂的质量比=(100g×20%):(100g-100g×20%)=1:4,故不符合题意;
C、相同质量的溶剂里,同一溶质的饱和溶液一定比它的相同质量的不饱和溶液所含的溶质多,故不符合题意;
D、某一物质的稀溶液,也可能是该物质在某温度下的饱和溶液,比如氢氧化钙溶液,故符合题意;
故选D。
5.D
【详解】A、根据表格数据可知20℃时,KNO3的溶解度为31.6g,则饱和溶液的溶质质量分数=,故选项说法错误;
B、选项未说明溶液的状态,则无法比较两种状态下溶质的质量,故选项说法错误;
C、40℃时KNO3的溶解度为63.9g,则100g40℃时KNO3的饱和溶液中溶质的质量为,则降温至10℃时,不会有43gKNO3晶体析出,故选项说法错误;
D、根据表格数据可知硝酸钾的溶解度随温度的升高而增大,则将 10℃时KNO3的饱和溶液升温至40℃时,溶液变为不饱和溶液,溶质与溶剂的质量都不变,KNO3溶液的溶质质量分数不变,故选项说法正确。
故选D。
6.D
【详解】溶液是均一、稳定、混合物,白糖能形成均一、稳定、混合物形成溶液,面粉、豆油、大米不能形成均一、稳定、混合物形成溶液,故选:D。
7.D
【详解】A、硫酸铜溶液颜色深浅与硫酸溶液的溶质质量分数成正比,烧杯①③中溶剂质量相同,溶质质量③>①,溶质质量分数③>①,即烧杯③中溶液颜色比烧杯①中溶液颜色深,选项错误,不符合题意;
B、由实验图示可知,烧杯①中①20℃时硫酸铜的饱和溶液,烧杯②中可能为20℃时硫酸铜的饱和溶液,也可能为20℃时硫酸铜的不饱和溶液,同种溶质和溶剂相同温度时,饱和溶液溶质质量分数大于不饱和溶液溶质质量分数,故溶质质量分数①≥②,选项错误,不符合题意;
C、由实验图示可知,烧杯③中溶液可能为50℃时硫酸铜的饱和溶液,也可能为50℃时硫酸铜的不饱和溶液,选项错误,不符合题意;
D、对比烧杯①③可知,在等量的溶剂中,50℃时溶解的硫酸铜质量大于20℃时溶解的硫酸铜质量,说明硫酸铜的溶解度随温度升高而增大,选项正确,符合题意;
故选D。
8.C
【详解】A.白糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项A不符合题意;
B.食盐溶于水,形成均一、稳定的混合物,属于溶液,故选项B不符合题意;
C.花生油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,属于乳浊液,故选项C符合题意;
D.葡萄糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项D不符合题意。
故选C。
9.C
【详解】用NaCl固体配制50g6%NaC1溶液,需要上述仪器中的烧杯、玻璃棒和托盘天平,该实验不需要加热,不需要酒精灯,故选C。
10.B
【详解】A、根据溶解度曲线,10℃时,甲、乙两种的溶解度相等,故甲、乙两种物质的饱和溶液浓度相同,正确;
B、根据溶解度曲线,甲、乙两物质的溶解度都随温度的升高而增大,故100C升温到300C,都由饱和溶液变为不饱和溶液,但溶液中的溶质、溶剂质量都不变,故溶质质量分数也不变,错误;
C、根据溶解度曲线,30℃时,甲的溶解度为60g,表示在100g水中最多只能溶解60g甲物质,故将40ga物质加入到50g水中并充分搅拌,只能溶解30g,故充分溶解后溶液的质量为80g,正确;
D,保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液,正确。
故选B。
11.D
【详解】A、油锅着火时用锅盖盖灭,隔绝了可燃物与空气中氧气的接触,火焰熄灭。正确。
B、常温下氮气化学性质稳定,无毒,所以可做食品保护气。正确。
C、将铁制成不锈钢,改变了内部结构,从而起到防止钢铁锈蚀的作用。正确。
D、洗涤剂具有乳化作用,能将油污分散成油污小液滴,形成乳浊液被水冲走,所以可用洗涤剂清洗餐具上的油污。错误。
故选D。
【点睛】
12.C
【详解】A、t1℃时,甲、乙的溶解度相等,所以甲、乙饱和溶液的溶质质量分数相等,故A说法错误;
B、 t2℃时,甲物质的溶解度是50g,溶解度的单位是g,故B说法错误;
C、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,分离甲和乙组成的混合物,可采用降温结晶的方法,故C说法正确;
D、由于不确定两种溶液是否饱和,所以将t2℃时甲物质的溶液降低温度到t1℃时,不能确定是否有晶体析出,故D说法错误;
故选C。
13.B
【详解】A、20℃时,它们的溶解度都大于10克,均为易溶物质,正确;
B、 20℃时,氯化钠的溶解度是36g,则在该温度下,100g水中最多能够溶解36g氯化钠形成136g饱和溶液,错误;
C、分别将 60℃的 三种物质饱和溶液降温至 0℃时,溶解度降低,三种溶液仍为饱和溶液,此时溶解度大小排序为NaNO3>NaCl>KNO3,正确;
D、硝酸钾中混有少量氯化钠 固体,降温后硝酸钾溶解度变小析出结晶,而氯化钠溶解度变化小,不析出,进而提纯硝酸钾。
故选B。
14.(1)C
(2)A
(3)降温结晶
【详解】(1)C的溶解度随温度升高而减小,而A、B溶解度随温度升高而增大,则只有C可通过升温的方法将接近饱和的溶液变为饱和溶液。
(2)由于降温过程中,A、B溶解度减小,且A的溶解度减小较大,则析出晶体最多的为A。
(3)A的溶解度随温度变化比较大,则可采用降温结晶的方法提纯A。
15. 6.0 量筒和胶头滴管 搅拌,加速溶解 1:9
【详解】(1)由题干可知,溶液质量为60g,溶质质量分数为10%,根据溶质质量分数为溶质质量与溶液质量之比可得,NaCl的质量=溶液质量X溶质质量分数,即NaCl的质量=60gX10%=6.0g,故填写:6.0g;
(2)量筒是用来量取液体体积的,胶头滴管可以在接近量取刻度时,用来滴加,故填写:量筒和胶头滴管;
(3)玻璃棒可以用来搅拌,而搅拌可以加速溶质的溶解速率,故填写:搅拌,加速溶解;
(4)从配好的溶液中倒出10g,根据溶液的均一性,溶质的质量分数不变,因此,10g溶液中NaCl的质量为10gX10%=1g,溶剂的质量为10g-1g=9g,溶质和溶剂的质量比为1g:9g=1:9,故填写:1:9。
16. t1 小于 20% 甲=乙
【详解】(1)溶解度曲线的交点表示该温度下两物质的溶解度相等,故甲和乙的溶解度相等时的温度为t1℃;
(2)t2℃时,甲的溶解度大于乙,则分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲小于乙;
(3)t2℃时,甲的溶解度为50g,则甲的饱和溶液的溶质质量分数为 ×100%,75g甲的饱和溶液的溶质质量为75g × ×100%=25g,将75g甲的饱和溶液与50g水混合后所得溶液中溶质的质量分数为 ×100%=20%;
(4)将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,甲、乙的溶解度都随温度降低而减小,且t1℃时甲、乙的溶解度相等,故所得溶液中溶质质量分数的大小关系是甲=乙。
【点睛】饱和溶液的溶质质量分数( )与溶解度( )的关系为: = ×100%。
17. 100mL 图①中氢氧化钠与砝码的位置颠倒 图③中仰视读数 ④①③⑤② ①③
【详解】(1)100g质量分数为10%的氢氧化钠溶液,需氢氧化钠的质量=100g×10%=10g;溶剂质量=溶液质量-溶质质量,则所需蒸馏水的质量=100g-10g=90g,水的密度为1g/cm3,则根据V=90cm3=90mL,应选用100mL的量筒;
(2)①托盘天平的使用要遵循“左物右码”的原则,图①中氢氧化钠与砝码的位置颠倒,操作错误;②量取液体时,视线与液体的凹液面最低处保持水平,图中仰视刻度,操作错误;
(3)配制溶质为固体的溶液操作顺序为计算、称量、溶解、装瓶存放。故顺序为④①③⑤②;
(4)
①用量筒量取水时仰视读数,会导致水的体积偏大,故溶液相当于被稀释,溶液溶质质量分数小于10%,正确;
②往烧杯中加水时有水溅出,所加入水的体积小于理论值,导致溶液溶质质量分数大于10%,错误;
③称量含不溶性杂质的氯化钠来配制溶液,实际氯化钠的质量会小于理论值,导致溶液溶质质量分数小于10%,正确;
④溶液是均一、稳定的混合物,故将配制好的溶液往试剂瓶中转移时有少量溅出,对溶液溶质质量分数没有影响,溶液溶质质量分数等于10%,错误;
故本题选①③。
18. C C t3 A=B>C
【详解】(1)从图中可以看出,三种物质中,随温度升高溶解度减小的物质C;
(2)从图中可以看出,在t1℃时,A、B的溶解度都小于ag,故A、B形成的是饱和溶液,而C的溶解度大于ag,故C形成的是不饱和溶液;
(3)从图中可以看出,在t3℃时三种物质的溶解度都是ag,故若使这三种溶液溶质的质量分数相等,则温度应由t1℃升到t3℃;
(4)从图中可以看出,在t4℃时,C的溶解度小于ag,则C中的溶质不能完全溶解;A、B的溶解度都大于ag,则A、B中的溶质都能溶解;故若将温度由t1℃升至t4℃时,三种溶液中溶质质量分数的大小关系A=B>C;
19. 饱和溶液 先计算出配制硝酸钾溶液所需硝酸钾的质量为52.4g,水的质量为47.6g,用托盘天平称量52.4g的硝酸钾,倒入烧杯中,然后量取47.6mL的水,加热至60℃,倒入烧杯中,用玻璃棒搅拌,即可得到60℃的100gKNO3的饱和溶液。
【详解】(1)20℃时,NaCl的溶解度是36.0g,即20℃时,100g水中最多能溶解36.0gNaCl,将40gNaCl放入100g水中,所得溶液是饱和溶液。
(2)首先计算出需要硝酸钾、水的质量,60℃时,硝酸钾的溶解度是110g,设需要硝酸钾的质量是x,则=,解得x=52.4g,则水的质量是100g-52.4g=47.6g,用托盘天平称量52.4g的硝酸钾,倒入烧杯中,量取47.6mL的水,加热至60℃,然后倒入烧杯中,用玻璃棒搅拌,即可得到60℃的100gKNO3饱和溶液。
20.(1)6:1:8
(2)分子在不断运
(3)元素
(4)乳化
【详解】(1)醋酸中碳、氢、氧元素质量比是(12×2):(1×4):(16×2)=6:1:8。
(2)闻到气味是因为分子在不断运动,带有气味的分子运动到人的鼻子使人闻到气味。
(3)物质有元素组成,这里铁、锌、氟、硒指的是元素。不是指具体的存在形式。
(4)炊具上的油污可用洗洁精清洗,这是利用了洗洁精的乳化作用。通过乳化作用将油污分散成小油滴,形成乳浊液而去污。
21. 99.5% 可控制反应速率 CO2部分溶于水
【详解】(1)方案一:设产生19.7g碳酸钡沉淀需要碳酸钠的质量为 x
所以样品中Na2CO3质量分数为: ×100%=99.5%>99.2%,因此属于优等品;
(2)方案二:装置中使用注射器加入稀硫酸的好处是:可控制反应速率,实验中由于二氧化碳能够溶于水且能够和水,会导致收集的二氧化碳偏少,也可能导管中存留一部分水产生误差。
22.(1)氧气、水蒸气
(2)降低
(3)氯化钠
(4)在常温下,铝能与空气中的氧气反应生成一层致密的氧化铝薄膜
(5) 放热 生锈放热量小于热量散失
(6)铁生锈消耗氧气,装置中的压强变小,则将注射器中的盐酸吸入,盐酸与铁反应生成氢气
(7)分别将铁放入不同浓度的氧气的试管中,并且试管中有等量的水,若观察到氧气浓度较高的试管中铁生锈严重,则说明氧气浓度越高,铁生锈越快
【详解】(1)由图1和表格可知,A中铁钉与空气中的氧气和水接触,有一层铁锈,B中铁钉只与蒸馏水接触,没有与空气中的氧气接触,无明显变化,C中铁钉只与空气中的氧气接触,没有与蒸馏水接触,无明显变化,对比A、B、C试管中实验现象,可以得出,铁锈蚀是与空气中的氧气、水蒸气发生了化学变化,故填写:氧气、水蒸气。
(2)根据气体的溶解度与温度的关系:一定压强下,气体的溶解度随温度的升高而降低可知,得到无氧蒸馏水可采用煮沸的方法,是因为氧气在水中的溶解度随温度的升高而降低,故填写:降低。
(3)根据控制变量法可知,A和D两试管中气体条件相同,但A中是无氧蒸馏水,D中是无氧蒸馏水配成的氯化钠饱和溶液,一周后铁钉表面,A中有一层铁锈,D中有较厚铁锈,因此,实验现象,说明铁锈蚀快慢与氯化钠有关,故填写:氯化钠。
(4)生活中铁制品易生锈而铝制品不易生锈的原因是:在常温下,铝能与空气中的氧气反应生成一层致密的氧化铝薄膜,故填写:在常温下,铝能与空气中的氧气反应生成一层致密的氧化铝薄膜。
(5)根据图3可知,t1~t2和t3~t4两阶段,随着时间的增加,温度在不断升高,说明铁生锈是放热过程,故填写:放热;
铁生锈是缓慢氧化,释放热量,t2~t3这段时间反应并未停止但生锈速度减慢,因此放出热量少,装置散失热量快,导致温度开始下降,故填写:生锈放热量小于热量散失。
(6)t3时刻后压强突然变大,原因是:铁生锈消耗氧气,装置中的压强变小,则将注射器中的盐酸吸入,盐酸与铁反应生成氢气,故填写:铁生锈消耗氧气,装置中的压强变小,则将注射器中的盐酸吸入,盐酸与铁反应生成氢气。
(7)小丽同学猜想:铁锈蚀的快慢还可能与氧气的浓度有关,而铁生锈与氧气和水有关,只要利用控制变量法,控制容器中水的量不变,改变氧气的浓度,通过观察铁生锈的程度就可以得出结论,因此,实验方案的步骤是:分别将铁放入不同浓度的氧气的试管中,并且试管中有等量的水,实验现象是:观察到氧气浓度较高的试管中铁生锈严重,实验结论:说明氧气浓度越高,铁生锈越快,故填写:分别将铁放入不同浓度的氧气的试管中,并且试管中有等量的水,若观察到氧气浓度较高的试管中铁生锈严重,则说明氧气浓度越高,铁生锈越快。
23. 氧气/O2 质量/化学性质 化学性质/质量 C中产生气泡的速率比D慢 3.2
【详解】实验探究:Ⅰ、从B中产生大量能使带火星木条复燃的气体,可知产生的气体是氧气;
Ⅱ、向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣, 又产生大量能使带火星木条复燃的气体,说明化学反应前后,红砖粉末的化学性质不变,滤渣质量等于ag,说明化学反应前后,红砖粉末的质量不变,红砖粉末能重复使用且在反应前后质量和化学性质均没有发生变化可知,红砖粉末能作过氧化氢分解的催化剂;
Ⅲ、结论为:红砖粉末的催化效果没有二氧化锰粉末好,说明现象为:C中产生气泡的速率比D慢;
拓展应用:反应充分后得到溶质质量分数为2%的硫酸铜溶液,则溶剂质量分数为98%,该溶液溶剂为水,即,,解得,过氧化氢分解为水和氧气,根据质量守恒定律,反应后减少的质量即为生成氧气的质量,即生成氧气的质量为:101.2g-98g=3.2g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列有关水的说法中,正确的是
A.水结成冰后,水分子间的间隔变大
B.电解水时,正极会产生较多氢气
C.水中含有2个氢原子和1个氧原子
D.硝酸铵固体溶水时,溶液温度上升
2.对影响溶质在水中溶解速率的实验探究如图所示。下列说法正确的是
A.对比实验①和②,可探究搅拌对溶质在水中溶解速率的影响
B.对比实验②和③,可探究水的温度对溶质在水中溶解速率的影响
C.对比实验①和④,可探究固体溶质的颗粒大小对溶质在水中溶解速率的影响
D.对比实验③和④,可探究水的质量对溶质在水中溶解速率的影响
3.实验室配制50g溶质质量分数为6%的氯化钠溶液,下列做法正确的是
A.用托盘天平称取5g氯化钠
B.用50mL量筒量取所需水的体积
C.溶解氯化钠时,使用的玻璃仪器有量筒、玻璃棒
D.将配制好的溶液装入广口瓶中,塞好瓶塞并贴上标签
4.下列说法中正确的是
A.均一、稳定且无色的液体都是溶液
B.100g溶质质量分数为20%的溶液中,溶质和溶剂的质量比为1:5
C.同一溶质的饱和溶液一定比它的相同质量的不饱和溶液所含的溶质多
D.某一物质的稀溶液,也可能是该物质在某温度下的饱和溶液
5.KNO3在不同温度下的溶解度如下表所示。下列说法正确的是
温度/℃ 0 10 20 30 40
溶解度/g 13.3 20.9 31.6 45.8 63.9
A.20℃时,KNO3饱和溶液的溶质质量分数为31.6%
B.30℃100gKNO3溶液中溶质的质量比10℃100gKNO3溶液中溶质的质量大
C.将100g40℃时KNO3的饱和溶液降温至10℃时,有43gKNO3晶体析出
D.将 10℃时KNO3的饱和溶液升温至40℃时,KNO3溶液的溶质质量分数不变
6.学过溶液的概念之后,小明想在家用厨房里配制溶液,下列物质分别放入水中,充分搅拌,可形成溶液的是
A.面粉 B.豆油 C.大米 D.白糖
7.用硫酸铜粉末进行如图所示的实验,对所得溶液的分析正确的是
A.三杯溶液颜色一致 B.烧杯中溶液的溶质质量分数:①>②
C.③溶液是不饱和溶液 D.硫酸铜的溶解度随温度升高而增大
8.把少量下列物质分别放入水中,充分搅拌,不能得到溶液的是
A.白糖 B.食盐 C.花生油 D.葡萄糖
9.实验室用NaCl固体配制50g6%NaC1溶液。下列仪器一般不需要用到的是
A.烧杯 B.玻璃棒 C.酒精灯 D.托盘天平
10.下图是甲、乙两种固体物质在水中的溶解度曲线,下列说法不正确的是
A.10℃时,甲、乙两种物质的饱和溶液浓度相同
B.将10℃时的甲、乙两种饱和溶液分别升温至30℃,溶液中溶质的质量分数都增大
C.30℃时,将40g甲物质加入50g水中,充分溶解后溶液的质量为80g
D.保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液
11.化学能够帮助我们更好的认识世界,下列有关做法的解释不正确的是()
A.油锅着火时用锅盖盖灭——隔绝空气
B.氮气可做食品保护气——常温下氮气化学性质稳定
C.将铁制成不锈钢可防止锈蚀——改变内部结构
D.用洗涤剂清洗餐具上的油污——洗涤剂能溶解油污
12.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.t1℃时,甲、乙溶液的溶质质量分数相等
B.t2℃时,甲物质的溶解度是50
C.分离甲和乙组成的混合物,可采用降温结晶的方法
D.将t2℃时甲物质的溶液降低温度到t1℃时,一定有晶体析出
13.KNO3、NaNO3、NaCl 的溶解度曲线如图所示,下列说法错误的是
A.三种物质均为易溶物质
B.20℃时,100g NaCl 饱和溶液中含 36g NaCl
C.分别将 60℃的 KNO3、NaNO3、NaCl 饱和溶液降温至 0℃时,三种溶液仍为饱和溶液,且溶质质量分数为NaNO3>NaCl>KNO3
D.KNO3 中混有少量 NaCl 固体,可以用降温结晶的方法提纯 KNO3
二、填空题
14.下图分别表示A、B、C三种物质的溶解度曲线,试答:
(1)通过加溶质、蒸发溶剂、升高温度均可使接近饱和的溶液变为其饱和溶液的物质是 。
(2)等质量的三种饱和溶液从60℃降温至20℃时,其中析出晶体最多的是 。
(3)要从A、B、C的混合物中分离出A,最好用 法。
15.从下图选择仪器,配置60g溶质质量分数为10%的NaCl溶液。
(1)需要称量NaCl的质量为 g。
(2)量取水用到的仪器有 (写名称)。
(3)配溶液时玻璃的作用是 。
(4)从配好的溶液中倒出10g,其中溶质和溶剂的质量比为 。
16.如图是甲、乙两种固体的溶解度曲线。
(1)甲和乙的溶解度相等时的温度为 ℃;
(2)t2℃时,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲 乙(填“大于”、“小于”或“等于”);
(3)t2℃时,将75g甲的饱和溶液与50g水混合后所得溶液中溶质的质量分数为 。
(4)将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质质量分数的大小关系是 。
17.小明要用100g质量分数为10%的氢氧化钠溶液来制作“叶脉书签”.如图是他配制氢氧化钠溶液的实验操作示意图.
(1)量取所需要的水应选择 (选填“10 mL”、“50 mL”或“100 mL”)量筒.
(2)指出图中的二处操作错误: 、 .
(3)用上述图示的序号表示配制溶液的操作顺序: .
(4)如果配制的氢氧化钠溶液溶质质量分数小于10%,则可能造成误差的原因有
①用量筒量取水时仰视读数;
②往烧杯中加水时有水溅出;
③称量含不溶性杂质的氯化钠来配制溶液;
④将配制好的溶液往试剂瓶中转移时有少量溅出.
18.如图是A、B、C三种固体物质(固体组成与溶质相同)的溶解度曲线。在t1℃时,将质量为ag的A、B、C三种物质分别加入100g水中,根据图示回答下列问题:
(1)三种物质中,随温度升高溶解度减小的物质是 ;
(2)t1℃时,所得三种物质的溶液中为不饱和溶液的是 ;
(3)若使这三种溶液溶质的质量分数相等,则温度应由t2℃升至 ℃;
(4)若将温度由t1℃至t4℃时,三种溶液中溶质质量分数的大小关系为 。
19.溶解是生活中常见的现象,不同物质在水中的溶解能力不同:下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)。
温度(℃) 0 20 40 60 80 100
KNO3 13.3 31.6 63.9 110 169 246
NaCl 35.7 36.0 36.6 37.3 38.4 39.8
(1)20℃时,将40gNaCl放入100g水中,所得溶液是 (填“饱和溶液”或“不饱和溶液”)。
(2)要配制60℃的100gKNO3的饱和溶液,请简要说明配制的步骤和操作 。
20.在“宝石节”期间,我们不仅可以看到丰富的文艺节目、绚烂的宝石,还可以品尝到国内外特色美食。
(1)梧州人爱吃的“酸嘢”可以开胃、助消化。制作“酸嘢”使用的醋酸CH3COOH中碳、氢、氧元素质量比是 。
(2)“宝石节”活动现场,人们闻到烤羊肉香飘四溢的原因是 。
(3)六堡茶展厅聚集了很多爱茶人士。茶叶中富含铁、锌、氟、硒等,这里铁、锌、氟、硒指的是 (“原子;分子;元素”)。
(4)炊具上的油污可用洗洁精清洗,这是利用了洗洁精的 作用。
三、科学探究题
21.某化学兴趣小组的同学为了测定某厂生产的纯碱是否属于优等品(国家规定:优等品中碳酸钠的质量分数不低于99.2%),设计如下两种实验方案:
(1)方案一:称取样品10.65g,加水完全溶解,向其中加入足量的氯化钡溶液,充分反应后,过滤、洗涤、干燥得固体19.70g.通过计算(写出计算过程) 判断该厂的产品是否属于优等品.(杂质可溶于水且不与氯化钡反应)
(2)方案二:用如图所示的装置,通过准确测量排出水的体积,也可计算样品的纯度。该装置中仪使用注射器的优点是 ,但实验后同学们发现所测的碳酸钠的纯度偏低,造成此结果的原因可能是 .(装置气密性良好)(写一条即可)。
22.我国高铁创造的中国速度令世界瞩目,某学习小组对高铁建设中的钢铁锈蚀进行探究。
【提出问题】铁锈蚀与哪些因素有关。
【查阅资料】碳粉可加快铁的锈蚀,碳粉不与盐酸反应;氧化铁能与盐酸反应,不产生气体。
【设计实验】
实验一:定性探究铁锈蚀的因素
取四枚大小相同的洁净无锈铁钉分别放入试管,进行图1实验,现象如下表。
试管编号 A B C D
一周后铁钉表面现象 有一层铁锈 无明显变化 无明显变化 有较厚铁锈
(1)对比A、B、C试管中实验现象,说明铁锈蚀是与空气中的 发生化学反应。
(2)得到无氧蒸馏水可采用煮沸的方法,是因为氧气在水中的溶解度随温度的升高而 (填“升高”或“降低”)。
(3)对比A和D试管中实验现象,说明铁锈蚀快慢与 有关;
(4)生活中铁制品易生锈而铝制品不易生锈的原因是 。
实验二:定量探究影响铁锈蚀的因素
小组设计了图2装置,检查气密性,将5g铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2mL饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上(此时没有推动注射器活塞),采集数据。
(5)据图3,说明铁生锈是 (填“放热”或“吸热”),t2~t3这段时间反应并未停止但温度却开始降低,原因是 。
(6)据图2图4分析t3时刻后压强突然变大,原因是 。
【反思评价】
(7)小丽同学猜测:铁锈蚀的快慢还可能与氧气的浓度有关,为判断该猜测是否正确,请你设计实验验证小丽同学的猜想,简述实验方案。(实验方案包括操作、现象和结论) 。
23.课本第二单元课后作业中有“寻找新的催化剂” 的探究内容,实验中学探究小组据此设计了如下探究方案。
【提出问题】红砖粉末能否作为过氧化氢溶液分解的催化剂?如果能,效果如何?
【实验探究】
实验步骤 实验现象 实验结论及解释
Ⅰ. A中无明显现象, B中产生大量能使带火星木条复燃的气体 产生的气体是 ② 红砖粉末能改变过氧化氢分解速率
Ⅱ. 向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣 ① 又产生大量能使带火星木条复燃的气体滤渣质量等于ag 红砖粉末的 和 在反应前后均没有发生变化,能作过氧化氢分解的催化剂
Ⅲ. 两试管中均产生气泡且 红砖粉末的催化效果没有二氧化锰粉末好
【拓展应用】已知CuSO4也可作为过氧化氢分解的催化剂。向101.2g一定溶质质量分数的过氧化氢溶液中加入2g CuSO4粉末,充分反应后得到溶质质量分数为2%的溶液,则生成氧气 g。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、水结成冰后体积变大,水分子间的间隔变大,故A说法正确,符合题意;
B、电解水时,正极会产生的气体较少是氧气.故B说法不正确,不符合题意;
C、每个水分子中含有2个氢原子和1个氧原子.故C说法不正确,不符合题意;
D、硝酸铵固体溶水时吸热,溶液温度降低.故D说法不正确,不符合题意。
故选A。
2.A
【详解】A、实验①和②中,其它因素相同,而不同的是搅拌,因此可以探究搅拌对溶质溶解速率的影响,故选项说法正确;
B、实验②和③,溶质的形状不同,水的温度也不同,因此无法比较水的质量对溶解速率的影响,故选项说法错误;
C、实验①和④,溶质的形状不同,水的体积也不同,因此无法比较水的质量对溶解速率的影响,故选项说法错误;
D、实验③和④,水的温度也不同,水的体积也不同,因此无法比较水的质量对溶解速率的影响,故选项说法错误。
故选A。
3.B
【详解】A、需要氯化钠的质量为:50g×6%=3g,所以应该用托盘天平称取3g氯化钠,故A错误;B、量筒使用的就近原则,需要水的质量为50g-3g=47g,合47mL,所以用50ml量筒量取所需水的体积,故B正确;C、溶解氯化钠时,使用的玻璃仪器有烧杯、玻璃棒,量筒中不能配制溶液,故C错误;D、液体应该装在细口瓶内,故D错误;故选B。
4.D
【详解】A、均一、稳定且无色的液体不都是溶液,比如水是均一、稳定且无色的液体,是纯净物,故不符合题意;
B、100g溶质质量分数为20%的溶液中,溶质和溶剂的质量比=(100g×20%):(100g-100g×20%)=1:4,故不符合题意;
C、相同质量的溶剂里,同一溶质的饱和溶液一定比它的相同质量的不饱和溶液所含的溶质多,故不符合题意;
D、某一物质的稀溶液,也可能是该物质在某温度下的饱和溶液,比如氢氧化钙溶液,故符合题意;
故选D。
5.D
【详解】A、根据表格数据可知20℃时,KNO3的溶解度为31.6g,则饱和溶液的溶质质量分数=,故选项说法错误;
B、选项未说明溶液的状态,则无法比较两种状态下溶质的质量,故选项说法错误;
C、40℃时KNO3的溶解度为63.9g,则100g40℃时KNO3的饱和溶液中溶质的质量为,则降温至10℃时,不会有43gKNO3晶体析出,故选项说法错误;
D、根据表格数据可知硝酸钾的溶解度随温度的升高而增大,则将 10℃时KNO3的饱和溶液升温至40℃时,溶液变为不饱和溶液,溶质与溶剂的质量都不变,KNO3溶液的溶质质量分数不变,故选项说法正确。
故选D。
6.D
【详解】溶液是均一、稳定、混合物,白糖能形成均一、稳定、混合物形成溶液,面粉、豆油、大米不能形成均一、稳定、混合物形成溶液,故选:D。
7.D
【详解】A、硫酸铜溶液颜色深浅与硫酸溶液的溶质质量分数成正比,烧杯①③中溶剂质量相同,溶质质量③>①,溶质质量分数③>①,即烧杯③中溶液颜色比烧杯①中溶液颜色深,选项错误,不符合题意;
B、由实验图示可知,烧杯①中①20℃时硫酸铜的饱和溶液,烧杯②中可能为20℃时硫酸铜的饱和溶液,也可能为20℃时硫酸铜的不饱和溶液,同种溶质和溶剂相同温度时,饱和溶液溶质质量分数大于不饱和溶液溶质质量分数,故溶质质量分数①≥②,选项错误,不符合题意;
C、由实验图示可知,烧杯③中溶液可能为50℃时硫酸铜的饱和溶液,也可能为50℃时硫酸铜的不饱和溶液,选项错误,不符合题意;
D、对比烧杯①③可知,在等量的溶剂中,50℃时溶解的硫酸铜质量大于20℃时溶解的硫酸铜质量,说明硫酸铜的溶解度随温度升高而增大,选项正确,符合题意;
故选D。
8.C
【详解】A.白糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项A不符合题意;
B.食盐溶于水,形成均一、稳定的混合物,属于溶液,故选项B不符合题意;
C.花生油不溶于水,不能和水形成均一、稳定的混合物,即不能够形成溶液,属于乳浊液,故选项C符合题意;
D.葡萄糖易溶于水,形成均一、稳定的混合物,属于溶液,故选项D不符合题意。
故选C。
9.C
【详解】用NaCl固体配制50g6%NaC1溶液,需要上述仪器中的烧杯、玻璃棒和托盘天平,该实验不需要加热,不需要酒精灯,故选C。
10.B
【详解】A、根据溶解度曲线,10℃时,甲、乙两种的溶解度相等,故甲、乙两种物质的饱和溶液浓度相同,正确;
B、根据溶解度曲线,甲、乙两物质的溶解度都随温度的升高而增大,故100C升温到300C,都由饱和溶液变为不饱和溶液,但溶液中的溶质、溶剂质量都不变,故溶质质量分数也不变,错误;
C、根据溶解度曲线,30℃时,甲的溶解度为60g,表示在100g水中最多只能溶解60g甲物质,故将40ga物质加入到50g水中并充分搅拌,只能溶解30g,故充分溶解后溶液的质量为80g,正确;
D,保持20℃,蒸发溶剂可使接近饱和的乙溶液变成饱和溶液,正确。
故选B。
11.D
【详解】A、油锅着火时用锅盖盖灭,隔绝了可燃物与空气中氧气的接触,火焰熄灭。正确。
B、常温下氮气化学性质稳定,无毒,所以可做食品保护气。正确。
C、将铁制成不锈钢,改变了内部结构,从而起到防止钢铁锈蚀的作用。正确。
D、洗涤剂具有乳化作用,能将油污分散成油污小液滴,形成乳浊液被水冲走,所以可用洗涤剂清洗餐具上的油污。错误。
故选D。
【点睛】
12.C
【详解】A、t1℃时,甲、乙的溶解度相等,所以甲、乙饱和溶液的溶质质量分数相等,故A说法错误;
B、 t2℃时,甲物质的溶解度是50g,溶解度的单位是g,故B说法错误;
C、甲的溶解度受温度影响较大,乙的溶解度受温度影响较小,分离甲和乙组成的混合物,可采用降温结晶的方法,故C说法正确;
D、由于不确定两种溶液是否饱和,所以将t2℃时甲物质的溶液降低温度到t1℃时,不能确定是否有晶体析出,故D说法错误;
故选C。
13.B
【详解】A、20℃时,它们的溶解度都大于10克,均为易溶物质,正确;
B、 20℃时,氯化钠的溶解度是36g,则在该温度下,100g水中最多能够溶解36g氯化钠形成136g饱和溶液,错误;
C、分别将 60℃的 三种物质饱和溶液降温至 0℃时,溶解度降低,三种溶液仍为饱和溶液,此时溶解度大小排序为NaNO3>NaCl>KNO3,正确;
D、硝酸钾中混有少量氯化钠 固体,降温后硝酸钾溶解度变小析出结晶,而氯化钠溶解度变化小,不析出,进而提纯硝酸钾。
故选B。
14.(1)C
(2)A
(3)降温结晶
【详解】(1)C的溶解度随温度升高而减小,而A、B溶解度随温度升高而增大,则只有C可通过升温的方法将接近饱和的溶液变为饱和溶液。
(2)由于降温过程中,A、B溶解度减小,且A的溶解度减小较大,则析出晶体最多的为A。
(3)A的溶解度随温度变化比较大,则可采用降温结晶的方法提纯A。
15. 6.0 量筒和胶头滴管 搅拌,加速溶解 1:9
【详解】(1)由题干可知,溶液质量为60g,溶质质量分数为10%,根据溶质质量分数为溶质质量与溶液质量之比可得,NaCl的质量=溶液质量X溶质质量分数,即NaCl的质量=60gX10%=6.0g,故填写:6.0g;
(2)量筒是用来量取液体体积的,胶头滴管可以在接近量取刻度时,用来滴加,故填写:量筒和胶头滴管;
(3)玻璃棒可以用来搅拌,而搅拌可以加速溶质的溶解速率,故填写:搅拌,加速溶解;
(4)从配好的溶液中倒出10g,根据溶液的均一性,溶质的质量分数不变,因此,10g溶液中NaCl的质量为10gX10%=1g,溶剂的质量为10g-1g=9g,溶质和溶剂的质量比为1g:9g=1:9,故填写:1:9。
16. t1 小于 20% 甲=乙
【详解】(1)溶解度曲线的交点表示该温度下两物质的溶解度相等,故甲和乙的溶解度相等时的温度为t1℃;
(2)t2℃时,甲的溶解度大于乙,则分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲小于乙;
(3)t2℃时,甲的溶解度为50g,则甲的饱和溶液的溶质质量分数为 ×100%,75g甲的饱和溶液的溶质质量为75g × ×100%=25g,将75g甲的饱和溶液与50g水混合后所得溶液中溶质的质量分数为 ×100%=20%;
(4)将t2℃时甲、乙两种物质的饱和溶液降温至t1℃,甲、乙的溶解度都随温度降低而减小,且t1℃时甲、乙的溶解度相等,故所得溶液中溶质质量分数的大小关系是甲=乙。
【点睛】饱和溶液的溶质质量分数( )与溶解度( )的关系为: = ×100%。
17. 100mL 图①中氢氧化钠与砝码的位置颠倒 图③中仰视读数 ④①③⑤② ①③
【详解】(1)100g质量分数为10%的氢氧化钠溶液,需氢氧化钠的质量=100g×10%=10g;溶剂质量=溶液质量-溶质质量,则所需蒸馏水的质量=100g-10g=90g,水的密度为1g/cm3,则根据V=90cm3=90mL,应选用100mL的量筒;
(2)①托盘天平的使用要遵循“左物右码”的原则,图①中氢氧化钠与砝码的位置颠倒,操作错误;②量取液体时,视线与液体的凹液面最低处保持水平,图中仰视刻度,操作错误;
(3)配制溶质为固体的溶液操作顺序为计算、称量、溶解、装瓶存放。故顺序为④①③⑤②;
(4)
①用量筒量取水时仰视读数,会导致水的体积偏大,故溶液相当于被稀释,溶液溶质质量分数小于10%,正确;
②往烧杯中加水时有水溅出,所加入水的体积小于理论值,导致溶液溶质质量分数大于10%,错误;
③称量含不溶性杂质的氯化钠来配制溶液,实际氯化钠的质量会小于理论值,导致溶液溶质质量分数小于10%,正确;
④溶液是均一、稳定的混合物,故将配制好的溶液往试剂瓶中转移时有少量溅出,对溶液溶质质量分数没有影响,溶液溶质质量分数等于10%,错误;
故本题选①③。
18. C C t3 A=B>C
【详解】(1)从图中可以看出,三种物质中,随温度升高溶解度减小的物质C;
(2)从图中可以看出,在t1℃时,A、B的溶解度都小于ag,故A、B形成的是饱和溶液,而C的溶解度大于ag,故C形成的是不饱和溶液;
(3)从图中可以看出,在t3℃时三种物质的溶解度都是ag,故若使这三种溶液溶质的质量分数相等,则温度应由t1℃升到t3℃;
(4)从图中可以看出,在t4℃时,C的溶解度小于ag,则C中的溶质不能完全溶解;A、B的溶解度都大于ag,则A、B中的溶质都能溶解;故若将温度由t1℃升至t4℃时,三种溶液中溶质质量分数的大小关系A=B>C;
19. 饱和溶液 先计算出配制硝酸钾溶液所需硝酸钾的质量为52.4g,水的质量为47.6g,用托盘天平称量52.4g的硝酸钾,倒入烧杯中,然后量取47.6mL的水,加热至60℃,倒入烧杯中,用玻璃棒搅拌,即可得到60℃的100gKNO3的饱和溶液。
【详解】(1)20℃时,NaCl的溶解度是36.0g,即20℃时,100g水中最多能溶解36.0gNaCl,将40gNaCl放入100g水中,所得溶液是饱和溶液。
(2)首先计算出需要硝酸钾、水的质量,60℃时,硝酸钾的溶解度是110g,设需要硝酸钾的质量是x,则=,解得x=52.4g,则水的质量是100g-52.4g=47.6g,用托盘天平称量52.4g的硝酸钾,倒入烧杯中,量取47.6mL的水,加热至60℃,然后倒入烧杯中,用玻璃棒搅拌,即可得到60℃的100gKNO3饱和溶液。
20.(1)6:1:8
(2)分子在不断运
(3)元素
(4)乳化
【详解】(1)醋酸中碳、氢、氧元素质量比是(12×2):(1×4):(16×2)=6:1:8。
(2)闻到气味是因为分子在不断运动,带有气味的分子运动到人的鼻子使人闻到气味。
(3)物质有元素组成,这里铁、锌、氟、硒指的是元素。不是指具体的存在形式。
(4)炊具上的油污可用洗洁精清洗,这是利用了洗洁精的乳化作用。通过乳化作用将油污分散成小油滴,形成乳浊液而去污。
21. 99.5% 可控制反应速率 CO2部分溶于水
【详解】(1)方案一:设产生19.7g碳酸钡沉淀需要碳酸钠的质量为 x
所以样品中Na2CO3质量分数为: ×100%=99.5%>99.2%,因此属于优等品;
(2)方案二:装置中使用注射器加入稀硫酸的好处是:可控制反应速率,实验中由于二氧化碳能够溶于水且能够和水,会导致收集的二氧化碳偏少,也可能导管中存留一部分水产生误差。
22.(1)氧气、水蒸气
(2)降低
(3)氯化钠
(4)在常温下,铝能与空气中的氧气反应生成一层致密的氧化铝薄膜
(5) 放热 生锈放热量小于热量散失
(6)铁生锈消耗氧气,装置中的压强变小,则将注射器中的盐酸吸入,盐酸与铁反应生成氢气
(7)分别将铁放入不同浓度的氧气的试管中,并且试管中有等量的水,若观察到氧气浓度较高的试管中铁生锈严重,则说明氧气浓度越高,铁生锈越快
【详解】(1)由图1和表格可知,A中铁钉与空气中的氧气和水接触,有一层铁锈,B中铁钉只与蒸馏水接触,没有与空气中的氧气接触,无明显变化,C中铁钉只与空气中的氧气接触,没有与蒸馏水接触,无明显变化,对比A、B、C试管中实验现象,可以得出,铁锈蚀是与空气中的氧气、水蒸气发生了化学变化,故填写:氧气、水蒸气。
(2)根据气体的溶解度与温度的关系:一定压强下,气体的溶解度随温度的升高而降低可知,得到无氧蒸馏水可采用煮沸的方法,是因为氧气在水中的溶解度随温度的升高而降低,故填写:降低。
(3)根据控制变量法可知,A和D两试管中气体条件相同,但A中是无氧蒸馏水,D中是无氧蒸馏水配成的氯化钠饱和溶液,一周后铁钉表面,A中有一层铁锈,D中有较厚铁锈,因此,实验现象,说明铁锈蚀快慢与氯化钠有关,故填写:氯化钠。
(4)生活中铁制品易生锈而铝制品不易生锈的原因是:在常温下,铝能与空气中的氧气反应生成一层致密的氧化铝薄膜,故填写:在常温下,铝能与空气中的氧气反应生成一层致密的氧化铝薄膜。
(5)根据图3可知,t1~t2和t3~t4两阶段,随着时间的增加,温度在不断升高,说明铁生锈是放热过程,故填写:放热;
铁生锈是缓慢氧化,释放热量,t2~t3这段时间反应并未停止但生锈速度减慢,因此放出热量少,装置散失热量快,导致温度开始下降,故填写:生锈放热量小于热量散失。
(6)t3时刻后压强突然变大,原因是:铁生锈消耗氧气,装置中的压强变小,则将注射器中的盐酸吸入,盐酸与铁反应生成氢气,故填写:铁生锈消耗氧气,装置中的压强变小,则将注射器中的盐酸吸入,盐酸与铁反应生成氢气。
(7)小丽同学猜想:铁锈蚀的快慢还可能与氧气的浓度有关,而铁生锈与氧气和水有关,只要利用控制变量法,控制容器中水的量不变,改变氧气的浓度,通过观察铁生锈的程度就可以得出结论,因此,实验方案的步骤是:分别将铁放入不同浓度的氧气的试管中,并且试管中有等量的水,实验现象是:观察到氧气浓度较高的试管中铁生锈严重,实验结论:说明氧气浓度越高,铁生锈越快,故填写:分别将铁放入不同浓度的氧气的试管中,并且试管中有等量的水,若观察到氧气浓度较高的试管中铁生锈严重,则说明氧气浓度越高,铁生锈越快。
23. 氧气/O2 质量/化学性质 化学性质/质量 C中产生气泡的速率比D慢 3.2
【详解】实验探究:Ⅰ、从B中产生大量能使带火星木条复燃的气体,可知产生的气体是氧气;
Ⅱ、向B试管中重新加入5%的过氧化氢溶液,反应停止后过滤、洗涤、干燥、称量滤渣, 又产生大量能使带火星木条复燃的气体,说明化学反应前后,红砖粉末的化学性质不变,滤渣质量等于ag,说明化学反应前后,红砖粉末的质量不变,红砖粉末能重复使用且在反应前后质量和化学性质均没有发生变化可知,红砖粉末能作过氧化氢分解的催化剂;
Ⅲ、结论为:红砖粉末的催化效果没有二氧化锰粉末好,说明现象为:C中产生气泡的速率比D慢;
拓展应用:反应充分后得到溶质质量分数为2%的硫酸铜溶液,则溶剂质量分数为98%,该溶液溶剂为水,即,,解得,过氧化氢分解为水和氧气,根据质量守恒定律,反应后减少的质量即为生成氧气的质量,即生成氧气的质量为:101.2g-98g=3.2g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
