2024年云南省高三高考化学备考思路与迎考策略课件(共34张PPT)
文档属性
| 名称 | 2024年云南省高三高考化学备考思路与迎考策略课件(共34张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-03 17:43:18 | ||
图片预览








文档简介
(共34张PPT)
2024年云南高考化学备考思路与迎考策略
一、回归教材,重视基础,脚踏实地的考出应有水平;
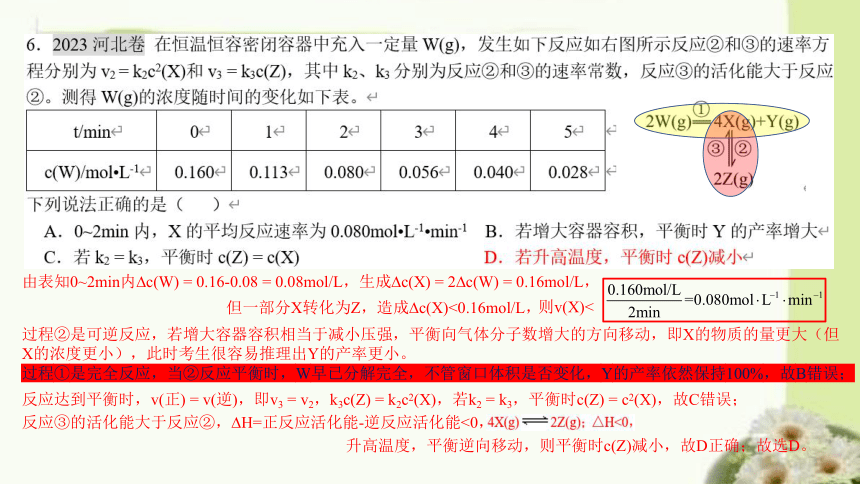
9.2023浙江卷 下列反应的离子方程式正确的是( )
A.碘化亚铁溶液与等物质的量的氯气:
2Fe2+ + 2I- + 2Cl2 === 2Fe3+ + I2 + 4Cl-
B.向次氯酸钙溶液通入足量二氧化碳:
ClO- + CO2 + H2O === HClO + HCO3-
C.铜与稀硝酸:Cu + 4H+ + 2NO3- === Cu2+ + 2NO2 + 2H2O
D.向硫化钠溶液通入足量二氧化硫:
S2- + 2SO2 + 2H2O === H2S + 2HSO3-
A.Cl2先与I-反应,后与Fe2+反应;FeI2溶液与等物质的量的Cl2,碘离子与氯气恰好完全反应:2I- + Cl2 === I2 + 2Cl-,故A错误;
向次氯酸钙溶液通入足量二氧化碳,反应生成碳酸氢钙和次氯酸:ClO- + CO2 + H2O === HClO + HCO3-,故B正确;
铜与稀硝酸反应生成硝酸铜、一氧化氮和水:3Cu + 8H+ + 2NO3- === 3Cu2+ + 2NO + 4H2O,故C错误;
对应的离子反应方程式为:2S2- + 5SO2 + 2H2O === 3S + 4HSO3-,故D错误;
通过可能发生的反应:Na2S + SO2 + H2O === Na2SO3 + H2S、2H2S + SO2 === 3S + 2H2O、Na2SO3 + SO2 + H2O === 2NaHSO3;
判断出产物为S和HSO3-;因此向Na2S溶液通入足量SO2,溶液变浑浊,溶液中生成NaHSO3:
这种情况务必提醒考生反应顺序的梳理,类似的情况很多,如FeBr2溶液中加入一定量的氯气;
工业生产时常用NH4Cl代替盐酸,本题正好选材于此。
ZnO + 2NH4Cl + H2O === ZnCl2 + 2NH3 H2O;Zn2+ + 4NH3 H2O ==== [Zn(NH3)4]2+ + 4H2O;
理论上来讲,ZnO、Fe2O3和Fe3O4均可以溶解于NH4Cl溶液,
即O2 + 4Fe(OH)2 + 2H2O === 4Fe(OH)3,
导致认为B项是正确结论
即大部分的Fe2O3和Fe3O4并未发生溶解,
实际情况是滤渣成分主要是Fe2O3和Fe3O4,Fe(OH)3只有少量,B错误。
由表知0~2min内 c(W) = 0.16-0.08 = 0.08mol/L,生成 c(X) = 2 c(W) = 0.16mol/L,
但一部分X转化为Z,造成 c(X)<0.16mol/L,
则v(X)<
过程②是可逆反应,若增大容器容积相当于减小压强,平衡向气体分子数增大的方向移动,即X的物质的量更大(但X的浓度更小),此时考生很容易推理出Y的产率更小。
过程①是完全反应,当②反应平衡时,W早已分解完全,不管窗口体积是否变化,Y的产率依然保持100%,故B错误;
反应达到平衡时,v(正) = v(逆),即v3 = v2,k3c(Z) = k2c2(X),若k2 = k3,平衡时c(Z) = c2(X),故C错误;
反应③的活化能大于反应②, H=正反应活化能-逆反应活化能<0,
升高温度,平衡逆向移动,则平衡时c(Z)减小,故D正确;故选D。
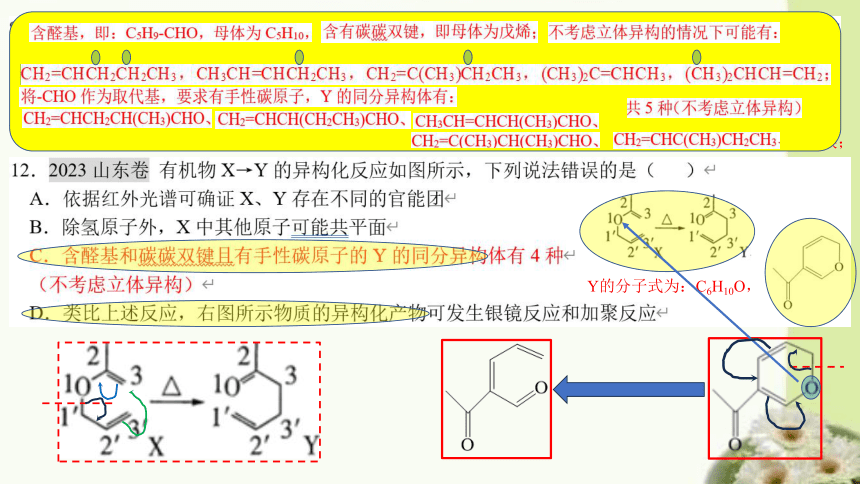
1mol该物质最多能与2molNaOH反应,故B错误;
Y的分子式为:C6H10O,
标准状况时,2.24LCl2与足量的水反应转移的电子数为0.1NA;
向水中加入Na2O2,反应后所得溶液中滴加几滴酚酞,溶液最终变为红色,说明反应产生了NaOH,带有火星的木条复燃,说明产生了O2;
溶解了1mol Cl2的氯水中,不论存放时间的长短,均有:
N(Cl2) + N(Cl-) = NA【N(Cl2)和N(Cl-)表示Cl2和Cl-的个数】;
根据氮原子的电子排布,可以确定有稳定的NCl3,不可能有NCl5分子 ;
常温常压下,46 g NO2与92 g N2O4,所含的分子数后者是前者的两倍;
先加入AgNO3溶液,产生白色沉淀,再加入稀HNO3溶液,白色沉淀不溶解,则溶液中一定含有大量的Cl﹣;
0.5mol雄黄(As4S4),结构如右图,含有NA个As-As键;
由1H、2H、3H、12C、13C、14C所组成的CH≡CH分子共有45种;
K35ClO3与浓H37Cl反应制得7.1 g氯气,则生成的Cl2分子数为0.1NA;
二、重视“能量流”与“物质流”,熟悉此类问题的分析方法,轻松解决这类新型化学试题的应试问题;
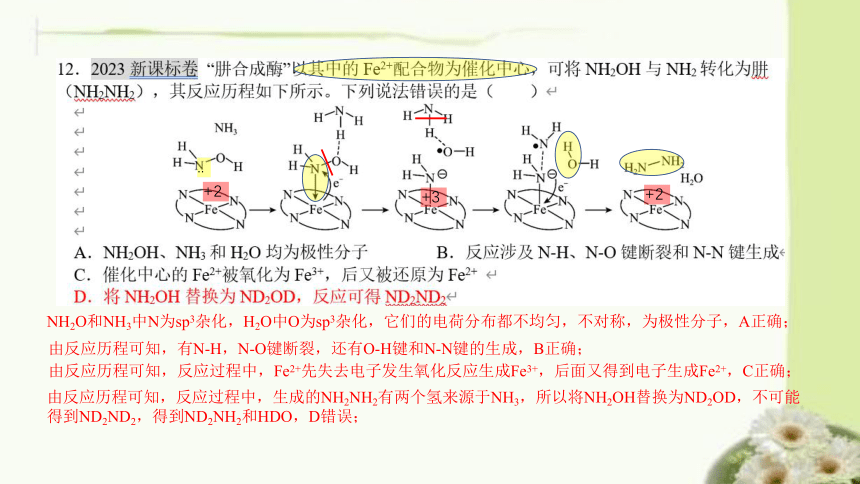
+2
..
+3
+2
NH2O和NH3中N为sp3杂化,H2O中O为sp3杂化,它们的电荷分布都不均匀,不对称,为极性分子,A正确;
由反应历程可知,有N-H,N-O键断裂,还有O-H键和N-N键的生成,B正确;
由反应历程可知,反应过程中,Fe2+先失去电子发生氧化反应生成Fe3+,后面又得到电子生成Fe2+,C正确;
由反应历程可知,反应过程中,生成的NH2NH2有两个氢来源于NH3,所以将NH2OH替换为ND2OD,不可能得到ND2ND2,得到ND2NH2和HDO,D错误;
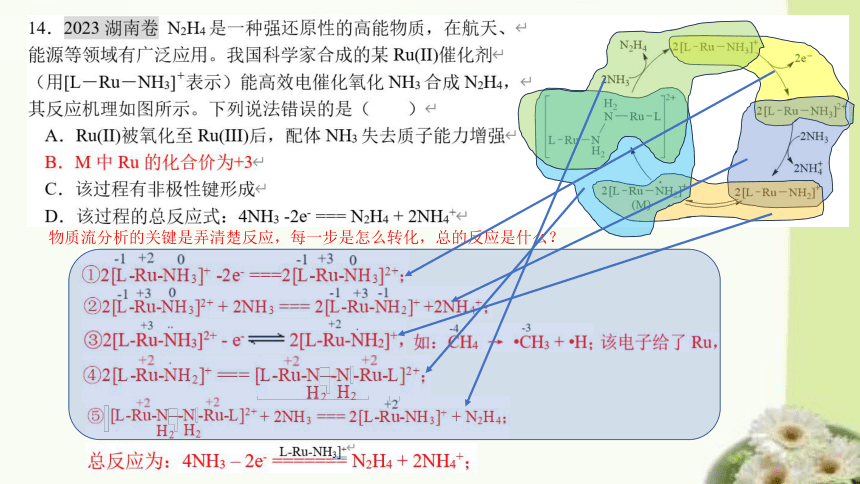
物质流分析的关键是弄清楚反应,每一步是怎么转化,总的反应是什么?
Ru(Ⅱ)被氧化至Ru (Ⅲ)后,[L-Ru-NH3]+中的Ru带有更多的正电荷,其与N原子成键后,Ru吸引电子的能力比Ru (Ⅱ)强,这种作用使得配体NH3中的N-H键极性变强且更易断裂,因此其失去质子(H+)的能力增强,A说法正确;
Ru (Ⅱ)中Ru的化合价为+2,当其变为Ru (Ⅲ)后,Ru的化合价变为+3,Ru (Ⅲ)失去2个质子后,N原子产生了1个孤电子对,Ru的化合价不变;M为[L-Ru-NH2 ]+,当[L-Ru-NH2]+变为M时,N原子的孤电子对拆为2个电子并转移给Ru 1个电子,导致Ru的化合价由+3价变为+2,因此,B说法不正确;
该过程M变为[L-Ru-NH2-NH2-Ru-L]2+时,有N-N键形成,N-N是非极性键,C说法正确;
从整个过程来看,4个NH3失去了2个电子后生成了1个N2H4和2个NH4+,Ru (Ⅱ)是催化剂,因此,该过程的总反应式为:4NH3 -2e- === N2H4 + 2NH4+,D说法正确;
三、重视结构知识的整理与应用,迎接新高考模式的新挑战。
即Y7与Z7相对质量相差7,也就是Y、Z相对质量相差1,
且Y、Z的化学环境相同,说明Y、Z为两种同位素,如1H、2H、3H或12C与13C等;
即:3x+7y+w+r = 40;
X、W和R三种元素位于同周期,很明显,应该是第二周期;
考虑到只有X、W、R同周期,因此,Y只能是第一周期的H原子,即y=1;
设X的最外层电子数为a(X的核外电子数为2+a),则R的核外电子数为r = 2a,
上式变为:3(a+2)+7+w+2a = 40,5a+w = 27,
a=3,w=12(X、R不在同周期,舍去);
a=4,w=7;则X为C,R为O,W为N;
a=5,w=2(X、R不在同周期,舍去);
最后的结论是:X为C;Y为H;W为N;R为O;当Y为1H时,Z为2H;当Y为2H时,Z为3H;
由X、Y、W和R四种元素所组成的42电子粒子为NH4HCO3,俗称碳氨,可以在农业生产上发挥很大作用,A正确;
第一电离能:N>O>C>H,B错误;
化合物X3Y7WR为C3H7NO,由于酰胺基有-CO-NH2或-CO-NH-或-CO-N-等多种理解,C错误;
C、N和O可以形成CH3-CH3、N2H4、H2O2,它们都是电子数为18的氢化物,D错误;
根据“均摊法”,晶胞中含4个Zr、8×1/8+12×1/4+6×1/2+1=8个O,则立方氧化锆的化学式为ZrO2,
Zr的配位数为8,根据化学式ZrO2,O的配位数为4,选项A正确;
四个Zr原子组成正四面体,该四面体的棱边就是Zr原子之间的最短距离,正好为面对角线的一半,
即a/2pm,C正确;
(1/4,1/4,1/4)
(3/4,3/4,1/4),
(0,0,0)
(3/2,3/2,1)
位置为xy平面的面心,D正确;
x、y、z三个方向均应加3/4,
x、y、z三个方向均应加3/4,
(1/2,1/2,0
四、以五种常数为核心,结合反应的顺序和恒等关系,巧解溶液分析的高考压轴题。
加入氨水后最终溶解,成为Ag(NH3)2Cl溶液,对应的反应为:
题给条件可以理解为依次进行以下反应:
c(Cl-)呈现增大趋势,
c(Ag+)由于溶解平衡的正向移动,可以看成有段时间保持不变,后来随着c(NH3)的增大,逐渐减小,
而[Ag(NH3)]+和[Ag(NH3)2]+不断增大,
但最终主体应该是[Ag(NH3)2]+;
所以,III为Ag+,
IV为Cl-;
I为[Ag(NH3)2]+,
II为[Ag(NH3)]+;
当c(NH3) = 10-1mol L-1时,c([Ag(NH3)2]+) = c(Cl-) = 10-2.35 mol L-1;c(Ag+) = 10-7.40 mol L-1,c([Ag(NH3)]+) = 10-5.16 mol L-1,
但开始时c(Cl-) = c(Ag+);
所以有:Ksp(AgCl) = c(Ag+)×c(Cl-) = 10-9.75,B正确;
反应的K = c([Ag(NH3)2]+)/[c(NH3)×c([Ag(NH3)]+)] = 103.81,C正确;
当c(NH3) = 0.01mol L-1时,
图中显示c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+),D正确;
则Ksp(AgxX) = cx(Ag+)×c(Xx-),
转化成相应的离子浓度代入Ksp(AgxX) = cx(Ag+)×c(Xx-) = 1×10-16 = 10-16,(10-3)x×10-7 = 10-16,x = 3,
即Ag3X(s);Ksp(Ag3X) = 1×10-16;
按照同样的方法,在图像上任找两点(0,10),(3,7),
转化成相应的离子浓度代入Ksp(AgyY) = cy(Ag+)×c(Yy-) = 1×10-10 = 10-10,(10-3)y×10-7 = 10-10,y = 1,
即AgY(s);Ksp(AgY) = 1×10-10;
根据分析可知,x=3,y=1,x : y = 3 : 1,A项正确;
由图像可知,J点混合溶液中各离子浓度为:c(Ag+) = 10-3mol L-1,c(X3-) = c(Y-) = 10-7mol L-1,c(X3-)/c(Y-) = 1,
加入AgNO3(s)会使c(Ag+)增大,可以假定某一数值,如c(Ag+) = 0.1mol L-1,
c(X3-) = 10-16/(0.1)3 = 10-13mol L-1,c(Y-) = 10-10/0.1 = 10-9mol L-1,
c(X3-)/c(Y-) = 10-13/10-9 = 10-4,c(X3-)/c(Y-)变小,B正确;
向AgxX固体中加入NayY溶液,
该反应的平衡常数K = Ksp(Ag3X)/K3sp(AgY) = 10-16/(10-10)3 = 1014,K值极大,可发生AgxX→AgyY的转化,C项正确;
在图像上任找两点(0,16),(3,7),
五、以电对分析为依托,全面准确破解电化学难题。
Zn为负极,放电时Zn失去电子变为Zn2+,电极反应为:Zn – 2e- === Zn2+;
阳离子向正极迁移,则放电时Zn2+由负极向正极迁移,B说法正确;
放电时正极反应为:V2O5 + nH2O + 2xe- + xZn2+ === ZnxV2O5 nH2O;
电池的总反应为xZn + V2O5 + nH2O === ZnxV2O5 nH2O。
则充电时阳极的电极反应为:ZnxV2O5 nH2O – 2xe- === xZn2+ + V2O5 + nH2O,D说法正确;
则其在充电时的总反应为ZnxV2O5 nH2O === xZn + V2O5 + nH2O,C说法不正确;
由题意可知放电时钠电极为原电池负极,电极反应为:Na – e- === Na+;
硫电极得电子,发生一连串反应,即S8→S82-→S62-→S42-→Sx2-;
硫电极为原电池正极,电极反应可以表示为:2Na+ + x/8S8 + 2e- → Na2Sx。
充电时与放电正好反向;
故充电时,Na+由硫电极迁移至钠电极,A错误;
放电时Na在a电极失去电子,失去的电子经外电路流向b电极,硫黄粉在b电极上得电子与a电极释放出的Na+结合得到Na2Sx,电子在外电路的流向为a→b,B正确;
C正确;
炭化纤维素纸中含有大量的炭,炭具有良好的导电性,可以增强硫电极的导电性能,D正确;
本题的本质是浓差电池。
甲中因为反应:Cu2++ 4NH3 ==== [Cu(NH3)4]2+,导致c(Cu2+)下降,
因此甲室Cu电极为负极,电极反应为Cu – 2e- === Cu2+;
乙室Cu电极自然就是正极,
电极反应为Cu2+ + 2e- === Cu;
也可以表示为:Cu -2e- + 4NH3 === [Cu(NH3)4]2+,
则电池总反应为:Cu2++ 4NH3 ==== [Cu(NH3)4]2+,C正确;
NH3扩散到乙室会与铜离子反应生成[Cu(NH3)4]2+,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,故D正确。
原电池在工作的过程中若不考虑离子的移动,甲池富余阳离子Cu(NH3)42+,乙池富余SO42-;
若隔膜为阳离子膜,则产品应该是在乙池流出的溶液低温热解产生,
即:Cu(NH3)4SO4 === CuSO4 + 4NH3↑;
但图中显示低温热解的是甲池流出的溶液,所以,隔膜是阴离子膜,
在电池工作的过程中理论上来讲只需要在乙池不断添加CuSO4电镀废液;故B错误;
六、以反应为中心,结合主元素的传递和副元素的排除为主线,依托教材,合理联想,正确化解流程分析试题。
Co2+、Co3+、
Ni2+、Al3+、
Mg2+
根据表中数据可以计算出pH = 9.0时,Co2+、Co3+、Ni2+、Al3+、Mg2+的浓度分别约为:5.9×10-5mol L-1、1.6×10-29mol L-1、5.5×10-6mol L-1、1.3×10-18mol L-1、5.6×10-2mol L-1;
Mg2+、NO3-
Mg(NO3)2 6H2O
Co(OH)2、Co(OH)3、
Ni(OH)2、Al(OH)3;
Al(OH)3;
Co(NH3)62+、Ni(NH3)62+;
MgO + H2O === Mg(OH)2
MgO + 2H+ === Mg2+ + H2O
晶体
减少胶状物质对镍钴氢氧化物的包裹,增加了滤泥与氨性溶液的接触面积。
HCl气体
8×1/8 = 1个;
6×1/2 = 3个;
1个
化学式为:AlCoO3;
白球与黑球之间的最短距离为,
白球与叉球之间的最短距离为a/2;
考虑到>a/2;结合题中表述“Al与O最小间距大于Co与O最小间距”,所以,黑球为Al原子,叉球为Co原子;
即白球为氧原子,
设晶胞边长为a,
体心;
以顶点Al分析,面心的氧原子一个横截面有4个,三个横截面共12个,因此晶体中一个Al周围与其最近的O的个数为12;
晶体A为Mg(NO3)2 6H2O,
晶体A含6个结晶水,
还剩余5个水分子,
因此所得HNO3溶液中n(HNO3)与n(H2O)的比值理论上最高为2 : 5;
可重复利用的是HNO3和MgO;故答案为:MgO。
七、以原理预判为前提,身临其境的理解并完成综合实验的分析与评价。
应该隔绝空气;
“水膜保护”;
2Al + 2OH- + 2H2O ==== 2AlO2- + 3H2↑
(现在应该写成:2Al + 2OH- + 6H2O ==== 2Al(OH)4- + 3H2↑)
碱洗的目的是除铝;
水洗的目的是除碱;
加入有机溶剂显然是极性溶剂;
当水准管内液面持续上升时说明气流速度太快或反应已经完成,
此时应该减小H2的通入速率或中止反应;
(现在应该写成:2Al + 2OH- + 6H2O ==== 2Al(OH)4- + 3H2↑)
取最后一次洗涤液,测pH为中性或取最后一次洗涤液于试管中,滴加几滴酚酞,如果溶液不变粉红色,则证明洗涤干净,否则没有洗涤干净
极性溶剂只有CH3COCH3和CH3CH2OH
,但极性较强的为乙醇,故选C;
向集气管中充入H2时,氢气从左侧进入,向下进入集气管,
当由集气管向装置Ⅱ供气,此时孔路位置需调节为气体由下方的集气管出来,向右进入装置Ⅱ,
恒压滴液漏斗;
根据题给信息可知,雷尼Ni暴露在空气中可以自燃,故反应前向装置Ⅱ中通入N2一段时间,目的是排除装置中的空气,防止雷尼Ni自燃;
由于雷尼镍活性很高,对H2有强烈的吸附作用,当导气管插入液面以下后,雷尼镍表面迅速被H2所吸附,
使得雷尼镍催化剂对邻硝基苯胺的吸附减弱,最终导致催化氢化反应速率降低;
也就是会导致催化剂中毒;
反应完成后,氢气不再被消耗,则集气管中液面不再改变。
八、以竞争反应为主线,平衡常数为中心,全面破解多平衡体系的各种问题。
x(C6H5C2H5) = x(C6H5CH=CH2) = x(H2) = 1/3,所以:KP = 100/3KPa;
设加入水蒸气xmol,平衡转化率提高至75%,即:
KP = 100/3KPa=[0.75/(1.75+x)]2×100/[0.25/(1.75+x)],解得:x = 5.0mol;
(3)根据(2)的计算结果,可以推断出图中横坐标表面上是乙苯的转化率,实际上应该是充入了更多的水蒸气;
在恒温恒压的条件下,不断加入水蒸气,反应④、⑤由于Qp反应⑥ Qc=Kp,平衡不移动,
由此好像可以得出:n(C6H5CH=CH2)和n(C6H6)增加,它们各自的选择性S应该增大;
如此得出的结论是:曲线a代表甲苯,但生成苯乙烯的反应④是主体反应,反应⑤为副反应,所以,b代表C6H5CH=CH2,c代表苯;
但题中强调反应④为主体反应,反应⑤、⑥为副反应,主反应的选择性理应高于副反应。
曲线a芳香烃产物的选择性明显大于曲线b、c芳香烃产物的选择性,应该是曲线a代表产物苯乙烯的选择性,曲线b代表苯,c代表甲苯。
但问题是a的选择性为何越来越低呢?
只有一种解释,即:S(苯乙烯) + S(苯) + S(甲苯) = 1,
由于S(甲苯)变化太小,导致S(苯乙烯)与S(苯)之间出现此涨彼消的关系,
所以,S的变化趋势与平衡移动的方向不一定完全一致。
催化剂颗粒大小会影响接触面积,会影响反应速率,D项错误;
(5)电负性Cl>Br>I,则极性C-Cl键>C-Br键>C-I键,原子半径r(Cl)CuBr在水中的溶度积常数Ksp=c(Cu+) c(Br-);
谢谢大家,祝2024年高考大捷!
2024年云南高考化学备考思路与迎考策略
一、回归教材,重视基础,脚踏实地的考出应有水平;
9.2023浙江卷 下列反应的离子方程式正确的是( )
A.碘化亚铁溶液与等物质的量的氯气:
2Fe2+ + 2I- + 2Cl2 === 2Fe3+ + I2 + 4Cl-
B.向次氯酸钙溶液通入足量二氧化碳:
ClO- + CO2 + H2O === HClO + HCO3-
C.铜与稀硝酸:Cu + 4H+ + 2NO3- === Cu2+ + 2NO2 + 2H2O
D.向硫化钠溶液通入足量二氧化硫:
S2- + 2SO2 + 2H2O === H2S + 2HSO3-
A.Cl2先与I-反应,后与Fe2+反应;FeI2溶液与等物质的量的Cl2,碘离子与氯气恰好完全反应:2I- + Cl2 === I2 + 2Cl-,故A错误;
向次氯酸钙溶液通入足量二氧化碳,反应生成碳酸氢钙和次氯酸:ClO- + CO2 + H2O === HClO + HCO3-,故B正确;
铜与稀硝酸反应生成硝酸铜、一氧化氮和水:3Cu + 8H+ + 2NO3- === 3Cu2+ + 2NO + 4H2O,故C错误;
对应的离子反应方程式为:2S2- + 5SO2 + 2H2O === 3S + 4HSO3-,故D错误;
通过可能发生的反应:Na2S + SO2 + H2O === Na2SO3 + H2S、2H2S + SO2 === 3S + 2H2O、Na2SO3 + SO2 + H2O === 2NaHSO3;
判断出产物为S和HSO3-;因此向Na2S溶液通入足量SO2,溶液变浑浊,溶液中生成NaHSO3:
这种情况务必提醒考生反应顺序的梳理,类似的情况很多,如FeBr2溶液中加入一定量的氯气;
工业生产时常用NH4Cl代替盐酸,本题正好选材于此。
ZnO + 2NH4Cl + H2O === ZnCl2 + 2NH3 H2O;Zn2+ + 4NH3 H2O ==== [Zn(NH3)4]2+ + 4H2O;
理论上来讲,ZnO、Fe2O3和Fe3O4均可以溶解于NH4Cl溶液,
即O2 + 4Fe(OH)2 + 2H2O === 4Fe(OH)3,
导致认为B项是正确结论
即大部分的Fe2O3和Fe3O4并未发生溶解,
实际情况是滤渣成分主要是Fe2O3和Fe3O4,Fe(OH)3只有少量,B错误。
由表知0~2min内 c(W) = 0.16-0.08 = 0.08mol/L,生成 c(X) = 2 c(W) = 0.16mol/L,
但一部分X转化为Z,造成 c(X)<0.16mol/L,
则v(X)<
过程②是可逆反应,若增大容器容积相当于减小压强,平衡向气体分子数增大的方向移动,即X的物质的量更大(但X的浓度更小),此时考生很容易推理出Y的产率更小。
过程①是完全反应,当②反应平衡时,W早已分解完全,不管窗口体积是否变化,Y的产率依然保持100%,故B错误;
反应达到平衡时,v(正) = v(逆),即v3 = v2,k3c(Z) = k2c2(X),若k2 = k3,平衡时c(Z) = c2(X),故C错误;
反应③的活化能大于反应②, H=正反应活化能-逆反应活化能<0,
升高温度,平衡逆向移动,则平衡时c(Z)减小,故D正确;故选D。
1mol该物质最多能与2molNaOH反应,故B错误;
Y的分子式为:C6H10O,
标准状况时,2.24LCl2与足量的水反应转移的电子数为0.1NA;
向水中加入Na2O2,反应后所得溶液中滴加几滴酚酞,溶液最终变为红色,说明反应产生了NaOH,带有火星的木条复燃,说明产生了O2;
溶解了1mol Cl2的氯水中,不论存放时间的长短,均有:
N(Cl2) + N(Cl-) = NA【N(Cl2)和N(Cl-)表示Cl2和Cl-的个数】;
根据氮原子的电子排布,可以确定有稳定的NCl3,不可能有NCl5分子 ;
常温常压下,46 g NO2与92 g N2O4,所含的分子数后者是前者的两倍;
先加入AgNO3溶液,产生白色沉淀,再加入稀HNO3溶液,白色沉淀不溶解,则溶液中一定含有大量的Cl﹣;
0.5mol雄黄(As4S4),结构如右图,含有NA个As-As键;
由1H、2H、3H、12C、13C、14C所组成的CH≡CH分子共有45种;
K35ClO3与浓H37Cl反应制得7.1 g氯气,则生成的Cl2分子数为0.1NA;
二、重视“能量流”与“物质流”,熟悉此类问题的分析方法,轻松解决这类新型化学试题的应试问题;
+2
..
+3
+2
NH2O和NH3中N为sp3杂化,H2O中O为sp3杂化,它们的电荷分布都不均匀,不对称,为极性分子,A正确;
由反应历程可知,有N-H,N-O键断裂,还有O-H键和N-N键的生成,B正确;
由反应历程可知,反应过程中,Fe2+先失去电子发生氧化反应生成Fe3+,后面又得到电子生成Fe2+,C正确;
由反应历程可知,反应过程中,生成的NH2NH2有两个氢来源于NH3,所以将NH2OH替换为ND2OD,不可能得到ND2ND2,得到ND2NH2和HDO,D错误;
物质流分析的关键是弄清楚反应,每一步是怎么转化,总的反应是什么?
Ru(Ⅱ)被氧化至Ru (Ⅲ)后,[L-Ru-NH3]+中的Ru带有更多的正电荷,其与N原子成键后,Ru吸引电子的能力比Ru (Ⅱ)强,这种作用使得配体NH3中的N-H键极性变强且更易断裂,因此其失去质子(H+)的能力增强,A说法正确;
Ru (Ⅱ)中Ru的化合价为+2,当其变为Ru (Ⅲ)后,Ru的化合价变为+3,Ru (Ⅲ)失去2个质子后,N原子产生了1个孤电子对,Ru的化合价不变;M为[L-Ru-NH2 ]+,当[L-Ru-NH2]+变为M时,N原子的孤电子对拆为2个电子并转移给Ru 1个电子,导致Ru的化合价由+3价变为+2,因此,B说法不正确;
该过程M变为[L-Ru-NH2-NH2-Ru-L]2+时,有N-N键形成,N-N是非极性键,C说法正确;
从整个过程来看,4个NH3失去了2个电子后生成了1个N2H4和2个NH4+,Ru (Ⅱ)是催化剂,因此,该过程的总反应式为:4NH3 -2e- === N2H4 + 2NH4+,D说法正确;
三、重视结构知识的整理与应用,迎接新高考模式的新挑战。
即Y7与Z7相对质量相差7,也就是Y、Z相对质量相差1,
且Y、Z的化学环境相同,说明Y、Z为两种同位素,如1H、2H、3H或12C与13C等;
即:3x+7y+w+r = 40;
X、W和R三种元素位于同周期,很明显,应该是第二周期;
考虑到只有X、W、R同周期,因此,Y只能是第一周期的H原子,即y=1;
设X的最外层电子数为a(X的核外电子数为2+a),则R的核外电子数为r = 2a,
上式变为:3(a+2)+7+w+2a = 40,5a+w = 27,
a=3,w=12(X、R不在同周期,舍去);
a=4,w=7;则X为C,R为O,W为N;
a=5,w=2(X、R不在同周期,舍去);
最后的结论是:X为C;Y为H;W为N;R为O;当Y为1H时,Z为2H;当Y为2H时,Z为3H;
由X、Y、W和R四种元素所组成的42电子粒子为NH4HCO3,俗称碳氨,可以在农业生产上发挥很大作用,A正确;
第一电离能:N>O>C>H,B错误;
化合物X3Y7WR为C3H7NO,由于酰胺基有-CO-NH2或-CO-NH-或-CO-N-等多种理解,C错误;
C、N和O可以形成CH3-CH3、N2H4、H2O2,它们都是电子数为18的氢化物,D错误;
根据“均摊法”,晶胞中含4个Zr、8×1/8+12×1/4+6×1/2+1=8个O,则立方氧化锆的化学式为ZrO2,
Zr的配位数为8,根据化学式ZrO2,O的配位数为4,选项A正确;
四个Zr原子组成正四面体,该四面体的棱边就是Zr原子之间的最短距离,正好为面对角线的一半,
即a/2pm,C正确;
(1/4,1/4,1/4)
(3/4,3/4,1/4),
(0,0,0)
(3/2,3/2,1)
位置为xy平面的面心,D正确;
x、y、z三个方向均应加3/4,
x、y、z三个方向均应加3/4,
(1/2,1/2,0
四、以五种常数为核心,结合反应的顺序和恒等关系,巧解溶液分析的高考压轴题。
加入氨水后最终溶解,成为Ag(NH3)2Cl溶液,对应的反应为:
题给条件可以理解为依次进行以下反应:
c(Cl-)呈现增大趋势,
c(Ag+)由于溶解平衡的正向移动,可以看成有段时间保持不变,后来随着c(NH3)的增大,逐渐减小,
而[Ag(NH3)]+和[Ag(NH3)2]+不断增大,
但最终主体应该是[Ag(NH3)2]+;
所以,III为Ag+,
IV为Cl-;
I为[Ag(NH3)2]+,
II为[Ag(NH3)]+;
当c(NH3) = 10-1mol L-1时,c([Ag(NH3)2]+) = c(Cl-) = 10-2.35 mol L-1;c(Ag+) = 10-7.40 mol L-1,c([Ag(NH3)]+) = 10-5.16 mol L-1,
但开始时c(Cl-) = c(Ag+);
所以有:Ksp(AgCl) = c(Ag+)×c(Cl-) = 10-9.75,B正确;
反应的K = c([Ag(NH3)2]+)/[c(NH3)×c([Ag(NH3)]+)] = 103.81,C正确;
当c(NH3) = 0.01mol L-1时,
图中显示c([Ag(NH3)2]+)>c([Ag(NH3)]+)>c(Ag+),D正确;
则Ksp(AgxX) = cx(Ag+)×c(Xx-),
转化成相应的离子浓度代入Ksp(AgxX) = cx(Ag+)×c(Xx-) = 1×10-16 = 10-16,(10-3)x×10-7 = 10-16,x = 3,
即Ag3X(s);Ksp(Ag3X) = 1×10-16;
按照同样的方法,在图像上任找两点(0,10),(3,7),
转化成相应的离子浓度代入Ksp(AgyY) = cy(Ag+)×c(Yy-) = 1×10-10 = 10-10,(10-3)y×10-7 = 10-10,y = 1,
即AgY(s);Ksp(AgY) = 1×10-10;
根据分析可知,x=3,y=1,x : y = 3 : 1,A项正确;
由图像可知,J点混合溶液中各离子浓度为:c(Ag+) = 10-3mol L-1,c(X3-) = c(Y-) = 10-7mol L-1,c(X3-)/c(Y-) = 1,
加入AgNO3(s)会使c(Ag+)增大,可以假定某一数值,如c(Ag+) = 0.1mol L-1,
c(X3-) = 10-16/(0.1)3 = 10-13mol L-1,c(Y-) = 10-10/0.1 = 10-9mol L-1,
c(X3-)/c(Y-) = 10-13/10-9 = 10-4,c(X3-)/c(Y-)变小,B正确;
向AgxX固体中加入NayY溶液,
该反应的平衡常数K = Ksp(Ag3X)/K3sp(AgY) = 10-16/(10-10)3 = 1014,K值极大,可发生AgxX→AgyY的转化,C项正确;
在图像上任找两点(0,16),(3,7),
五、以电对分析为依托,全面准确破解电化学难题。
Zn为负极,放电时Zn失去电子变为Zn2+,电极反应为:Zn – 2e- === Zn2+;
阳离子向正极迁移,则放电时Zn2+由负极向正极迁移,B说法正确;
放电时正极反应为:V2O5 + nH2O + 2xe- + xZn2+ === ZnxV2O5 nH2O;
电池的总反应为xZn + V2O5 + nH2O === ZnxV2O5 nH2O。
则充电时阳极的电极反应为:ZnxV2O5 nH2O – 2xe- === xZn2+ + V2O5 + nH2O,D说法正确;
则其在充电时的总反应为ZnxV2O5 nH2O === xZn + V2O5 + nH2O,C说法不正确;
由题意可知放电时钠电极为原电池负极,电极反应为:Na – e- === Na+;
硫电极得电子,发生一连串反应,即S8→S82-→S62-→S42-→Sx2-;
硫电极为原电池正极,电极反应可以表示为:2Na+ + x/8S8 + 2e- → Na2Sx。
充电时与放电正好反向;
故充电时,Na+由硫电极迁移至钠电极,A错误;
放电时Na在a电极失去电子,失去的电子经外电路流向b电极,硫黄粉在b电极上得电子与a电极释放出的Na+结合得到Na2Sx,电子在外电路的流向为a→b,B正确;
C正确;
炭化纤维素纸中含有大量的炭,炭具有良好的导电性,可以增强硫电极的导电性能,D正确;
本题的本质是浓差电池。
甲中因为反应:Cu2++ 4NH3 ==== [Cu(NH3)4]2+,导致c(Cu2+)下降,
因此甲室Cu电极为负极,电极反应为Cu – 2e- === Cu2+;
乙室Cu电极自然就是正极,
电极反应为Cu2+ + 2e- === Cu;
也可以表示为:Cu -2e- + 4NH3 === [Cu(NH3)4]2+,
则电池总反应为:Cu2++ 4NH3 ==== [Cu(NH3)4]2+,C正确;
NH3扩散到乙室会与铜离子反应生成[Cu(NH3)4]2+,铜离子浓度降低,铜离子得电子能力减弱,因此将对电池电动势产生影响,故D正确。
原电池在工作的过程中若不考虑离子的移动,甲池富余阳离子Cu(NH3)42+,乙池富余SO42-;
若隔膜为阳离子膜,则产品应该是在乙池流出的溶液低温热解产生,
即:Cu(NH3)4SO4 === CuSO4 + 4NH3↑;
但图中显示低温热解的是甲池流出的溶液,所以,隔膜是阴离子膜,
在电池工作的过程中理论上来讲只需要在乙池不断添加CuSO4电镀废液;故B错误;
六、以反应为中心,结合主元素的传递和副元素的排除为主线,依托教材,合理联想,正确化解流程分析试题。
Co2+、Co3+、
Ni2+、Al3+、
Mg2+
根据表中数据可以计算出pH = 9.0时,Co2+、Co3+、Ni2+、Al3+、Mg2+的浓度分别约为:5.9×10-5mol L-1、1.6×10-29mol L-1、5.5×10-6mol L-1、1.3×10-18mol L-1、5.6×10-2mol L-1;
Mg2+、NO3-
Mg(NO3)2 6H2O
Co(OH)2、Co(OH)3、
Ni(OH)2、Al(OH)3;
Al(OH)3;
Co(NH3)62+、Ni(NH3)62+;
MgO + H2O === Mg(OH)2
MgO + 2H+ === Mg2+ + H2O
晶体
减少胶状物质对镍钴氢氧化物的包裹,增加了滤泥与氨性溶液的接触面积。
HCl气体
8×1/8 = 1个;
6×1/2 = 3个;
1个
化学式为:AlCoO3;
白球与黑球之间的最短距离为,
白球与叉球之间的最短距离为a/2;
考虑到>a/2;结合题中表述“Al与O最小间距大于Co与O最小间距”,所以,黑球为Al原子,叉球为Co原子;
即白球为氧原子,
设晶胞边长为a,
体心;
以顶点Al分析,面心的氧原子一个横截面有4个,三个横截面共12个,因此晶体中一个Al周围与其最近的O的个数为12;
晶体A为Mg(NO3)2 6H2O,
晶体A含6个结晶水,
还剩余5个水分子,
因此所得HNO3溶液中n(HNO3)与n(H2O)的比值理论上最高为2 : 5;
可重复利用的是HNO3和MgO;故答案为:MgO。
七、以原理预判为前提,身临其境的理解并完成综合实验的分析与评价。
应该隔绝空气;
“水膜保护”;
2Al + 2OH- + 2H2O ==== 2AlO2- + 3H2↑
(现在应该写成:2Al + 2OH- + 6H2O ==== 2Al(OH)4- + 3H2↑)
碱洗的目的是除铝;
水洗的目的是除碱;
加入有机溶剂显然是极性溶剂;
当水准管内液面持续上升时说明气流速度太快或反应已经完成,
此时应该减小H2的通入速率或中止反应;
(现在应该写成:2Al + 2OH- + 6H2O ==== 2Al(OH)4- + 3H2↑)
取最后一次洗涤液,测pH为中性或取最后一次洗涤液于试管中,滴加几滴酚酞,如果溶液不变粉红色,则证明洗涤干净,否则没有洗涤干净
极性溶剂只有CH3COCH3和CH3CH2OH
,但极性较强的为乙醇,故选C;
向集气管中充入H2时,氢气从左侧进入,向下进入集气管,
当由集气管向装置Ⅱ供气,此时孔路位置需调节为气体由下方的集气管出来,向右进入装置Ⅱ,
恒压滴液漏斗;
根据题给信息可知,雷尼Ni暴露在空气中可以自燃,故反应前向装置Ⅱ中通入N2一段时间,目的是排除装置中的空气,防止雷尼Ni自燃;
由于雷尼镍活性很高,对H2有强烈的吸附作用,当导气管插入液面以下后,雷尼镍表面迅速被H2所吸附,
使得雷尼镍催化剂对邻硝基苯胺的吸附减弱,最终导致催化氢化反应速率降低;
也就是会导致催化剂中毒;
反应完成后,氢气不再被消耗,则集气管中液面不再改变。
八、以竞争反应为主线,平衡常数为中心,全面破解多平衡体系的各种问题。
x(C6H5C2H5) = x(C6H5CH=CH2) = x(H2) = 1/3,所以:KP = 100/3KPa;
设加入水蒸气xmol,平衡转化率提高至75%,即:
KP = 100/3KPa=[0.75/(1.75+x)]2×100/[0.25/(1.75+x)],解得:x = 5.0mol;
(3)根据(2)的计算结果,可以推断出图中横坐标表面上是乙苯的转化率,实际上应该是充入了更多的水蒸气;
在恒温恒压的条件下,不断加入水蒸气,反应④、⑤由于Qp
由此好像可以得出:n(C6H5CH=CH2)和n(C6H6)增加,它们各自的选择性S应该增大;
如此得出的结论是:曲线a代表甲苯,但生成苯乙烯的反应④是主体反应,反应⑤为副反应,所以,b代表C6H5CH=CH2,c代表苯;
但题中强调反应④为主体反应,反应⑤、⑥为副反应,主反应的选择性理应高于副反应。
曲线a芳香烃产物的选择性明显大于曲线b、c芳香烃产物的选择性,应该是曲线a代表产物苯乙烯的选择性,曲线b代表苯,c代表甲苯。
但问题是a的选择性为何越来越低呢?
只有一种解释,即:S(苯乙烯) + S(苯) + S(甲苯) = 1,
由于S(甲苯)变化太小,导致S(苯乙烯)与S(苯)之间出现此涨彼消的关系,
所以,S的变化趋势与平衡移动的方向不一定完全一致。
催化剂颗粒大小会影响接触面积,会影响反应速率,D项错误;
(5)电负性Cl>Br>I,则极性C-Cl键>C-Br键>C-I键,原子半径r(Cl)
谢谢大家,祝2024年高考大捷!
同课章节目录
