第四章物质结构元素周期律(含解析) 单元同步练习题-2023--2024学年高一化学人教版必修1
文档属性
| 名称 | 第四章物质结构元素周期律(含解析) 单元同步练习题-2023--2024学年高一化学人教版必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 430.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-03 19:25:39 | ||
图片预览




文档简介
第四章 物质结构 元素周期律 单元同步练习题
一、单选题
1.下列关于元素周期表的叙述正确的是
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.元素所在的周期数等于它的电子层数,所在的族序数等于它的最外层电子数
C.元素周期表有7个横行即7个周期,18个纵列即18个族
D.某种元素的相对原子质量取整数值,就是其原子序数
2.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
Y Z
M X
A.原子半径
B.M元素最高价氧化物具有两性
C.X的最简单气态氢化物的热稳定性比Z的小
D.Y的最高价氧化物对应水化物的酸性比X的弱
3.如下图所示是氯气的制备以及氯、溴、碘的非金属性比较实验,充分反应一段时间后,打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察实验现象,下列说法正确的是
A.F装置中的Na2SO3溶液能吸收Cl2,进行尾气处理
B.装置B中可盛放水吸收氯气中的HCl气体
C.装置E下层呈现紫红色
D.装置E中有机试剂层呈现紫红色,能说明非金属性:Br>I
4.下列关于卤族元素的说法正确的是
A.从HF、HCl、HBr、HI的酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
B.卤族元素的单质只有氧化性
C.从F到I,原子得电子能力逐渐减弱
D.卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易
5.以下关于锂、钠、钾、铷、铯的叙述不正确的是
①原子结构的相同点是最外层电子数相同,都为1;②单质熔点最高的是铯;③与O2反应均可得到多种氧化物;④单质的密度依次增大,均要保存在煤油中 ⑤单质的还原性依次增强 ⑥对应离子的氧化性依次增强
A.①③⑤ B.②④⑥ C.②③④⑥ D.①⑤
6.某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表一种元素,其中O点代表氢元素。下列说法不正确的是
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B、C最高价氧化物对应的水化物可相互反应
D.最简单氢化物的热稳定性:A>D
7.我国科学家开发出一种光学晶体M,其结构如图。X、Y、Z、W为原子序数依次增大的短周期主族元素,其中X和Y的质子数之和等于Z的电子数,Y和Z同周期,Z和W同主族。下列说法正确的是
A.简单离子半径:YC.Z分别与X、Y可形成多种共价化合物 D.Y、W的氧化物对应的水化物都是强酸
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的原子半径在短周期元素中最大,W与Y同主族。下列说法正确的是
A.原子半径:ZC.最简单气态氢化物的热稳定性:X>Y D.最高价氧化物对应水化物的酸性:W9.高铁酸钾净水原理:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH,设NA为阿伏加德罗常数的值。下列有关说法正确的是
A.常温下,生成22.4LO2时转移电子数为4NA
B.1molK2FeO4反应生成的Fe(OH)3胶粒数小于NA
C.K2FeO4、KOH为离子化合物,H2O、O2为共价化合物
D.反应过程既有极性键断裂与形成又有非极性键的断裂与形成
10.X、Y、Z、W是原子序数依次增大的短周期主族元素,X的一种单质的硬度在自然界中最大,Y的单质在空气中燃烧生成淡黄色固体,W是同周期元素中非金属性最强的元素,X、Z、W原子最外层电子数之和等于17。下列叙述正确的是
A.X的氢化物可能含有18个电子
B.简单离子半径:ZC.X、Y、Z的最高价氧化物对应的水化物之间均可相互反应
D.工业上常用电解YW饱和溶液制取Y单质
11.化学与生活、生产、科学与技术等密切相关。下列说法正确的是
A.工业上利用油脂在酸性条件下水解制取肥皂
B.摄入人体内的淀粉在酶作用下逐步水解最终生成葡萄糖
C.“C919”大飞机使用的氮化硅陶瓷是传统的硅酸盐材料
D.中国空间站存储器所用的材料石墨烯与金刚石互为同分异构体
12.据北京青年报2022年10月22日报道,我国新一代“人造太阳”HL-2M“托卡马克”装置近日取得突破性进展,等离子体电流突破1兆安培,距离可控核聚变点火又近了一步。“人造太阳”中的核聚变反应之一为H+H→He+n。下列说法错误的是
A.常温同压下,等质量的H2、H2体积之比为1∶3
B.H2O与H2O化学性质基本相同
C.1molH的中子数比1molH的多1mol
D.H2O能稳定存在于自然界中
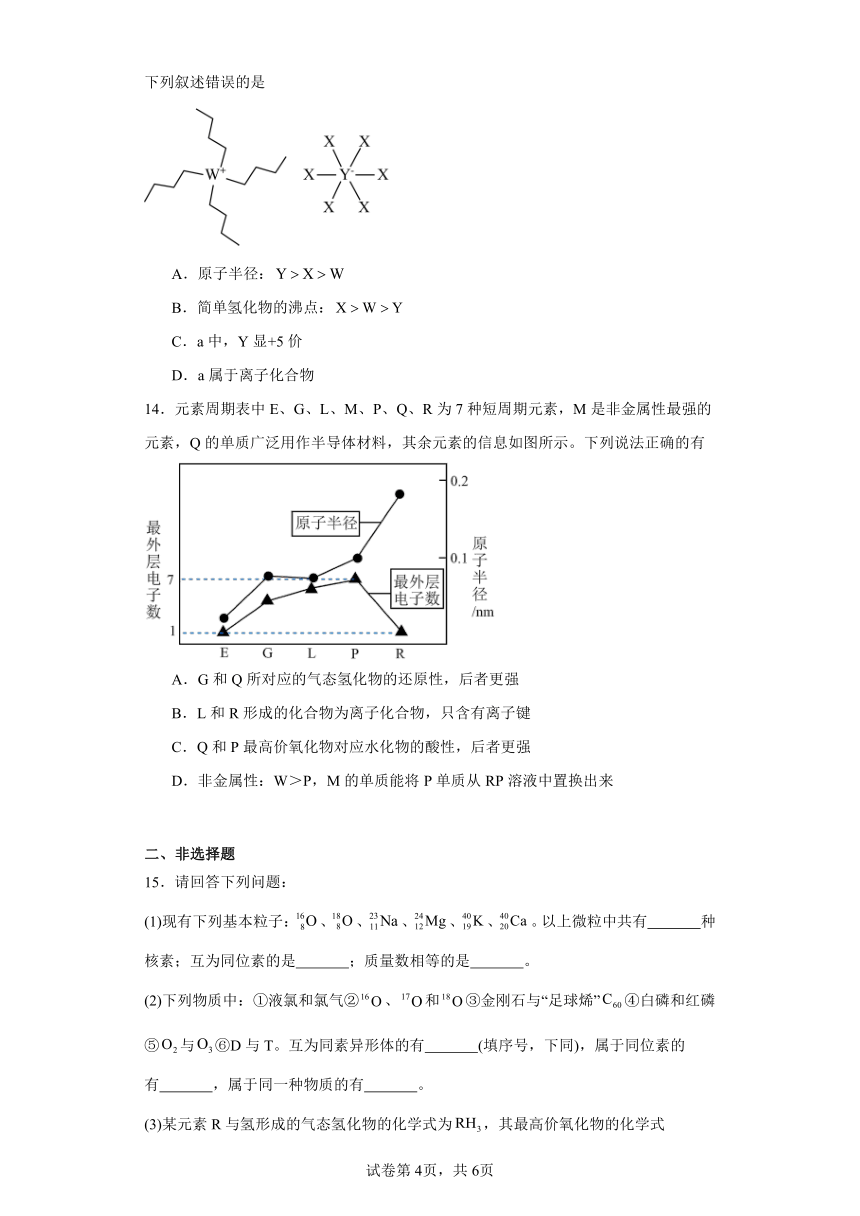
13.化合物a可用作导电涂料、静电喷涂、喷码油墨生产等,其中W、X、Y是原子序数依次增大的主族元素,W、Y同主族,a的结构式如图,且W、X满足八电子结构。下列叙述错误的是
A.原子半径:
B.简单氢化物的沸点:
C.a中,Y显+5价
D.a属于离子化合物
14.元素周期表中E、G、L、M、P、Q、R为7种短周期元素,M是非金属性最强的元素,Q的单质广泛用作半导体材料,其余元素的信息如图所示。下列说法正确的有
A.G和Q所对应的气态氢化物的还原性,后者更强
B.L和R形成的化合物为离子化合物,只含有离子键
C.Q和P最高价氧化物对应水化物的酸性,后者更强
D.非金属性:W>P,M的单质能将P单质从RP溶液中置换出来
二、非选择题
15.请回答下列问题:
(1)现有下列基本粒子:、、、、、。以上微粒中共有 种核素;互为同位素的是 ;质量数相等的是 。
(2)下列物质中:①液氯和氯气②、和③金刚石与“足球烯”④白磷和红磷⑤与⑥D与T。互为同素异形体的有 (填序号,下同),属于同位素的有 ,属于同一种物质的有 。
(3)某元素R与氢形成的气态氢化物的化学式为,其最高价氧化物的化学式为 。
(4)有下列物质①N2②Na2O2③MgCl2④H2O⑤CH4。请用序号填空:以上属于离子化合物的物质是 ;属于共价化合物的物质是 ;既含有离子键又含有共价键的物质是 。
16.冬季当大雪飘落后,我们都会看到环卫工人往雪地里撒一种叫融雪剂的物质,其作用是为城市道路、高速公路、机场等设施融雪化冰,有的融雪剂还可用作建筑工程冬季施工冰雪融化的速融剂和防冻外加剂等。
一种融雪剂主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的电子式是 ,XY2中离子半径由大到小的顺序是 (用离子符号表示)。
(2)主族元素C原子的最外层电子数是其电子层数的2倍,C与Y相邻,则C与Y的最高价氧化物对应的水化物酸性较弱的是 (填化学式);D是地壳中含量最多的一种元素,D的单质的同素异形体有 和 。
(3)元素W与Y同周期,0.1 mol的W单质能从酸中置换出2.24 L H2(标准状况),则W单质的元素名称为 ;W单质与热水反应的化学方程式为 。
(4)Y与G同族,且G的单质常温下呈液态,Y和G两种元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填序号)。
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的含氧酸的酸性
17.铁、铝在生产生活中有广泛的应用。完成下列填空:
(1)铝用作电线是利用了铝的 性;铁用作炊具是利用了铁的 性。
(2)常温下由于浓硫酸能使铁 ,因此浓硫酸可用铁槽车运输。
(3)铁器时代标志着较高水平的生产力发展,铁及其化合物被广泛应用于我们的生活中。学生甲学了有关铁的内容后非常感兴趣,他选择①使用铁粉与硫粉混合在空气中加热;②铁粉与CuSO4溶液反应将0价铁转化成+2价铁的化合物,写出这两种途径的化学方程式:① ;② 。
18.请回答下列问题:
(1)标准状况下与标准状况下 L 气体含有相同数目的氢原子数。
(2)27g某二价金属的氯化物中含有0.4mol的,则R的摩尔质量为 。
(3)某实验过程中需要用溶液配制溶液475mL,配制过程中需要用到下列仪器中的 (填字母)。
A. B. C. D.
下列情况会使所配溶液浓度偏低的是 (填序号)。
①未进行洗涤操作
②转移至容量瓶中前容量瓶内有少量蒸馏水
③定容时,俯视容量瓶的刻度线
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为 。
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则中 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.门捷列夫研制出的元素周期表,不仅揭示了元素间的内在联系和变化规律,也为发现新元素及探究物质的用途提供了依据,其价值非凡,A正确;
B.周期数=电子层数,主族序数=最外层电子数,对于副族及第Ⅷ族元素,族序数不一定等于相应原子的最外层电子数,B错误;
C.元素周期表中的8、9、10三个纵列合在一起叫做第Ⅷ族,故共有16个族,C错误;
D.元素的原子序数等于元素的核电荷数或对应原子的质子数,D错误;
故选A。
2.D
【分析】根据四种短周期元素在周期表位置可知,四种元素应位于第二周期、第三周期,只有M为金属,则M为Al,X为Si,Y为N,Z为O,据此分析;
【详解】A.一般情况下,电子层数越多,原子半径越大,因此M的原子半径大于Z,故A说法正确;
B.根据M为Al,最高价氧化物为氧化铝,氧化铝为两性氧化物,故B说法正确;
C.X的简单氢化物为SiH4,Z的简单氢化物为H2O,氧元素的非金属性强于硅元素,H2O的热稳定强,故C说法正确;
D.Y的最高价氧化物对应水化物为HNO3,属于强酸,X的最高价氧化物对应水化物为H2SiO3,属于弱酸,故D说法错误;
答案为D。
3.A
【分析】装置A制备氯气,装置B起安全瓶作用同时吸收氯化氢,装置D中氯气氧化溴化钠,装置E中氯气和单质溴均能氧化碘化钾,装置F中氯气氧化亚硫酸钠,据此解答。
【详解】A.F中发生Cl2+SO+H2O=2Cl-+SO+2H+,吸收多余Cl2,A正确;
B.Cl2能与水反应生成HClO和HCl,所以不能用水吸收Cl2中的杂质,B错误;
C.苯的密度比水的小,应在上层,所以装置E上层呈现紫红色,C错误;
D.溴单质能和碘化钾反应生成碘单质,但过量Cl2也会氧化碘离子生成碘单质,造成干扰,所以不能证明非金属性:Br>I,D错误;
答案选A。
4.C
【详解】A.F、Cl、Br、I的非金属性逐渐减弱,但HF、HCl、HBr、HI的酸性逐渐增强,A错误;
B.氯气、溴、碘既有氧化性又有还原性,B错误;
C.从F到I,原子核对最外层电子的吸引力逐渐减弱,原子得电子的能力逐渐减弱,C正确;
D.元素的非金属性越强,其单质与氢气越容易化合,非金属性F>Cl>Br>I,所以卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由易变难,D错误;
答案选C。
5.C
【详解】①锂、钠、钾、铷、铯均为第ⅠA族元素,原子的最外层都有一个电子,①正确;
②碱金属单质的熔、沸点随着原子序数的增加而降低,所以单质熔点最低的是铯,②错误;
③Li与O2反应只能得到Li2O,③错误;
④Li的密度比煤油小,不能保存在煤油中,应该保存在石蜡中,④错误;
⑤碱金属元素随原子序数的增加,原子半径逐渐增大,失电子能力逐渐增强,所以其单质的还原性依次增强,它们对应离子的氧化性依次减弱,⑤正确;
⑥根据⑤的分析可判断⑥错误;
答案选C。
6.A
【详解】A.离O点越远的元素原子序数越大,原子序数越大不一定原子半径越大,同一周期从左往右,原子半径递减,故A错误;
B.虚线相连的元素处于同一族,B正确;
C.B的最高价氧化物对应的水化物为氢氧化钠, C的最高价氧化物对应的水化物为氢氧化铝,反应生成偏铝酸钠和水,故C正确;
D.A、D处于同一主族,同主族元素从上往下,非金属性逐渐减小,最简单氢化物的热稳定性逐渐减小,故最简单氢化物的热稳定性:A>D,故D正确。
答案为:A。
7.C
【分析】由已知可以推出:X为H,Y为N,Z为O,W为S。
【详解】A.简单离子半径:N3->O2-,A项错误;
B.在火山口附近也存在游离态的硫单质,B项错误;
C.H和O元素可形成H2O和H2O2,N和O元素可形成NO、NO2,C项正确;
D.未指明是否为元素最高价氧化物对应的水化物,无法判断其酸性强弱,D项错误;
故选:C。
8.B
【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,Y是地壳中含量最高的元素,则Y为O;W与Y同主族,则W为S;Z的原子半径在短周期元素中最大,其原子序数大于O,则Z为Na;X原子的最外层电子数是其次外层电子数的2倍,X为C,所以X、Y、Z、W依次是C、O、Na、S。
【详解】A.原子半径:Na>S,故A错误;
B.Y、Z形成的化合物有氧化钠和过氧化钠,过氧化钠中含有共价键,故B正确;
C.非金属性越强,最简单气态氢化物的热稳定性越强,非金属性:CD.非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:S>C,则最高价氧化物对应水化物的酸性:W>X,故D错误;
故选B。
9.B
【详解】A.常温下,气体摩尔体积大于22.4L/mol,生成22.4LO2时,物质的量小于1mol,转移电子数小于4NA,故A错误;
B.4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH,1mol K2FeO4反应生成Fe(OH)3物质的量1mol,氢氧化铁胶粒是氢氧化铁的集合体,Fe(OH)3胶粒数小于NA,故B正确;
C.氧气是单质,不属于化合物,故C错误;
D.同种原子间形成的共价键为非极性键,反应过程中不存在非极性键的断裂,存在非极性键的形成,故D错误;
故选:B。
10.A
【分析】自然界中最硬的单质是金刚石,故X为C;Y的单质在空气中燃烧生成淡黄色固体,则Y为Na;W是同周期元素中非金属性最强的元素,则W为Cl;X、Z、W的原子最外层电子数之和等于17,则Z最外层电子数为6,Z为S。
【详解】A.为18电子的分子,A项正确;
B.简单离子半径:,即,B项错误;
C.与之间不能发生化学反应,C项错误;
D.工业上常用电解熔融NaCl制取Na单质,D项错误;
故选:A。
11.B
【详解】A.利用油脂在碱性条件下的水解反应工业上制取肥皂,故A错误;
B.淀粉属于多糖,在人体内酶作用下水解生成葡萄糖,经肠壁吸收进入血液,故B正确;
C.氮化硅不属于硅酸盐,氮化硅陶瓷属于新型无机非金属材料,故C错误;
D.石墨烯与金刚石是同种元素组成的不同单质,互为同素异形体,故D错误;
故选:B。
12.D
【详解】A.常温同压下,气体体积之比等于其物质的量之比,当气体质量相同时,气体体积之比等于其相对分子质量之反比,即1∶3,A项正确;
B.、互为同位素,同位素及其化合物化学性质几乎相同,B项正确;
C.、的中子数分别为2、1,则1mol的中子数比1mol的多1mol ,C项正确;
D.是放射性核素,及其化合物不能稳定存在于自然界中,D项错误;
故选:D。
13.A
【分析】从结构分析,W成四个键还多一个电子失去形成正一价离子,说明W最外层是五个电子,又W、Y同族原子序数依次增大分别是N和P,X形成一个键达到8电子稳定,且X在N和P之间,与P形成的是共价键,因此X是F。
【详解】A.原子半径是P>N>F,故A错误;
B.简单氢化物的沸点:HF>NH3>PH3,故B正确;
C.a中P形成四个键同时又失去1个电子,Y是+5价,故C正确;
D.a是由阴阳离子形成的化合物,是离子化合物,故D正确;
答案选A。
14.C
【分析】由题干信息可知,元素周期表中E、G、L、M、P、Q、R为7种短周期元素,M是非金属性最强的元素即为F,Q的单质广泛用作半导体材料即为Si,由图中信息可知,E、R的最外层电子数为1,G的最外层电子数为5,L的最外层电子数为6,P的最外层电子数为7,原子半径为R>P>L,G>L,L>E,结合原子半径同一周期从左往右依次减小,同一主族从上往下依次增大的规律可推知:R为Na、P为Cl,L为O,G为N,E为H,据此分析解题。
【详解】A.由分析可知,G为Si,Q为N,则有非金属性N>Si,氧化性N2>Si,故G和Q所对应的气态氢化物的还原性SiH4>NH3,即前者更强,A错误;
B.由分析可知,L为O,R为Na,L和R形成的化合物为离子化合物有Na2O只含有离子键,而Na2O2即有离子键又有共价键,B错误;
C.由分析可知,Q为Si,P为Cl,非金属性Cl>Si,则Q和P最高价氧化物对应水化物的酸性H2SiO3<HClO4,即后者更强,C正确;
D.由分析可知,M为F,P为Cl,则非金属性:F>Cl即M>P,F2与NaCl溶液反应时先与水反应,方程式为:2F2+2H2O=4HF+O2,即M的单质即F2不能将P单质即Cl2从RP即NaCl溶液中置换出来,D错误;
故答案为:C。
15.(1) 6 、 、
(2) ③④⑤ ②⑥ ①
(3)
(4) ②③ ④⑤ ②
【详解】(1)核素为质子数、中子数一定的原子;核素的表示方法为:元素符号左下角为质子数,左上角为质量数;具有相同质子数,不同中子数的同一元素的不同核素互为同位素;
以上微粒中共有6种核素;互为同位素的是、;质量数相等的是、;
(2)同素异形体是同种元素组成的单质;
①液氯和氯气为同一种物质的不同状态;②、和三者互为同位素;③金刚石与“足球烯”互为同素异形体;④白磷和红磷互为同素异形体;⑤与互为同素异形体;⑥D与T互为同位素;
故互为同素异形体的有③④⑤,属于同位素的有②⑥,属于同一种物质的有①;
(3)某元素R与氢形成的气态氢化物的化学式为,其化合价为-3,则其最外层电子数为5,最高价为+5,最高价氧化物的化学式为。
(4)①N2为含有共价键单质;②Na2O2是由钠离子和过氧根离子构成的离子化合物,过氧根离子中含有共价键;③MgCl2是由镁离子和氯离子构成的离子化合物④H2O是氢氧元素组成的共价化合物;⑤CH4是碳氢元素组成的共价化合物;
故以上属于离子化合物的物质是②③;属于共价化合物的物质是④⑤;既含有离子键又含有共价键的物质是②。
16.(1) Cl->Ca2+
(2) H2SO4 O2 O3
(3) 镁 Mg+2H2OMg(OH)2+H2↑
(4) 氯 bc
【详解】(1)一种融雪剂主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子,则1个X2+或Y-含有的电子数目是,则X是Ca,Y是Cl元素,该化合物是CaCl2,Ca2+与2Cl-通过离子键结合,其电子式是;
Ca2+、Cl-电子层结构相同,离子的核电荷数越大,离子半径就越小,所以离子半径由大到小的顺序是:Cl->Ca2+;
(2)主族元素C原子的最外层电子数是其电子层数的2倍,C与Y相邻,则C核外电子排布是2、8、6,C是S元素。同一周期主族元素的原子序数越大,元素的非金属就越强,元素的非金属性:S<Cl,所以S与Cl的最高价氧化物对应的水化物H2SO4、HClO4中酸性较弱的是H2SO4;
D是地壳中含量最多的一种元素,则D是O元素。O元素的单质的同素异形体有O2、O3;
(3)Y是Cl元素,W与Y同周期,0.1 mol的W单质能从酸中置换出2.24 LH2(标准状况),该H2的物质的量是0.1 mol,则W是+2价金属,故W单质的元素名称为镁;W单质与热水反应产生Mg(OH)2、H2,则的化学方程式为:Mg+2H2OMg(OH)2+H2↑;
(4)Y与G同族,且G的单质常温下呈液态,则G是Br元素;同一主族元素,原子序数越大,元素的非金属性越弱,所以Cl、Br两种元素中非金属性较强的元素是氯元素。
a.不能根据这两种元素的常见单质的沸点的高低判断元素非金属性强弱,a不符合题意;
b.元素的非金属性越强,其单质与氢气化合就越容易,因此可通过比较这两种元素的单质与氢气化合的难易判断元素非金属性强弱,b符合题意;
c.元素的非金属性越强,其相应的气态氢化物的稳定性就越强,因此可通过比较这两种元素的气态氢化物的稳定性判断元素非金属性强弱,c符合题意;
d.元素形成的含氧酸未指明是否是其最高价含氧酸,因此不能通过比较这两种元素的含氧酸的酸性判断元素非金属性强弱,d不符合题意;
故合理选项是bc。
17.(1) 导电 导热
(2)钝化
(3) Fe+SFeS Fe+CuSO4=FeSO4+Cu
【详解】(1)铝具有优良的导电性,所以铝用作电线;铁具有优良导热性,铁用作炊具;
(2)常温下,铁、铝在浓硫酸中钝化,因此浓硫酸可用铁槽车运输;
(3)①硫的氧化性较弱,使用铁粉与硫粉混合在空气中加热生成硫化亚铁:Fe+SFeS;
②铁粉与CuSO4溶液反应生成铜单质和硫酸亚铁,Fe+CuSO4=FeSO4+Cu。
18.(1)6.72
(2)
(3) BC ①④
(4)
(5)299
【详解】(1)3.4g对应物质的量: ,0.2ml 所含H原子数为0.6NA,与0.3mol所含H原子数相同,对应体积: ;
(2)某二价金属的氯化物中含有 0.4mol的,则= 0.2mol,其摩尔质量: ;
(3)用溶液配制溶液475mL,是用浓溶液稀释,配制过程中需要用的仪器有BC;①未进行洗涤操作,溶质物质的量偏小,浓度偏低,故①符合题意;②转移至容量瓶中前容量瓶内有少量蒸馏水,对结果无影响,故②不符合题意;③定容时,俯视容量瓶的刻度线,溶液体积偏小,物质的量浓度偏高,故③不符合题意;④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,溶液体积偏大,浓度偏低,故④符合题意;
(4)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,体现该反应原理的化学方程式为;
(5)核素的表示方法为:元素符号左下角为质子数,左上角为质量数;Uue与Na同主族,位于第八周期,称为类纺,则其原子序数为119,其一种可能存在的核素原子核中有180个中子,则学中Z=119,A=119+180=299 。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列关于元素周期表的叙述正确的是
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要里程碑之一
B.元素所在的周期数等于它的电子层数,所在的族序数等于它的最外层电子数
C.元素周期表有7个横行即7个周期,18个纵列即18个族
D.某种元素的相对原子质量取整数值,就是其原子序数
2.四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是
Y Z
M X
A.原子半径
B.M元素最高价氧化物具有两性
C.X的最简单气态氢化物的热稳定性比Z的小
D.Y的最高价氧化物对应水化物的酸性比X的弱
3.如下图所示是氯气的制备以及氯、溴、碘的非金属性比较实验,充分反应一段时间后,打开装置D的活塞,将装置D中少量溶液加入装置E中,振荡,观察实验现象,下列说法正确的是
A.F装置中的Na2SO3溶液能吸收Cl2,进行尾气处理
B.装置B中可盛放水吸收氯气中的HCl气体
C.装置E下层呈现紫红色
D.装置E中有机试剂层呈现紫红色,能说明非金属性:Br>I
4.下列关于卤族元素的说法正确的是
A.从HF、HCl、HBr、HI的酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
B.卤族元素的单质只有氧化性
C.从F到I,原子得电子能力逐渐减弱
D.卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由难变易
5.以下关于锂、钠、钾、铷、铯的叙述不正确的是
①原子结构的相同点是最外层电子数相同,都为1;②单质熔点最高的是铯;③与O2反应均可得到多种氧化物;④单质的密度依次增大,均要保存在煤油中 ⑤单质的还原性依次增强 ⑥对应离子的氧化性依次增强
A.①③⑤ B.②④⑥ C.②③④⑥ D.①⑤
6.某同学在研究前18号元素时发现,可以将它们排成如图所示的蜗牛形状,图中每个点代表一种元素,其中O点代表氢元素。下列说法不正确的是
A.离O点越远的元素原子半径越大
B.虚线相连的元素处于同一族
C.B、C最高价氧化物对应的水化物可相互反应
D.最简单氢化物的热稳定性:A>D
7.我国科学家开发出一种光学晶体M,其结构如图。X、Y、Z、W为原子序数依次增大的短周期主族元素,其中X和Y的质子数之和等于Z的电子数,Y和Z同周期,Z和W同主族。下列说法正确的是
A.简单离子半径:Y
8.短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层电子数的2倍,Y是地壳中含量最多的元素,Z的原子半径在短周期元素中最大,W与Y同主族。下列说法正确的是
A.原子半径:Z
A.常温下,生成22.4LO2时转移电子数为4NA
B.1molK2FeO4反应生成的Fe(OH)3胶粒数小于NA
C.K2FeO4、KOH为离子化合物,H2O、O2为共价化合物
D.反应过程既有极性键断裂与形成又有非极性键的断裂与形成
10.X、Y、Z、W是原子序数依次增大的短周期主族元素,X的一种单质的硬度在自然界中最大,Y的单质在空气中燃烧生成淡黄色固体,W是同周期元素中非金属性最强的元素,X、Z、W原子最外层电子数之和等于17。下列叙述正确的是
A.X的氢化物可能含有18个电子
B.简单离子半径:Z
D.工业上常用电解YW饱和溶液制取Y单质
11.化学与生活、生产、科学与技术等密切相关。下列说法正确的是
A.工业上利用油脂在酸性条件下水解制取肥皂
B.摄入人体内的淀粉在酶作用下逐步水解最终生成葡萄糖
C.“C919”大飞机使用的氮化硅陶瓷是传统的硅酸盐材料
D.中国空间站存储器所用的材料石墨烯与金刚石互为同分异构体
12.据北京青年报2022年10月22日报道,我国新一代“人造太阳”HL-2M“托卡马克”装置近日取得突破性进展,等离子体电流突破1兆安培,距离可控核聚变点火又近了一步。“人造太阳”中的核聚变反应之一为H+H→He+n。下列说法错误的是
A.常温同压下,等质量的H2、H2体积之比为1∶3
B.H2O与H2O化学性质基本相同
C.1molH的中子数比1molH的多1mol
D.H2O能稳定存在于自然界中
13.化合物a可用作导电涂料、静电喷涂、喷码油墨生产等,其中W、X、Y是原子序数依次增大的主族元素,W、Y同主族,a的结构式如图,且W、X满足八电子结构。下列叙述错误的是
A.原子半径:
B.简单氢化物的沸点:
C.a中,Y显+5价
D.a属于离子化合物
14.元素周期表中E、G、L、M、P、Q、R为7种短周期元素,M是非金属性最强的元素,Q的单质广泛用作半导体材料,其余元素的信息如图所示。下列说法正确的有
A.G和Q所对应的气态氢化物的还原性,后者更强
B.L和R形成的化合物为离子化合物,只含有离子键
C.Q和P最高价氧化物对应水化物的酸性,后者更强
D.非金属性:W>P,M的单质能将P单质从RP溶液中置换出来
二、非选择题
15.请回答下列问题:
(1)现有下列基本粒子:、、、、、。以上微粒中共有 种核素;互为同位素的是 ;质量数相等的是 。
(2)下列物质中:①液氯和氯气②、和③金刚石与“足球烯”④白磷和红磷⑤与⑥D与T。互为同素异形体的有 (填序号,下同),属于同位素的有 ,属于同一种物质的有 。
(3)某元素R与氢形成的气态氢化物的化学式为,其最高价氧化物的化学式为 。
(4)有下列物质①N2②Na2O2③MgCl2④H2O⑤CH4。请用序号填空:以上属于离子化合物的物质是 ;属于共价化合物的物质是 ;既含有离子键又含有共价键的物质是 。
16.冬季当大雪飘落后,我们都会看到环卫工人往雪地里撒一种叫融雪剂的物质,其作用是为城市道路、高速公路、机场等设施融雪化冰,有的融雪剂还可用作建筑工程冬季施工冰雪融化的速融剂和防冻外加剂等。
一种融雪剂主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子。
(1)该融雪剂的电子式是 ,XY2中离子半径由大到小的顺序是 (用离子符号表示)。
(2)主族元素C原子的最外层电子数是其电子层数的2倍,C与Y相邻,则C与Y的最高价氧化物对应的水化物酸性较弱的是 (填化学式);D是地壳中含量最多的一种元素,D的单质的同素异形体有 和 。
(3)元素W与Y同周期,0.1 mol的W单质能从酸中置换出2.24 L H2(标准状况),则W单质的元素名称为 ;W单质与热水反应的化学方程式为 。
(4)Y与G同族,且G的单质常温下呈液态,Y和G两种元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填序号)。
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
d.比较这两种元素的含氧酸的酸性
17.铁、铝在生产生活中有广泛的应用。完成下列填空:
(1)铝用作电线是利用了铝的 性;铁用作炊具是利用了铁的 性。
(2)常温下由于浓硫酸能使铁 ,因此浓硫酸可用铁槽车运输。
(3)铁器时代标志着较高水平的生产力发展,铁及其化合物被广泛应用于我们的生活中。学生甲学了有关铁的内容后非常感兴趣,他选择①使用铁粉与硫粉混合在空气中加热;②铁粉与CuSO4溶液反应将0价铁转化成+2价铁的化合物,写出这两种途径的化学方程式:① ;② 。
18.请回答下列问题:
(1)标准状况下与标准状况下 L 气体含有相同数目的氢原子数。
(2)27g某二价金属的氯化物中含有0.4mol的,则R的摩尔质量为 。
(3)某实验过程中需要用溶液配制溶液475mL,配制过程中需要用到下列仪器中的 (填字母)。
A. B. C. D.
下列情况会使所配溶液浓度偏低的是 (填序号)。
①未进行洗涤操作
②转移至容量瓶中前容量瓶内有少量蒸馏水
③定容时,俯视容量瓶的刻度线
④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
(4)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为 。
(5)2022年我国科学家开始参与研究Uue新元素的合成。Uue与Na同主族,位于第八周期,称为类钫,其一种可能存在的核素原子核中有180个中子,则中 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.门捷列夫研制出的元素周期表,不仅揭示了元素间的内在联系和变化规律,也为发现新元素及探究物质的用途提供了依据,其价值非凡,A正确;
B.周期数=电子层数,主族序数=最外层电子数,对于副族及第Ⅷ族元素,族序数不一定等于相应原子的最外层电子数,B错误;
C.元素周期表中的8、9、10三个纵列合在一起叫做第Ⅷ族,故共有16个族,C错误;
D.元素的原子序数等于元素的核电荷数或对应原子的质子数,D错误;
故选A。
2.D
【分析】根据四种短周期元素在周期表位置可知,四种元素应位于第二周期、第三周期,只有M为金属,则M为Al,X为Si,Y为N,Z为O,据此分析;
【详解】A.一般情况下,电子层数越多,原子半径越大,因此M的原子半径大于Z,故A说法正确;
B.根据M为Al,最高价氧化物为氧化铝,氧化铝为两性氧化物,故B说法正确;
C.X的简单氢化物为SiH4,Z的简单氢化物为H2O,氧元素的非金属性强于硅元素,H2O的热稳定强,故C说法正确;
D.Y的最高价氧化物对应水化物为HNO3,属于强酸,X的最高价氧化物对应水化物为H2SiO3,属于弱酸,故D说法错误;
答案为D。
3.A
【分析】装置A制备氯气,装置B起安全瓶作用同时吸收氯化氢,装置D中氯气氧化溴化钠,装置E中氯气和单质溴均能氧化碘化钾,装置F中氯气氧化亚硫酸钠,据此解答。
【详解】A.F中发生Cl2+SO+H2O=2Cl-+SO+2H+,吸收多余Cl2,A正确;
B.Cl2能与水反应生成HClO和HCl,所以不能用水吸收Cl2中的杂质,B错误;
C.苯的密度比水的小,应在上层,所以装置E上层呈现紫红色,C错误;
D.溴单质能和碘化钾反应生成碘单质,但过量Cl2也会氧化碘离子生成碘单质,造成干扰,所以不能证明非金属性:Br>I,D错误;
答案选A。
4.C
【详解】A.F、Cl、Br、I的非金属性逐渐减弱,但HF、HCl、HBr、HI的酸性逐渐增强,A错误;
B.氯气、溴、碘既有氧化性又有还原性,B错误;
C.从F到I,原子核对最外层电子的吸引力逐渐减弱,原子得电子的能力逐渐减弱,C正确;
D.元素的非金属性越强,其单质与氢气越容易化合,非金属性F>Cl>Br>I,所以卤素单质与氢气化合按F2、Cl2、Br2、I2的顺序由易变难,D错误;
答案选C。
5.C
【详解】①锂、钠、钾、铷、铯均为第ⅠA族元素,原子的最外层都有一个电子,①正确;
②碱金属单质的熔、沸点随着原子序数的增加而降低,所以单质熔点最低的是铯,②错误;
③Li与O2反应只能得到Li2O,③错误;
④Li的密度比煤油小,不能保存在煤油中,应该保存在石蜡中,④错误;
⑤碱金属元素随原子序数的增加,原子半径逐渐增大,失电子能力逐渐增强,所以其单质的还原性依次增强,它们对应离子的氧化性依次减弱,⑤正确;
⑥根据⑤的分析可判断⑥错误;
答案选C。
6.A
【详解】A.离O点越远的元素原子序数越大,原子序数越大不一定原子半径越大,同一周期从左往右,原子半径递减,故A错误;
B.虚线相连的元素处于同一族,B正确;
C.B的最高价氧化物对应的水化物为氢氧化钠, C的最高价氧化物对应的水化物为氢氧化铝,反应生成偏铝酸钠和水,故C正确;
D.A、D处于同一主族,同主族元素从上往下,非金属性逐渐减小,最简单氢化物的热稳定性逐渐减小,故最简单氢化物的热稳定性:A>D,故D正确。
答案为:A。
7.C
【分析】由已知可以推出:X为H,Y为N,Z为O,W为S。
【详解】A.简单离子半径:N3->O2-,A项错误;
B.在火山口附近也存在游离态的硫单质,B项错误;
C.H和O元素可形成H2O和H2O2,N和O元素可形成NO、NO2,C项正确;
D.未指明是否为元素最高价氧化物对应的水化物,无法判断其酸性强弱,D项错误;
故选:C。
8.B
【分析】短周期主族元素X、Y、Z、W的原子序数依次增大,Y是地壳中含量最高的元素,则Y为O;W与Y同主族,则W为S;Z的原子半径在短周期元素中最大,其原子序数大于O,则Z为Na;X原子的最外层电子数是其次外层电子数的2倍,X为C,所以X、Y、Z、W依次是C、O、Na、S。
【详解】A.原子半径:Na>S,故A错误;
B.Y、Z形成的化合物有氧化钠和过氧化钠,过氧化钠中含有共价键,故B正确;
C.非金属性越强,最简单气态氢化物的热稳定性越强,非金属性:C
故选B。
9.B
【详解】A.常温下,气体摩尔体积大于22.4L/mol,生成22.4LO2时,物质的量小于1mol,转移电子数小于4NA,故A错误;
B.4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH,1mol K2FeO4反应生成Fe(OH)3物质的量1mol,氢氧化铁胶粒是氢氧化铁的集合体,Fe(OH)3胶粒数小于NA,故B正确;
C.氧气是单质,不属于化合物,故C错误;
D.同种原子间形成的共价键为非极性键,反应过程中不存在非极性键的断裂,存在非极性键的形成,故D错误;
故选:B。
10.A
【分析】自然界中最硬的单质是金刚石,故X为C;Y的单质在空气中燃烧生成淡黄色固体,则Y为Na;W是同周期元素中非金属性最强的元素,则W为Cl;X、Z、W的原子最外层电子数之和等于17,则Z最外层电子数为6,Z为S。
【详解】A.为18电子的分子,A项正确;
B.简单离子半径:,即,B项错误;
C.与之间不能发生化学反应,C项错误;
D.工业上常用电解熔融NaCl制取Na单质,D项错误;
故选:A。
11.B
【详解】A.利用油脂在碱性条件下的水解反应工业上制取肥皂,故A错误;
B.淀粉属于多糖,在人体内酶作用下水解生成葡萄糖,经肠壁吸收进入血液,故B正确;
C.氮化硅不属于硅酸盐,氮化硅陶瓷属于新型无机非金属材料,故C错误;
D.石墨烯与金刚石是同种元素组成的不同单质,互为同素异形体,故D错误;
故选:B。
12.D
【详解】A.常温同压下,气体体积之比等于其物质的量之比,当气体质量相同时,气体体积之比等于其相对分子质量之反比,即1∶3,A项正确;
B.、互为同位素,同位素及其化合物化学性质几乎相同,B项正确;
C.、的中子数分别为2、1,则1mol的中子数比1mol的多1mol ,C项正确;
D.是放射性核素,及其化合物不能稳定存在于自然界中,D项错误;
故选:D。
13.A
【分析】从结构分析,W成四个键还多一个电子失去形成正一价离子,说明W最外层是五个电子,又W、Y同族原子序数依次增大分别是N和P,X形成一个键达到8电子稳定,且X在N和P之间,与P形成的是共价键,因此X是F。
【详解】A.原子半径是P>N>F,故A错误;
B.简单氢化物的沸点:HF>NH3>PH3,故B正确;
C.a中P形成四个键同时又失去1个电子,Y是+5价,故C正确;
D.a是由阴阳离子形成的化合物,是离子化合物,故D正确;
答案选A。
14.C
【分析】由题干信息可知,元素周期表中E、G、L、M、P、Q、R为7种短周期元素,M是非金属性最强的元素即为F,Q的单质广泛用作半导体材料即为Si,由图中信息可知,E、R的最外层电子数为1,G的最外层电子数为5,L的最外层电子数为6,P的最外层电子数为7,原子半径为R>P>L,G>L,L>E,结合原子半径同一周期从左往右依次减小,同一主族从上往下依次增大的规律可推知:R为Na、P为Cl,L为O,G为N,E为H,据此分析解题。
【详解】A.由分析可知,G为Si,Q为N,则有非金属性N>Si,氧化性N2>Si,故G和Q所对应的气态氢化物的还原性SiH4>NH3,即前者更强,A错误;
B.由分析可知,L为O,R为Na,L和R形成的化合物为离子化合物有Na2O只含有离子键,而Na2O2即有离子键又有共价键,B错误;
C.由分析可知,Q为Si,P为Cl,非金属性Cl>Si,则Q和P最高价氧化物对应水化物的酸性H2SiO3<HClO4,即后者更强,C正确;
D.由分析可知,M为F,P为Cl,则非金属性:F>Cl即M>P,F2与NaCl溶液反应时先与水反应,方程式为:2F2+2H2O=4HF+O2,即M的单质即F2不能将P单质即Cl2从RP即NaCl溶液中置换出来,D错误;
故答案为:C。
15.(1) 6 、 、
(2) ③④⑤ ②⑥ ①
(3)
(4) ②③ ④⑤ ②
【详解】(1)核素为质子数、中子数一定的原子;核素的表示方法为:元素符号左下角为质子数,左上角为质量数;具有相同质子数,不同中子数的同一元素的不同核素互为同位素;
以上微粒中共有6种核素;互为同位素的是、;质量数相等的是、;
(2)同素异形体是同种元素组成的单质;
①液氯和氯气为同一种物质的不同状态;②、和三者互为同位素;③金刚石与“足球烯”互为同素异形体;④白磷和红磷互为同素异形体;⑤与互为同素异形体;⑥D与T互为同位素;
故互为同素异形体的有③④⑤,属于同位素的有②⑥,属于同一种物质的有①;
(3)某元素R与氢形成的气态氢化物的化学式为,其化合价为-3,则其最外层电子数为5,最高价为+5,最高价氧化物的化学式为。
(4)①N2为含有共价键单质;②Na2O2是由钠离子和过氧根离子构成的离子化合物,过氧根离子中含有共价键;③MgCl2是由镁离子和氯离子构成的离子化合物④H2O是氢氧元素组成的共价化合物;⑤CH4是碳氢元素组成的共价化合物;
故以上属于离子化合物的物质是②③;属于共价化合物的物质是④⑤;既含有离子键又含有共价键的物质是②。
16.(1) Cl->Ca2+
(2) H2SO4 O2 O3
(3) 镁 Mg+2H2OMg(OH)2+H2↑
(4) 氯 bc
【详解】(1)一种融雪剂主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol电子,则1个X2+或Y-含有的电子数目是,则X是Ca,Y是Cl元素,该化合物是CaCl2,Ca2+与2Cl-通过离子键结合,其电子式是;
Ca2+、Cl-电子层结构相同,离子的核电荷数越大,离子半径就越小,所以离子半径由大到小的顺序是:Cl->Ca2+;
(2)主族元素C原子的最外层电子数是其电子层数的2倍,C与Y相邻,则C核外电子排布是2、8、6,C是S元素。同一周期主族元素的原子序数越大,元素的非金属就越强,元素的非金属性:S<Cl,所以S与Cl的最高价氧化物对应的水化物H2SO4、HClO4中酸性较弱的是H2SO4;
D是地壳中含量最多的一种元素,则D是O元素。O元素的单质的同素异形体有O2、O3;
(3)Y是Cl元素,W与Y同周期,0.1 mol的W单质能从酸中置换出2.24 LH2(标准状况),该H2的物质的量是0.1 mol,则W是+2价金属,故W单质的元素名称为镁;W单质与热水反应产生Mg(OH)2、H2,则的化学方程式为:Mg+2H2OMg(OH)2+H2↑;
(4)Y与G同族,且G的单质常温下呈液态,则G是Br元素;同一主族元素,原子序数越大,元素的非金属性越弱,所以Cl、Br两种元素中非金属性较强的元素是氯元素。
a.不能根据这两种元素的常见单质的沸点的高低判断元素非金属性强弱,a不符合题意;
b.元素的非金属性越强,其单质与氢气化合就越容易,因此可通过比较这两种元素的单质与氢气化合的难易判断元素非金属性强弱,b符合题意;
c.元素的非金属性越强,其相应的气态氢化物的稳定性就越强,因此可通过比较这两种元素的气态氢化物的稳定性判断元素非金属性强弱,c符合题意;
d.元素形成的含氧酸未指明是否是其最高价含氧酸,因此不能通过比较这两种元素的含氧酸的酸性判断元素非金属性强弱,d不符合题意;
故合理选项是bc。
17.(1) 导电 导热
(2)钝化
(3) Fe+SFeS Fe+CuSO4=FeSO4+Cu
【详解】(1)铝具有优良的导电性,所以铝用作电线;铁具有优良导热性,铁用作炊具;
(2)常温下,铁、铝在浓硫酸中钝化,因此浓硫酸可用铁槽车运输;
(3)①硫的氧化性较弱,使用铁粉与硫粉混合在空气中加热生成硫化亚铁:Fe+SFeS;
②铁粉与CuSO4溶液反应生成铜单质和硫酸亚铁,Fe+CuSO4=FeSO4+Cu。
18.(1)6.72
(2)
(3) BC ①④
(4)
(5)299
【详解】(1)3.4g对应物质的量: ,0.2ml 所含H原子数为0.6NA,与0.3mol所含H原子数相同,对应体积: ;
(2)某二价金属的氯化物中含有 0.4mol的,则= 0.2mol,其摩尔质量: ;
(3)用溶液配制溶液475mL,是用浓溶液稀释,配制过程中需要用的仪器有BC;①未进行洗涤操作,溶质物质的量偏小,浓度偏低,故①符合题意;②转移至容量瓶中前容量瓶内有少量蒸馏水,对结果无影响,故②不符合题意;③定容时,俯视容量瓶的刻度线,溶液体积偏小,物质的量浓度偏高,故③不符合题意;④定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,溶液体积偏大,浓度偏低,故④符合题意;
(4)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,体现该反应原理的化学方程式为;
(5)核素的表示方法为:元素符号左下角为质子数,左上角为质量数;Uue与Na同主族,位于第八周期,称为类纺,则其原子序数为119,其一种可能存在的核素原子核中有180个中子,则学中Z=119,A=119+180=299 。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
