华师大版科学八上期末专题复习: 粒子与元素(含答案)
文档属性
| 名称 | 华师大版科学八上期末专题复习: 粒子与元素(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 530.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-01-05 11:19:48 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
华师大版八上期末专题复习: 粒子与元素
一、单选题
1.如图是教材中用来表示电解水过程的示意图(其中“O”“●”分别表示氢原子和氧原子)分析示意图,可作出的正确判断是( )
A.常温常压下水可以分解
B.氢原子在该变化过程中不可再分
C.1个水分子中含有1个氢分子和1个氧原子
D.电解水的最终产物是氢、氧原子
2.为了探究水电解的微观过程,王玲同学做了一些分子、原子的模型,其中能表示构成水的微粒的是( )
A. B. C. D.
3.若用" "表示氢原子,用“ "表示氧原子,则水分子的模型可表示为( )。
A. B. C. D.
4.下列物质的分子模型可用“ ”表示的是( )
A.氮分子 B.氯分子 C.氯化氢分子 D.甲烷分子
5.十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出的分子概念认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的一种粒子;⑤分子的质量等于构成它的原子的质量之和;⑥分子在不停的运动。通过你的学习,你认为上述观点中存在明显不足的是( )
A.①②⑤ B.①③ C.④⑤⑥ D.③⑤
6.分子和原子的主要区别是( )
A.分子大,原子小
B.分子在化学反应中可以再分,而原子不能
C.分子能构成物质,而原子不能
D.构成物质的分子之间有作用力,而原子没有
7.下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.分子很小,所以没有质量
C.分子、原子、离子都可以构成物质
D.在化学反应中,分子可以再分,原子也可以再分
8.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b B.原子的质量集中在a和c上
C.原子中b与c的数目一定相同 D.原子中a与c的数目一定相同
9.下列排序正确的是( )
A.地壳中元素的含量:
B.硫元素的化合价:
C.空气中物质的质量:
D.原子序数排列:
10.生活中常会见到“加碘盐”、“含氟牙膏”、“加铁酱油”,其中的“碘”、“氟”、“铁”指的是( )
A.原子 B.离子 C.元素 D.分子
11.下列元素分类正确的是( )
A.金属元素:钙、镁、钡、铜、铁、汞
B.非金属元素:碳、氢、氧、氮、磷、金
C.稀有气体元素:氦、氖、氩、氪、氯、氡
D.人体必需的微量元素:铁、碘、氟、硒、钙、铅
12.下列符号既可表示一个原子,又可表示一种元素,还能表示一种物质的是( )
A.N B.Mg C.O2 D.H
13.国际通用的元素符号是用1个或2个拉丁文字母表示的,其中第一个字母大写,第二个字母小写。镍元素的拉丁文名称为Niccolum,则镍的元素符号为( )
A.Ni B.NI C.n D.Na
14.我国北斗卫星导航系统应用了铷原子钟。如图是铷在元素周期表中的信息。下列有关铷的说法正确的是( )
A.铷元素属于非金属元素 B.铷原子的质量是85.47g
C.铷元素的元素符号为Rb D.铷原子核内有37个中子
15.如图是元素周期表的一部分。下列说法正确的是( )
A.硼为金属元素
B.碳的原子序数是12.01
C.铝是地壳中含量最高的元素
D.三种原子中质量最大的是铝
16.1854年法国化学家德维尔在实验室中意外地发现一种新元素。已知该元素的一个原子中含有40个微粒,其中14个微粒不带电,则该原子的相对原子质量是( )
A.27 B.26 C.54 D.34
17.以下关于相对原子质量的叙述正确的是( )
①相对原子质量就是一个原子质量
②相对原子质量就是一个碳原子质量
③相对原子质量的单位是“千克”
④相对原子质量的近似值为质子数和中子数之和
⑤一般所指的是相对原子质量的近似值
A.③④⑤ B.④⑤ C.③⑤ D.②④⑤
18.C-12原子的实际质量为M克,则实际质量为2M克的一种元素的原子相对原子质量为( )
A.24M B.24 C.2 M D.2
19.如图形象说明了相对原子质量的含义,从图中获得的信息正确的是( )
A.碳12原子象西瓜一样大
B.氧原子质量是碳12原子的1.4倍
C.氧原子的质量与碳12原子质量的 的比值是16
D.碳12原子质量比氧原子质量大
二、填空题
20.保持水的化学性质的最小微粒是 。
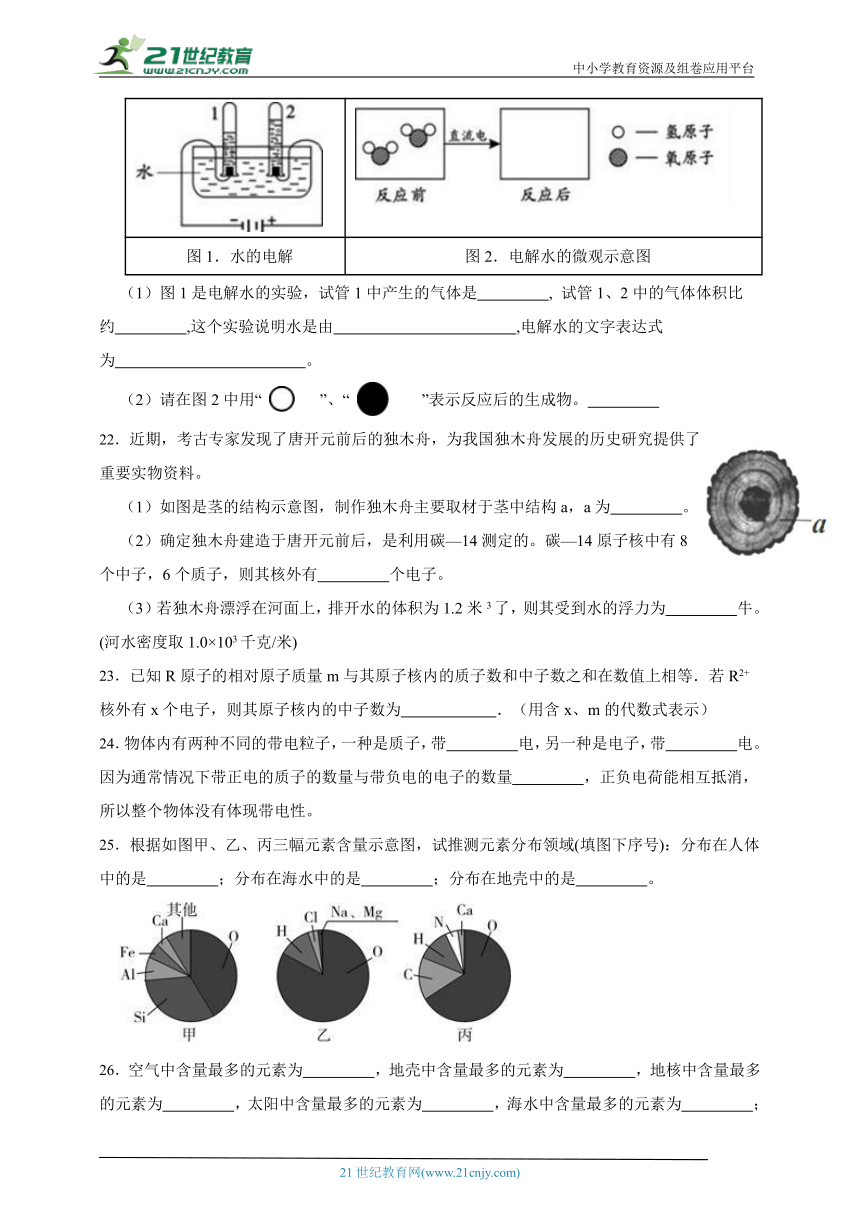
21.小科通过微信公号“胜哥课程”观看了《水的电解》科学视频后,对相关知识有了一定的理解。
水在通电的条件下可以发生化学反应,请根据图1和图2回答问题。
图1.水的电解 图2.电解水的微观示意图
(1)图1是电解水的实验,试管1中产生的气体是 , 试管1、2中的气体体积比约 ,这个实验说明水是由 ,电解水的文字表达式为 。
(2)请在图2中用“ ”、“ ”表示反应后的生成物。
22.近期,考古专家发现了唐开元前后的独木舟,为我国独木舟发展的历史研究提供了重要实物资料。
(1)如图是茎的结构示意图,制作独木舟主要取材于茎中结构a,a为 。
(2)确定独木舟建造于唐开元前后,是利用碳—14测定的。碳—14原子核中有8个中子,6个质子,则其核外有 个电子。
(3)若独木舟漂浮在河面上,排开水的体积为1.2米3了,则其受到水的浮力为 牛。(河水密度取1.0×103千克/米)
23.已知R原子的相对原子质量m与其原子核内的质子数和中子数之和在数值上相等.若R2+核外有x个电子,则其原子核内的中子数为 .(用含x、m的代数式表示)
24.物体内有两种不同的带电粒子,一种是质子,带 电,另一种是电子,带 电。因为通常情况下带正电的质子的数量与带负电的电子的数量 ,正负电荷能相互抵消,所以整个物体没有体现带电性。
25.根据如图甲、乙、丙三幅元素含量示意图,试推测元素分布领域(填图下序号):分布在人体中的是 ;分布在海水中的是 ;分布在地壳中的是 。
26.空气中含量最多的元素为 ,地壳中含量最多的元素为 ,地核中含量最多的元素为 ,太阳中含量最多的元素为 ,海水中含量最多的元素为 ;人体中含量最多的元素为 。(均填元素符号)
27.成语中被填的字与元素名称谐音,根据下面的示范,用相应元素符号填写成语。
高山(S)水,功高(Ca)世,
十全十 ,拾 不昧,
雪中送 ,叶落 根,
石心肠,火树 花。
28.如图是元素周期表的一部分。根据图片信息可以知道:
(1)氧元素在图乙中的 位置 (填图乙中的序号)。
(2)氧元素可以与图乙中的元素⑥组成多种物质,请写出其中一种物质的化学式: 。
29.元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
认真分析信息,回答:
(1)很多科学家对元素周期表的发现和完善做出了贡献,请写出其中一位科学家的名字: 。
(2)查出碳的相对原子质量是 ,写出16号元素的元素符号 。
(3)上表中每一周期元素原子序数的变化规律是 。
三、实验探究题
30.探究原子结构的奥秘。
(情景提供)19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
(提出问题)电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
(进行实验)1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
实验做法如图所示:
⑴放射源——放射性物质放出α粒子(带正电荷),质量是电子质量的7 000倍;
⑵金箔——作为靶子,厚度1 μm,重叠了3 000层左右的原子;
⑶荧光屏——α粒子打在上面发出闪光;
⑷显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
(收集证据)绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
(猜想与假设)α粒子遇到电子后,就像飞行的子弹碰到灰尘一样,运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
(解释与结论)
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。
(2)1 μm金箔包含了3 000层左右的金原子,绝大多数α粒子穿过后方向不变,说明______________。
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的 。
答案解析部分
1.B
知识点:构成物质的粒子模型
解析:A、根据水通电发生分解反应分析;
B、根据原子化学变化中不能改变分析;
C、根据水分子由氢、氧原子构成分析;
D、根据电解水的生成物分析。
A、水需在通电作用下分解,不符合题意;
B、氢原子在该变化过程中不可再分,只是重新组合 ,符合题意;
C、 1个水分子中含有2个氢原子和1个氧原子 ,不符合题意;
D、 电解水的最终产物是氢分子和氧分子,不符合题意;
故选B。
2.C
知识点:构成物质的粒子模型
解析:根据对水分子结构的认识判断。
根据化学式H2O可知,水分子由两个氢原子和一个氧原子构成,故C正确,而A、B、D错误。
故选C。
3.D
知识点:构成物质的粒子模型
解析:根据一个水分子是由2个氢原子和1个氧原子构成分析。
一个水分子是由2个氢原子和1个氧原子构成,所以水分子的模型为;
故选D。
4.C
知识点:分子的定义与分子的特性
解析:根据分子模型确定组成原子的种类和个数,然后对各个选项进行判断即可。
根据分子模型 可知,该分子由两种原子构成,且每种原子只有一个。
A.氮分子N2由两个氮原子构成,故A不合题意;
B.氯分子Cl2由两个氯原子构成,故B不合题意;
C.氯化氢分子HCl由一个H原子和一个Cl原子构成,故C符合题意;
D.甲烷分子CH4由一个C原子和4个氢原子构成,故D不合题意。
故选C。
5.B
知识点:分子的定义与分子的特性
解析:根据物质组成的知识分析即可。
①分子、原子和离子都是构成物质的基本微粒,故①错误;
②分子由原子构成,故②正确;
③金属单质、固态非金属单质和稀有气体都是由原子直接构成的,故③错误;
④分子是保持物质化学性质的一种粒子,故④正确;
⑤分子的质量等于构成它的原子的质量之和,故⑤正确;
⑥分子在不停的运动,故⑥正确。
因此上述观点中存在明显不足的是①③。
故选B。
6.B
知识点:分子和原子的区别和联系
解析:根据对分子和原子的认识分析判断。
A.分子由原子构成,但是不同原子的大小不同,因此分子不一定比原子大,故A错误;
B.分子在化学反应中可以再分,而原子不能,故B正确;
C.分子和原子都是构成物质的基本微粒,故C错误;
D.分子之间存在作用力,原子之间也存在作用力,故D错误。
故选B。
7.C
知识点:分子和原子的区别和联系
解析:根据对分子、原子和离子的认识分析判断。
A.分子是保持物质化学性质的最小微粒,故A错误;
B.分子很小,但是却有质量,故B错误;
C.分子、原子、离子都是构成物质的基本微粒,故C正确;
D.在化学反应中,分子可以再分,原子不能再分,因此原子是化学变化中的最小微粒,故D错误。
故选C。
8.D
知识点:原子的构成与探索过程
解析:原子中间为原子核,原子核由带正电的质子和不带电的中子构成,核外是绕核高速旋转的带负电的电子,据此分析判断。
根据图片可知,a为电子、b为中子,c为质子。
A.不同的原子,原子序数不同;因为质子数=原子序数,所以决定原子种类的粒子是c,故A错误;
B.电子几乎没有质量,原子的质量集中在中子b和质子c上,故B错误;
C.在原子中,中子和质子的个数不一定相等,故C错误;
D.在原子中,正电荷数和负电荷数相等,即质子和电子的个数一定相同,故D正确。
故选D。
9.B
知识点:元素的种类与分布
解析:A、根据地壳中元素含量由多到少为氧、硅、铝、铁分析;
B、根据单质中元素化合价为0,化合物中元素化合价代数和为0分析;
C、根据空气中各成分体积含量分析;
D、根据原子序数分析。
A、地壳中元素含量由多到少为氧、硅、铝、铁,不符合题意;
B、SO2中硫元素化合价为+4价,S中硫元素为0价,H2S中硫元素为-2价,符合题意;
C、空气中物质体积由多到少为氮气、氧气、稀有气体、二氧化碳,不符合题意;
D、原子序数由小到大为碳、氮、氧,不符合题意;
故选B。
10.C
知识点:元素的种类与分布
解析:根据食品中各成分为元素的成分而与存在形态无关分析。
生活中常会见到“加碘盐”、“含氟牙膏”、“加铁酱油”中的“碘”、“氟”、“铁”指的是元素;
故选C。
11.A
知识点:元素的种类与分布
解析:A、根据元素名称带“钅”的为金属元素分析;
B、根据金属与金属元素分析;
C、根据稀有气体元素的种类分析;
D、根据必需的微量元素种类分析。
A、 钙、镁、钡、铜、铁、汞都属于金属元素,符合题意;
B、金属于金属元素,不符合题意;
C、 氯 不属于稀有气体元素,不符合题意;
D、铅不属于必需的微量元素,不符合题意;
故选A。
12.B
知识点:元素的符号及其意义
解析:分析各个选项中符号的意义即可。
A.N的意义:①氮元素;②一个氮原子,但是氮气用N2表示,故A错误;
B.Mg的意义:①镁元素;②一个镁原子;③单质镁,故B正确;
C.O2的意义:①一个氧分子;②氧气,但是不能表示氧原子,故C错误;
D.H的意义:①一个氢原子;②氢元素,但是不能表示氢气(H2),故D错误。
故选B。
13.A
知识点:元素的符号及其意义
解析:根据元素符号“一大二小”的书写原则分析。
镍的元素符号为 Ni,A正确。
故选A。
14.C
知识点:元素周期表
解析:(1)如果元素名字中含有金字旁,则为金属元素;否则为非金属元素;
(2)(2)(4)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,正下方的数字为相对原子质量,左上角的字母为元素符号。
A.铷中含有金字旁,则铷元素属于金属元素,故A错误;
B.铷原子的相对原子质量为85.47,故B错误;
C.铷元素的元素符号为Rb,故C正确;
D.铷原子序数为37,而质子数等于原子序数,那么质子数为37,故D错误。
故选C。
15.D
知识点:元素周期表
解析:从元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量。
A、硼为非金属元素,不符合题意;
B、 碳的原子序数是6,不符合题意;
C、 铝是地壳中含量最高的金属元素,地壳中含量最高的元素是氧元素,不符合题意;
D、相对原子质量大则原子质量大,三种原子中铝的相对原子质量最大,则质量最大的是铝 ,符合题意;
故选D。
16.A
知识点:相对原子质量
解析:原子内部的微粒包括电子、质子和中子;质子数等于核外电子数;中子不带电,据此分析计算。
因为中子不带电,所以该原子内部有14个中子,
那么质子数和核外电子数的和就是:40-14=26。
因为质子数和核外电子数相等,
所以质子数为:26÷2=13。
因为相对原子质量=质子数+中子数,
所以该原子的相对原子质量为:13+14=27。
故选A。
17.B
知识点:相对原子质量
解析:根据相对原子质量定义分析。
①相对原子质量是一个原子质量与碳原子质量的1/12之比,错误;②相对原子质量是一个原子质量与碳原子质量的1/12之比,错误;③相对原子质量的单位是“1”,错误;④相对原子质量的近似值为质子数和中子数之和,正确;⑤一般所指的是相对原子质量的近似值,正确;
故选B。
18.B
知识点:相对原子质量
解析:根据相对原子质量定义分析。
实际质量为2M克的一种元素的原子相对原子质量为;
故答案为:B。
19.C
知识点:相对原子质量
解析:A、根据原子大小主要跟原子电子层数有关,进行解答;B、根据图示可知氧原子质量是碳12原子的 倍,进行解答;C、根据图示可知:一个氧原子的质量相当于16个 碳-12原子质量的 的质量,进行解答;D、根据图示可知:碳12原子质量小于氧原子质量,进行解答.本题考查学生对相对原子质量概念的理解与掌握.相对原子质量是以一个碳-12原子质量的 作为标准,任何一个原子的真实质量跟一个碳-12原子质量的 的比值,称为该原子的相对原子质量。
解:A、根据原子大小主要跟原子电子层数有关,原子十分微小,不能说碳12原子象西瓜一样大;故A错误;
B、根据图示可知氧原子质量是碳12原子的 倍,故B错误;
C、根据图示可知:一个氧原子的质量相当于16个碳-12原子质量的 的质量,所以氧原子的质量与碳12原子质量的1/12的比值是16;故C正确;
D、根据图示可知:碳12原子质量小于氧原子质量,故D错误。
故答案为:C
20.水分子
知识点:分子的定义与分子的特性
解析:根据分子的性质解答。
保持水的化学性质的最小微粒是水分子。
21.(1)氢气;2:1;氢元素和氧元素组成;水氢气+氧气 (2)、
知识点:水的组成和主要性质;分子的定义与分子的特性
解析:(1)根据电解水的现象及结论分析;
(2)根据氢分子和氧分子的构成分析。
(1) 图1试管1中产生的气体体积多,为氢气, 试管1、2中的气体体积比约 2:1;该实验说明水由氢元素和氧元素组成的,电解水的方字表达式为水氢气+氧气;
(2)水通电生成氢气和氧气,每个氢分子由2个氢原子构成,每个氧分子由2个氧原子构成,微粒结构图为、;
故答案为:(1)氢气;2:1;氢元素和氧元素组成;水氢气+氧气;(2)、。
22.(1)木质部 (2)6 (3)12000
知识点:茎的形态结构;浮力大小的计算;分子和原子的区别和联系
解析:木质茎从外向内分为树皮,韧皮部,形成层,木质部,髓;原子电中性,质子带正电,核外电子带负电,中子不带电;F浮=ρ液gV排;
(1)a是木质部;
(2)原子电中性,质子带正电,核外电子带负电,中子不带电,所以其 则其核外有6个电子。
(3) 若独木舟漂浮在河面上,排开水的体积为1.2米3了,则其受到水的浮力为12000牛。
F浮=ρ液gV排 = 1.0×103千克/米×10N/kg×1.2米3 =12000N;
故答案为:(1)木质部(2)6(3)12000
23.m﹣x﹣2
知识点:原子的构成与探索过程
解析:在原子中,质子数=电子数=核电荷数,据此分析解答。
R2+是R原子失去2个电子得到的,则R原子核外电子数为:x+2。根据“质子数=核外电子数”可知,R原子的质子数为x+2,那么中子数为:m-(x+2)=m-x-2。
24.正;负;相等
知识点:原子的构成与探索过程
解析:根据原子结构的知识分析解答。
物体内有两种不同的带电粒子,一种是质子,带正电,另一种是电子,带负电。因为通常情况下带正电的质子的数量与带负电的电子的数量相等,正负电荷能相互抵消,所以整个物体没有体现带电性。
25.丙;乙;甲
知识点:元素的种类与分布
解析:根据人体、地壳、海水中元素的含量分析。
人体中氧元素含量最高,其次是碳元素,故丙为人体中元素的分布图,海水中氧最高,然后是氢,故为乙图,地壳中最高元素为氧,其次是硅,故为甲图;
故答案为:丙;乙;甲。
26.N;O;Fe;H;O;o
知识点:元素的符号及其意义
解析:根据空气、地壳、地核、海水、人体中含量最多的元素分析。
空气中含量最多的元素为氮元素,符号为N; 地壳中含量最多的元素为氧,符号为O; 地核中含量最多的元素为铁,符号为Fe; 太阳中含量最多的元素氢,符号为H;海水中含量最多的元素为氧,符号为O;人体中含量最多的元素为氧,符号为O;
故答案为:N;O;Fe;H;O ;O。
27.Mg;Au;C;Si;Fe;Ag
知识点:元素的符号及其意义
解析:根据各元素符号书写方法分析。
镁的元素符号为Mg,金的元素符号为 Au ,碳的元素符号为C,硅的元素符号为Si,铁的元素符号为Fe,银的符号为Ag;
故答案为:Mg;Au;C;Si;Fe;Ag 。
28.(1)③
(2)SO2或SO3
知识点:元素周期表
解析:(1)在元素周期表中,左上角的数字就是原子序数,也就是它在元素周期表中的位置;
(2)根据图片确定元素⑥的名称,再确定它和氧元素组成化合物的名字和化学式。
(1)根据甲图可知,左上角的数字为8,即氧元素的原子序数为8,第一行有2种元素,那么它应该在周期表第二行的第6个位置,故选③;
(2)根据图片可知,元素⑥为硫元素,它和氧元素可以生成二氧化硫或三氧化硫气体,写作SO2或SO3。
29.(1)门捷列夫
(2)12.01;S
(3)从左到右依次增大
知识点:元素周期表
解析:(1)根据门捷列夫编制元素周期表分析;
(2)根据元素周期表中最下方数字为相对原子质量分析;
(3)根据元素周期表信息中左上角数字为原子序数分析。
(1) 门捷列夫编制元素周期表;
(2)碳的相对原子质量为12.01,16号元素为硫元素,符号为S;
(3)由表中所给信息可知,每一周期元素原子序数从左到右依次增大;
故答案为:(1) 门捷列夫 ;12.01;S;(3)从左到右依次增大。
30.(1)不会;原子核
(2)B (3)C
知识点:原子的构成与探索过程
解析:(1)原子分布均匀,则α粒子受到的排斥力大小几乎相同,那么它们的偏转角度相同,就不会有发生大角度散射的情况。原子核在原子中心,体积很小但是质量很大。
(2)α粒子的运动方向不变,说明它们几乎没有受到原子核的排斥力,即原子内部大部分都是空的,据此分析解答;
(3)根据原子结构的特点判断。
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是原子核。
(2)1 μm金箔包含了3 000层左右的金原子,绝大多数α粒子穿过后方向不变,说明:原子内部绝大部分空间是空的,故选B。
(3)原子中心为原子核,质量很大体积很小,周围是绕核高速运动的电子,原子内部大部分都是空的,故选C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
华师大版八上期末专题复习: 粒子与元素
一、单选题
1.如图是教材中用来表示电解水过程的示意图(其中“O”“●”分别表示氢原子和氧原子)分析示意图,可作出的正确判断是( )
A.常温常压下水可以分解
B.氢原子在该变化过程中不可再分
C.1个水分子中含有1个氢分子和1个氧原子
D.电解水的最终产物是氢、氧原子
2.为了探究水电解的微观过程,王玲同学做了一些分子、原子的模型,其中能表示构成水的微粒的是( )
A. B. C. D.
3.若用" "表示氢原子,用“ "表示氧原子,则水分子的模型可表示为( )。
A. B. C. D.
4.下列物质的分子模型可用“ ”表示的是( )
A.氮分子 B.氯分子 C.氯化氢分子 D.甲烷分子
5.十九世纪初,意大利科学家阿伏加德罗在总结前人工作的基础上,提出的分子概念认为:①一切物质都是由分子组成的;②分子由原子构成;③原子不能独立存在;④分子是保持物质化学性质的一种粒子;⑤分子的质量等于构成它的原子的质量之和;⑥分子在不停的运动。通过你的学习,你认为上述观点中存在明显不足的是( )
A.①②⑤ B.①③ C.④⑤⑥ D.③⑤
6.分子和原子的主要区别是( )
A.分子大,原子小
B.分子在化学反应中可以再分,而原子不能
C.分子能构成物质,而原子不能
D.构成物质的分子之间有作用力,而原子没有
7.下列有关分子、原子和离子的说法正确的是( )
A.分子是保持物质性质的一种粒子
B.分子很小,所以没有质量
C.分子、原子、离子都可以构成物质
D.在化学反应中,分子可以再分,原子也可以再分
8.如图为某原子结构模型的示意图,其中a、b、c是构成该原子的三种不同粒子,下列说法正确的是( )
A.决定该原子种类的粒子是b B.原子的质量集中在a和c上
C.原子中b与c的数目一定相同 D.原子中a与c的数目一定相同
9.下列排序正确的是( )
A.地壳中元素的含量:
B.硫元素的化合价:
C.空气中物质的质量:
D.原子序数排列:
10.生活中常会见到“加碘盐”、“含氟牙膏”、“加铁酱油”,其中的“碘”、“氟”、“铁”指的是( )
A.原子 B.离子 C.元素 D.分子
11.下列元素分类正确的是( )
A.金属元素:钙、镁、钡、铜、铁、汞
B.非金属元素:碳、氢、氧、氮、磷、金
C.稀有气体元素:氦、氖、氩、氪、氯、氡
D.人体必需的微量元素:铁、碘、氟、硒、钙、铅
12.下列符号既可表示一个原子,又可表示一种元素,还能表示一种物质的是( )
A.N B.Mg C.O2 D.H
13.国际通用的元素符号是用1个或2个拉丁文字母表示的,其中第一个字母大写,第二个字母小写。镍元素的拉丁文名称为Niccolum,则镍的元素符号为( )
A.Ni B.NI C.n D.Na
14.我国北斗卫星导航系统应用了铷原子钟。如图是铷在元素周期表中的信息。下列有关铷的说法正确的是( )
A.铷元素属于非金属元素 B.铷原子的质量是85.47g
C.铷元素的元素符号为Rb D.铷原子核内有37个中子
15.如图是元素周期表的一部分。下列说法正确的是( )
A.硼为金属元素
B.碳的原子序数是12.01
C.铝是地壳中含量最高的元素
D.三种原子中质量最大的是铝
16.1854年法国化学家德维尔在实验室中意外地发现一种新元素。已知该元素的一个原子中含有40个微粒,其中14个微粒不带电,则该原子的相对原子质量是( )
A.27 B.26 C.54 D.34
17.以下关于相对原子质量的叙述正确的是( )
①相对原子质量就是一个原子质量
②相对原子质量就是一个碳原子质量
③相对原子质量的单位是“千克”
④相对原子质量的近似值为质子数和中子数之和
⑤一般所指的是相对原子质量的近似值
A.③④⑤ B.④⑤ C.③⑤ D.②④⑤
18.C-12原子的实际质量为M克,则实际质量为2M克的一种元素的原子相对原子质量为( )
A.24M B.24 C.2 M D.2
19.如图形象说明了相对原子质量的含义,从图中获得的信息正确的是( )
A.碳12原子象西瓜一样大
B.氧原子质量是碳12原子的1.4倍
C.氧原子的质量与碳12原子质量的 的比值是16
D.碳12原子质量比氧原子质量大
二、填空题
20.保持水的化学性质的最小微粒是 。
21.小科通过微信公号“胜哥课程”观看了《水的电解》科学视频后,对相关知识有了一定的理解。
水在通电的条件下可以发生化学反应,请根据图1和图2回答问题。
图1.水的电解 图2.电解水的微观示意图
(1)图1是电解水的实验,试管1中产生的气体是 , 试管1、2中的气体体积比约 ,这个实验说明水是由 ,电解水的文字表达式为 。
(2)请在图2中用“ ”、“ ”表示反应后的生成物。
22.近期,考古专家发现了唐开元前后的独木舟,为我国独木舟发展的历史研究提供了重要实物资料。
(1)如图是茎的结构示意图,制作独木舟主要取材于茎中结构a,a为 。
(2)确定独木舟建造于唐开元前后,是利用碳—14测定的。碳—14原子核中有8个中子,6个质子,则其核外有 个电子。
(3)若独木舟漂浮在河面上,排开水的体积为1.2米3了,则其受到水的浮力为 牛。(河水密度取1.0×103千克/米)
23.已知R原子的相对原子质量m与其原子核内的质子数和中子数之和在数值上相等.若R2+核外有x个电子,则其原子核内的中子数为 .(用含x、m的代数式表示)
24.物体内有两种不同的带电粒子,一种是质子,带 电,另一种是电子,带 电。因为通常情况下带正电的质子的数量与带负电的电子的数量 ,正负电荷能相互抵消,所以整个物体没有体现带电性。
25.根据如图甲、乙、丙三幅元素含量示意图,试推测元素分布领域(填图下序号):分布在人体中的是 ;分布在海水中的是 ;分布在地壳中的是 。
26.空气中含量最多的元素为 ,地壳中含量最多的元素为 ,地核中含量最多的元素为 ,太阳中含量最多的元素为 ,海水中含量最多的元素为 ;人体中含量最多的元素为 。(均填元素符号)
27.成语中被填的字与元素名称谐音,根据下面的示范,用相应元素符号填写成语。
高山(S)水,功高(Ca)世,
十全十 ,拾 不昧,
雪中送 ,叶落 根,
石心肠,火树 花。
28.如图是元素周期表的一部分。根据图片信息可以知道:
(1)氧元素在图乙中的 位置 (填图乙中的序号)。
(2)氧元素可以与图乙中的元素⑥组成多种物质,请写出其中一种物质的化学式: 。
29.元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
认真分析信息,回答:
(1)很多科学家对元素周期表的发现和完善做出了贡献,请写出其中一位科学家的名字: 。
(2)查出碳的相对原子质量是 ,写出16号元素的元素符号 。
(3)上表中每一周期元素原子序数的变化规律是 。
三、实验探究题
30.探究原子结构的奥秘。
(情景提供)19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
(提出问题)电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
(进行实验)1910年英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。
实验做法如图所示:
⑴放射源——放射性物质放出α粒子(带正电荷),质量是电子质量的7 000倍;
⑵金箔——作为靶子,厚度1 μm,重叠了3 000层左右的原子;
⑶荧光屏——α粒子打在上面发出闪光;
⑷显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度α粒子的到达情况。
(收集证据)绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
(猜想与假设)α粒子遇到电子后,就像飞行的子弹碰到灰尘一样,运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
(解释与结论)
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就 (填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是 。
(2)1 μm金箔包含了3 000层左右的金原子,绝大多数α粒子穿过后方向不变,说明______________。
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
(3)科学家对原子结构的探究经历了三个过程,通过α粒子散射实验,你认为原子结构为以下的 。
答案解析部分
1.B
知识点:构成物质的粒子模型
解析:A、根据水通电发生分解反应分析;
B、根据原子化学变化中不能改变分析;
C、根据水分子由氢、氧原子构成分析;
D、根据电解水的生成物分析。
A、水需在通电作用下分解,不符合题意;
B、氢原子在该变化过程中不可再分,只是重新组合 ,符合题意;
C、 1个水分子中含有2个氢原子和1个氧原子 ,不符合题意;
D、 电解水的最终产物是氢分子和氧分子,不符合题意;
故选B。
2.C
知识点:构成物质的粒子模型
解析:根据对水分子结构的认识判断。
根据化学式H2O可知,水分子由两个氢原子和一个氧原子构成,故C正确,而A、B、D错误。
故选C。
3.D
知识点:构成物质的粒子模型
解析:根据一个水分子是由2个氢原子和1个氧原子构成分析。
一个水分子是由2个氢原子和1个氧原子构成,所以水分子的模型为;
故选D。
4.C
知识点:分子的定义与分子的特性
解析:根据分子模型确定组成原子的种类和个数,然后对各个选项进行判断即可。
根据分子模型 可知,该分子由两种原子构成,且每种原子只有一个。
A.氮分子N2由两个氮原子构成,故A不合题意;
B.氯分子Cl2由两个氯原子构成,故B不合题意;
C.氯化氢分子HCl由一个H原子和一个Cl原子构成,故C符合题意;
D.甲烷分子CH4由一个C原子和4个氢原子构成,故D不合题意。
故选C。
5.B
知识点:分子的定义与分子的特性
解析:根据物质组成的知识分析即可。
①分子、原子和离子都是构成物质的基本微粒,故①错误;
②分子由原子构成,故②正确;
③金属单质、固态非金属单质和稀有气体都是由原子直接构成的,故③错误;
④分子是保持物质化学性质的一种粒子,故④正确;
⑤分子的质量等于构成它的原子的质量之和,故⑤正确;
⑥分子在不停的运动,故⑥正确。
因此上述观点中存在明显不足的是①③。
故选B。
6.B
知识点:分子和原子的区别和联系
解析:根据对分子和原子的认识分析判断。
A.分子由原子构成,但是不同原子的大小不同,因此分子不一定比原子大,故A错误;
B.分子在化学反应中可以再分,而原子不能,故B正确;
C.分子和原子都是构成物质的基本微粒,故C错误;
D.分子之间存在作用力,原子之间也存在作用力,故D错误。
故选B。
7.C
知识点:分子和原子的区别和联系
解析:根据对分子、原子和离子的认识分析判断。
A.分子是保持物质化学性质的最小微粒,故A错误;
B.分子很小,但是却有质量,故B错误;
C.分子、原子、离子都是构成物质的基本微粒,故C正确;
D.在化学反应中,分子可以再分,原子不能再分,因此原子是化学变化中的最小微粒,故D错误。
故选C。
8.D
知识点:原子的构成与探索过程
解析:原子中间为原子核,原子核由带正电的质子和不带电的中子构成,核外是绕核高速旋转的带负电的电子,据此分析判断。
根据图片可知,a为电子、b为中子,c为质子。
A.不同的原子,原子序数不同;因为质子数=原子序数,所以决定原子种类的粒子是c,故A错误;
B.电子几乎没有质量,原子的质量集中在中子b和质子c上,故B错误;
C.在原子中,中子和质子的个数不一定相等,故C错误;
D.在原子中,正电荷数和负电荷数相等,即质子和电子的个数一定相同,故D正确。
故选D。
9.B
知识点:元素的种类与分布
解析:A、根据地壳中元素含量由多到少为氧、硅、铝、铁分析;
B、根据单质中元素化合价为0,化合物中元素化合价代数和为0分析;
C、根据空气中各成分体积含量分析;
D、根据原子序数分析。
A、地壳中元素含量由多到少为氧、硅、铝、铁,不符合题意;
B、SO2中硫元素化合价为+4价,S中硫元素为0价,H2S中硫元素为-2价,符合题意;
C、空气中物质体积由多到少为氮气、氧气、稀有气体、二氧化碳,不符合题意;
D、原子序数由小到大为碳、氮、氧,不符合题意;
故选B。
10.C
知识点:元素的种类与分布
解析:根据食品中各成分为元素的成分而与存在形态无关分析。
生活中常会见到“加碘盐”、“含氟牙膏”、“加铁酱油”中的“碘”、“氟”、“铁”指的是元素;
故选C。
11.A
知识点:元素的种类与分布
解析:A、根据元素名称带“钅”的为金属元素分析;
B、根据金属与金属元素分析;
C、根据稀有气体元素的种类分析;
D、根据必需的微量元素种类分析。
A、 钙、镁、钡、铜、铁、汞都属于金属元素,符合题意;
B、金属于金属元素,不符合题意;
C、 氯 不属于稀有气体元素,不符合题意;
D、铅不属于必需的微量元素,不符合题意;
故选A。
12.B
知识点:元素的符号及其意义
解析:分析各个选项中符号的意义即可。
A.N的意义:①氮元素;②一个氮原子,但是氮气用N2表示,故A错误;
B.Mg的意义:①镁元素;②一个镁原子;③单质镁,故B正确;
C.O2的意义:①一个氧分子;②氧气,但是不能表示氧原子,故C错误;
D.H的意义:①一个氢原子;②氢元素,但是不能表示氢气(H2),故D错误。
故选B。
13.A
知识点:元素的符号及其意义
解析:根据元素符号“一大二小”的书写原则分析。
镍的元素符号为 Ni,A正确。
故选A。
14.C
知识点:元素周期表
解析:(1)如果元素名字中含有金字旁,则为金属元素;否则为非金属元素;
(2)(2)(4)在元素周期表中,中间的汉字为元素名称,左上角的数字为原子序数,正下方的数字为相对原子质量,左上角的字母为元素符号。
A.铷中含有金字旁,则铷元素属于金属元素,故A错误;
B.铷原子的相对原子质量为85.47,故B错误;
C.铷元素的元素符号为Rb,故C正确;
D.铷原子序数为37,而质子数等于原子序数,那么质子数为37,故D错误。
故选C。
15.D
知识点:元素周期表
解析:从元素周期表可以获得的信息:左上角的数字表示原子序数;字母表示该元素的元素符号;中间的汉字表示元素名称;汉字下面的数字表示相对原子质量。
A、硼为非金属元素,不符合题意;
B、 碳的原子序数是6,不符合题意;
C、 铝是地壳中含量最高的金属元素,地壳中含量最高的元素是氧元素,不符合题意;
D、相对原子质量大则原子质量大,三种原子中铝的相对原子质量最大,则质量最大的是铝 ,符合题意;
故选D。
16.A
知识点:相对原子质量
解析:原子内部的微粒包括电子、质子和中子;质子数等于核外电子数;中子不带电,据此分析计算。
因为中子不带电,所以该原子内部有14个中子,
那么质子数和核外电子数的和就是:40-14=26。
因为质子数和核外电子数相等,
所以质子数为:26÷2=13。
因为相对原子质量=质子数+中子数,
所以该原子的相对原子质量为:13+14=27。
故选A。
17.B
知识点:相对原子质量
解析:根据相对原子质量定义分析。
①相对原子质量是一个原子质量与碳原子质量的1/12之比,错误;②相对原子质量是一个原子质量与碳原子质量的1/12之比,错误;③相对原子质量的单位是“1”,错误;④相对原子质量的近似值为质子数和中子数之和,正确;⑤一般所指的是相对原子质量的近似值,正确;
故选B。
18.B
知识点:相对原子质量
解析:根据相对原子质量定义分析。
实际质量为2M克的一种元素的原子相对原子质量为;
故答案为:B。
19.C
知识点:相对原子质量
解析:A、根据原子大小主要跟原子电子层数有关,进行解答;B、根据图示可知氧原子质量是碳12原子的 倍,进行解答;C、根据图示可知:一个氧原子的质量相当于16个 碳-12原子质量的 的质量,进行解答;D、根据图示可知:碳12原子质量小于氧原子质量,进行解答.本题考查学生对相对原子质量概念的理解与掌握.相对原子质量是以一个碳-12原子质量的 作为标准,任何一个原子的真实质量跟一个碳-12原子质量的 的比值,称为该原子的相对原子质量。
解:A、根据原子大小主要跟原子电子层数有关,原子十分微小,不能说碳12原子象西瓜一样大;故A错误;
B、根据图示可知氧原子质量是碳12原子的 倍,故B错误;
C、根据图示可知:一个氧原子的质量相当于16个碳-12原子质量的 的质量,所以氧原子的质量与碳12原子质量的1/12的比值是16;故C正确;
D、根据图示可知:碳12原子质量小于氧原子质量,故D错误。
故答案为:C
20.水分子
知识点:分子的定义与分子的特性
解析:根据分子的性质解答。
保持水的化学性质的最小微粒是水分子。
21.(1)氢气;2:1;氢元素和氧元素组成;水氢气+氧气 (2)、
知识点:水的组成和主要性质;分子的定义与分子的特性
解析:(1)根据电解水的现象及结论分析;
(2)根据氢分子和氧分子的构成分析。
(1) 图1试管1中产生的气体体积多,为氢气, 试管1、2中的气体体积比约 2:1;该实验说明水由氢元素和氧元素组成的,电解水的方字表达式为水氢气+氧气;
(2)水通电生成氢气和氧气,每个氢分子由2个氢原子构成,每个氧分子由2个氧原子构成,微粒结构图为、;
故答案为:(1)氢气;2:1;氢元素和氧元素组成;水氢气+氧气;(2)、。
22.(1)木质部 (2)6 (3)12000
知识点:茎的形态结构;浮力大小的计算;分子和原子的区别和联系
解析:木质茎从外向内分为树皮,韧皮部,形成层,木质部,髓;原子电中性,质子带正电,核外电子带负电,中子不带电;F浮=ρ液gV排;
(1)a是木质部;
(2)原子电中性,质子带正电,核外电子带负电,中子不带电,所以其 则其核外有6个电子。
(3) 若独木舟漂浮在河面上,排开水的体积为1.2米3了,则其受到水的浮力为12000牛。
F浮=ρ液gV排 = 1.0×103千克/米×10N/kg×1.2米3 =12000N;
故答案为:(1)木质部(2)6(3)12000
23.m﹣x﹣2
知识点:原子的构成与探索过程
解析:在原子中,质子数=电子数=核电荷数,据此分析解答。
R2+是R原子失去2个电子得到的,则R原子核外电子数为:x+2。根据“质子数=核外电子数”可知,R原子的质子数为x+2,那么中子数为:m-(x+2)=m-x-2。
24.正;负;相等
知识点:原子的构成与探索过程
解析:根据原子结构的知识分析解答。
物体内有两种不同的带电粒子,一种是质子,带正电,另一种是电子,带负电。因为通常情况下带正电的质子的数量与带负电的电子的数量相等,正负电荷能相互抵消,所以整个物体没有体现带电性。
25.丙;乙;甲
知识点:元素的种类与分布
解析:根据人体、地壳、海水中元素的含量分析。
人体中氧元素含量最高,其次是碳元素,故丙为人体中元素的分布图,海水中氧最高,然后是氢,故为乙图,地壳中最高元素为氧,其次是硅,故为甲图;
故答案为:丙;乙;甲。
26.N;O;Fe;H;O;o
知识点:元素的符号及其意义
解析:根据空气、地壳、地核、海水、人体中含量最多的元素分析。
空气中含量最多的元素为氮元素,符号为N; 地壳中含量最多的元素为氧,符号为O; 地核中含量最多的元素为铁,符号为Fe; 太阳中含量最多的元素氢,符号为H;海水中含量最多的元素为氧,符号为O;人体中含量最多的元素为氧,符号为O;
故答案为:N;O;Fe;H;O ;O。
27.Mg;Au;C;Si;Fe;Ag
知识点:元素的符号及其意义
解析:根据各元素符号书写方法分析。
镁的元素符号为Mg,金的元素符号为 Au ,碳的元素符号为C,硅的元素符号为Si,铁的元素符号为Fe,银的符号为Ag;
故答案为:Mg;Au;C;Si;Fe;Ag 。
28.(1)③
(2)SO2或SO3
知识点:元素周期表
解析:(1)在元素周期表中,左上角的数字就是原子序数,也就是它在元素周期表中的位置;
(2)根据图片确定元素⑥的名称,再确定它和氧元素组成化合物的名字和化学式。
(1)根据甲图可知,左上角的数字为8,即氧元素的原子序数为8,第一行有2种元素,那么它应该在周期表第二行的第6个位置,故选③;
(2)根据图片可知,元素⑥为硫元素,它和氧元素可以生成二氧化硫或三氧化硫气体,写作SO2或SO3。
29.(1)门捷列夫
(2)12.01;S
(3)从左到右依次增大
知识点:元素周期表
解析:(1)根据门捷列夫编制元素周期表分析;
(2)根据元素周期表中最下方数字为相对原子质量分析;
(3)根据元素周期表信息中左上角数字为原子序数分析。
(1) 门捷列夫编制元素周期表;
(2)碳的相对原子质量为12.01,16号元素为硫元素,符号为S;
(3)由表中所给信息可知,每一周期元素原子序数从左到右依次增大;
故答案为:(1) 门捷列夫 ;12.01;S;(3)从左到右依次增大。
30.(1)不会;原子核
(2)B (3)C
知识点:原子的构成与探索过程
解析:(1)原子分布均匀,则α粒子受到的排斥力大小几乎相同,那么它们的偏转角度相同,就不会有发生大角度散射的情况。原子核在原子中心,体积很小但是质量很大。
(2)α粒子的运动方向不变,说明它们几乎没有受到原子核的排斥力,即原子内部大部分都是空的,据此分析解答;
(3)根据原子结构的特点判断。
(1)若原子质量、正电荷在原子内均匀分布,则极少数α粒子就不会发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是原子核。
(2)1 μm金箔包含了3 000层左右的金原子,绝大多数α粒子穿过后方向不变,说明:原子内部绝大部分空间是空的,故选B。
(3)原子中心为原子核,质量很大体积很小,周围是绕核高速运动的电子,原子内部大部分都是空的,故选C。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
