湖北省重点高中智学联盟2023-2024学年高二上学期12月联考化学试题(含答案)
文档属性
| 名称 | 湖北省重点高中智学联盟2023-2024学年高二上学期12月联考化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 848.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-04 11:02:37 | ||
图片预览



文档简介
湖北省重点高中智学联盟2023年秋季高二年级12月联考
化学试题
可能用到的相对原子质量:H1 C12 O16 Na23 Cl35.5 Ca40 Ba137
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.“新洲造”快船一号甲火箭以“一箭五星”的方式将德和三号五颗卫星送入预定轨道。下列可作为现代航天火箭推进剂的是( )
A.液氮—液氢 B.液氧—液氢
C.液态—液氧 D.液氮—液氧
2.设为阿伏加德罗常数的值。下列说法正确的是( )
A.溶液中含有的数目为
B.的溶液中离子数等于
C.电解饱和食盐水时,若阴阳两极产生气体的总体积为,则转移电子数为
D.氯化铵水溶液中与离子数之和大于
3.对下列各组化学反应的知识解读正确的是( )
选项 化学反应 知识解读
A 的燃烧热为
B 白磷比红磷更稳定
C 化合反应都是放热反应
D 吸热反应一定需要加热
4.一定温度时,恒容密闭容器中发生反应:,达平衡充入。下列说法错误的是( )
A.平衡向正反应方向移动 B.的分解率不变
C.的百分含量不变 D.气体颜色深浅不变
5.下列反应中的能量变化与图像一致的是( )
选项 能量变化 图像
A 在中燃烧
B 稀盐酸与稀溶液在烧杯中混合
C 将晶体与晶体放入烧杯中搅拌
D 向装有稀盐酸的试管中放入光亮的镁条
6.铜氨液可吸收除去原料气(、及少量、的混合气)中的,反应原理为: 。提高平衡吸收率的有利条件是( )
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
7.下列现象与电化学腐蚀无关的是( )
A.银制奖牌久置后表面变暗 B.铁锅炒菜后未洗净擦干容易生锈
C.“暖宝宝”撕开包装迅速发热 D.电工操作中不能将铝线和铜线接在一起
8.下列实验操作对应的离子方程式错误是( )
A.电解饱和溶液:
B.向溶液中滴入溶液:
C.向溶液中滴入稀溶液:
D.用溶液处理水垢中的:
9.控制合适的条件,将反应设计成如图所示原电池装置,下列说法正确的是( )
甲 乙
A.开始时,甲烧杯中石墨棒是负极
B.该反应处于平衡状态时无电流通过
C.电流计指针归“0”后,甲烧杯中加入时,指针再次向右偏转
D.反应达平衡后,甲烧杯中加入,盐桥中的阴离子向乙烧杯中迁移
10.一定温度下,向恒容密闭容器中加入氨基甲酸铵固体,发生反应:,下列情况不能说明反应达到平衡状态的是( )
A.混合气体的压强不变 B.混合气体的密度不变
C.混合气体的总物质的量不变 D.混合气体的平均相对分子质量不变
11.用下列实验装置进行相应实验,能达到实验目的的是( )
选项 A B C D
实验装置
实验目的 测定中和热 探究温度对化学平衡的影响 蒸发溶液得到固体 验证铁钉能发生析氢腐蚀
12.下列实验及现象的解释或得出结论正确的是( )
选项 实验及现象 解释或结论
A 用计测定同浓度溶液和溶液的,溶液的较大 酸性弱于
B 向含酚酞的溶液中加入少量固体,有白色沉淀生成,溶液颜色变浅 在溶液中存在水解平衡
C 向2支盛有不同浓度溶液的试管中同时加入溶液,未观察到明显的实验现象的差异 的浓度对该反应速率无影响
D 用计测得溶液的 的电离程度大于的水解程度
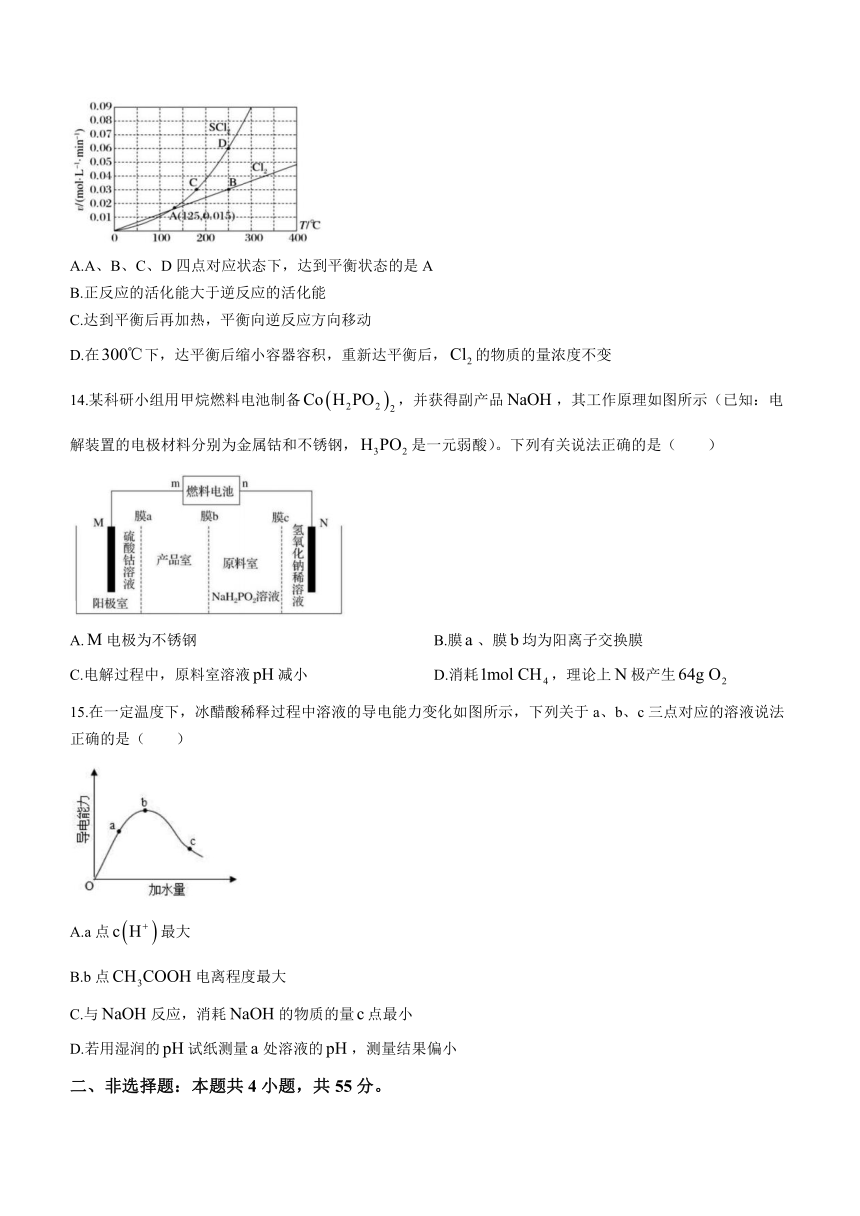
13.一定压强下,向密闭容器中充入和,发生反应:。和的消耗速率()与温度()的关系如图所示,以下说法中正确的是( )
A.A、B、C、D四点对应状态下,达到平衡状态的是A
B.正反应的活化能大于逆反应的活化能
C.达到平衡后再加热,平衡向逆反应方向移动
D.在下,达平衡后缩小容器容积,重新达平衡后,的物质的量浓度不变
14.某科研小组用甲烷燃料电池制备,并获得副产品,其工作原理如图所示(已知:电解装置的电极材料分别为金属钴和不锈钢,是一元弱酸)。下列有关说法正确的是( )
A.电极为不锈钢 B.膜、膜均为阳离子交换膜
C.电解过程中,原料室溶液减小 D.消耗,理论上极产生
15.在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,下列关于a、b、c三点对应的溶液说法正确的是( )
A.a点最大
B.b点电离程度最大
C.与反应,消耗的物质的量点最小
D.若用湿润的试纸测量处溶液的,测量结果偏小
二、非选择题:本题共4小题,共55分。
16.(14分)
肼()作为火箭发射的燃料助力神州十七号载人飞船发射取得圆满成功。
回答下列问题:
(1)以配合物为催化中心,可实现与转化为,反应历程如下所示:
①反应过程中涉及断裂的化学键是______,形成的化学键是______(填标号)。
a.键 b.键 c.键 d.键
②若将替换为,反应所得含氮物质是______。
(2)键能是指气态分子中化学键解离成气态原子所吸收的能量。已知部分化学键的键能如下表所示:
化学键
键能 391 463 497 945 193
则和反应的热化学方程式是______。
若用代替作氧化剂,反应释放的能量更大。
已知:
则的______。
(3)是二元弱碱,在水中的电离方式与相似。第二步电离的方程式是______,与形成正盐的化学式是______。
17.(14分)
人体血液中钙含量是判断身体健康状况的重要指标。某实验小组测定人体血液中浓度的实验步骤如下:
Ⅰ.取血样,加过量溶液,析出沉淀。
Ⅱ.将此沉淀洗涤后转移至锥形瓶中,加过量稀硫酸振荡,充分反应得,再用标准溶液滴定,计算血液中的浓度。
回答下列问题:
(1)标准溶液使用______(填“酸式”或“碱式”)滴定管盛装。滴定前,装有标准液的滴定管排气泡时,应选择下图中的______(填标号)。
a b c d
(2)滴定过程中发生反应的离子方程式是______,判断滴定达到终点的现象是______。
(3)从化学原理的角度考虑,步骤Ⅰ中加入溶液需过量的原因是______。
(4)每次取血样,重复实验步骤Ⅰ、Ⅱ,所得数据如表所示:
实验组数 1 2 3 4
标准溶液初始读数 1.00 0.00 4.40 0.50
滴定终点时标准溶液读数 11.00 10.05 15.60 10.45
则血液样品中浓度为______(保留2位有效数字)。若測第1组数据时,装标准溶液的滴定管水洗后没有润洗,则测定结果______(填“偏大”“偏小”或“无影响”)。
18.(13分)
含砷物质是常见的污染物,酸性废水(含和)中砷元素回收利用的流程如图所示。
已知:ⅰ.常温下,、
ⅱ.当溶液中离子的浓度小于时,可认为生成沉淀时该离子已沉淀完全。
回答下列问题:
(1)“碱浸”工序中随的加入,废水中含五价砷微粒的物质的量分数随的变化如图所示,其中。曲线表示微粒是______,常温下的水解常数______。
(2)“沉砷”工序发生的离子方程式是:,该反应平衡常数的表达式是______。当完全除去时,“沉砷”溶液的______(计算结果保留一位小数)。
(3)“还原”工序生成的是弱酸,用离子方程表示溶液显碱性的原因:______。
(4)“废渣”的成分是______。“滤液2”可返回到______工序中循环利用。
19.(14分)
丙烯是产量仅次于乙烯的重要基本有机原料之一,丙烷脱氢制丙烯技术已经工业化。
Ⅰ.无氧脱氢法:
(1)制丙烯的部分反应历程如图所示(TS代表过渡态,代表铂催化剂)。
由图可知,该反应的限速步骤是第______(填“一”或“二”)个断键的反应。有利于该反应自发进行的条件是______(填“高温”“低温”或“任意温度”)。
(2)在压强分别为和的条件下,在密闭容器中充入等量的,发生脱氢反应,和的平衡时物质的量分数随温度的变化如图所示。
①在a、b、c、d四条直线中,分别表示时和物质的量分数的是______、______。
②点对应的平衡常数______(以分压表示,分压=总压物质的量分数)。
Ⅱ.氧化脱氢法:
(3)在催化剂作用下,相同时间内,不同温度下氧化脱氢的转化率和的产率如下:
反应温度 465 480 495 510
的转化率 5.5 12.1 17.3 28.4
的产率 4.7 9.5 12.8 18.5
①的转化率随温度升高而上升的原因是_______(答出1条即可)。
②已知: 。随着温度升高,的选择性______(填“升高”“降低”或“不变”),可能的原因是______。
湖北省重点高中智学联盟2023年秋季高二年级12月联考
化学试题参考答案
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B D A D C C A A B D B B C C D
二、非选择题:本题共5小题,共55分。
16.(14分,每空2分)
(1)①ac bd ②
(2)
(3)
17.(14分,除标注外,每空2分)
(1)酸式 d
(2)
滴入最后半滴标准溶液,溶液恰好由无色变为浅红色,且半分钟内无变化
(3)增大的浓度,使的平衡向逆反应方向移动,确保被完全沉淀
(4)2.5 偏大
18.(13分,除标注外,每空2分)
(1) (2) (或大于13.8)
(3)
(4)(1分) 酸化
19.(14分,除标注外,每空2分)
(1)一 高温
(2)①c(1分)b(1分)②
(3)①温度升高,脱氢反应速率增大(或催化剂的活性增大,反应速率增大)
②降低温度升高,有利于被氧化成其他产物的副反应发生
化学试题
可能用到的相对原子质量:H1 C12 O16 Na23 Cl35.5 Ca40 Ba137
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的)
1.“新洲造”快船一号甲火箭以“一箭五星”的方式将德和三号五颗卫星送入预定轨道。下列可作为现代航天火箭推进剂的是( )
A.液氮—液氢 B.液氧—液氢
C.液态—液氧 D.液氮—液氧
2.设为阿伏加德罗常数的值。下列说法正确的是( )
A.溶液中含有的数目为
B.的溶液中离子数等于
C.电解饱和食盐水时,若阴阳两极产生气体的总体积为,则转移电子数为
D.氯化铵水溶液中与离子数之和大于
3.对下列各组化学反应的知识解读正确的是( )
选项 化学反应 知识解读
A 的燃烧热为
B 白磷比红磷更稳定
C 化合反应都是放热反应
D 吸热反应一定需要加热
4.一定温度时,恒容密闭容器中发生反应:,达平衡充入。下列说法错误的是( )
A.平衡向正反应方向移动 B.的分解率不变
C.的百分含量不变 D.气体颜色深浅不变
5.下列反应中的能量变化与图像一致的是( )
选项 能量变化 图像
A 在中燃烧
B 稀盐酸与稀溶液在烧杯中混合
C 将晶体与晶体放入烧杯中搅拌
D 向装有稀盐酸的试管中放入光亮的镁条
6.铜氨液可吸收除去原料气(、及少量、的混合气)中的,反应原理为: 。提高平衡吸收率的有利条件是( )
A.高温、高压 B.高温、低压 C.低温、高压 D.低温、低压
7.下列现象与电化学腐蚀无关的是( )
A.银制奖牌久置后表面变暗 B.铁锅炒菜后未洗净擦干容易生锈
C.“暖宝宝”撕开包装迅速发热 D.电工操作中不能将铝线和铜线接在一起
8.下列实验操作对应的离子方程式错误是( )
A.电解饱和溶液:
B.向溶液中滴入溶液:
C.向溶液中滴入稀溶液:
D.用溶液处理水垢中的:
9.控制合适的条件,将反应设计成如图所示原电池装置,下列说法正确的是( )
甲 乙
A.开始时,甲烧杯中石墨棒是负极
B.该反应处于平衡状态时无电流通过
C.电流计指针归“0”后,甲烧杯中加入时,指针再次向右偏转
D.反应达平衡后,甲烧杯中加入,盐桥中的阴离子向乙烧杯中迁移
10.一定温度下,向恒容密闭容器中加入氨基甲酸铵固体,发生反应:,下列情况不能说明反应达到平衡状态的是( )
A.混合气体的压强不变 B.混合气体的密度不变
C.混合气体的总物质的量不变 D.混合气体的平均相对分子质量不变
11.用下列实验装置进行相应实验,能达到实验目的的是( )
选项 A B C D
实验装置
实验目的 测定中和热 探究温度对化学平衡的影响 蒸发溶液得到固体 验证铁钉能发生析氢腐蚀
12.下列实验及现象的解释或得出结论正确的是( )
选项 实验及现象 解释或结论
A 用计测定同浓度溶液和溶液的,溶液的较大 酸性弱于
B 向含酚酞的溶液中加入少量固体,有白色沉淀生成,溶液颜色变浅 在溶液中存在水解平衡
C 向2支盛有不同浓度溶液的试管中同时加入溶液,未观察到明显的实验现象的差异 的浓度对该反应速率无影响
D 用计测得溶液的 的电离程度大于的水解程度
13.一定压强下,向密闭容器中充入和,发生反应:。和的消耗速率()与温度()的关系如图所示,以下说法中正确的是( )
A.A、B、C、D四点对应状态下,达到平衡状态的是A
B.正反应的活化能大于逆反应的活化能
C.达到平衡后再加热,平衡向逆反应方向移动
D.在下,达平衡后缩小容器容积,重新达平衡后,的物质的量浓度不变
14.某科研小组用甲烷燃料电池制备,并获得副产品,其工作原理如图所示(已知:电解装置的电极材料分别为金属钴和不锈钢,是一元弱酸)。下列有关说法正确的是( )
A.电极为不锈钢 B.膜、膜均为阳离子交换膜
C.电解过程中,原料室溶液减小 D.消耗,理论上极产生
15.在一定温度下,冰醋酸稀释过程中溶液的导电能力变化如图所示,下列关于a、b、c三点对应的溶液说法正确的是( )
A.a点最大
B.b点电离程度最大
C.与反应,消耗的物质的量点最小
D.若用湿润的试纸测量处溶液的,测量结果偏小
二、非选择题:本题共4小题,共55分。
16.(14分)
肼()作为火箭发射的燃料助力神州十七号载人飞船发射取得圆满成功。
回答下列问题:
(1)以配合物为催化中心,可实现与转化为,反应历程如下所示:
①反应过程中涉及断裂的化学键是______,形成的化学键是______(填标号)。
a.键 b.键 c.键 d.键
②若将替换为,反应所得含氮物质是______。
(2)键能是指气态分子中化学键解离成气态原子所吸收的能量。已知部分化学键的键能如下表所示:
化学键
键能 391 463 497 945 193
则和反应的热化学方程式是______。
若用代替作氧化剂,反应释放的能量更大。
已知:
则的______。
(3)是二元弱碱,在水中的电离方式与相似。第二步电离的方程式是______,与形成正盐的化学式是______。
17.(14分)
人体血液中钙含量是判断身体健康状况的重要指标。某实验小组测定人体血液中浓度的实验步骤如下:
Ⅰ.取血样,加过量溶液,析出沉淀。
Ⅱ.将此沉淀洗涤后转移至锥形瓶中,加过量稀硫酸振荡,充分反应得,再用标准溶液滴定,计算血液中的浓度。
回答下列问题:
(1)标准溶液使用______(填“酸式”或“碱式”)滴定管盛装。滴定前,装有标准液的滴定管排气泡时,应选择下图中的______(填标号)。
a b c d
(2)滴定过程中发生反应的离子方程式是______,判断滴定达到终点的现象是______。
(3)从化学原理的角度考虑,步骤Ⅰ中加入溶液需过量的原因是______。
(4)每次取血样,重复实验步骤Ⅰ、Ⅱ,所得数据如表所示:
实验组数 1 2 3 4
标准溶液初始读数 1.00 0.00 4.40 0.50
滴定终点时标准溶液读数 11.00 10.05 15.60 10.45
则血液样品中浓度为______(保留2位有效数字)。若測第1组数据时,装标准溶液的滴定管水洗后没有润洗,则测定结果______(填“偏大”“偏小”或“无影响”)。
18.(13分)
含砷物质是常见的污染物,酸性废水(含和)中砷元素回收利用的流程如图所示。
已知:ⅰ.常温下,、
ⅱ.当溶液中离子的浓度小于时,可认为生成沉淀时该离子已沉淀完全。
回答下列问题:
(1)“碱浸”工序中随的加入,废水中含五价砷微粒的物质的量分数随的变化如图所示,其中。曲线表示微粒是______,常温下的水解常数______。
(2)“沉砷”工序发生的离子方程式是:,该反应平衡常数的表达式是______。当完全除去时,“沉砷”溶液的______(计算结果保留一位小数)。
(3)“还原”工序生成的是弱酸,用离子方程表示溶液显碱性的原因:______。
(4)“废渣”的成分是______。“滤液2”可返回到______工序中循环利用。
19.(14分)
丙烯是产量仅次于乙烯的重要基本有机原料之一,丙烷脱氢制丙烯技术已经工业化。
Ⅰ.无氧脱氢法:
(1)制丙烯的部分反应历程如图所示(TS代表过渡态,代表铂催化剂)。
由图可知,该反应的限速步骤是第______(填“一”或“二”)个断键的反应。有利于该反应自发进行的条件是______(填“高温”“低温”或“任意温度”)。
(2)在压强分别为和的条件下,在密闭容器中充入等量的,发生脱氢反应,和的平衡时物质的量分数随温度的变化如图所示。
①在a、b、c、d四条直线中,分别表示时和物质的量分数的是______、______。
②点对应的平衡常数______(以分压表示,分压=总压物质的量分数)。
Ⅱ.氧化脱氢法:
(3)在催化剂作用下,相同时间内,不同温度下氧化脱氢的转化率和的产率如下:
反应温度 465 480 495 510
的转化率 5.5 12.1 17.3 28.4
的产率 4.7 9.5 12.8 18.5
①的转化率随温度升高而上升的原因是_______(答出1条即可)。
②已知: 。随着温度升高,的选择性______(填“升高”“降低”或“不变”),可能的原因是______。
湖北省重点高中智学联盟2023年秋季高二年级12月联考
化学试题参考答案
一、选择题:本题共15小题,每小题3分,共45分。每小题只有一个选项符合题目要求。
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B D A D C C A A B D B B C C D
二、非选择题:本题共5小题,共55分。
16.(14分,每空2分)
(1)①ac bd ②
(2)
(3)
17.(14分,除标注外,每空2分)
(1)酸式 d
(2)
滴入最后半滴标准溶液,溶液恰好由无色变为浅红色,且半分钟内无变化
(3)增大的浓度,使的平衡向逆反应方向移动,确保被完全沉淀
(4)2.5 偏大
18.(13分,除标注外,每空2分)
(1) (2) (或大于13.8)
(3)
(4)(1分) 酸化
19.(14分,除标注外,每空2分)
(1)一 高温
(2)①c(1分)b(1分)②
(3)①温度升高,脱氢反应速率增大(或催化剂的活性增大,反应速率增大)
②降低温度升高,有利于被氧化成其他产物的副反应发生
同课章节目录
