第3节 元素性质及其变化规律第一课时 课件(共25张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第3节 元素性质及其变化规律第一课时 课件(共25张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-04 13:02:35 | ||
图片预览







文档简介
(共25张PPT)
第三节 元素性质及其变化规律
第1课时
原子半径及其变化规律、元素的电离能及其变化规律
学习目标
1、通过让学生阅读课本,找出原子半径的测定方法,并总结原子半径变化规律。
2、通过原子半径大小的比较,让学生会根据电子排布解释原子得失电子能力的强弱。
3、通过讨论探究,让学生会判断电离能的大小。
在元素周期表中,随着原子序数的递增,元素基态原子的核外电子排布呈现周期性变化,元素的性质也呈现周期性变化。那么,元素哪些性质呈现周期性变化 元素性质周期性变化的本质是什么 如何运用元素周期表推测元素的基本性质
联想质疑
一、原子半径及其变化规律
原子半径是如何测定的?
一是共价半径,
二是是范德华半径;
三是金属半径。
一种方法是根据固态单质的密度;两个相邻原子的核间距为两个原子的半径之和,再通过实验来测定分子或固体中原子的核间距,从而求得相关原子的原子半径
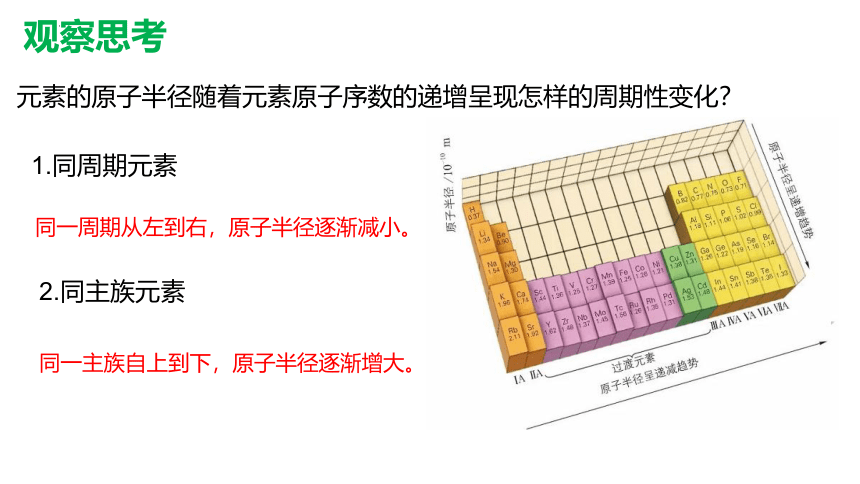
观察思考
元素的原子半径随着元素原子序数的递增呈现怎样的周期性变化?
1.同周期元素
2.同主族元素
同一周期从左到右,原子半径逐渐减小。
同一主族自上到下,原子半径逐渐增大。
同一周期自左至右原子半径逐渐减小,但变化幅度不大。
原因是同一周期过渡元素增加的电子都分布在(n-1)d轨道上,电子间的排斥作用与核对电子的吸引作用大致相当。
(2)过渡元素
1.影响微粒半径的因素主要是核电荷数和电子层数。
2.阳离子半径小于对应的原子半径,阴离子半径大于对应的原子半径,
3.电子层结构相同的离子,随核电荷数增大,离子半径减小,
4.不同价态的同种元素的离子,核外电子多的半径大,
微粒半径大小的比较方法
同周期中 ; 同主族中
如r(Na+)<r(Na),r(S)<r(S2-)。
如r(O2-)>r(F-)>r(Na+)>r(Mg2+)
如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
思考:
1、是否电子层数多的元素半径一定大于电子层数少的元素的原子半径?
2、“对于元素周期表中的一切元素,均满足同周期从左往右原子半径逐渐减小,同主族从上到下半径逐渐增大”这句话是否正确?为什么?
不一定。原子半径的大小由核电荷数与电子层两个因素综合决定,如碱金属元素的原子半径比它下一周期的卤族元素的原子半径大。
不正确。此规律仅适用于主族元素,而对于副族元素、0族元素原子半径大小不适用此规律。
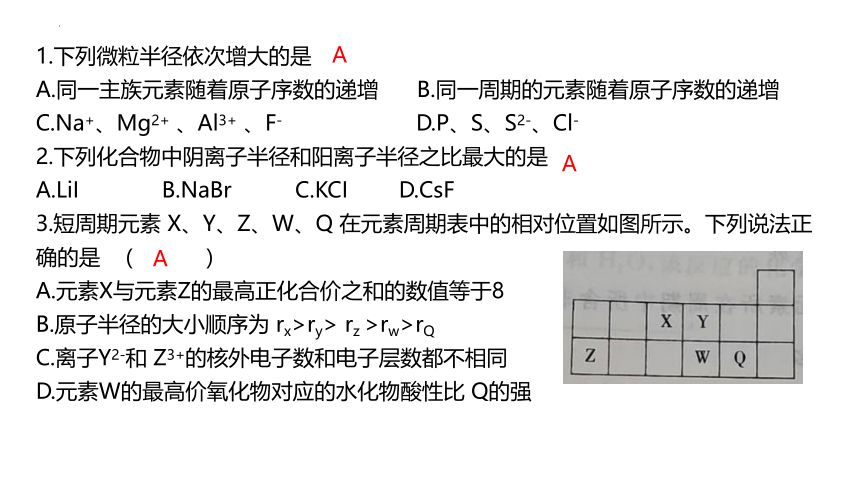
1.下列微粒半径依次增大的是
A.同一主族元素随着原子序数的递增 B.同一周期的元素随着原子序数的递增
C.Na+、Mg2+ 、Al3+ 、F- D.P、S、S2-、Cl-
2.下列化合物中阴离子半径和阳离子半径之比最大的是
A.LiI B.NaBr C.KCI D.CsF
3.短周期元素 X、Y、Z、W、Q 在元素周期表中的相对位置如图所示。下列说法正确的是 ( )
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为 rx>ry> rz >rw>rQ
C.离子Y2-和 Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物酸性比 Q的强
A
A
A
思考
元素周期表中元素原子得失电子能力呈现的递变规律是什么?如何利用原子半径和价电子数进行解释?
(1)除稀有气体元素外,同周期从左到右,元素原子获得电子的能力越来越强(失去电子的能力越来越弱)
(2)同主族自上而下,金属元素原子失去电子的能力越来越强(非金属元素原子获得电子的能力越来越弱)
(1)金属活动性顺序表中越靠前,金属原子失电子能力越强。
(3)同一周期的金属元素,从左往右,原子失电子能力依次减弱。
(4)金属与水或酸置换出氢气时,置换反应越容易发生,金属原子失电子能力越强。
(2)金属与盐溶液反应,较活泼金属(失电子能力强)置换出较不活泼的金属。
(5)最高价氧化物对应的水化物碱性越强,失电子能力越强。
元素原子得、失电子能力强弱的判断
1.元素原子失去电子能力(金属性/还原性)的判断依据
2.元素原子得到电子能力(非金属性/氧化性)的判断依据
(2)非金属元素最高价氧化物对应水化物的酸性越强,得电子能力越强。
(3)非金属元素的单质与氢气化合越容易,得电子能力越强;生成的气态氢化物越稳定,得电子能力越强。
(4)不同的非金属单质M和N在溶液中发生置换反应,若M能置换出N,则得电子能力M>N。
(1)同周期的非金属元素,从左到右得电子能力依次增强(不包括稀有气体)。
1、现有三种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4; ②1s22s22p63s23p3 ③1s22s22p63s23p5
则下列有关比较中,正确的是
A.失电子能力:③>①>② B.原子半径: ③>②>①
C.含氧酸的酸性:③>①>② D.气态氢化物稳定性: ③>①>②
2.短周期主族元素 X、Y、Z、W 的原子序数依次增大,X 原子 p原子轨道上未成对电子最多,Z的周期序数与族序数相等,基态时 W 原子 3p原子轨道上有 5 个电子,Y与W处于同一主族。下列说法正确的是
A.原子半径:r(X)C.Z 的最高价氧化物对应水化物的酸性比W的强
D.Y 的简单气态氢化物的热稳定性比 W的弱
D
B
3、运用元素周期律,判断下列语句,其中正确的是 。
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是ⅦA族,其氢化物的稳定性小于HCl
③根据同周期元素的失电子能力变化趋势,推出Al的金属性比Mg大
④第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
①②⑥
一、电离能
1、电离能定义:气态基态原子或气态基态离子失去一个电子所需要的最小能量。常用符号 I 表示,单位为kJ/mol。
2、第一电离能:
基态气态原子失去一个电子形成+1价气态阳离子所需的能量,叫做该元素的第一电离能,用符号I1表示. M (g) → M+ (g) + e- ; I1
第二电离能:M+ (g) → M2+ (g) + e- ; I2
第三电离能:M2+ (g) → M3+ (g) + e- ; I3
3.意义:判断金属元素的原子在气态时失去电子的难易程度,数值越小越易失电子。
1、钠原子失去一个电子,吸收能量还是放出能量?为什么?
2、气态铝原子失去一个电子变气态Al+ ,吸收的能量为577.5kJ/mol,若气态Al+再失去一个电子所要吸收的能量还是577.5 kJ/mol吗?为什么?
3、分析Al的电离能数据,你发现什么规律?试用原子结构知识加以解释,并推测同一元素不同级电离能的变化规律。
元素 I1 I2 I3 I4 I5
Al 577.5 1816.7 2744.8 11577 14842
探究一
同一元素不同能级电离能变化规律:逐级增大,且存在突跃 。
判断元素通常价态
1、试推测比较Na、Mg、Al的第一电离能大小,并从原子半径和核电荷数角度加以解释。据你推测,第三周期元素第一电离能的主要变化趋势是怎样的?
2、对照第三周期元素的第一电离能变化趋势,你还发现了哪些问题?试用原子结构知识加以解释。
3、对照1-36号元素第一电离能变化趋势图,你又发现了哪些新规律及问题?
思考:
5 10 15 20 25 30 35 原子序数
I1
H
He
Li
Ne
Na
Ar
K
Kr
5 10 15 20 25 30 35 原子序数
I1
N
Be
Mg
Ca
P
As
1-36 号元素第一电离能变化趋势
Li
Na
He
Ne
Ar
K
ⅡA
ⅤA
ⅠA
思考:
1、金属元素、稀有气体元素第一电离能大小?
2、第ⅡA和第ⅤA族元素电离能为什么会大于相邻元素?
【规律总结】
不同元素第一电离能的变化规律:
1、同周期元素I1从左到右呈增大趋势,碱金属元素的I1最小,稀有气体元素的I1最大。
2、同一主族元素I1从上到下逐渐减小。
3、元素的I1随原子序数的递增呈现周期性变化。
4、同周期元素I1变化存在反常现象: ⅡA>ⅢA, ⅤA>ⅥA
5、同周期过渡元素的I1变化不太规则,从左到右略有增加
1、根据下列五种元素的电离能数据(单位:kJ/mol),你能得到哪些信息?
元素代号 I1 I2 I3 I4
Q 2080 4000 6100 9400
R 500 4600 6900 9500
S 740 1500 7700 10500
T 580 1800 2700 11600
U 420 3100 4400 5900
根据你得到的信息,回答下面问题。
(1)在周期表中,最可能处于同一族的是( )
A . Q和R B .S和T C . T和U D . R和T E .R和U
(2)它们的氯化物的化学式,最可能正确的是( )
A . QCl2 B .RCl C . SCl3 D. TCl E. UCl4
(3)下列元素中,化学性质和物理性质最像Q元素的是( )
A . 硼(1s22s22p1) B . 铍(1s22s2) C . 锂(1s22s1) D .氢(1s1) E . 氦(1s2)
E
B
E
2、已知X、Y是主族元素,I为电离能,单位是KJ/mol。根据下表所列数据判断错误的是 ( )
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应。
元素 I1 I2 I3 I4
X 500 4600 6900 9500
Y 580 1800 2700 11600
D
3.X、Y、Z、W 为原子序数依次增大的前四周期元素,X的一种单质是天然存在的最坚硬矿物质,Z 原子最外层电子数为次外层电子数的三倍,W 基态原子的价电子排布为3d64s2。下列说法正确的是
A.原子半径:Z>Y>X B.元素的第一电离能:Z>Y>X
C.X、Y 最高价含氧酸的酸性:Y>X D.w2+价电子轨道表示式:
C
4.短周期元素原子组成的某种分子的结构式如图所示。X原子的核外电子只有一种运动状态;W、Y、Z位于同一周期,Z元素原子中 p轨道所含电子数与 s 轨道相等。E与W 有相同数目的价电子。下列说法错误的是
A.得电子能力:XB.简单阴离子半径:WC.同周期中,第一电离能大于Z的元素有 2种
D.同主族元素中,W 形成的气态氢化物最稳定
C
5.下图是原子序数为 1~19 的元素的第一电离能的变化曲线(其中部分元素的第一电离能已经标出数据)。结合元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列有关问题
(1)碱金属元素中 Li、Na、 K 的第一电离能分别为_____kJ·mol-1_____kJ·mol-1
______kJ·mol-1
(2)同主族中不同元素的第一电离能变化的规律为:
______________________
碱金属元素这一变化的规律与碱金属的活泼性的关系是_______________
(3)钙元素的第一电离能的数值范围为___________________
520
496
419
随着原子序数的递增,第一电离能逐渐变小
金属越活泼其第一电离能越小
大于419小于738
第三节 元素性质及其变化规律
第1课时
原子半径及其变化规律、元素的电离能及其变化规律
学习目标
1、通过让学生阅读课本,找出原子半径的测定方法,并总结原子半径变化规律。
2、通过原子半径大小的比较,让学生会根据电子排布解释原子得失电子能力的强弱。
3、通过讨论探究,让学生会判断电离能的大小。
在元素周期表中,随着原子序数的递增,元素基态原子的核外电子排布呈现周期性变化,元素的性质也呈现周期性变化。那么,元素哪些性质呈现周期性变化 元素性质周期性变化的本质是什么 如何运用元素周期表推测元素的基本性质
联想质疑
一、原子半径及其变化规律
原子半径是如何测定的?
一是共价半径,
二是是范德华半径;
三是金属半径。
一种方法是根据固态单质的密度;两个相邻原子的核间距为两个原子的半径之和,再通过实验来测定分子或固体中原子的核间距,从而求得相关原子的原子半径
观察思考
元素的原子半径随着元素原子序数的递增呈现怎样的周期性变化?
1.同周期元素
2.同主族元素
同一周期从左到右,原子半径逐渐减小。
同一主族自上到下,原子半径逐渐增大。
同一周期自左至右原子半径逐渐减小,但变化幅度不大。
原因是同一周期过渡元素增加的电子都分布在(n-1)d轨道上,电子间的排斥作用与核对电子的吸引作用大致相当。
(2)过渡元素
1.影响微粒半径的因素主要是核电荷数和电子层数。
2.阳离子半径小于对应的原子半径,阴离子半径大于对应的原子半径,
3.电子层结构相同的离子,随核电荷数增大,离子半径减小,
4.不同价态的同种元素的离子,核外电子多的半径大,
微粒半径大小的比较方法
同周期中 ; 同主族中
如r(Na+)<r(Na),r(S)<r(S2-)。
如r(O2-)>r(F-)>r(Na+)>r(Mg2+)
如r(Fe2+)>r(Fe3+),r(Cu+)>r(Cu2+)。
思考:
1、是否电子层数多的元素半径一定大于电子层数少的元素的原子半径?
2、“对于元素周期表中的一切元素,均满足同周期从左往右原子半径逐渐减小,同主族从上到下半径逐渐增大”这句话是否正确?为什么?
不一定。原子半径的大小由核电荷数与电子层两个因素综合决定,如碱金属元素的原子半径比它下一周期的卤族元素的原子半径大。
不正确。此规律仅适用于主族元素,而对于副族元素、0族元素原子半径大小不适用此规律。
1.下列微粒半径依次增大的是
A.同一主族元素随着原子序数的递增 B.同一周期的元素随着原子序数的递增
C.Na+、Mg2+ 、Al3+ 、F- D.P、S、S2-、Cl-
2.下列化合物中阴离子半径和阳离子半径之比最大的是
A.LiI B.NaBr C.KCI D.CsF
3.短周期元素 X、Y、Z、W、Q 在元素周期表中的相对位置如图所示。下列说法正确的是 ( )
A.元素X与元素Z的最高正化合价之和的数值等于8
B.原子半径的大小顺序为 rx>ry> rz >rw>rQ
C.离子Y2-和 Z3+的核外电子数和电子层数都不相同
D.元素W的最高价氧化物对应的水化物酸性比 Q的强
A
A
A
思考
元素周期表中元素原子得失电子能力呈现的递变规律是什么?如何利用原子半径和价电子数进行解释?
(1)除稀有气体元素外,同周期从左到右,元素原子获得电子的能力越来越强(失去电子的能力越来越弱)
(2)同主族自上而下,金属元素原子失去电子的能力越来越强(非金属元素原子获得电子的能力越来越弱)
(1)金属活动性顺序表中越靠前,金属原子失电子能力越强。
(3)同一周期的金属元素,从左往右,原子失电子能力依次减弱。
(4)金属与水或酸置换出氢气时,置换反应越容易发生,金属原子失电子能力越强。
(2)金属与盐溶液反应,较活泼金属(失电子能力强)置换出较不活泼的金属。
(5)最高价氧化物对应的水化物碱性越强,失电子能力越强。
元素原子得、失电子能力强弱的判断
1.元素原子失去电子能力(金属性/还原性)的判断依据
2.元素原子得到电子能力(非金属性/氧化性)的判断依据
(2)非金属元素最高价氧化物对应水化物的酸性越强,得电子能力越强。
(3)非金属元素的单质与氢气化合越容易,得电子能力越强;生成的气态氢化物越稳定,得电子能力越强。
(4)不同的非金属单质M和N在溶液中发生置换反应,若M能置换出N,则得电子能力M>N。
(1)同周期的非金属元素,从左到右得电子能力依次增强(不包括稀有气体)。
1、现有三种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4; ②1s22s22p63s23p3 ③1s22s22p63s23p5
则下列有关比较中,正确的是
A.失电子能力:③>①>② B.原子半径: ③>②>①
C.含氧酸的酸性:③>①>② D.气态氢化物稳定性: ③>①>②
2.短周期主族元素 X、Y、Z、W 的原子序数依次增大,X 原子 p原子轨道上未成对电子最多,Z的周期序数与族序数相等,基态时 W 原子 3p原子轨道上有 5 个电子,Y与W处于同一主族。下列说法正确的是
A.原子半径:r(X)
D.Y 的简单气态氢化物的热稳定性比 W的弱
D
B
3、运用元素周期律,判断下列语句,其中正确的是 。
①碱金属单质的熔点随原子序数的增大而降低
②砹(At)是ⅦA族,其氢化物的稳定性小于HCl
③根据同周期元素的失电子能力变化趋势,推出Al的金属性比Mg大
④第2周期非金属元素的气态氢化物溶于水后,水溶液均为酸性
⑤铊(Tl)与铝同主族,其单质既能与盐酸反应,又能与氢氧化钠溶液反应
⑥若X+和Y2-的核外电子层结构相同,则原子序数:X>Y
①②⑥
一、电离能
1、电离能定义:气态基态原子或气态基态离子失去一个电子所需要的最小能量。常用符号 I 表示,单位为kJ/mol。
2、第一电离能:
基态气态原子失去一个电子形成+1价气态阳离子所需的能量,叫做该元素的第一电离能,用符号I1表示. M (g) → M+ (g) + e- ; I1
第二电离能:M+ (g) → M2+ (g) + e- ; I2
第三电离能:M2+ (g) → M3+ (g) + e- ; I3
3.意义:判断金属元素的原子在气态时失去电子的难易程度,数值越小越易失电子。
1、钠原子失去一个电子,吸收能量还是放出能量?为什么?
2、气态铝原子失去一个电子变气态Al+ ,吸收的能量为577.5kJ/mol,若气态Al+再失去一个电子所要吸收的能量还是577.5 kJ/mol吗?为什么?
3、分析Al的电离能数据,你发现什么规律?试用原子结构知识加以解释,并推测同一元素不同级电离能的变化规律。
元素 I1 I2 I3 I4 I5
Al 577.5 1816.7 2744.8 11577 14842
探究一
同一元素不同能级电离能变化规律:逐级增大,且存在突跃 。
判断元素通常价态
1、试推测比较Na、Mg、Al的第一电离能大小,并从原子半径和核电荷数角度加以解释。据你推测,第三周期元素第一电离能的主要变化趋势是怎样的?
2、对照第三周期元素的第一电离能变化趋势,你还发现了哪些问题?试用原子结构知识加以解释。
3、对照1-36号元素第一电离能变化趋势图,你又发现了哪些新规律及问题?
思考:
5 10 15 20 25 30 35 原子序数
I1
H
He
Li
Ne
Na
Ar
K
Kr
5 10 15 20 25 30 35 原子序数
I1
N
Be
Mg
Ca
P
As
1-36 号元素第一电离能变化趋势
Li
Na
He
Ne
Ar
K
ⅡA
ⅤA
ⅠA
思考:
1、金属元素、稀有气体元素第一电离能大小?
2、第ⅡA和第ⅤA族元素电离能为什么会大于相邻元素?
【规律总结】
不同元素第一电离能的变化规律:
1、同周期元素I1从左到右呈增大趋势,碱金属元素的I1最小,稀有气体元素的I1最大。
2、同一主族元素I1从上到下逐渐减小。
3、元素的I1随原子序数的递增呈现周期性变化。
4、同周期元素I1变化存在反常现象: ⅡA>ⅢA, ⅤA>ⅥA
5、同周期过渡元素的I1变化不太规则,从左到右略有增加
1、根据下列五种元素的电离能数据(单位:kJ/mol),你能得到哪些信息?
元素代号 I1 I2 I3 I4
Q 2080 4000 6100 9400
R 500 4600 6900 9500
S 740 1500 7700 10500
T 580 1800 2700 11600
U 420 3100 4400 5900
根据你得到的信息,回答下面问题。
(1)在周期表中,最可能处于同一族的是( )
A . Q和R B .S和T C . T和U D . R和T E .R和U
(2)它们的氯化物的化学式,最可能正确的是( )
A . QCl2 B .RCl C . SCl3 D. TCl E. UCl4
(3)下列元素中,化学性质和物理性质最像Q元素的是( )
A . 硼(1s22s22p1) B . 铍(1s22s2) C . 锂(1s22s1) D .氢(1s1) E . 氦(1s2)
E
B
E
2、已知X、Y是主族元素,I为电离能,单位是KJ/mol。根据下表所列数据判断错误的是 ( )
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族的元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第3周期,它可与冷水剧烈反应。
元素 I1 I2 I3 I4
X 500 4600 6900 9500
Y 580 1800 2700 11600
D
3.X、Y、Z、W 为原子序数依次增大的前四周期元素,X的一种单质是天然存在的最坚硬矿物质,Z 原子最外层电子数为次外层电子数的三倍,W 基态原子的价电子排布为3d64s2。下列说法正确的是
A.原子半径:Z>Y>X B.元素的第一电离能:Z>Y>X
C.X、Y 最高价含氧酸的酸性:Y>X D.w2+价电子轨道表示式:
C
4.短周期元素原子组成的某种分子的结构式如图所示。X原子的核外电子只有一种运动状态;W、Y、Z位于同一周期,Z元素原子中 p轨道所含电子数与 s 轨道相等。E与W 有相同数目的价电子。下列说法错误的是
A.得电子能力:X
D.同主族元素中,W 形成的气态氢化物最稳定
C
5.下图是原子序数为 1~19 的元素的第一电离能的变化曲线(其中部分元素的第一电离能已经标出数据)。结合元素在元素周期表中的位置,分析图中曲线的变化特点,并回答下列有关问题
(1)碱金属元素中 Li、Na、 K 的第一电离能分别为_____kJ·mol-1_____kJ·mol-1
______kJ·mol-1
(2)同主族中不同元素的第一电离能变化的规律为:
______________________
碱金属元素这一变化的规律与碱金属的活泼性的关系是_______________
(3)钙元素的第一电离能的数值范围为___________________
520
496
419
随着原子序数的递增,第一电离能逐渐变小
金属越活泼其第一电离能越小
大于419小于738
