山东省临沂市临沭重点中学2023-2024学年高二上学期12月教学质量监测化学试题(PDF含解析)
文档属性
| 名称 | 山东省临沂市临沭重点中学2023-2024学年高二上学期12月教学质量监测化学试题(PDF含解析) |  | |
| 格式 | |||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-04 16:39:34 | ||
图片预览




文档简介
临沭一中 2023-2024 学年高二上学期 12 月份教学质量检测
化学试题
2023.12
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的
姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用 2B 铅笔(按填涂样例)正确填涂;非选择题答案必须使用 0.5 毫
米黑色签字笔书写。保持卡面清洁,不折叠、不破损。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、
试题卷上答题无效。
4.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Fe-56 Cu-64
Zn-65 K 39 Cr 52
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符
合题目要求。
1. 下列说法正确的是
A. “量子化”就是不连续的意思,微观粒子运动均有此特点
B. 英国科学家道尔顿首先发现了电子
C. 焰色反应与电子跃迁有关,属于化学变化
D. 基态氢原子转变成激发态氢原子时释放能量
2. 在一密闭容器中,反应 aM(g) bN(g)达到平衡后,保持温度不变,将容器体积增加一
倍,当达到新的平衡时,N 的浓度变为原来的 60%,则
A. 平衡向正反应方向移动 B. 物质 M 的转化率变小
C. 反应的化学平衡常数变大 D. a、b 的大小关系是:a>b
3. 已知在 K2Cr O 2 2 2 7溶液中存在平衡:Cr2 O7 (橙色)+H2O 2Cr O4 (黄色)+2H+。下列有关该
平衡的说法中正确的是
A. 当化学平衡向正反应方向移动时,平衡常数一定增大
2
B. 当化学平衡向正反应方向移动时,溶液中 Cr2O7 的浓度一定降低
2
C. 当 2v(Cr2O7 )正=v(H+)逆时,反应一定处于平衡状态
D. 当向溶液中加入一定量的水时,化学平衡一定不移动
4. 下列有关说法正确的是
A. 一定条件下,将0.5molN2 和1.5molH2 置于密闭的容器中充分反应生成 NH3 g ,放
热19.3kJ,其热化学方程式为 N2 g 3H2 g 2NH3 g H 38.6kJ mol 1
H B. 在稀溶液中, aq OH aq H2O 1 H 57.3kJ / mol,若将含
0.5molH2SO4的浓硫酸与含1molNaOH 的溶液混合,放出的热量大于57.3kJ
1
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
C. 在一密闭容器中发生反应 2SO2 O2 2SO3 ,增大压强,平衡正向移动,平衡常数
的值增大
D. SO2 的催化氧化是一个放热反应,所以升高温度,正反应速率增大,逆反应速率减小
5. 常温下,下列有关电解质溶液的叙述正确的是( )
A. 等浓度等体积的强酸与强碱溶液混合后,溶液的 pH=7
B. pH=5 的硫酸溶液加水稀释 500 倍,则稀释后 c(SO42-)与 c(H+)的比值为 1:2
C. pH=10 的 Ba(OH)2 溶液和 pH=13 的 NaOH 溶液等体积混合后溶液的 pH=10.7(已知
lg2=0.3)
D. 将 10 mL pH=a 的盐酸与 100 mL pH=b 的 Ba(OH)2 溶液混合后恰好中和,则 a+b=
13
6. 已知断裂1mol H2 (g)中的H H 键需要吸收 436kJ 的能量,断裂 1mol O2 (g)中的共价
键需要吸收 498kJ 的能量,生成H2O(g)中的 1mol H O 键能放出 462.8kJ 的能量。下列说
法正确的是
A. 断裂 1mol H2O中的化学键需要吸收 925.6kJ 的能量
B. 2H2 (g) O2 (g)═2H2O(g) ,1mol O2 参与应放出能量 481.2kJ
C. 2H2O(l)═2H2(g) O2(g) ,该反应放出能量 471.6kJ
1
D. H2 (g) O2 (g)═H2O(l) ,1mol O2 参与反应放出能量 240.6kJ2
7. 某化学反应的反应过程与能量变化如图所示,下列说法不.正.确.的是
A. 该反应为放热反应 B. 生成物比反应物稳定
C. 使用催化剂,该反应的反应热变小 D. 反应物的总能量高于生成物的总能量
8. 已知:
①H2O g H2 g
1
O2 g H 241.8kJ / mol2
②C s 1 O2 g CO g H 110.5kJ / mol2
③C s O2 g CO2 g H 393.5kJ / mol
下列说法错误的是
A. 上述反应属于吸热反应的是①
2
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
B. 表示 C 的燃烧热的热化学方程式是③
C. 10gH2 完全燃烧生成水蒸气,放热 2418kJ
1
D. CO 燃烧的热化学方程式为CO g O2 g CO2 g H 283kJ / mol2
9. 在密闭容器中,反应 2X(g)+Y(g) 3Z(g)达到平衡后,若将容器体积缩小一半,对反应
产生的影响是
A. v(正)减小,v (逆)增大 B. v (正)增大,v (逆)减小
C. v (正),v (逆)都减小 D. v (正),v (逆)都增大
10. 常温下,①pH=2 的 CH3COOH 溶液;②pH=2 的 H2SO4溶液;③pH=12 的氨水;④pH
=12 的 NaOH 溶液。相同条件下,有关上述溶液的比较中,正确的是
A. 将②、④溶液混合后,pH=7,消耗溶液的体积:②<④
B. 向 10mL 上述四溶液中各加入 90 mL 水后,溶液的 pH:③>④>①>②
C. 等体积的①、②、④溶液分别与足量铝粉反应,生成 H2 的量:②最多
D. 水电离的 c(H+):①=②=③=④
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项
符合题目要求,全选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
11. 已知部分弱电解质的电离平衡常数如下表:
弱电解质 CH3COOH H2CO3 HClO NH3 H2O
电离平衡 K 4.3 10 7
常数 K a 1.7 10
5 al
11 Ka 4.7 10
8 Kb 1.7 10
5
(25℃) Ka 2 5.6 10
常温下,下列分析正确的是
A. pH 相同的①CH3COONa ② NaHCO3 ③NaClO 溶液中的 c Na :③>②>①
B. 0.1 mol L 1 CH3COONH
4 溶液中: c NH4 c CH COO 3
C. 中和等体积等浓度的醋酸和次氯酸,需要 NaOH 的物质的量相同
D. 反应HCO 3 CH3COOH CH3COO
H2CO3,K 2.4 10 2
12. 一定温度下,在 N2O5 的四氯化碳溶液(100mL)中发生分解反应:
2N2O5 4NO2 O2 ,测得不同时刻 N2O5 ,浓度变化如图。下列说法错误的是
A. 0 1200s ,生成 NO2 的平均速率约为1.2 10 3 mol L 1 s 1
B. 1200s 1710s ,放出O2 的体积为 2.016L(标准状况)
C. 推测 t 可能为 2900
D. 反应达平衡后再加入 100mL 四氯化碳,平衡正向移动,溶液颜色变深
3
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
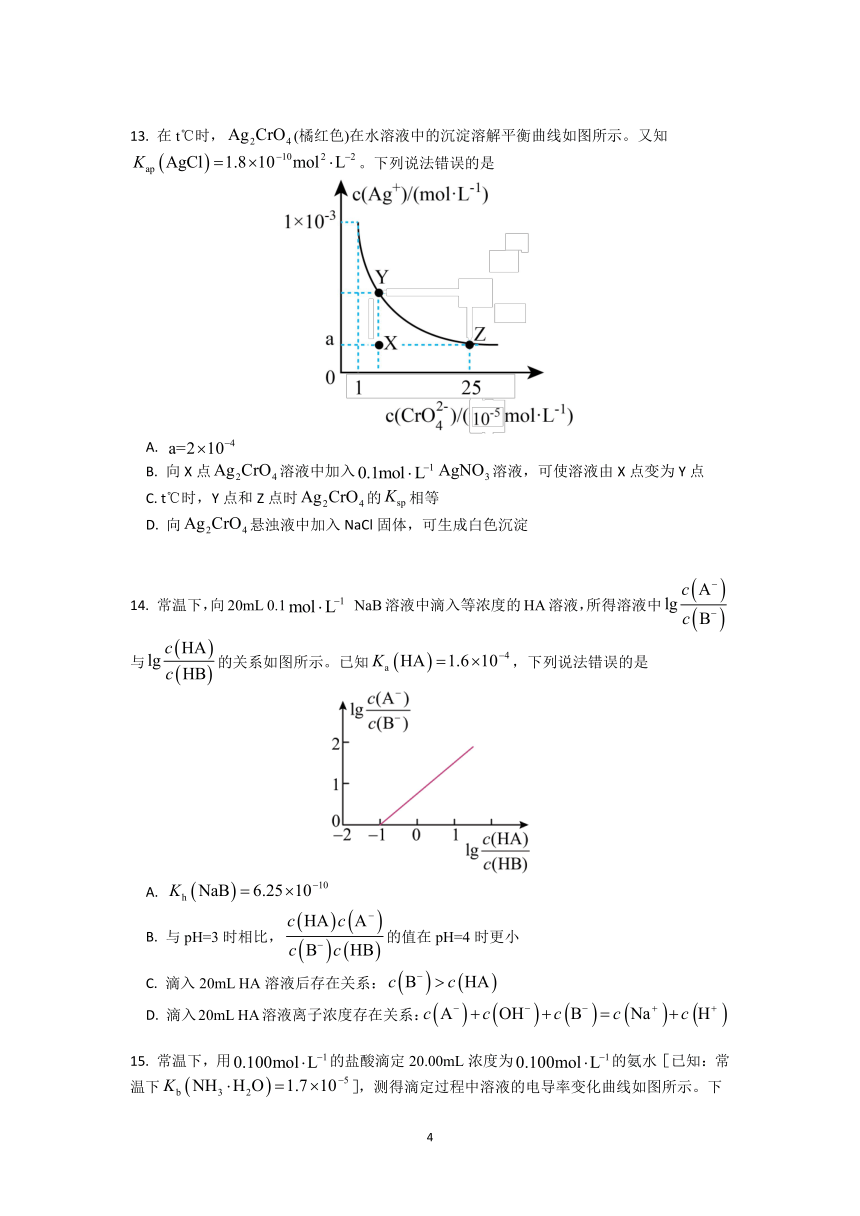
13. 在 t℃时,Ag2CrO4 (橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知
Kap AgCl 1.8 10 10mol 2 L 2 。下列说法错误的是
A. a=2 10 4
B. 向 X 点Ag2CrO4溶液中加入0.1mol L 1 AgNO3 溶液,可使溶液由 X 点变为 Y 点
C. t℃时,Y 点和 Z 点时Ag2CrO4的Ksp 相等
D. 向Ag2CrO4悬浊液中加入 NaCl 固体,可生成白色沉淀
c A
14. 常温下,向 20mL 0.1 mol L 1 NaB溶液中滴入等浓度的HA溶液,所得溶液中 lg
c B
c HA
与 lg
的关系如图所示。已知Ka HA 1.6 10 4 ,下列说法错误的是c HB
A. K NaB 6.25 10 10h
c HA c A
B. 与 pH=3 时相比, 的值在 pH=4 时更小c B c HB
C. 20mL HA c B 滴入 溶液后存在关系: c HA
D. 滴入20mL HA溶液离子浓度存在关系:c A c OH c B c Na c H
15. 常温下,用0.100mol L 1的盐酸滴定 20.00mL 浓度为0.100mol L 1的氨水[已知:常
温下Kb NH3 H2O 1.7 10 5],测得滴定过程中溶液的电导率变化曲线如图所示。下
4
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
列说法错误的是
A. a 点溶液O H 浓度约为1.3 10 3 mol L 1
B. b 点溶液: c NH4 c NH3 H2O c Cl
C. c 点溶液 c NH3 H2O c OH
D. d 点溶液 c H c OH c NH 4 2c NH 3 H 2O
三、非选择题:本题共 5 小题,共 60 分。
16. 近年来我国大力加强温室气体 CO2催化氢化合成甲醇技术的工业化量产研究,实现可持
续发展。回答下列问题:
(1)已知: CO2(g)+H2(g) CO(g)+H2O(g), ΔH1=+41.1 kJgmol-1 K1
CO(g)+2H2(g) CH3OH(g) ΔH2 =-90.0 kJgmol-1 K2
写出 CO2 催化氢化合成甲醇的热化学方程式:_______________________________________;
用 K1、K2 表示此反应的化学平衡常数 K=___________________。
(2)为提高CH3OH(g)的产率,理论上应采用的条件是___________(填序号)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250 ℃时,在恒容密闭容器中由CO2(g) 催化氢化合成CH3OH(g),如图为不同投料比
[ n(H2 )/n(CO2 ) ]时某反应物 X 的平衡转化率的变化曲
线。反应物 X 是_________(填“ CO2 ”或“ H2 ”)。
(4)250 ℃时,在体积为 2.0 L 的恒容密闭容器中加
入 6 mol H2、2 mol CO2 和催化剂,10 min 时反应达到
平衡,测得 c(CH3OH)=0.75 molgL
-1。
①前 10 min 内H2 的平均反应速率
v(H2 )= _________mol L-1 min -1。
②化学平衡常数K= ________。
③下列描述中能说明上述反应已达平衡的是
_____________ (选填编号)。
a.3v 正(H2) =v 逆(CH3OH) b.容器中气体压强不随时间而变化
c.c (H2) : c (CO2) =1 : 1 d.容器中气体平均相对分子质量不随时间而变化
④催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反
应时间,四组实验数据:得到如下
实验编号 温度/K 催化剂 CO2的转化率/% 甲醇的选择性/%
A 543 Cu/ZnO 纳米棒 12.3 42.3
B 543 Cu/ZnO 纳米片 11.9 72.7
C 553 Cu/ZnO 纳米棒 15.3 39.1
D 553 Cu/ZnO 纳米片 12.0 70.6
5
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
根据上表所给数据,用CO2 生产甲醇的最优条件为_________(填实验编号)。
17. 某学生用 0.5000mol L 1的标准 NaOH 溶液滴定未知浓度的硫酸,其操作分为如下几
步:
①用蒸馏水洗涤碱式滴定管,注入 0.5000mol L 1标准 NaOH 溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取 20.00mL 待测液注入润洗过的雉形瓶中,并加入 2 滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
⑥重复以上滴定操作 2~3 次
请回答下列问题:
(1)以上步骤有错误的个数为_____个。
(2)步骤④中,量取 20.00mL 待测液应使用_____(填仪器名称)。
(3)步骤⑤滴定时眼睛应注视_____;到达滴定终点的现象是_____。
(4)下图是某次滴定时的滴定管中的液面,其读数为_____mL。
(5)以下是实验数据记录表
NaOH 溶液体积(mL)
滴定次数 硫酸体积(mL)
滴定前 滴定后
1 20.00 0.00 18.10
2 20.00 2.20 18.40
3 20.00 2.00 18.16
从表中可以看出,其中 1 次滴定记录的 NaOH 溶液体积明显和另外两次的体积相差过大,
其可能的原因是_____。
A. 锥形瓶装液前,留有少量蒸馏水
B. 第 1 次滴定时,碱式滴定管未润洗
C. 滴定前滴定管尖嘴有气泡,滴定结束无气泡
D. 滴定过程中刚变色就立即停止滴定
18. I.25℃时,部分弱酸的电离平衡常数如表所示:
CH3COOH HClO化学式 H3PO2 H2S H2CO3
电离平 Ka1 1.3 10
7 Ka1 4.4 10
7
衡常数 1.8 10 5 3.0 10
8K 5.9 10 2a Ka2 7.1 10
15 Ka 2 4.7 10
11
(25℃)
回答下列问题:
(1)次磷酸(H3PO2)是一元弱酸,NaH2PO2是_____(填“酸式盐”“碱式盐”或“正盐”)。
(2)写出向次氯酸钠溶液中通入少量 CO2的离子方程式_____(填序号)。
+
Ⅱ.某二元酸(化学式用 H2A 表示)的水溶液中存在的离子有:Na+、A2-、HA-、H 、OH-,
存在的分子有 H2O2.根据题意回答下列问题:
(3)写出酸 H2A 的两步电离方程式:_____;_____。
(4) 25℃时,将 amol / L 的醋酸与 bmol / L 的氢氧化钠溶液等体积混合,反应后溶液恰
好显中性,这时钠离子浓度与醋酸根浓度相等,用 a、b表示醋酸的电离平衡常数为_____。
6
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
19. 羰基硫(COS),用于合成除草剂、杀虫剂等,还能作粮食熏蒸剂。CO、CO2 、分别与H2S
反应均能制得COS,反应如下:
反应 I:CO g H2S g COS g H2 g H1
反应Ⅱ:CO2 g H2S g COS g H2O g H2
已知:在相同条件下,向两个容积相同且不变的密闭容器中按下表投料 N2 不参与反应),
分别发生上述反应。温度相同时,反应 I 的平衡常数大于反应Ⅱ的平衡常数。实线 a、b表
示在相同的时间内两反应中 n COS 随温度的变化关系如下图所示;虚线 c,d 表示两反应的
平衡曲线。
反应 I 反应Ⅱ
起始投料 CO H2S N2 CO2 H2S N2
起始物质的量 mol 1 1 3 1 1 3
完成下列填空:
(1)下列可判断反应Ⅱ达到平衡的是_____。
A. V 正(H2S)=V 正(COS) B. 容器内压强不再变化
C. c H2S : c COS 不再变化 D. V正 H2S V逆 COS
(2)实验测得反应Ⅱ的速率方程为:V正 k正c H2S c CO2 ,V逆 k逆c COS c H2O ,
k 为速率常数,则达到平衡后,仅升高温度 k 正增大的倍数_____(填“>”、“<”或“=”)k
逆增大的倍数。
(3)上图中能表示反应 I 的曲线是_____;相同条件下,延长足够的反应时间,反应体系中
Y 点COS的物质的量达到_____点(填“X”或“W”),该温度下该反应的平衡常数为
_____。
20. CO2甲烷化是实现“双碳”目标的重要途径。已知合成塔内发生的反应有:
Ⅰ. CO2 g 4H2 g CH4 g 2H2O g ΔH1
Ⅱ. CO2 g H2 g CO g H2O g ΔH2 0
Ⅲ. CO g 3H2 g CH4 g H2O g ΔH3 0
回答下列问题:
(1)催化剂的选择是CO2甲烷化技术的核心,图 1 为催化剂 M 催化反应Ⅰ的历程。根据
图 1 中能量变化情况,求算ΔH1 _______ kJ mol 1 (列式表示);反应_______(填“ⅰ”或“ⅱ”)
决定了反应Ⅰ正反应速率的快慢。
7
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
(2)反应Ⅱ的正、逆反应速率可分别表示为
v正 k正c CO2 c H 2 , v k c CO c H逆 逆 2O ,
k正、k逆分别为正、逆反应速率常数。T℃,在一恒容密
闭容器中加入等物质的量的CO2 g 和H2 g 只发生反
应Ⅱ,测得H2O g 和H2 g 的物质的量随时间变化如
图 2,则 M 点时, v正 : v逆 _______。
(3)保持CO2和H2 体积比 1:4 向合成塔内投料,发生
反应Ⅰ、Ⅱ、Ⅲ。
①若塔内气体的总流量控制在 60mL min 1 ,300℃测得CO2的转化率为 80%,则CO2反
应速率为_______mL min 1
②关于合成塔内反应体系,说法错误的是_______(填序号)。
A.降低反应温度,Ⅰ、Ⅱ、Ⅲ的反应速率都减小
B.平衡后增大体系压强,Ⅰ和Ⅲ平衡正向移动,Ⅱ平衡不移动
C.选用合适的催化剂能提高甲烷的选择性
D.其他条件不变时,增大CO2和H2 的投料比,可提高CO2的平衡转化率
E.及时分离出水蒸气、循环使用CO2和H2 ,可提高原料的利用率
③不同压强时,反应塔内CO2的平衡转化率随温度变化曲线如图所示。压强 p1 、p2 、p3由
大到小的顺序为_______;温度为 T℃时,三条曲线几乎交于一点的原因是_______。
8
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
临沭一中 2023-2024 学年高二上学期 12 月份教学质量检测
化学试题 参考答案
1. A 【解析】A.“量子化”就是不连续的意思,微观粒子运动均是量子化的,A正确;
B.1897 年,英国科学家约瑟夫·约翰·汤姆森发现电子,B 错误;
C.焰色反应没有新物质生成,是物理变化,C错误;
D.基态氢原子吸收能量发生跃迁变成激发态氢原子,D错误。答案选 A。
2. A 【解析】A.由分析可知,增大体积,减小压强,平衡向生成 N 的方向移动,则平衡
向正反应方向移动,A 正确;
B.减小压强,平衡向正反应方向移动,物质 M 的转化率增大,B 不正确;
C.在压强减小过程中,温度保持不变,则反应的化学平衡常数不变,C 不正确;
D.减小压强,平衡向气体分子数增大的方向(正反应方向)移动,则 a、b 的大小关系是:
a<b,D 不正确;故选 A。
3. C 【解析】A.对于一个确定的化学反应,K 只与温度有关,温度不变,平衡常数不变,
A 错误;B.增大 Cr O2 2 7 的浓度,化学平衡向正反应方向移动,溶液中 Cr2 O
2
7 的浓度增
大,B 2 错误;C.当 2v(Cr2 O +7 )正=v(H )逆时,该反应处于平衡状态,C 正确;D.加入一
定量的水,溶液中各个离子浓度均发生变化,平衡发生移动,D 错误;答案选:C。
4. B 【解析】A.0.5mol N2(g)和 1.5mol H2(g)置于密闭的容器中充分反应生成 NH3(g),放
热 19.3kJ,反应为可逆反应,而热化学反应中为完全反应的能量变化,则
N2(g)+3H2(g) 2NH3(g)△H<-38.6kJ mol-1,故 A 错误;
B.因为浓硫酸稀释放热,所以将含 0.5mol H2SO4的浓硫酸与含 1mol NaOH 的溶液混合,
放出的热量大于 57.3kJ,故 B 正确;
C.正反应 2SO2+O2 2SO3是气体体积减小的反应,增大压强,平衡正向移动,但温度不变,
则平衡常数 K 不变,故 C 错误;
D.升高温度,体系内活化分子百分含量增大,正逆反应速率均增大,故 D 错误;
故选:B。
5. D 【解析】A.等浓度等体积的硫酸与氢氧化钠溶液混合后,溶液的 pH<7,故 A 错误;
B.pH=5 的硫酸溶液中 c(H+)=1×10-5mol/L,c(SO 2-)= 5 10 64 mol / L,加水稀释 500 倍,
则稀释后 c(H+)=1×10-7mol/L,c(SO 2-)=1 10 84 mol / L ,c(SO42-)与 c(H+)的比值为 1:10,
故 B 错误;
C.pH=10 的 Ba(OH)2 溶液和 pH=13 的 NaOH 溶液等体积混合后溶液的 pH=12.7,故 C
错误;
D .将 10 mL pH = a 的盐酸与 100 mL pH = b 的 Ba(OH)2 溶液混合后恰好中和
10 a 10 10 3 10 14 b 100 10 3 ,则 a+b=13,故 D 正确。
6. B 【解析】A.未指明H2O的状态,A 项错误;
B.1mol O2 参与反应,放出的能量为
4mol 462.8kJ / mol 436kJ / molx2mol 498kJ 481.2kJ ,B 项正确;
C.水分解吸热,C 项错误;
1
D.根据 B 中分析可知,反应H2 (g) O2 (g)═H2O(g) 放出的能量为 240.6kJ,D 项错误。2
故选:B。
7. C 【解析】A. H =生成物的能量-反应物的能量,根据图示能量变化可知,生成物的
能量低于反应物的能量,所以 H<0,该反应属于放热反应,A 正确;
B.因为生成物的能量更低,所以生成物更稳定,B 正确;
C.催化剂只改变反应速率,不能改变反应的焓变,即使用催化剂,反应热不变,C 错误;
D.根据图示能量变化可知,反应物的总能量高于生成物的总能量,D 正确;
9
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
故选 C。
8. C 【解析】A. 吸热反应 H 0,表示吸热反应的是①,A 项正确;
B. 根据燃烧热的定义判断,B 项正确;
C. 根据①可知,热化学方程式H g 12 O2 g H2O g H 241.8kJ / mol,2
10g H2 完全燃烧生成水蒸气,放出的热量为 5mol×241.8 kJ/mol=1209 kJ,C 项错误;
1
D. 表 示 CO 燃 烧 的 热 化 学 方 程 式 为 ③―② , 即 CO g O
2 2
g CO2 g
H 283kJ / mol,D 项正确;
答案选 C。
9. D 【解析】若将容器体积缩小一半,X、Y、Z 的浓度均增大,因此正逆反应速率均增
大,故答案为 D 项。
10. D 【解析】A.将②、④溶液混合后,pH=7,因为 c(H+)酸=c(OH-)碱,所以消耗溶液的
体积②=④,A 不正确;
B. 向 10mL 上述四溶液中各加入 90 mL 水后,H2SO4 的 pH 增大 1,NaOH 的 pH 减小 1,
CH3COOH 的 pH 增大值小于 1,氨水的 pH 减小值小于 1,故溶液的 pH:③>④>②>①,B
不正确;
C. 等体积的①、②、④溶液分别与足量铝粉反应,因为醋酸的物质的量最大,所以醋酸生
成 H2 的量最多,C 错误;
D. 因为四份溶液中,电解质电离产生的氢离子或氢氧根离子浓度相等,对水的电离的影响
+
相同,所以水电离的 c(H ):①=②=③=④,D 正确;
故选 D。
11. BC
【解析】A.根据电离平衡常数大小关系:Ka( CH3COOH )>Ka1( H2CO3 )>Ka(HClO),则
对应离子水解程度依次增大,所以 pH 相同的①CH3COONa ② NaHCO3 ③NaClO 溶液中
的 c Na :①>②>③,A 错误;
B.醋酸与一水合氨的电离平衡常数相同,所以醋酸根离子与铵根离子的水解程度相当,则
c NH c CH COO 醋酸铵中存在 4 3 ,B 正确;
C.醋酸和次氯酸均为一元酸,则中和等体积等浓度的醋酸和次氯酸,需要 NaOH 的物质的
量相同,C 正确;
D .反应HCO3 CH3COOH CH3COO
H2CO3,
c(H CO ) c(CH COO -) c(H - + 5K 2 3 3 2CO3) c(CH3COO ) c(H ) Ka(CH3COOH) 1.7 10 39.53c(HCO3 ) c(CH3COOH) c(HCO3 ) c(CH3COOH) c(H
+) Ka1(H2CO3) 4 .3 10
7
,D 错误;
故选 BC。
12. BD
【解析】A. 0 1200s ,N2O5 的浓度减少(1.4-0.66)mol/L=0.74mol/L,则生成 NO2 的浓
1.48mol/L
度为 1.48mol/L 3 1 1,生成 NO2 的平均速率约为 1.2 10 mol L s ,故 A 正确;1200s
B. 1200s 1710s ,N2O5 的物质的量减少(0.66-0.48)mol/L 0.1L=0.018mol/L,放出O2 的
物质的量为 0.009mol,则放出O2 的体积为 0.009mol 22.4L/mol=0.2016L(标准状况),故 B
错误;
C. 由表格数据可知,N2O5 浓度从 0.96mol/L 减小为 0.48mol/L,所用时间为 1110s,推测
10
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
N2O5 浓度从 0.48mol/L 减小为 0.24mol/L,所用时间可能为 1110s,则 t 为 2820s,又随反应
进行,反应速率逐渐减小,则推测 t 可能为 2900,故 C 正确;
D. 反应达平衡后再加入 100mL 四氯化碳,所有物质的浓度均减小,溶液颜色变浅,故 D
错误;
故选 BD。
13. D
A K =c(Ag+ )2 c(CrO2- )=(1 10-3 -5【解析】 . sp 4 ) 1 10 1 10
-11
,当
c(CrO2- ) 25 10-5 +
K(Ag CrO)
mol/L c(Ag ) sp 2 4 1 10
-11
4 时, 2 10
-4mol/L ,
c(CrO2-4 ) 25 10
-5
故 A 正确;
B.X 点为Ag2CrO4的不饱和溶液,加入0.1mol L 1 AgNO3 溶液,c(Ag+ ) 2-增大,c(CrO4 )
在达到饱和前不变,向 X 点Ag2CrO4溶液中加入0.1mol L 1 AgNO3 溶液,可使溶液由 X
点变为 Y 点,故 B 正确;
C.Ksp 只受温度影响,温度不变平衡常数不变,t℃时,Y 点和 Z 点时Ag2CrO4的Ksp相
等,故 C 正确;
D.NaCl + -固体没有给出加入量,不能确定此时 c(Ag ) c(Cl )>Ks(p AgCl),不能确定是否
生成白色沉淀,故 D 错误;
故答案为 D。
14. B
K 1 10 14
【解析】A.Kh(NaB)= W = 5 =6.25×10-10,A 正确;K(a HB) 1.6 10
c HB c A- c A- c HB c H+ K HA
B a. = = =10 - - ,与 pH 无关,或者说 pH=4 时c B c HA c B c HA c H+ Ka HB
c HB c A -
- 的值与 pH=3 的一样大,B 错误;c B c HA
C.滴入 20mLHA 溶液后,NaB 与 HA 恰好反应得到等物质的量浓度 NaA 和 HB 混合溶液,
NaA 微弱水解,HB 微弱电离,由于 Ka(HA)=1.6×10-4,则 Ka(HB)=1.6×10-5,可推知 HB 电
离程度大于 NaA 水解程度,则混合溶液成酸性,根据平衡产物可判断存在关系:
c B c HA ,C 正确;
D.滴入 20mLHA 溶液后,NaB 与 HA 恰好反应得到等物质的量浓度 NaA 和 HB 混合溶液,
根据电荷守恒式可知溶液中存在关系: c A c OH c B c Na c H ,D
正确;
答案选 B。
15.BC
+ -
【解析】A.根据 NH3 H O 2 NH4 +OH 可得氨水的电离平衡
K = c(NH
+
4 ) c(OH
-) c(OH-)2 -
b ,可得 c(OH )= K ·c (NHc(NH H O c (NH H O) b 初始 3
H2O) 。已知
3 2 ) 初始 3 2
a 点溶液中 NH3 H2O 浓度为0.100mol L 1,带入上述计算式可得
c(OH-)= K b·c (NH3 H2O) 1.7 10
5 0.1 1.3 10 3mol L-1 ,A 正确;
初始
B.b 点时溶液中为等浓度的氯化铵和氨水,氯化铵的水解平衡常数
11
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
-14
Kh= Kw = 1 10 -5 5.9 10
10
,可知氨水电离能力强于氯化铵的水解能力,溶液为碱性,
Kb 1.7 10
c(OH-)>c(H +) +,根据电荷守恒 c(NH4 )+c(H
+ )=c(OH- )+c(Cl- ) + -可得 c(NH4)>c(Cl)。等
- +
浓度氯化铵和氨水混合溶液中存在物料守恒 2c(Cl )=c(NH3 H2O)+c(NH4 ),又因为
c(NH+)>c(Cl-) c(NH+4 ,可得 4 )>c(Cl
-)>c(NH3 H2O) ,故 B 错误;
C.c 点时溶液溶质为氯化铵溶液,铵根离子在水中发生水解,离子反应式为
NH+4 +H2O NH H O+H
+
3 2 ,溶液中一水合氨的浓度约等于氢离子浓度,而溶液呈酸
-
性,氢离子浓度大于氢氧根浓度,可推得 c(NH3 H2O)>c(OH ),C 错误;
D.d 点溶液中为等浓度的盐酸和氯化铵溶液,溶液中有物料守恒:
c(Cl-)=2c(NH3 H2O)+2c(NH
+
4 )
+
和电荷守恒: c(NH4 )+c(H
+ )=c(OH-)+c(Cl-),将物
+ - +
料守恒带入电荷守恒中可得 c(H )-c(OH )=2c(NH3 H2O)+c(NH4 ),D 正确;
故选 BC。
三、非选择题:本题共 5 小题,共 60 分。
16. ①. 3H2 (g)+CO2 (g) CH3OH(g)+H2O(g) ΔH=-48.9 kJgmol-1 ②. K1 K2
16
③. d ④. CO2 ⑤. 0.225 ⑥. ⑦. bd ⑧. B3
【解析】
【详解】(1)①CO2(g)+H2(g) H2O(g)+CO(g)△H1 =+41.1 kJ mol 1
②CO(g)+2H2(g) CH3OH(g)△H2= 90.0 kJ mol
1
根据盖斯定律①+②:3H2 (g)+CO2 (g CH3OH(g)+H2O(g)△H=(41.1 90.0)kJ mol 1= 48.9
kJ mol 1,用 K1、K2表示此反应的化学平衡常数 K= K1 K2 ,故答案为:3H2 (g)+CO2
(g CH3OH(g)+H2O(g)△H= 48.9 kJ mol 1;K1 K2 ;
(2)a. 高温使平衡逆向移动降低 CH3OH 产率,高压平衡正向移动提高 CH3OH 产率,故 a 错
误;
b. 低温平衡正向移动提高 CH3OH 产率,低压使平衡逆向移动降低 CH3OH 产率,故 b 错误;
c. 高温使平衡逆向移动降低 CH3OH 产率,低压使平衡逆向移动降低 CH3OH 产率,故 c 错
误;
d. 低温高压平衡正向移动提高 CH3OH 产率,故 d 正确,
故答案为:d;
n H2
(3)X 平衡转化率随着 的增大,而增大,根据勒夏特列原理,增大一种反应物的量,n CO2
可以提高另一种反应物的转化率,则 X 为 CO2,故答案为:CO2;
(4)①3H2(g)+CO2 (g) CH3OH(g)+H2O(g)
起始 c(mol L 1) 3 1 0 0
转化 c(mol L 1) 2.25 0.75 0.75 0.75
平衡 c(mol L 1) 0.75 0.25 0.75 0.75
v(H 2.25mol/L2 )= =0.225 mol L-1 min -1;10min
c H2O c CH3OH 0.75 0.75 16 16
②K= = 0.25 0.75 3 = ,故答案为: ;c CO2 c H2 3 3
③a. 3v 正(H2) =v 逆(CH3OH),不能说明正反应速率等于逆反应速率,不能说明反应达到平衡,
故 a 错误;
12
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
b. 该反应是气体体积减小的反应,反应过程中压强不断减小,当容器中气体压强不随时间
而变化时,说明该反应达到平衡,故 b 正确;
c. c (H2) : c (CO2) =1 : 1,不能说明正反应速率等于逆反应速率,不能说明反应达到平衡,故
c 错误;
d. 该反应是气体体积减小的反应,反应过程中气体总物质的量不断减小,气体总质量不变,
反应过程中气体平均相对分子质量不断减小,当容器中气体平均相对分子质量不随时间而变
化时,说明反应达到平衡,故 d 正确;
故选 bd;
④分别对比 AB、CD 实验,Cu/ZnO 纳米片催化剂,甲醇的选择性高,对比 BD,温度升高,
CO2 的转化率升高,但甲醇的选择性降低,CO2生产甲醇的最优选项为 B,故答案为:B。
17. (1)2 (2)酸式滴定管
(3) ①. 锥形瓶中溶液颜色变化 ②. 滴入最后半滴标准液,溶液由无色变为浅红
色,且半分钟内不褪色
(4)22.60 (5)BC
18.(1 )正盐 (2)ClO CO2 H2O=HClO HCO3
(3) ①. H2A HA
+H+ ②. HA H+ +A2
b
4 10 7( )
a b
19. (1)CD (2)<
1
(3) ①. bd ②. X ③. 或 0.0625
16
20.(1) ①. H2+ H3 ②.ⅱ
(2)9 (3) ①. 9.6 ②. D ③. p1>p2>p3 ④. T℃时以反应Ⅱ为主,反
应Ⅱ前后气体分子数相等,压强改变对平衡没有影响
13
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
化学试题
2023.12
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的
姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用 2B 铅笔(按填涂样例)正确填涂;非选择题答案必须使用 0.5 毫
米黑色签字笔书写。保持卡面清洁,不折叠、不破损。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、
试题卷上答题无效。
4.可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Fe-56 Cu-64
Zn-65 K 39 Cr 52
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符
合题目要求。
1. 下列说法正确的是
A. “量子化”就是不连续的意思,微观粒子运动均有此特点
B. 英国科学家道尔顿首先发现了电子
C. 焰色反应与电子跃迁有关,属于化学变化
D. 基态氢原子转变成激发态氢原子时释放能量
2. 在一密闭容器中,反应 aM(g) bN(g)达到平衡后,保持温度不变,将容器体积增加一
倍,当达到新的平衡时,N 的浓度变为原来的 60%,则
A. 平衡向正反应方向移动 B. 物质 M 的转化率变小
C. 反应的化学平衡常数变大 D. a、b 的大小关系是:a>b
3. 已知在 K2Cr O 2 2 2 7溶液中存在平衡:Cr2 O7 (橙色)+H2O 2Cr O4 (黄色)+2H+。下列有关该
平衡的说法中正确的是
A. 当化学平衡向正反应方向移动时,平衡常数一定增大
2
B. 当化学平衡向正反应方向移动时,溶液中 Cr2O7 的浓度一定降低
2
C. 当 2v(Cr2O7 )正=v(H+)逆时,反应一定处于平衡状态
D. 当向溶液中加入一定量的水时,化学平衡一定不移动
4. 下列有关说法正确的是
A. 一定条件下,将0.5molN2 和1.5molH2 置于密闭的容器中充分反应生成 NH3 g ,放
热19.3kJ,其热化学方程式为 N2 g 3H2 g 2NH3 g H 38.6kJ mol 1
H B. 在稀溶液中, aq OH aq H2O 1 H 57.3kJ / mol,若将含
0.5molH2SO4的浓硫酸与含1molNaOH 的溶液混合,放出的热量大于57.3kJ
1
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
C. 在一密闭容器中发生反应 2SO2 O2 2SO3 ,增大压强,平衡正向移动,平衡常数
的值增大
D. SO2 的催化氧化是一个放热反应,所以升高温度,正反应速率增大,逆反应速率减小
5. 常温下,下列有关电解质溶液的叙述正确的是( )
A. 等浓度等体积的强酸与强碱溶液混合后,溶液的 pH=7
B. pH=5 的硫酸溶液加水稀释 500 倍,则稀释后 c(SO42-)与 c(H+)的比值为 1:2
C. pH=10 的 Ba(OH)2 溶液和 pH=13 的 NaOH 溶液等体积混合后溶液的 pH=10.7(已知
lg2=0.3)
D. 将 10 mL pH=a 的盐酸与 100 mL pH=b 的 Ba(OH)2 溶液混合后恰好中和,则 a+b=
13
6. 已知断裂1mol H2 (g)中的H H 键需要吸收 436kJ 的能量,断裂 1mol O2 (g)中的共价
键需要吸收 498kJ 的能量,生成H2O(g)中的 1mol H O 键能放出 462.8kJ 的能量。下列说
法正确的是
A. 断裂 1mol H2O中的化学键需要吸收 925.6kJ 的能量
B. 2H2 (g) O2 (g)═2H2O(g) ,1mol O2 参与应放出能量 481.2kJ
C. 2H2O(l)═2H2(g) O2(g) ,该反应放出能量 471.6kJ
1
D. H2 (g) O2 (g)═H2O(l) ,1mol O2 参与反应放出能量 240.6kJ2
7. 某化学反应的反应过程与能量变化如图所示,下列说法不.正.确.的是
A. 该反应为放热反应 B. 生成物比反应物稳定
C. 使用催化剂,该反应的反应热变小 D. 反应物的总能量高于生成物的总能量
8. 已知:
①H2O g H2 g
1
O2 g H 241.8kJ / mol2
②C s 1 O2 g CO g H 110.5kJ / mol2
③C s O2 g CO2 g H 393.5kJ / mol
下列说法错误的是
A. 上述反应属于吸热反应的是①
2
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
B. 表示 C 的燃烧热的热化学方程式是③
C. 10gH2 完全燃烧生成水蒸气,放热 2418kJ
1
D. CO 燃烧的热化学方程式为CO g O2 g CO2 g H 283kJ / mol2
9. 在密闭容器中,反应 2X(g)+Y(g) 3Z(g)达到平衡后,若将容器体积缩小一半,对反应
产生的影响是
A. v(正)减小,v (逆)增大 B. v (正)增大,v (逆)减小
C. v (正),v (逆)都减小 D. v (正),v (逆)都增大
10. 常温下,①pH=2 的 CH3COOH 溶液;②pH=2 的 H2SO4溶液;③pH=12 的氨水;④pH
=12 的 NaOH 溶液。相同条件下,有关上述溶液的比较中,正确的是
A. 将②、④溶液混合后,pH=7,消耗溶液的体积:②<④
B. 向 10mL 上述四溶液中各加入 90 mL 水后,溶液的 pH:③>④>①>②
C. 等体积的①、②、④溶液分别与足量铝粉反应,生成 H2 的量:②最多
D. 水电离的 c(H+):①=②=③=④
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项
符合题目要求,全选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
11. 已知部分弱电解质的电离平衡常数如下表:
弱电解质 CH3COOH H2CO3 HClO NH3 H2O
电离平衡 K 4.3 10 7
常数 K a 1.7 10
5 al
11 Ka 4.7 10
8 Kb 1.7 10
5
(25℃) Ka 2 5.6 10
常温下,下列分析正确的是
A. pH 相同的①CH3COONa ② NaHCO3 ③NaClO 溶液中的 c Na :③>②>①
B. 0.1 mol L 1 CH3COONH
4 溶液中: c NH4 c CH COO 3
C. 中和等体积等浓度的醋酸和次氯酸,需要 NaOH 的物质的量相同
D. 反应HCO 3 CH3COOH CH3COO
H2CO3,K 2.4 10 2
12. 一定温度下,在 N2O5 的四氯化碳溶液(100mL)中发生分解反应:
2N2O5 4NO2 O2 ,测得不同时刻 N2O5 ,浓度变化如图。下列说法错误的是
A. 0 1200s ,生成 NO2 的平均速率约为1.2 10 3 mol L 1 s 1
B. 1200s 1710s ,放出O2 的体积为 2.016L(标准状况)
C. 推测 t 可能为 2900
D. 反应达平衡后再加入 100mL 四氯化碳,平衡正向移动,溶液颜色变深
3
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
13. 在 t℃时,Ag2CrO4 (橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知
Kap AgCl 1.8 10 10mol 2 L 2 。下列说法错误的是
A. a=2 10 4
B. 向 X 点Ag2CrO4溶液中加入0.1mol L 1 AgNO3 溶液,可使溶液由 X 点变为 Y 点
C. t℃时,Y 点和 Z 点时Ag2CrO4的Ksp 相等
D. 向Ag2CrO4悬浊液中加入 NaCl 固体,可生成白色沉淀
c A
14. 常温下,向 20mL 0.1 mol L 1 NaB溶液中滴入等浓度的HA溶液,所得溶液中 lg
c B
c HA
与 lg
的关系如图所示。已知Ka HA 1.6 10 4 ,下列说法错误的是c HB
A. K NaB 6.25 10 10h
c HA c A
B. 与 pH=3 时相比, 的值在 pH=4 时更小c B c HB
C. 20mL HA c B 滴入 溶液后存在关系: c HA
D. 滴入20mL HA溶液离子浓度存在关系:c A c OH c B c Na c H
15. 常温下,用0.100mol L 1的盐酸滴定 20.00mL 浓度为0.100mol L 1的氨水[已知:常
温下Kb NH3 H2O 1.7 10 5],测得滴定过程中溶液的电导率变化曲线如图所示。下
4
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
列说法错误的是
A. a 点溶液O H 浓度约为1.3 10 3 mol L 1
B. b 点溶液: c NH4 c NH3 H2O c Cl
C. c 点溶液 c NH3 H2O c OH
D. d 点溶液 c H c OH c NH 4 2c NH 3 H 2O
三、非选择题:本题共 5 小题,共 60 分。
16. 近年来我国大力加强温室气体 CO2催化氢化合成甲醇技术的工业化量产研究,实现可持
续发展。回答下列问题:
(1)已知: CO2(g)+H2(g) CO(g)+H2O(g), ΔH1=+41.1 kJgmol-1 K1
CO(g)+2H2(g) CH3OH(g) ΔH2 =-90.0 kJgmol-1 K2
写出 CO2 催化氢化合成甲醇的热化学方程式:_______________________________________;
用 K1、K2 表示此反应的化学平衡常数 K=___________________。
(2)为提高CH3OH(g)的产率,理论上应采用的条件是___________(填序号)。
a.高温高压 b.低温低压 c.高温低压 d.低温高压
(3)250 ℃时,在恒容密闭容器中由CO2(g) 催化氢化合成CH3OH(g),如图为不同投料比
[ n(H2 )/n(CO2 ) ]时某反应物 X 的平衡转化率的变化曲
线。反应物 X 是_________(填“ CO2 ”或“ H2 ”)。
(4)250 ℃时,在体积为 2.0 L 的恒容密闭容器中加
入 6 mol H2、2 mol CO2 和催化剂,10 min 时反应达到
平衡,测得 c(CH3OH)=0.75 molgL
-1。
①前 10 min 内H2 的平均反应速率
v(H2 )= _________mol L-1 min -1。
②化学平衡常数K= ________。
③下列描述中能说明上述反应已达平衡的是
_____________ (选填编号)。
a.3v 正(H2) =v 逆(CH3OH) b.容器中气体压强不随时间而变化
c.c (H2) : c (CO2) =1 : 1 d.容器中气体平均相对分子质量不随时间而变化
④催化剂和反应条件与反应物的转化率和产物的选择性高度相关。控制相同投料比和相同反
应时间,四组实验数据:得到如下
实验编号 温度/K 催化剂 CO2的转化率/% 甲醇的选择性/%
A 543 Cu/ZnO 纳米棒 12.3 42.3
B 543 Cu/ZnO 纳米片 11.9 72.7
C 553 Cu/ZnO 纳米棒 15.3 39.1
D 553 Cu/ZnO 纳米片 12.0 70.6
5
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
根据上表所给数据,用CO2 生产甲醇的最优条件为_________(填实验编号)。
17. 某学生用 0.5000mol L 1的标准 NaOH 溶液滴定未知浓度的硫酸,其操作分为如下几
步:
①用蒸馏水洗涤碱式滴定管,注入 0.5000mol L 1标准 NaOH 溶液至“0”刻度线以上
②固定好滴定管并使滴定管尖嘴充满液体
③调节液面至“0”或“0”刻度线以下,并记下读数
④量取 20.00mL 待测液注入润洗过的雉形瓶中,并加入 2 滴酚酞溶液
⑤用标准液滴定至终点,记下滴定管液面读数
⑥重复以上滴定操作 2~3 次
请回答下列问题:
(1)以上步骤有错误的个数为_____个。
(2)步骤④中,量取 20.00mL 待测液应使用_____(填仪器名称)。
(3)步骤⑤滴定时眼睛应注视_____;到达滴定终点的现象是_____。
(4)下图是某次滴定时的滴定管中的液面,其读数为_____mL。
(5)以下是实验数据记录表
NaOH 溶液体积(mL)
滴定次数 硫酸体积(mL)
滴定前 滴定后
1 20.00 0.00 18.10
2 20.00 2.20 18.40
3 20.00 2.00 18.16
从表中可以看出,其中 1 次滴定记录的 NaOH 溶液体积明显和另外两次的体积相差过大,
其可能的原因是_____。
A. 锥形瓶装液前,留有少量蒸馏水
B. 第 1 次滴定时,碱式滴定管未润洗
C. 滴定前滴定管尖嘴有气泡,滴定结束无气泡
D. 滴定过程中刚变色就立即停止滴定
18. I.25℃时,部分弱酸的电离平衡常数如表所示:
CH3COOH HClO化学式 H3PO2 H2S H2CO3
电离平 Ka1 1.3 10
7 Ka1 4.4 10
7
衡常数 1.8 10 5 3.0 10
8K 5.9 10 2a Ka2 7.1 10
15 Ka 2 4.7 10
11
(25℃)
回答下列问题:
(1)次磷酸(H3PO2)是一元弱酸,NaH2PO2是_____(填“酸式盐”“碱式盐”或“正盐”)。
(2)写出向次氯酸钠溶液中通入少量 CO2的离子方程式_____(填序号)。
+
Ⅱ.某二元酸(化学式用 H2A 表示)的水溶液中存在的离子有:Na+、A2-、HA-、H 、OH-,
存在的分子有 H2O2.根据题意回答下列问题:
(3)写出酸 H2A 的两步电离方程式:_____;_____。
(4) 25℃时,将 amol / L 的醋酸与 bmol / L 的氢氧化钠溶液等体积混合,反应后溶液恰
好显中性,这时钠离子浓度与醋酸根浓度相等,用 a、b表示醋酸的电离平衡常数为_____。
6
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
19. 羰基硫(COS),用于合成除草剂、杀虫剂等,还能作粮食熏蒸剂。CO、CO2 、分别与H2S
反应均能制得COS,反应如下:
反应 I:CO g H2S g COS g H2 g H1
反应Ⅱ:CO2 g H2S g COS g H2O g H2
已知:在相同条件下,向两个容积相同且不变的密闭容器中按下表投料 N2 不参与反应),
分别发生上述反应。温度相同时,反应 I 的平衡常数大于反应Ⅱ的平衡常数。实线 a、b表
示在相同的时间内两反应中 n COS 随温度的变化关系如下图所示;虚线 c,d 表示两反应的
平衡曲线。
反应 I 反应Ⅱ
起始投料 CO H2S N2 CO2 H2S N2
起始物质的量 mol 1 1 3 1 1 3
完成下列填空:
(1)下列可判断反应Ⅱ达到平衡的是_____。
A. V 正(H2S)=V 正(COS) B. 容器内压强不再变化
C. c H2S : c COS 不再变化 D. V正 H2S V逆 COS
(2)实验测得反应Ⅱ的速率方程为:V正 k正c H2S c CO2 ,V逆 k逆c COS c H2O ,
k 为速率常数,则达到平衡后,仅升高温度 k 正增大的倍数_____(填“>”、“<”或“=”)k
逆增大的倍数。
(3)上图中能表示反应 I 的曲线是_____;相同条件下,延长足够的反应时间,反应体系中
Y 点COS的物质的量达到_____点(填“X”或“W”),该温度下该反应的平衡常数为
_____。
20. CO2甲烷化是实现“双碳”目标的重要途径。已知合成塔内发生的反应有:
Ⅰ. CO2 g 4H2 g CH4 g 2H2O g ΔH1
Ⅱ. CO2 g H2 g CO g H2O g ΔH2 0
Ⅲ. CO g 3H2 g CH4 g H2O g ΔH3 0
回答下列问题:
(1)催化剂的选择是CO2甲烷化技术的核心,图 1 为催化剂 M 催化反应Ⅰ的历程。根据
图 1 中能量变化情况,求算ΔH1 _______ kJ mol 1 (列式表示);反应_______(填“ⅰ”或“ⅱ”)
决定了反应Ⅰ正反应速率的快慢。
7
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
(2)反应Ⅱ的正、逆反应速率可分别表示为
v正 k正c CO2 c H 2 , v k c CO c H逆 逆 2O ,
k正、k逆分别为正、逆反应速率常数。T℃,在一恒容密
闭容器中加入等物质的量的CO2 g 和H2 g 只发生反
应Ⅱ,测得H2O g 和H2 g 的物质的量随时间变化如
图 2,则 M 点时, v正 : v逆 _______。
(3)保持CO2和H2 体积比 1:4 向合成塔内投料,发生
反应Ⅰ、Ⅱ、Ⅲ。
①若塔内气体的总流量控制在 60mL min 1 ,300℃测得CO2的转化率为 80%,则CO2反
应速率为_______mL min 1
②关于合成塔内反应体系,说法错误的是_______(填序号)。
A.降低反应温度,Ⅰ、Ⅱ、Ⅲ的反应速率都减小
B.平衡后增大体系压强,Ⅰ和Ⅲ平衡正向移动,Ⅱ平衡不移动
C.选用合适的催化剂能提高甲烷的选择性
D.其他条件不变时,增大CO2和H2 的投料比,可提高CO2的平衡转化率
E.及时分离出水蒸气、循环使用CO2和H2 ,可提高原料的利用率
③不同压强时,反应塔内CO2的平衡转化率随温度变化曲线如图所示。压强 p1 、p2 、p3由
大到小的顺序为_______;温度为 T℃时,三条曲线几乎交于一点的原因是_______。
8
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
临沭一中 2023-2024 学年高二上学期 12 月份教学质量检测
化学试题 参考答案
1. A 【解析】A.“量子化”就是不连续的意思,微观粒子运动均是量子化的,A正确;
B.1897 年,英国科学家约瑟夫·约翰·汤姆森发现电子,B 错误;
C.焰色反应没有新物质生成,是物理变化,C错误;
D.基态氢原子吸收能量发生跃迁变成激发态氢原子,D错误。答案选 A。
2. A 【解析】A.由分析可知,增大体积,减小压强,平衡向生成 N 的方向移动,则平衡
向正反应方向移动,A 正确;
B.减小压强,平衡向正反应方向移动,物质 M 的转化率增大,B 不正确;
C.在压强减小过程中,温度保持不变,则反应的化学平衡常数不变,C 不正确;
D.减小压强,平衡向气体分子数增大的方向(正反应方向)移动,则 a、b 的大小关系是:
a<b,D 不正确;故选 A。
3. C 【解析】A.对于一个确定的化学反应,K 只与温度有关,温度不变,平衡常数不变,
A 错误;B.增大 Cr O2 2 7 的浓度,化学平衡向正反应方向移动,溶液中 Cr2 O
2
7 的浓度增
大,B 2 错误;C.当 2v(Cr2 O +7 )正=v(H )逆时,该反应处于平衡状态,C 正确;D.加入一
定量的水,溶液中各个离子浓度均发生变化,平衡发生移动,D 错误;答案选:C。
4. B 【解析】A.0.5mol N2(g)和 1.5mol H2(g)置于密闭的容器中充分反应生成 NH3(g),放
热 19.3kJ,反应为可逆反应,而热化学反应中为完全反应的能量变化,则
N2(g)+3H2(g) 2NH3(g)△H<-38.6kJ mol-1,故 A 错误;
B.因为浓硫酸稀释放热,所以将含 0.5mol H2SO4的浓硫酸与含 1mol NaOH 的溶液混合,
放出的热量大于 57.3kJ,故 B 正确;
C.正反应 2SO2+O2 2SO3是气体体积减小的反应,增大压强,平衡正向移动,但温度不变,
则平衡常数 K 不变,故 C 错误;
D.升高温度,体系内活化分子百分含量增大,正逆反应速率均增大,故 D 错误;
故选:B。
5. D 【解析】A.等浓度等体积的硫酸与氢氧化钠溶液混合后,溶液的 pH<7,故 A 错误;
B.pH=5 的硫酸溶液中 c(H+)=1×10-5mol/L,c(SO 2-)= 5 10 64 mol / L,加水稀释 500 倍,
则稀释后 c(H+)=1×10-7mol/L,c(SO 2-)=1 10 84 mol / L ,c(SO42-)与 c(H+)的比值为 1:10,
故 B 错误;
C.pH=10 的 Ba(OH)2 溶液和 pH=13 的 NaOH 溶液等体积混合后溶液的 pH=12.7,故 C
错误;
D .将 10 mL pH = a 的盐酸与 100 mL pH = b 的 Ba(OH)2 溶液混合后恰好中和
10 a 10 10 3 10 14 b 100 10 3 ,则 a+b=13,故 D 正确。
6. B 【解析】A.未指明H2O的状态,A 项错误;
B.1mol O2 参与反应,放出的能量为
4mol 462.8kJ / mol 436kJ / molx2mol 498kJ 481.2kJ ,B 项正确;
C.水分解吸热,C 项错误;
1
D.根据 B 中分析可知,反应H2 (g) O2 (g)═H2O(g) 放出的能量为 240.6kJ,D 项错误。2
故选:B。
7. C 【解析】A. H =生成物的能量-反应物的能量,根据图示能量变化可知,生成物的
能量低于反应物的能量,所以 H<0,该反应属于放热反应,A 正确;
B.因为生成物的能量更低,所以生成物更稳定,B 正确;
C.催化剂只改变反应速率,不能改变反应的焓变,即使用催化剂,反应热不变,C 错误;
D.根据图示能量变化可知,反应物的总能量高于生成物的总能量,D 正确;
9
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
故选 C。
8. C 【解析】A. 吸热反应 H 0,表示吸热反应的是①,A 项正确;
B. 根据燃烧热的定义判断,B 项正确;
C. 根据①可知,热化学方程式H g 12 O2 g H2O g H 241.8kJ / mol,2
10g H2 完全燃烧生成水蒸气,放出的热量为 5mol×241.8 kJ/mol=1209 kJ,C 项错误;
1
D. 表 示 CO 燃 烧 的 热 化 学 方 程 式 为 ③―② , 即 CO g O
2 2
g CO2 g
H 283kJ / mol,D 项正确;
答案选 C。
9. D 【解析】若将容器体积缩小一半,X、Y、Z 的浓度均增大,因此正逆反应速率均增
大,故答案为 D 项。
10. D 【解析】A.将②、④溶液混合后,pH=7,因为 c(H+)酸=c(OH-)碱,所以消耗溶液的
体积②=④,A 不正确;
B. 向 10mL 上述四溶液中各加入 90 mL 水后,H2SO4 的 pH 增大 1,NaOH 的 pH 减小 1,
CH3COOH 的 pH 增大值小于 1,氨水的 pH 减小值小于 1,故溶液的 pH:③>④>②>①,B
不正确;
C. 等体积的①、②、④溶液分别与足量铝粉反应,因为醋酸的物质的量最大,所以醋酸生
成 H2 的量最多,C 错误;
D. 因为四份溶液中,电解质电离产生的氢离子或氢氧根离子浓度相等,对水的电离的影响
+
相同,所以水电离的 c(H ):①=②=③=④,D 正确;
故选 D。
11. BC
【解析】A.根据电离平衡常数大小关系:Ka( CH3COOH )>Ka1( H2CO3 )>Ka(HClO),则
对应离子水解程度依次增大,所以 pH 相同的①CH3COONa ② NaHCO3 ③NaClO 溶液中
的 c Na :①>②>③,A 错误;
B.醋酸与一水合氨的电离平衡常数相同,所以醋酸根离子与铵根离子的水解程度相当,则
c NH c CH COO 醋酸铵中存在 4 3 ,B 正确;
C.醋酸和次氯酸均为一元酸,则中和等体积等浓度的醋酸和次氯酸,需要 NaOH 的物质的
量相同,C 正确;
D .反应HCO3 CH3COOH CH3COO
H2CO3,
c(H CO ) c(CH COO -) c(H - + 5K 2 3 3 2CO3) c(CH3COO ) c(H ) Ka(CH3COOH) 1.7 10 39.53c(HCO3 ) c(CH3COOH) c(HCO3 ) c(CH3COOH) c(H
+) Ka1(H2CO3) 4 .3 10
7
,D 错误;
故选 BC。
12. BD
【解析】A. 0 1200s ,N2O5 的浓度减少(1.4-0.66)mol/L=0.74mol/L,则生成 NO2 的浓
1.48mol/L
度为 1.48mol/L 3 1 1,生成 NO2 的平均速率约为 1.2 10 mol L s ,故 A 正确;1200s
B. 1200s 1710s ,N2O5 的物质的量减少(0.66-0.48)mol/L 0.1L=0.018mol/L,放出O2 的
物质的量为 0.009mol,则放出O2 的体积为 0.009mol 22.4L/mol=0.2016L(标准状况),故 B
错误;
C. 由表格数据可知,N2O5 浓度从 0.96mol/L 减小为 0.48mol/L,所用时间为 1110s,推测
10
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
N2O5 浓度从 0.48mol/L 减小为 0.24mol/L,所用时间可能为 1110s,则 t 为 2820s,又随反应
进行,反应速率逐渐减小,则推测 t 可能为 2900,故 C 正确;
D. 反应达平衡后再加入 100mL 四氯化碳,所有物质的浓度均减小,溶液颜色变浅,故 D
错误;
故选 BD。
13. D
A K =c(Ag+ )2 c(CrO2- )=(1 10-3 -5【解析】 . sp 4 ) 1 10 1 10
-11
,当
c(CrO2- ) 25 10-5 +
K(Ag CrO)
mol/L c(Ag ) sp 2 4 1 10
-11
4 时, 2 10
-4mol/L ,
c(CrO2-4 ) 25 10
-5
故 A 正确;
B.X 点为Ag2CrO4的不饱和溶液,加入0.1mol L 1 AgNO3 溶液,c(Ag+ ) 2-增大,c(CrO4 )
在达到饱和前不变,向 X 点Ag2CrO4溶液中加入0.1mol L 1 AgNO3 溶液,可使溶液由 X
点变为 Y 点,故 B 正确;
C.Ksp 只受温度影响,温度不变平衡常数不变,t℃时,Y 点和 Z 点时Ag2CrO4的Ksp相
等,故 C 正确;
D.NaCl + -固体没有给出加入量,不能确定此时 c(Ag ) c(Cl )>Ks(p AgCl),不能确定是否
生成白色沉淀,故 D 错误;
故答案为 D。
14. B
K 1 10 14
【解析】A.Kh(NaB)= W = 5 =6.25×10-10,A 正确;K(a HB) 1.6 10
c HB c A- c A- c HB c H+ K HA
B a. = = =10 - - ,与 pH 无关,或者说 pH=4 时c B c HA c B c HA c H+ Ka HB
c HB c A -
- 的值与 pH=3 的一样大,B 错误;c B c HA
C.滴入 20mLHA 溶液后,NaB 与 HA 恰好反应得到等物质的量浓度 NaA 和 HB 混合溶液,
NaA 微弱水解,HB 微弱电离,由于 Ka(HA)=1.6×10-4,则 Ka(HB)=1.6×10-5,可推知 HB 电
离程度大于 NaA 水解程度,则混合溶液成酸性,根据平衡产物可判断存在关系:
c B c HA ,C 正确;
D.滴入 20mLHA 溶液后,NaB 与 HA 恰好反应得到等物质的量浓度 NaA 和 HB 混合溶液,
根据电荷守恒式可知溶液中存在关系: c A c OH c B c Na c H ,D
正确;
答案选 B。
15.BC
+ -
【解析】A.根据 NH3 H O 2 NH4 +OH 可得氨水的电离平衡
K = c(NH
+
4 ) c(OH
-) c(OH-)2 -
b ,可得 c(OH )= K ·c (NHc(NH H O c (NH H O) b 初始 3
H2O) 。已知
3 2 ) 初始 3 2
a 点溶液中 NH3 H2O 浓度为0.100mol L 1,带入上述计算式可得
c(OH-)= K b·c (NH3 H2O) 1.7 10
5 0.1 1.3 10 3mol L-1 ,A 正确;
初始
B.b 点时溶液中为等浓度的氯化铵和氨水,氯化铵的水解平衡常数
11
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
-14
Kh= Kw = 1 10 -5 5.9 10
10
,可知氨水电离能力强于氯化铵的水解能力,溶液为碱性,
Kb 1.7 10
c(OH-)>c(H +) +,根据电荷守恒 c(NH4 )+c(H
+ )=c(OH- )+c(Cl- ) + -可得 c(NH4)>c(Cl)。等
- +
浓度氯化铵和氨水混合溶液中存在物料守恒 2c(Cl )=c(NH3 H2O)+c(NH4 ),又因为
c(NH+)>c(Cl-) c(NH+4 ,可得 4 )>c(Cl
-)>c(NH3 H2O) ,故 B 错误;
C.c 点时溶液溶质为氯化铵溶液,铵根离子在水中发生水解,离子反应式为
NH+4 +H2O NH H O+H
+
3 2 ,溶液中一水合氨的浓度约等于氢离子浓度,而溶液呈酸
-
性,氢离子浓度大于氢氧根浓度,可推得 c(NH3 H2O)>c(OH ),C 错误;
D.d 点溶液中为等浓度的盐酸和氯化铵溶液,溶液中有物料守恒:
c(Cl-)=2c(NH3 H2O)+2c(NH
+
4 )
+
和电荷守恒: c(NH4 )+c(H
+ )=c(OH-)+c(Cl-),将物
+ - +
料守恒带入电荷守恒中可得 c(H )-c(OH )=2c(NH3 H2O)+c(NH4 ),D 正确;
故选 BC。
三、非选择题:本题共 5 小题,共 60 分。
16. ①. 3H2 (g)+CO2 (g) CH3OH(g)+H2O(g) ΔH=-48.9 kJgmol-1 ②. K1 K2
16
③. d ④. CO2 ⑤. 0.225 ⑥. ⑦. bd ⑧. B3
【解析】
【详解】(1)①CO2(g)+H2(g) H2O(g)+CO(g)△H1 =+41.1 kJ mol 1
②CO(g)+2H2(g) CH3OH(g)△H2= 90.0 kJ mol
1
根据盖斯定律①+②:3H2 (g)+CO2 (g CH3OH(g)+H2O(g)△H=(41.1 90.0)kJ mol 1= 48.9
kJ mol 1,用 K1、K2表示此反应的化学平衡常数 K= K1 K2 ,故答案为:3H2 (g)+CO2
(g CH3OH(g)+H2O(g)△H= 48.9 kJ mol 1;K1 K2 ;
(2)a. 高温使平衡逆向移动降低 CH3OH 产率,高压平衡正向移动提高 CH3OH 产率,故 a 错
误;
b. 低温平衡正向移动提高 CH3OH 产率,低压使平衡逆向移动降低 CH3OH 产率,故 b 错误;
c. 高温使平衡逆向移动降低 CH3OH 产率,低压使平衡逆向移动降低 CH3OH 产率,故 c 错
误;
d. 低温高压平衡正向移动提高 CH3OH 产率,故 d 正确,
故答案为:d;
n H2
(3)X 平衡转化率随着 的增大,而增大,根据勒夏特列原理,增大一种反应物的量,n CO2
可以提高另一种反应物的转化率,则 X 为 CO2,故答案为:CO2;
(4)①3H2(g)+CO2 (g) CH3OH(g)+H2O(g)
起始 c(mol L 1) 3 1 0 0
转化 c(mol L 1) 2.25 0.75 0.75 0.75
平衡 c(mol L 1) 0.75 0.25 0.75 0.75
v(H 2.25mol/L2 )= =0.225 mol L-1 min -1;10min
c H2O c CH3OH 0.75 0.75 16 16
②K= = 0.25 0.75 3 = ,故答案为: ;c CO2 c H2 3 3
③a. 3v 正(H2) =v 逆(CH3OH),不能说明正反应速率等于逆反应速率,不能说明反应达到平衡,
故 a 错误;
12
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
b. 该反应是气体体积减小的反应,反应过程中压强不断减小,当容器中气体压强不随时间
而变化时,说明该反应达到平衡,故 b 正确;
c. c (H2) : c (CO2) =1 : 1,不能说明正反应速率等于逆反应速率,不能说明反应达到平衡,故
c 错误;
d. 该反应是气体体积减小的反应,反应过程中气体总物质的量不断减小,气体总质量不变,
反应过程中气体平均相对分子质量不断减小,当容器中气体平均相对分子质量不随时间而变
化时,说明反应达到平衡,故 d 正确;
故选 bd;
④分别对比 AB、CD 实验,Cu/ZnO 纳米片催化剂,甲醇的选择性高,对比 BD,温度升高,
CO2 的转化率升高,但甲醇的选择性降低,CO2生产甲醇的最优选项为 B,故答案为:B。
17. (1)2 (2)酸式滴定管
(3) ①. 锥形瓶中溶液颜色变化 ②. 滴入最后半滴标准液,溶液由无色变为浅红
色,且半分钟内不褪色
(4)22.60 (5)BC
18.(1 )正盐 (2)ClO CO2 H2O=HClO HCO3
(3) ①. H2A HA
+H+ ②. HA H+ +A2
b
4 10 7( )
a b
19. (1)CD (2)<
1
(3) ①. bd ②. X ③. 或 0.0625
16
20.(1) ①. H2+ H3 ②.ⅱ
(2)9 (3) ①. 9.6 ②. D ③. p1>p2>p3 ④. T℃时以反应Ⅱ为主,反
应Ⅱ前后气体分子数相等,压强改变对平衡没有影响
13
{#{QQABKYiQggCAQAAAARhCEQXaCAAQkAACCIoGBAAIMAABQRFABAA=}#}
同课章节目录
