2.2 醇和酚(含解析) 课后练习 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 2.2 醇和酚(含解析) 课后练习 2023-2024学年高二下学期化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | docx | ||
| 文件大小 | 260.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 09:54:39 | ||
图片预览




文档简介
2.2 醇和酚 课后练习
一、单选题
1.乙醇是很重要的化工原料。下列说法不正确的有( )
A.乙醇催化氧化可制备乙醛
B.乙醇与H2反应可制备乙烷
C.乙醇与金属钠反应可制备乙醇钠
D.乙醇与乙酸反应可制备乙酸乙酯
2.下列几组有机物中,用溴水无法鉴别的是( )
A.苯、、乙酸 B.环己烷、甲苯、乙醇
C.溴苯、苯乙烯、乙苯 D.甘油、乙酸乙酯、乙酸丙烯酯
3.下列属于加成反应的是( )
A.CH4+2O2 CO2+2H2O
B.CH2=CH2 +H2 CH3CH3
C. +HNO3 +H2O
D.2CH3CH2OH +O2 2CH3CHO+2H2O
4.关于物质的性质及其相关用途,说法错误的是( )
A.甲酸具有较强的还原性,工业上可以做还原剂
B.蛋白质盐析是可逆的,可采用多次盐析来分离提纯蛋白质
C.苯酚可以使蛋白质变性,可用于杀菌消毒
D.氯气具有很强的氧化性,可以用作漂白剂
5.苯酚( )在一定条件下能与氢气加成得到环己醇( ).下面关于这两种有机物的叙述中,错误的是( )
A.都能发生取代反应
B.都能与金属钠反应放出氢气
C.苯酚是比碳酸更强的酸,环己醇则显中性
D.苯酚与FeCl3溶液作用显紫色,环己醇加入FeCl3溶液中无明显现象
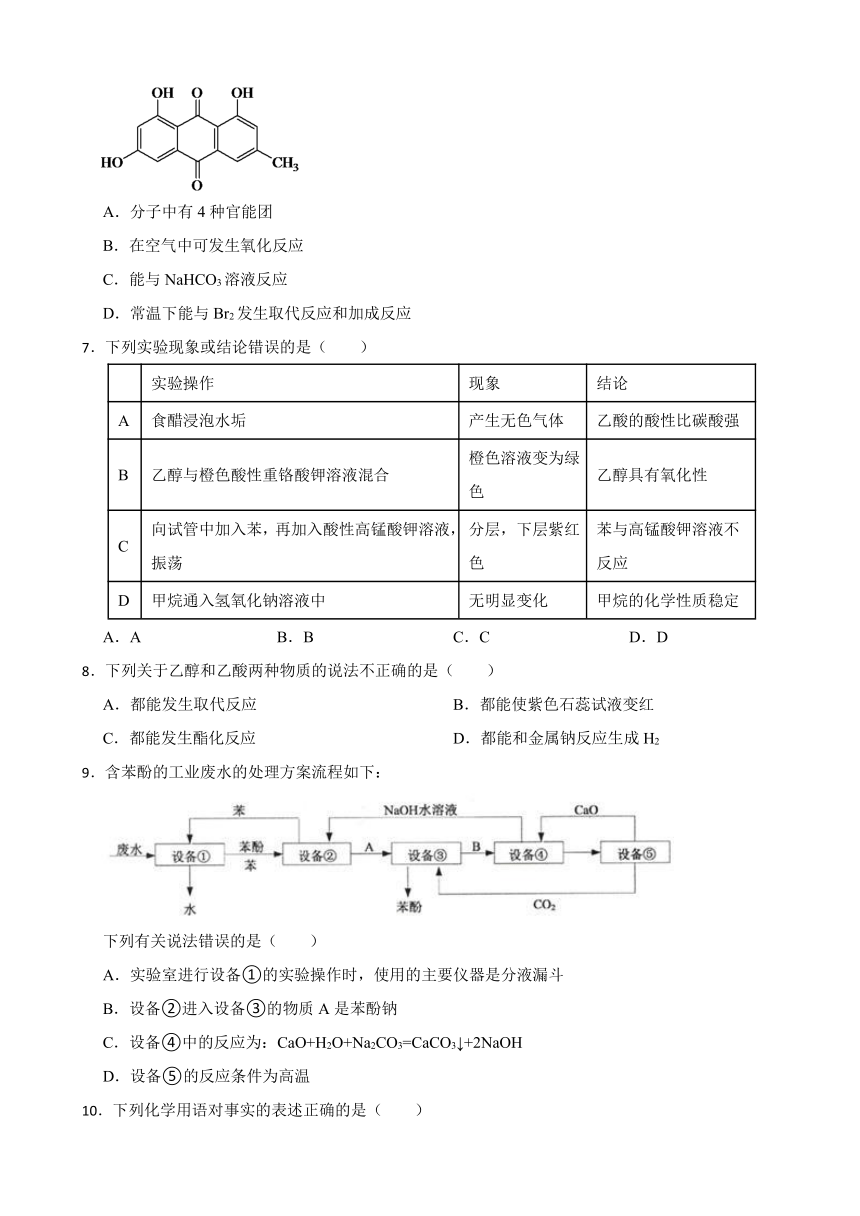
6.大黄素是中药大黄的主要成分,有广泛的药理作用。下列有关大黄素的说法正确的是( )
A.分子中有4种官能团
B.在空气中可发生氧化反应
C.能与NaHCO3溶液反应
D.常温下能与Br2发生取代反应和加成反应
7.下列实验现象或结论错误的是( )
实验操作 现象 结论
A 食醋浸泡水垢 产生无色气体 乙酸的酸性比碳酸强
B 乙醇与橙色酸性重铬酸钾溶液混合 橙色溶液变为绿色 乙醇具有氧化性
C 向试管中加入苯,再加入酸性高锰酸钾溶液,振荡 分层,下层紫红色 苯与高锰酸钾溶液不反应
D 甲烷通入氢氧化钠溶液中 无明显变化 甲烷的化学性质稳定
A.A B.B C.C D.D
8.下列关于乙醇和乙酸两种物质的说法不正确的是( )
A.都能发生取代反应 B.都能使紫色石蕊试液变红
C.都能发生酯化反应 D.都能和金属钠反应生成H2
9.含苯酚的工业废水的处理方案流程如下:
下列有关说法错误的是( )
A.实验室进行设备①的实验操作时,使用的主要仪器是分液漏斗
B.设备②进入设备③的物质A是苯酚钠
C.设备④中的反应为:CaO+H2O+Na2CO3=CaCO3↓+2NaOH
D.设备⑤的反应条件为高温
10.下列化学用语对事实的表述正确的是( )
A.乙醇在铜催化下被氧化:
B.用过量氨水吸收二氧化硫气体:
C.丙烯使溴的四氯化碳溶液褪色:
D.乙酸与乙醇的酯化反应:
11.乙醇在一定条件下发生化学反应时化学键断裂情况如下所示,则乙醇在催化氧化时,化学键断裂的位置是( )
A.②③ B.②④ C.①③ D.③④
12.下列关于酯化反应说法正确的是( )
A.用CH3CH218OH与CH3COOH发生酯化反应,生成H218O
B.反应液混合时,将浓硫酸倒入乙醇和乙酸的混合液中
C.可用分液漏斗分离饱和Na2CO3溶液和乙酸乙酯的混合溶液
D.在制备乙酸乙酯的实验中,为了防止乙酸和乙醇挥发,小火加热,避免液体沸腾
13.乙醇是生活中常见的有机物。下列有关乙醇的实验操作或现象错误的是( )
A.①中酸性溶液会褪色,乙醇转化为乙醛
B.②中钠会先沉在试管底部,表面有气泡产生,上方的火焰呈淡蓝色
C.③中灼热的铜丝插入乙醇中,铜丝由黑色变为红色
D.要制得无水乙醇应加入生石灰蒸馏
14.以下实验:①为检验RX是溴代烷,将RX与NaOH水溶液混合后再加入AgNO3溶液;②实验室里用无水乙醇和浓硫酸共热至170℃制乙烯;③用油脂与碳酸钠溶液混合加热制肥皂④在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾;会失败的实验是( )
A.①②③ B.①③④ C.②③④ D.①②③④
15.下列物质中,既能发生消去反应生成烯烃,又能发生氧化反应生成醛的是( )
A.CH3OH B.
C. D.
16.下列说法中不正确的是( )
A.能源与材料、信息一起被称为现代社会发展的三大支柱
B.乙烯是一种植物生长调节剂,也是水果催熟剂,其产量可衡量国家石油化工水平
C.德国化学家凯库勒从梦境中得到启发,提出了关于苯环结构的重要学说
D.乙醇能与活泼金属钠反应,不能被酸性 K2Cr2O7 溶液直接氧化成乙酸
二、综合题
17.书写下列方程式:
(1)乙酸和乙醇的酯化反应方程式
(2)工业冶炼镁的化学方程式
(3)二氧化硅与氢氟酸化学方程式
(4)Na2SO3与FeCl3反应的离子方程式
(5)火法炼铜化学方程式 .
18.生活中,有机化合物随处可见.请根据题意填空:
(1)75%的医用酒精可以灭活新型冠状病毒,是因为酒精可渗透到细胞组织内,使蛋白质发生 。
(2)新买的猕猴桃比较硬,放软了口感才好,为了尽快使猕猴挑变软,可以把猕猴桃和苹果放在一起,原因是苹果可以释放出 (填物质的名称)。
(3)炒菜时,加入酒和醋能使菜味香可口,原因是酒和醋反应生成了 (填物质的类别)。
(4)糖尿病患者的尿液中含有 (填物质的名称),该物质的溶液与新制氢氧化铜共热,产生 (填物质的颜色)沉淀。
19.烃A是合成食品包装袋的原料,A的一系列反应如下(部分反应条件略去):
回答下列问题:
(1)A的化学名称是 ,C的结构简式是 ;
(2)反应②的化学方程式: 。
(3)D分子中含有的官能团名称 ,反应②的反应类型为 。
(4)反应③的化学方程式 。
20.含苯酚的工业废水的处理流程如图所示:
(1)根据此流程图回答下列问题:
①流程图设备Ⅰ中进行的是 操作(填操作名称)。
②由设备Ⅲ进入设备Ⅳ的物质B是 (填化学式)。
③设备Ⅲ中发生反应的化学方程式为 。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、和。通过过滤可以使产物相互分离。
⑤流程图中能循环使用的物质是NaOH溶液、、和 (填化学式)。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是 。由上述流程图总结出从废水中回收苯酚的方法是:
①用有机溶剂萃取废液中的苯酚;
②加入某种药品的水溶液使苯酚与有机溶剂脱离;
③加入某物质又析出苯酚。
若第②步加入的某种药品是KOH,其反应的化学方程式为 。
(3)为测定废水中苯酚的含量,取此废水100mL,向其中加入足量饱和溴水至不再产生沉淀为止,得到沉淀0.331g,则此废水中苯酚的含量为 。
21.根据所学知识完成下面的题目:
(1)含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1g L﹣1以上的工业废水应回收苯酚.某研究性学习小组设计下列流程,探究废水中苯酚的回收方法.
①可用 为试剂检验水样中是否含有苯酚.
②操作I的名称为 ,试剂a的化学式为 .
③通入CO2发生反应生成苯酚的化学方程式为 .
(2)某有机物的分子式为C3H6O3.
①1mol该有机物充分燃烧消耗的O2在标准状况下的体积为 L.
②若两分子该有机物能生成六元环状结构,写出该反应的化学方程式 .
答案解析部分
1.【答案】B
【解析】【解答】A. 乙醇催化氧化可制备乙醛,A正确,A不符合题意;
B. 乙醇与H2不反应,不能制备乙烷,B错误,B符合题意;
C. 乙醇与金属钠反应生成氢气和乙醇钠,可制备乙醇钠,C正确,C不符合题意;
D. 乙醇与乙酸反应可制备乙酸乙酯,D正确,D不符合题意,
故正确答案选B。
【分析】乙醇中不存在不饱和键所以不发生和氢气 的反应。
2.【答案】B
【解析】【解答】A.苯和不与溴水反应且可以萃取溴水中的溴单质,苯有机层在上层,有机层在下层,乙酸可以与水互溶,可以鉴别,故A不符合题意;
B.环己烷与甲苯不与溴水反应,且有机层都在上层,用溴水无法鉴别,故B符合题意;
C.溴苯和乙苯不与溴水反应,溴苯有机层在下层,乙苯有机层在上层,苯乙烯会与溴水发生反应使溴水褪色,可以鉴别,故C不符合题意;
D.甘油和乙酸乙酯不与溴水发生反应,甘油可以和溴水互溶,乙酸乙酯不与溴水发生反应,有机层在上层,乙酸丙烯酯会与溴水发生反应使溴水褪色,可以鉴别,故D不符合题意;
故答案为:B。
【分析】A.苯和四氯化碳能萃取溴,苯的密度小于水,四氯化碳密度大于水;
B.环己烷与甲苯不与溴水反应,且有机层都在上层;
C.溴苯和乙苯不与溴水反应,溴苯在下层,乙苯有机层在上层,苯乙烯会与溴水发生反应使溴水褪色;
D.甘油可以和溴水互溶,乙酸乙酯不与溴水发生反应,有机层在上层,乙酸丙烯酯会与溴水发生反应使溴水褪色。
3.【答案】B
【解析】【解答】A. CH4+2O2 CO2+2H2O属于氧化还原反应,不属于加成反应,选项A不符合题意;
B. CH2=CH2 +H2 CH3CH3属于加成反应,选项B符合题意;
C. +HNO3 +H2O属于硝化反应,也属于取代反应,选项C不符合题意;
D. 2CH3CH2OH +O2 2CH3CHO+2H2O属于氧化反应,不属于加成反应,选项D不符合题意。
故答案为:B。
【分析】掌握加成反应的含义,有机物中不饱和键发生部分断裂直接与其他原子相连而产生的的新物质。
4.【答案】D
【解析】【解答】A.甲酸同时具有醛和羧酸的性质,具有较强的还原性,工业上常用做还原剂,故A不符合题意;
B.向蛋白质溶液中加入饱和无机盐溶液会降低蛋白质的溶解度而析出蛋白质而产生盐析,盐析是可逆过程,可采用多次盐析来分离提纯蛋白质,故B不符合题意;
C.苯酚有毒,可以使蛋白质变性,常用于杀菌消毒,故C不符合题意;
D.氯气可以用作漂白剂是因为氯气与水反应生成具有强氧化性的次氯酸使有机色质漂白褪色,与氯气的氧化性无关,故D符合题意;
故答案为:D。
【分析】A.甲酸中含有醛基,醛基具有还原性;
B.蛋白质的盐析是可逆的过程;
C.苯酚有毒,能使蛋白质变性。
5.【答案】C
【解析】【解答】解:A、苯环能发生取代反应,羟基能发生取代反应,所以苯酚、环己醇都能发生取代反应,故A正确;
B、根据醇羟基与酚羟基都能与金属钠反应放出氢气,所以苯酚、环己醇都能与金属钠反应放出氢气,故B正确;
C、根据苯酚的酸性比碳酸弱,环己醇显中性,故C错误;
D、根据酚遇FeCl3溶液作用显紫色,而醇无此性质,所以苯酚与FeCl3溶液作用显紫色,环己醇加入FeCl3溶液中无明显现象,故D正确;
故选C.
【分析】A、根据苯环能发生取代反应,羟基能发生取代反应;
B、根据醇羟基与酚羟基都能与金属钠反应放出氢气;
C、根据苯酚的酸性比碳酸弱,环己醇显中性;
D、根据酚遇FeCl3溶液作用显紫色,而醇无此性质;
6.【答案】B
【解析】【解答】A.根据物质结构简式可知:该物质分子中含有羟基、羰基两种官能团,A不符合题意;
B.该物质分子中含有酚羟基,容易被空气中的氧气氧化,因而能发生氧化反应,B符合题意;
C.由于碳酸的酸性比苯酚酸性强,所以该物质不能与NaHCO3溶液反应,C不符合题意;
D.在常温下该物质能与Br2发生取代反应,但是不能与其发生加成反应,D不符合题意;
故答案为:B。
【分析】A.该分子中含有酚羟基、羰基;
B.酚羟基易被空气氧化;
C.-COOH能和NaHCO3溶液反应;
D.苯环上酚羟基的邻位、对位的氢原子可以与溴发生取代反应,但无碳碳双键。
7.【答案】B
【解析】【解答】A.食醋浸泡水垢,发生强酸制取弱酸的反应,则乙酸的酸性比碳酸强,A不符合题意;
B.乙醇具有还原性,被重铬酸钾氧化,则橙色溶液变为绿色,结论不合理,B符合题意;
C.苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含碳碳双键,不与高锰酸钾溶液反应,C不符合题意;
D.甲烷属于饱和烃,性质稳定,不能与氢氧化钠溶液反应,D不符合题意;
故答案为:B
【分析】A.水垢的主要成分是CaCO3,能与醋酸反应;
B.乙醇能被酸性重铬酸钾溶液氧化;
C.苯与酸性高锰酸钾溶液不反应;
D.甲烷与NaOH溶液不反应;
8.【答案】B
【解析】【解答】A、由于乙醇和乙酸都能发生酯化反应生成乙酸乙酯,故A正确;
B、乙醇不显示酸性,乙酸显示酸性,乙醇不能使紫色的石蕊试液变化,故B错误;
C、二者都能发生酯化反应,故C正确;
D、由于乙醇和乙酸中都有羟基,都能够和钠反应生成氢气,故D正确;
故选B.
【分析】A、乙酸、乙醇的酯化反应就是取代反应;
B、使紫色石蕊试液变红的物质具有酸性;
C、酸和醇一定条件下发生酯化反应;
D、乙醇和乙酸都含有羟基,可以和钠反应生成氢气.
9.【答案】C
【解析】【解答】A.设备①中有苯酚,苯和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,使用的主要仪器是分液漏斗,故A不符合题意;
B.由分析可知,设备①中有苯酚,苯和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,进入设备②,设备②加入氢氧化钠溶液,可得到苯酚钠,A是苯酚钠,故B不符合题意;
C.设备④中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀,化学方程式为:CaO+NaHCO3=CaCO3↓+NaOH,故C符合题意;
D.设备⑤中生成CaO和CO2,发生的是碳酸钙的分解反应,该反应条件为高温,故D不符合题意;
故答案为:C。
【分析】由流程可知,设备①中有苯酚,苯和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,进入设备②,设备②加入氢氧化钠溶液,可得到苯酚钠,苯不与氢氧化钠反应,将要分层,溶液上层为苯,下层为苯酚钠,在设备③中通入二氧化碳可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,设备④中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀,据此解答。
10.【答案】A
【解析】【解答】A.乙醇在铜催化下被氧化为乙醛,反应方程式是,故A符合题意;
B.用过量氨水吸收二氧化硫气体生成亚硫酸铵,反应化学方程式是,故B不符合题意;
C.丙烯与溴的四氯化碳溶液发生加成反应生成1,2-二溴丙烷,反应方程式是,故C不符合题意;
D.乙酸与乙醇发生酯化反应生成乙酸乙酯和水,反应方程式是:,故D不符合题意;
故答案为:A。
【分析】A、乙醇催化氧化生成乙醛;
B、二氧化硫少量形成硫酸铵,二氧化硫过量生成硫酸氢铵;
C、注意烯烃可以和溴发生加成反应;
D、注意酯化反应时,酸脱羟基醇脱氢。
11.【答案】B
【解析】【解答】解:乙醇在铜催化下和氧气反应时,生成乙醛,断裂②④键,
故选B.
【分析】乙醇在催化氧化时,﹣CH2OH结构被氧化为﹣CHO结构,根据官能团的变化判断断裂的化学键.
12.【答案】C
【解析】【解答】 A.根据酯化反应规律特点“酸脱羟基醇脱氢”可知 18O 应存在酯中,故A错误;
B.酯化反应加入试剂先后顺序为:先加入醇,再加入浓硫酸和羧酸,故B错误;
C.乙酸乙酯在饱和碳酸钠溶液中溶解度降低分层,可用分液漏斗进行分液,故C正确;
D.小火加热主要目的是为了避免温度过高生成其它产物,例如乙醇和浓硫酸在140℃会发生反应分子间脱水成醚,故D错误;
故选C。
【分析】A.根据酯化反应规律“酸脱羟基醇脱氢”分析;
B.酯化反应加入试剂先后顺序为:先加入醇,再加入浓硫酸和羧酸;
C.依据试剂的性质分析;
D.防止发生副反应;
13.【答案】A
【解析】【解答】A.酸性KMnO4溶液中滴加乙醇,乙醇被氧化为乙酸,则酸性KMnO4溶液会褪色,A选项不符合题意;
B.乙醇的密度比钠小,金属钠沉在乙醇底部,乙醇中含有羟基,能与金属钠反应生成氢气,产生的氢气燃烧产生淡蓝色火焰,B选项不符合题意;
C.灼烧至红热的铜丝表面生成CuO,趁热插入乙醇中后又被乙醇还原为金属铜,即铜丝由黑色变红,C选项不符合题意;
D.乙醇中含有少量水,加入生石灰和水反应生成氢氧化钙,增大与乙醇的沸点差异,然后蒸馏可除杂,D选项不符合题意;
故答案为:A。
【分析】A、羟基具有还原性,可以使酸性高锰酸钾溶液褪色;
B、钠密度大于乙醇,因此沉在底部,生成气体;
C、铜作为催化剂,在空气中灼烧变为黑色,深入乙醇变为红色;
D、水和生石灰反应,沸点提高,有利于蒸馏操作中乙醇和水的分离。
14.【答案】B
【解析】【解答】①检验卤代烃水解产物,应先加入硝酸中和剩余的碱,再加硝酸银检验卤素离子,避免对溴离子检验产生干扰,故①实验会失败;
②实验室里用无水乙醇和浓硫酸共热至170℃制得乙烯,故②实验能够成功;
③皂化反应反应中必须使用强碱,而碳酸钠的碱性较弱,皂化反应的反应速率缓慢,反应不完全,用于制皂费时费力,成本高,得不偿失,故③实验失败;
④乙醛与新制氢氧化铜反应应在碱性环境中反应,加入的氢氧化钠溶液不足,故④实验失败;
故选B.
【分析】①检验RX是溴代烷,加入硝酸银溶液之前应该使用硝酸中和过量的碱,否则会干扰溴离子的检验;
②乙醇与浓硫酸共热,温度不同,产物不同;
③皂化反应用强碱与油脂发生反应,不能使用碳酸钠;
④醛与氢氧化铜的反应需在碱性环境下进行,氢氧化钠应该过量.
15.【答案】B
【解析】【解答】A、甲醇不能发生消去反应,A不符合题意;
B、该醇既能发生消去反应生成烯烃,又能发生氧化反应生成醛,B符合题意;
C、与羟基相连的碳原子上没有氢原子,不能发生催化氧化,C不符合题意;
D、其氧化产物是羰基,得不到醛基,D不符合题意,答案选B。
【分析】掌握醇的性质是解答的关键,醇的催化氧化的反应情况与跟羟基(—OH)相连的碳原子上的氢原子的个数有关: ;醇分子中,连有羟基(-OH)的碳原子必须有相邻的碳原子,并且此相邻的碳原子上必须连有氢原子时,才可发生消去反应,生成不饱和键。
16.【答案】D
【解析】【解答】A.能源是人类社会活动的基础,与材料、信息一起被称为现代社会发展的三大支柱,A不符合题意;
B.乙烯的产量是衡量一个国家石油化工水平的标志,也是一种植物生长调节剂和水果催熟剂,B不符合题意;
C.德国化学家凯库勒从梦境中得到启发,成功的提出了关于苯环的凯库勒结构,C不符合题意;
D.乙醇能与金属钠反应放出氢气,可以直接被酸性 K2Cr2O7溶液氧化成乙酸,D符合题意。
故答案为:D
【分析】A.能源与材料、信息是现代文明发展的根本;
B.乙烯在现代化工生产中具有极其重要的作用;
C.熟悉苯的凯库勒结构的由来;
D.乙醇中的羟基使其能被其他强氧化剂氧化。
17.【答案】(1)CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
(2)MgCl2 Mg+Cl2↑
(3)SiO2+4HF=SiF4↑+2H2O
(4)2Fe3++SO32﹣+1H2O=2Fe2++SO42﹣+2H+
(5)Cu2S+O2 2Cu+SO2
【解析】【解答】解:(1)发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;(2)工业冶炼镁是电解氯化镁,化学方程式为:MgCl2 Mg+Cl2↑,故答案为:MgCl2 Mg+Cl2↑;(3)二氧化硅可以和唯一的酸HF之间反应生成四氟化硅和水,反应方程式为:SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;(4)铁离子和亚硫酸根离子的氧化还原反应,铁离子得电子被还原,亚硫酸根离子失电子被氧化,离子反应方程式为:2Fe3++SO32﹣+1H2O=2Fe2++SO42﹣+2H+,故答案为:2Fe3++SO32﹣+1H2O=2Fe2++SO42﹣+2H+;(5)火法炼铜原理为:高温下将硫化亚铜与氧气反应生成二氧化硫和铜,方程式:Cu2S+O2 2Cu+SO2,故答案为:Cu2S+O2 2Cu+SO2.
【分析】(1)发生酯化反应生成乙酸乙酯和水;(2)工业冶炼镁是电解氯化镁;(3)二氧化硅与氢氟酸反应,生成四氟化硅气体和水;(4)铁离子和亚硫酸根离子的氧化还原反应,铁离子得电子被还原,亚硫酸根离子失电子被氧化;(5)火法炼铜原理为:高温下将硫化亚铜与氧气反应生成二氧化硫和铜.
18.【答案】(1)变性
(2)乙烯
(3)酯
(4)葡萄糖;砖红色
【解析】【解答】(1)75%的医用酒精可渗透到细胞组织内,使细胞失去活性,从而灭活新型冠状病毒,其原因是使蛋白质发生变性。答案为:变性;
(2)新买的猕猴桃比较硬,表明猕猴桃还没有完全成熟,可与苹果放在一起进行催熟,原因是苹果可以释放出乙烯。答案为:乙烯;
(3)炒菜时,加入酒和醋能使菜味香可口,原因是酒和醋能发生酯化反应,生成具有水果香味的乙酸乙酯,乙酸乙酯属于酯。答案为:酯;
(4)糖尿病患者的尿糖含量高,其尿液中含有的糖为葡萄糖,该物质的溶液与新制氢氧化铜共热,产生Cu2O沉淀,该物质呈砖红色。答案为:葡萄糖;砖红色。
【分析】(1)酒精可以使蛋白质变性
(2)乙烯是果实催熟剂
(3)酸和醇发生了酯化反应
(4)根据醛基的检验特性,尿中含有葡萄糖,与氢氧化铜作用得到砖红色的氧化亚铜
19.【答案】(1)乙烯;
(2)
(3)羧基;氧化反应
(4)2CH3CHO+O2→2CH3COOH
【解析】【解答】(1)由分析可知,A的结构简式为CH2=CH2,因此A的化学名称为乙烯;C的结构简式为CH3CHO。
(2)反应②是CH3CH2OH的催化氧化反应,该反应的化学方程式为2CH3CH2OH+O22CH3CHO+H2O。
(3)由分析可知,D的结构简式为CH3COOH,其所含的官能团为羧基;反应②是乙醇的催化氧化反应,因此其反应类型为氧化反应。
(4)反应③是乙醛的氧化反应,该反应的化学方程式为2CH3CHO+O2→2CH3COOH。
【分析】烃A是合成食品包装袋的原料,因此A为CH2=CH2;A与H2O反应生成B,因此B为CH3CH2OH;B与O2发生氧化反应生成乙醛,因此C为CH3CHO;C与O2进一步发生氧化反应,生成乙酸,因此D为CH3COOH。A与O2在银的催化作用下反应E,因此E为环氧乙烷;E与H2O进一步反应生成F(C2H6O2),因此F的结构简式为HOCH2CH2OH。D与F在浓硫酸加热条件下发生酯化反应,生成G(C6H10O4),因此G的结构简式为CH3COOCH2CH2OOCCH3。
20.【答案】(1)萃取、分液;;+CO2+H2O→+NaHCO3;CaO
(2)向污水中滴加溶液,若溶液呈紫色,则表明污水中有苯酚;+KOH→+ H2O
(3)940
【解析】【解答】设备Ⅰ里废水和苯混合分离出水,为萃取、分液,设备II中向苯和苯酚的混合液中加入氢氧化钠溶液,苯酚和氢氧化钠反应生成苯酚钠并分离出苯,物质A为苯酚钠溶液,设备III中通入二氧化碳分离出苯酚,同时生成碳酸氢钠,物质B为碳酸氢钠溶液,设备IV中加入氧化钙与碳酸氢钠溶液反应生成氢氧化钠、二氧化碳和碳酸钙,过滤分离出碳酸钙,设备V中碳酸钙受热分解生成氧化钙和二氧化碳。
(1)①设备Ⅰ里废水和苯混合分离出水,为萃取、分液。
②在设备Ⅲ中通入CO2分离出苯酚,同时生成碳酸氢钠,剩下的物质B是NaHCO3溶液。
③设备Ⅲ中二氧化碳、水与苯酚钠反应生成苯酚和碳酸氢钠,反应的化学方程式为:+CO2+H2O→+NaHCO3。
⑤设备V中碳酸钙受热分解生成氧化钙和二氧化碳,因此流程图中能循环使用的物质除了NaOH溶液、二氧化碳、苯之外,还有CaO。
(2)酚类物质遇氯化铁溶液会显紫色,因此用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,方法为:向污水中滴加溶液,若溶液呈紫色,则表明污水中有苯酚;苯酚与氢氧化钾溶液反应生成苯酚钾和水,反应的化学方程式为:+KOH→+H2O。
(3)设每升废水含苯酚的质量为x,则根据方程式+3Br2→↓+3HBr可知,x==0.94g,所以此废水中苯酚的含量为940mg·L-1。
【分析】设备I,利用苯酚易溶于苯,进行萃取分液,把苯酚萃取出来,设备II,加入氢氧化钠溶液,与苯酚反应,分液,得到苯酚钠,回收苯进入设备I,设备II,通入二氧化碳与苯酚钠反应,得到苯酚,得到的碳酸钠进入设备IV,加入氧化钙,得到氢氧化钠溶液和碳酸钙,碳酸钙进入设备V,高分分解得到二氧化碳,循环使用。
21.【答案】(1)FeCl3溶液或浓溴水;萃取(或萃取分液);NaOH;C6H5ONa+CO2+H2O→C6H5OH+NaHCO3
(2)67.2;
【解析】【解答】解:(1)①苯酚与氯化铁发生显色反应,苯酚与溴水反应生成白色沉淀,则选择检验试剂为FeCl3溶液或浓溴水,故答案为:FeCl3溶液或浓溴水;②由分离流程可知,加苯为萃取剂,操作1为萃取,然后得到有机层;苯酚与NaOH反应生成苯酚钠溶于水,则试剂a为NaOH,故答案为:萃取(或萃取分液);NaOH;③苯酚钠与二氧化碳、水反应生成苯酚、碳酸氢钠,该反应为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;(2)①1mol该有机物充分燃烧生成CO2和H2O,消耗O2为3+ ﹣ =3mol,其标况下体积为3mol×22.4L/mol=67.2L,故答案为:67.2;②有机物两分子间相互反应生成含有六元环状结构的产物,发生酯化反应,该反应为 ,故答案为: .
【分析】(1)①苯酚与氯化铁发生显色反应;②由分离流程可知,加苯为萃取剂,操作1为萃取,然后得到有机层;苯酚与NaOH反应生成苯酚钠溶于水,则试剂a为NaOH;③苯酚钠与二氧化碳、水反应生成苯酚、碳酸氢钠;(2)①1mol该有机物充分燃烧生成CO2和H2O,消耗O2为3+ ﹣ =3mol,结合标况计算体积;
②有机物两分子间相互反应生成含有六元环状结构的产物,发生酯化反应.
一、单选题
1.乙醇是很重要的化工原料。下列说法不正确的有( )
A.乙醇催化氧化可制备乙醛
B.乙醇与H2反应可制备乙烷
C.乙醇与金属钠反应可制备乙醇钠
D.乙醇与乙酸反应可制备乙酸乙酯
2.下列几组有机物中,用溴水无法鉴别的是( )
A.苯、、乙酸 B.环己烷、甲苯、乙醇
C.溴苯、苯乙烯、乙苯 D.甘油、乙酸乙酯、乙酸丙烯酯
3.下列属于加成反应的是( )
A.CH4+2O2 CO2+2H2O
B.CH2=CH2 +H2 CH3CH3
C. +HNO3 +H2O
D.2CH3CH2OH +O2 2CH3CHO+2H2O
4.关于物质的性质及其相关用途,说法错误的是( )
A.甲酸具有较强的还原性,工业上可以做还原剂
B.蛋白质盐析是可逆的,可采用多次盐析来分离提纯蛋白质
C.苯酚可以使蛋白质变性,可用于杀菌消毒
D.氯气具有很强的氧化性,可以用作漂白剂
5.苯酚( )在一定条件下能与氢气加成得到环己醇( ).下面关于这两种有机物的叙述中,错误的是( )
A.都能发生取代反应
B.都能与金属钠反应放出氢气
C.苯酚是比碳酸更强的酸,环己醇则显中性
D.苯酚与FeCl3溶液作用显紫色,环己醇加入FeCl3溶液中无明显现象
6.大黄素是中药大黄的主要成分,有广泛的药理作用。下列有关大黄素的说法正确的是( )
A.分子中有4种官能团
B.在空气中可发生氧化反应
C.能与NaHCO3溶液反应
D.常温下能与Br2发生取代反应和加成反应
7.下列实验现象或结论错误的是( )
实验操作 现象 结论
A 食醋浸泡水垢 产生无色气体 乙酸的酸性比碳酸强
B 乙醇与橙色酸性重铬酸钾溶液混合 橙色溶液变为绿色 乙醇具有氧化性
C 向试管中加入苯,再加入酸性高锰酸钾溶液,振荡 分层,下层紫红色 苯与高锰酸钾溶液不反应
D 甲烷通入氢氧化钠溶液中 无明显变化 甲烷的化学性质稳定
A.A B.B C.C D.D
8.下列关于乙醇和乙酸两种物质的说法不正确的是( )
A.都能发生取代反应 B.都能使紫色石蕊试液变红
C.都能发生酯化反应 D.都能和金属钠反应生成H2
9.含苯酚的工业废水的处理方案流程如下:
下列有关说法错误的是( )
A.实验室进行设备①的实验操作时,使用的主要仪器是分液漏斗
B.设备②进入设备③的物质A是苯酚钠
C.设备④中的反应为:CaO+H2O+Na2CO3=CaCO3↓+2NaOH
D.设备⑤的反应条件为高温
10.下列化学用语对事实的表述正确的是( )
A.乙醇在铜催化下被氧化:
B.用过量氨水吸收二氧化硫气体:
C.丙烯使溴的四氯化碳溶液褪色:
D.乙酸与乙醇的酯化反应:
11.乙醇在一定条件下发生化学反应时化学键断裂情况如下所示,则乙醇在催化氧化时,化学键断裂的位置是( )
A.②③ B.②④ C.①③ D.③④
12.下列关于酯化反应说法正确的是( )
A.用CH3CH218OH与CH3COOH发生酯化反应,生成H218O
B.反应液混合时,将浓硫酸倒入乙醇和乙酸的混合液中
C.可用分液漏斗分离饱和Na2CO3溶液和乙酸乙酯的混合溶液
D.在制备乙酸乙酯的实验中,为了防止乙酸和乙醇挥发,小火加热,避免液体沸腾
13.乙醇是生活中常见的有机物。下列有关乙醇的实验操作或现象错误的是( )
A.①中酸性溶液会褪色,乙醇转化为乙醛
B.②中钠会先沉在试管底部,表面有气泡产生,上方的火焰呈淡蓝色
C.③中灼热的铜丝插入乙醇中,铜丝由黑色变为红色
D.要制得无水乙醇应加入生石灰蒸馏
14.以下实验:①为检验RX是溴代烷,将RX与NaOH水溶液混合后再加入AgNO3溶液;②实验室里用无水乙醇和浓硫酸共热至170℃制乙烯;③用油脂与碳酸钠溶液混合加热制肥皂④在试管中加入2mL10%的CuSO4溶液,滴入2%的NaOH溶液4~6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾;会失败的实验是( )
A.①②③ B.①③④ C.②③④ D.①②③④
15.下列物质中,既能发生消去反应生成烯烃,又能发生氧化反应生成醛的是( )
A.CH3OH B.
C. D.
16.下列说法中不正确的是( )
A.能源与材料、信息一起被称为现代社会发展的三大支柱
B.乙烯是一种植物生长调节剂,也是水果催熟剂,其产量可衡量国家石油化工水平
C.德国化学家凯库勒从梦境中得到启发,提出了关于苯环结构的重要学说
D.乙醇能与活泼金属钠反应,不能被酸性 K2Cr2O7 溶液直接氧化成乙酸
二、综合题
17.书写下列方程式:
(1)乙酸和乙醇的酯化反应方程式
(2)工业冶炼镁的化学方程式
(3)二氧化硅与氢氟酸化学方程式
(4)Na2SO3与FeCl3反应的离子方程式
(5)火法炼铜化学方程式 .
18.生活中,有机化合物随处可见.请根据题意填空:
(1)75%的医用酒精可以灭活新型冠状病毒,是因为酒精可渗透到细胞组织内,使蛋白质发生 。
(2)新买的猕猴桃比较硬,放软了口感才好,为了尽快使猕猴挑变软,可以把猕猴桃和苹果放在一起,原因是苹果可以释放出 (填物质的名称)。
(3)炒菜时,加入酒和醋能使菜味香可口,原因是酒和醋反应生成了 (填物质的类别)。
(4)糖尿病患者的尿液中含有 (填物质的名称),该物质的溶液与新制氢氧化铜共热,产生 (填物质的颜色)沉淀。
19.烃A是合成食品包装袋的原料,A的一系列反应如下(部分反应条件略去):
回答下列问题:
(1)A的化学名称是 ,C的结构简式是 ;
(2)反应②的化学方程式: 。
(3)D分子中含有的官能团名称 ,反应②的反应类型为 。
(4)反应③的化学方程式 。
20.含苯酚的工业废水的处理流程如图所示:
(1)根据此流程图回答下列问题:
①流程图设备Ⅰ中进行的是 操作(填操作名称)。
②由设备Ⅲ进入设备Ⅳ的物质B是 (填化学式)。
③设备Ⅲ中发生反应的化学方程式为 。
④在设备Ⅳ中,物质B的水溶液和CaO反应后,产物是NaOH、和。通过过滤可以使产物相互分离。
⑤流程图中能循环使用的物质是NaOH溶液、、和 (填化学式)。
(2)为了防止水源污染,用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,此方法是 。由上述流程图总结出从废水中回收苯酚的方法是:
①用有机溶剂萃取废液中的苯酚;
②加入某种药品的水溶液使苯酚与有机溶剂脱离;
③加入某物质又析出苯酚。
若第②步加入的某种药品是KOH,其反应的化学方程式为 。
(3)为测定废水中苯酚的含量,取此废水100mL,向其中加入足量饱和溴水至不再产生沉淀为止,得到沉淀0.331g,则此废水中苯酚的含量为 。
21.根据所学知识完成下面的题目:
(1)含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1g L﹣1以上的工业废水应回收苯酚.某研究性学习小组设计下列流程,探究废水中苯酚的回收方法.
①可用 为试剂检验水样中是否含有苯酚.
②操作I的名称为 ,试剂a的化学式为 .
③通入CO2发生反应生成苯酚的化学方程式为 .
(2)某有机物的分子式为C3H6O3.
①1mol该有机物充分燃烧消耗的O2在标准状况下的体积为 L.
②若两分子该有机物能生成六元环状结构,写出该反应的化学方程式 .
答案解析部分
1.【答案】B
【解析】【解答】A. 乙醇催化氧化可制备乙醛,A正确,A不符合题意;
B. 乙醇与H2不反应,不能制备乙烷,B错误,B符合题意;
C. 乙醇与金属钠反应生成氢气和乙醇钠,可制备乙醇钠,C正确,C不符合题意;
D. 乙醇与乙酸反应可制备乙酸乙酯,D正确,D不符合题意,
故正确答案选B。
【分析】乙醇中不存在不饱和键所以不发生和氢气 的反应。
2.【答案】B
【解析】【解答】A.苯和不与溴水反应且可以萃取溴水中的溴单质,苯有机层在上层,有机层在下层,乙酸可以与水互溶,可以鉴别,故A不符合题意;
B.环己烷与甲苯不与溴水反应,且有机层都在上层,用溴水无法鉴别,故B符合题意;
C.溴苯和乙苯不与溴水反应,溴苯有机层在下层,乙苯有机层在上层,苯乙烯会与溴水发生反应使溴水褪色,可以鉴别,故C不符合题意;
D.甘油和乙酸乙酯不与溴水发生反应,甘油可以和溴水互溶,乙酸乙酯不与溴水发生反应,有机层在上层,乙酸丙烯酯会与溴水发生反应使溴水褪色,可以鉴别,故D不符合题意;
故答案为:B。
【分析】A.苯和四氯化碳能萃取溴,苯的密度小于水,四氯化碳密度大于水;
B.环己烷与甲苯不与溴水反应,且有机层都在上层;
C.溴苯和乙苯不与溴水反应,溴苯在下层,乙苯有机层在上层,苯乙烯会与溴水发生反应使溴水褪色;
D.甘油可以和溴水互溶,乙酸乙酯不与溴水发生反应,有机层在上层,乙酸丙烯酯会与溴水发生反应使溴水褪色。
3.【答案】B
【解析】【解答】A. CH4+2O2 CO2+2H2O属于氧化还原反应,不属于加成反应,选项A不符合题意;
B. CH2=CH2 +H2 CH3CH3属于加成反应,选项B符合题意;
C. +HNO3 +H2O属于硝化反应,也属于取代反应,选项C不符合题意;
D. 2CH3CH2OH +O2 2CH3CHO+2H2O属于氧化反应,不属于加成反应,选项D不符合题意。
故答案为:B。
【分析】掌握加成反应的含义,有机物中不饱和键发生部分断裂直接与其他原子相连而产生的的新物质。
4.【答案】D
【解析】【解答】A.甲酸同时具有醛和羧酸的性质,具有较强的还原性,工业上常用做还原剂,故A不符合题意;
B.向蛋白质溶液中加入饱和无机盐溶液会降低蛋白质的溶解度而析出蛋白质而产生盐析,盐析是可逆过程,可采用多次盐析来分离提纯蛋白质,故B不符合题意;
C.苯酚有毒,可以使蛋白质变性,常用于杀菌消毒,故C不符合题意;
D.氯气可以用作漂白剂是因为氯气与水反应生成具有强氧化性的次氯酸使有机色质漂白褪色,与氯气的氧化性无关,故D符合题意;
故答案为:D。
【分析】A.甲酸中含有醛基,醛基具有还原性;
B.蛋白质的盐析是可逆的过程;
C.苯酚有毒,能使蛋白质变性。
5.【答案】C
【解析】【解答】解:A、苯环能发生取代反应,羟基能发生取代反应,所以苯酚、环己醇都能发生取代反应,故A正确;
B、根据醇羟基与酚羟基都能与金属钠反应放出氢气,所以苯酚、环己醇都能与金属钠反应放出氢气,故B正确;
C、根据苯酚的酸性比碳酸弱,环己醇显中性,故C错误;
D、根据酚遇FeCl3溶液作用显紫色,而醇无此性质,所以苯酚与FeCl3溶液作用显紫色,环己醇加入FeCl3溶液中无明显现象,故D正确;
故选C.
【分析】A、根据苯环能发生取代反应,羟基能发生取代反应;
B、根据醇羟基与酚羟基都能与金属钠反应放出氢气;
C、根据苯酚的酸性比碳酸弱,环己醇显中性;
D、根据酚遇FeCl3溶液作用显紫色,而醇无此性质;
6.【答案】B
【解析】【解答】A.根据物质结构简式可知:该物质分子中含有羟基、羰基两种官能团,A不符合题意;
B.该物质分子中含有酚羟基,容易被空气中的氧气氧化,因而能发生氧化反应,B符合题意;
C.由于碳酸的酸性比苯酚酸性强,所以该物质不能与NaHCO3溶液反应,C不符合题意;
D.在常温下该物质能与Br2发生取代反应,但是不能与其发生加成反应,D不符合题意;
故答案为:B。
【分析】A.该分子中含有酚羟基、羰基;
B.酚羟基易被空气氧化;
C.-COOH能和NaHCO3溶液反应;
D.苯环上酚羟基的邻位、对位的氢原子可以与溴发生取代反应,但无碳碳双键。
7.【答案】B
【解析】【解答】A.食醋浸泡水垢,发生强酸制取弱酸的反应,则乙酸的酸性比碳酸强,A不符合题意;
B.乙醇具有还原性,被重铬酸钾氧化,则橙色溶液变为绿色,结论不合理,B符合题意;
C.苯不能使酸性高锰酸钾溶液褪色,说明苯分子中不含碳碳双键,不与高锰酸钾溶液反应,C不符合题意;
D.甲烷属于饱和烃,性质稳定,不能与氢氧化钠溶液反应,D不符合题意;
故答案为:B
【分析】A.水垢的主要成分是CaCO3,能与醋酸反应;
B.乙醇能被酸性重铬酸钾溶液氧化;
C.苯与酸性高锰酸钾溶液不反应;
D.甲烷与NaOH溶液不反应;
8.【答案】B
【解析】【解答】A、由于乙醇和乙酸都能发生酯化反应生成乙酸乙酯,故A正确;
B、乙醇不显示酸性,乙酸显示酸性,乙醇不能使紫色的石蕊试液变化,故B错误;
C、二者都能发生酯化反应,故C正确;
D、由于乙醇和乙酸中都有羟基,都能够和钠反应生成氢气,故D正确;
故选B.
【分析】A、乙酸、乙醇的酯化反应就是取代反应;
B、使紫色石蕊试液变红的物质具有酸性;
C、酸和醇一定条件下发生酯化反应;
D、乙醇和乙酸都含有羟基,可以和钠反应生成氢气.
9.【答案】C
【解析】【解答】A.设备①中有苯酚,苯和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,使用的主要仪器是分液漏斗,故A不符合题意;
B.由分析可知,设备①中有苯酚,苯和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,进入设备②,设备②加入氢氧化钠溶液,可得到苯酚钠,A是苯酚钠,故B不符合题意;
C.设备④中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀,化学方程式为:CaO+NaHCO3=CaCO3↓+NaOH,故C符合题意;
D.设备⑤中生成CaO和CO2,发生的是碳酸钙的分解反应,该反应条件为高温,故D不符合题意;
故答案为:C。
【分析】由流程可知,设备①中有苯酚,苯和工业废水,可经萃取、分液得到苯酚的苯溶液混合物,进入设备②,设备②加入氢氧化钠溶液,可得到苯酚钠,苯不与氢氧化钠反应,将要分层,溶液上层为苯,下层为苯酚钠,在设备③中通入二氧化碳可得到苯酚,发生C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,设备④中的主要物质为NaHCO3,在溶液中加入氧化钙,可生成氢氧化钠和碳酸钙沉淀,据此解答。
10.【答案】A
【解析】【解答】A.乙醇在铜催化下被氧化为乙醛,反应方程式是,故A符合题意;
B.用过量氨水吸收二氧化硫气体生成亚硫酸铵,反应化学方程式是,故B不符合题意;
C.丙烯与溴的四氯化碳溶液发生加成反应生成1,2-二溴丙烷,反应方程式是,故C不符合题意;
D.乙酸与乙醇发生酯化反应生成乙酸乙酯和水,反应方程式是:,故D不符合题意;
故答案为:A。
【分析】A、乙醇催化氧化生成乙醛;
B、二氧化硫少量形成硫酸铵,二氧化硫过量生成硫酸氢铵;
C、注意烯烃可以和溴发生加成反应;
D、注意酯化反应时,酸脱羟基醇脱氢。
11.【答案】B
【解析】【解答】解:乙醇在铜催化下和氧气反应时,生成乙醛,断裂②④键,
故选B.
【分析】乙醇在催化氧化时,﹣CH2OH结构被氧化为﹣CHO结构,根据官能团的变化判断断裂的化学键.
12.【答案】C
【解析】【解答】 A.根据酯化反应规律特点“酸脱羟基醇脱氢”可知 18O 应存在酯中,故A错误;
B.酯化反应加入试剂先后顺序为:先加入醇,再加入浓硫酸和羧酸,故B错误;
C.乙酸乙酯在饱和碳酸钠溶液中溶解度降低分层,可用分液漏斗进行分液,故C正确;
D.小火加热主要目的是为了避免温度过高生成其它产物,例如乙醇和浓硫酸在140℃会发生反应分子间脱水成醚,故D错误;
故选C。
【分析】A.根据酯化反应规律“酸脱羟基醇脱氢”分析;
B.酯化反应加入试剂先后顺序为:先加入醇,再加入浓硫酸和羧酸;
C.依据试剂的性质分析;
D.防止发生副反应;
13.【答案】A
【解析】【解答】A.酸性KMnO4溶液中滴加乙醇,乙醇被氧化为乙酸,则酸性KMnO4溶液会褪色,A选项不符合题意;
B.乙醇的密度比钠小,金属钠沉在乙醇底部,乙醇中含有羟基,能与金属钠反应生成氢气,产生的氢气燃烧产生淡蓝色火焰,B选项不符合题意;
C.灼烧至红热的铜丝表面生成CuO,趁热插入乙醇中后又被乙醇还原为金属铜,即铜丝由黑色变红,C选项不符合题意;
D.乙醇中含有少量水,加入生石灰和水反应生成氢氧化钙,增大与乙醇的沸点差异,然后蒸馏可除杂,D选项不符合题意;
故答案为:A。
【分析】A、羟基具有还原性,可以使酸性高锰酸钾溶液褪色;
B、钠密度大于乙醇,因此沉在底部,生成气体;
C、铜作为催化剂,在空气中灼烧变为黑色,深入乙醇变为红色;
D、水和生石灰反应,沸点提高,有利于蒸馏操作中乙醇和水的分离。
14.【答案】B
【解析】【解答】①检验卤代烃水解产物,应先加入硝酸中和剩余的碱,再加硝酸银检验卤素离子,避免对溴离子检验产生干扰,故①实验会失败;
②实验室里用无水乙醇和浓硫酸共热至170℃制得乙烯,故②实验能够成功;
③皂化反应反应中必须使用强碱,而碳酸钠的碱性较弱,皂化反应的反应速率缓慢,反应不完全,用于制皂费时费力,成本高,得不偿失,故③实验失败;
④乙醛与新制氢氧化铜反应应在碱性环境中反应,加入的氢氧化钠溶液不足,故④实验失败;
故选B.
【分析】①检验RX是溴代烷,加入硝酸银溶液之前应该使用硝酸中和过量的碱,否则会干扰溴离子的检验;
②乙醇与浓硫酸共热,温度不同,产物不同;
③皂化反应用强碱与油脂发生反应,不能使用碳酸钠;
④醛与氢氧化铜的反应需在碱性环境下进行,氢氧化钠应该过量.
15.【答案】B
【解析】【解答】A、甲醇不能发生消去反应,A不符合题意;
B、该醇既能发生消去反应生成烯烃,又能发生氧化反应生成醛,B符合题意;
C、与羟基相连的碳原子上没有氢原子,不能发生催化氧化,C不符合题意;
D、其氧化产物是羰基,得不到醛基,D不符合题意,答案选B。
【分析】掌握醇的性质是解答的关键,醇的催化氧化的反应情况与跟羟基(—OH)相连的碳原子上的氢原子的个数有关: ;醇分子中,连有羟基(-OH)的碳原子必须有相邻的碳原子,并且此相邻的碳原子上必须连有氢原子时,才可发生消去反应,生成不饱和键。
16.【答案】D
【解析】【解答】A.能源是人类社会活动的基础,与材料、信息一起被称为现代社会发展的三大支柱,A不符合题意;
B.乙烯的产量是衡量一个国家石油化工水平的标志,也是一种植物生长调节剂和水果催熟剂,B不符合题意;
C.德国化学家凯库勒从梦境中得到启发,成功的提出了关于苯环的凯库勒结构,C不符合题意;
D.乙醇能与金属钠反应放出氢气,可以直接被酸性 K2Cr2O7溶液氧化成乙酸,D符合题意。
故答案为:D
【分析】A.能源与材料、信息是现代文明发展的根本;
B.乙烯在现代化工生产中具有极其重要的作用;
C.熟悉苯的凯库勒结构的由来;
D.乙醇中的羟基使其能被其他强氧化剂氧化。
17.【答案】(1)CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
(2)MgCl2 Mg+Cl2↑
(3)SiO2+4HF=SiF4↑+2H2O
(4)2Fe3++SO32﹣+1H2O=2Fe2++SO42﹣+2H+
(5)Cu2S+O2 2Cu+SO2
【解析】【解答】解:(1)发生酯化反应生成乙酸乙酯和水,反应的化学方程式为CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O,故答案为:CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O;(2)工业冶炼镁是电解氯化镁,化学方程式为:MgCl2 Mg+Cl2↑,故答案为:MgCl2 Mg+Cl2↑;(3)二氧化硅可以和唯一的酸HF之间反应生成四氟化硅和水,反应方程式为:SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;(4)铁离子和亚硫酸根离子的氧化还原反应,铁离子得电子被还原,亚硫酸根离子失电子被氧化,离子反应方程式为:2Fe3++SO32﹣+1H2O=2Fe2++SO42﹣+2H+,故答案为:2Fe3++SO32﹣+1H2O=2Fe2++SO42﹣+2H+;(5)火法炼铜原理为:高温下将硫化亚铜与氧气反应生成二氧化硫和铜,方程式:Cu2S+O2 2Cu+SO2,故答案为:Cu2S+O2 2Cu+SO2.
【分析】(1)发生酯化反应生成乙酸乙酯和水;(2)工业冶炼镁是电解氯化镁;(3)二氧化硅与氢氟酸反应,生成四氟化硅气体和水;(4)铁离子和亚硫酸根离子的氧化还原反应,铁离子得电子被还原,亚硫酸根离子失电子被氧化;(5)火法炼铜原理为:高温下将硫化亚铜与氧气反应生成二氧化硫和铜.
18.【答案】(1)变性
(2)乙烯
(3)酯
(4)葡萄糖;砖红色
【解析】【解答】(1)75%的医用酒精可渗透到细胞组织内,使细胞失去活性,从而灭活新型冠状病毒,其原因是使蛋白质发生变性。答案为:变性;
(2)新买的猕猴桃比较硬,表明猕猴桃还没有完全成熟,可与苹果放在一起进行催熟,原因是苹果可以释放出乙烯。答案为:乙烯;
(3)炒菜时,加入酒和醋能使菜味香可口,原因是酒和醋能发生酯化反应,生成具有水果香味的乙酸乙酯,乙酸乙酯属于酯。答案为:酯;
(4)糖尿病患者的尿糖含量高,其尿液中含有的糖为葡萄糖,该物质的溶液与新制氢氧化铜共热,产生Cu2O沉淀,该物质呈砖红色。答案为:葡萄糖;砖红色。
【分析】(1)酒精可以使蛋白质变性
(2)乙烯是果实催熟剂
(3)酸和醇发生了酯化反应
(4)根据醛基的检验特性,尿中含有葡萄糖,与氢氧化铜作用得到砖红色的氧化亚铜
19.【答案】(1)乙烯;
(2)
(3)羧基;氧化反应
(4)2CH3CHO+O2→2CH3COOH
【解析】【解答】(1)由分析可知,A的结构简式为CH2=CH2,因此A的化学名称为乙烯;C的结构简式为CH3CHO。
(2)反应②是CH3CH2OH的催化氧化反应,该反应的化学方程式为2CH3CH2OH+O22CH3CHO+H2O。
(3)由分析可知,D的结构简式为CH3COOH,其所含的官能团为羧基;反应②是乙醇的催化氧化反应,因此其反应类型为氧化反应。
(4)反应③是乙醛的氧化反应,该反应的化学方程式为2CH3CHO+O2→2CH3COOH。
【分析】烃A是合成食品包装袋的原料,因此A为CH2=CH2;A与H2O反应生成B,因此B为CH3CH2OH;B与O2发生氧化反应生成乙醛,因此C为CH3CHO;C与O2进一步发生氧化反应,生成乙酸,因此D为CH3COOH。A与O2在银的催化作用下反应E,因此E为环氧乙烷;E与H2O进一步反应生成F(C2H6O2),因此F的结构简式为HOCH2CH2OH。D与F在浓硫酸加热条件下发生酯化反应,生成G(C6H10O4),因此G的结构简式为CH3COOCH2CH2OOCCH3。
20.【答案】(1)萃取、分液;;+CO2+H2O→+NaHCO3;CaO
(2)向污水中滴加溶液,若溶液呈紫色,则表明污水中有苯酚;+KOH→+ H2O
(3)940
【解析】【解答】设备Ⅰ里废水和苯混合分离出水,为萃取、分液,设备II中向苯和苯酚的混合液中加入氢氧化钠溶液,苯酚和氢氧化钠反应生成苯酚钠并分离出苯,物质A为苯酚钠溶液,设备III中通入二氧化碳分离出苯酚,同时生成碳酸氢钠,物质B为碳酸氢钠溶液,设备IV中加入氧化钙与碳酸氢钠溶液反应生成氢氧化钠、二氧化碳和碳酸钙,过滤分离出碳酸钙,设备V中碳酸钙受热分解生成氧化钙和二氧化碳。
(1)①设备Ⅰ里废水和苯混合分离出水,为萃取、分液。
②在设备Ⅲ中通入CO2分离出苯酚,同时生成碳酸氢钠,剩下的物质B是NaHCO3溶液。
③设备Ⅲ中二氧化碳、水与苯酚钠反应生成苯酚和碳酸氢钠,反应的化学方程式为:+CO2+H2O→+NaHCO3。
⑤设备V中碳酸钙受热分解生成氧化钙和二氧化碳,因此流程图中能循环使用的物质除了NaOH溶液、二氧化碳、苯之外,还有CaO。
(2)酚类物质遇氯化铁溶液会显紫色,因此用简单而又现象明显的方法检验某工厂排放的污水中有无苯酚,方法为:向污水中滴加溶液,若溶液呈紫色,则表明污水中有苯酚;苯酚与氢氧化钾溶液反应生成苯酚钾和水,反应的化学方程式为:+KOH→+H2O。
(3)设每升废水含苯酚的质量为x,则根据方程式+3Br2→↓+3HBr可知,x==0.94g,所以此废水中苯酚的含量为940mg·L-1。
【分析】设备I,利用苯酚易溶于苯,进行萃取分液,把苯酚萃取出来,设备II,加入氢氧化钠溶液,与苯酚反应,分液,得到苯酚钠,回收苯进入设备I,设备II,通入二氧化碳与苯酚钠反应,得到苯酚,得到的碳酸钠进入设备IV,加入氧化钙,得到氢氧化钠溶液和碳酸钙,碳酸钙进入设备V,高分分解得到二氧化碳,循环使用。
21.【答案】(1)FeCl3溶液或浓溴水;萃取(或萃取分液);NaOH;C6H5ONa+CO2+H2O→C6H5OH+NaHCO3
(2)67.2;
【解析】【解答】解:(1)①苯酚与氯化铁发生显色反应,苯酚与溴水反应生成白色沉淀,则选择检验试剂为FeCl3溶液或浓溴水,故答案为:FeCl3溶液或浓溴水;②由分离流程可知,加苯为萃取剂,操作1为萃取,然后得到有机层;苯酚与NaOH反应生成苯酚钠溶于水,则试剂a为NaOH,故答案为:萃取(或萃取分液);NaOH;③苯酚钠与二氧化碳、水反应生成苯酚、碳酸氢钠,该反应为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,故答案为:C6H5ONa+CO2+H2O→C6H5OH+NaHCO3;(2)①1mol该有机物充分燃烧生成CO2和H2O,消耗O2为3+ ﹣ =3mol,其标况下体积为3mol×22.4L/mol=67.2L,故答案为:67.2;②有机物两分子间相互反应生成含有六元环状结构的产物,发生酯化反应,该反应为 ,故答案为: .
【分析】(1)①苯酚与氯化铁发生显色反应;②由分离流程可知,加苯为萃取剂,操作1为萃取,然后得到有机层;苯酚与NaOH反应生成苯酚钠溶于水,则试剂a为NaOH;③苯酚钠与二氧化碳、水反应生成苯酚、碳酸氢钠;(2)①1mol该有机物充分燃烧生成CO2和H2O,消耗O2为3+ ﹣ =3mol,结合标况计算体积;
②有机物两分子间相互反应生成含有六元环状结构的产物,发生酯化反应.
