化学人教版(2019)必修第二册5.1.4硫及其化合物—不同价态含硫物质的转化(共41张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册5.1.4硫及其化合物—不同价态含硫物质的转化(共41张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 26.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 09:08:23 | ||
图片预览








文档简介
(共41张PPT)
第一节 硫及其化合物
第4课时:不同价态含硫物质的转化
第五章 化工生产中的重要非金属元素
不同价态含硫物质的转化关系
01
实验探究不同价态含硫物质的转化
02
学习目标
1.通过阅读教材“资料卡片—自然界中硫的存在和转化”内容,了解含硫物质进入大气的主要途径,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识,培养社会责任感。
2.根据硫元素的不同价态,了解硫元素不同价态间的转化及反应条件的控制,理解硫及其化合物的相互转化原理,熟悉常见的化学方程式
3.通过实验探究,知道含不同价态硫元素的物质可以相互转化,并能设计实验进行探究或验证,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识,培养社会责任感。
视频--不同含硫物质的转化
不同价态含硫物质的转化关系
不同价态含硫物质的转化关系
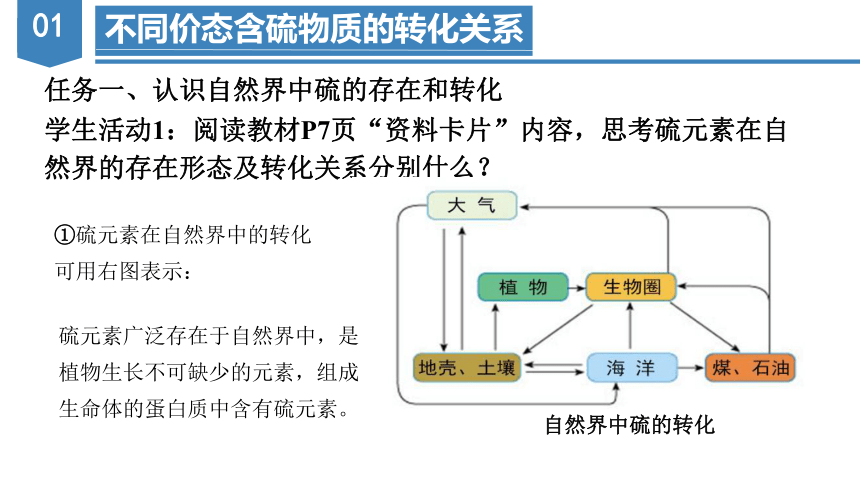
任务一、认识自然界中硫的存在和转化
H2S
CaSO4 2H2O
FeS2
SO3
SO2
H2SO3
H2SO4
CuFeS2
NaSO4 10H2O
自然界中硫元素的存在示意图
S
不同价态含硫物质的转化关系
任务一、认识自然界中硫的存在和转化
学生活动1:阅读教材P7页“资料卡片”内容,思考硫元素在自
然界的存在形态及转化关系分别什么?
自然界中硫的转化
①硫元素在自然界中的转化
可用右图表示:
硫元素广泛存在于自然界中,是
植物生长不可缺少的元素,组成
生命体的蛋白质中含有硫元素。
不同价态含硫物质的转化关系
任务一、认识自然界中硫的存在和转化
②自然界中游离态的硫存在于火山口附近或地壳的岩层里,煤中也含有少量硫。
③自然界中化合态的硫广泛存在于硫酸盐、硫化物、火山喷发时释放的气体中、地下水里、动植物体内。例如黄铁矿(FeS2)、黄铜矿(CuFeS2)、石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)。火山口附近的硫单质会被大气中是氧气氧化成二氧化硫,二氧化硫可被进一步氧化成三氧化硫,二氧化硫和三氧化硫遇水分别形成亚硫酸和硫酸。
学生活动1:阅读教材P7页“资料卡片”内容,思考硫元素在自
然界的存在形态及转化关系分别什么?
不同价态含硫物质的转化关系
任务一、认识自然界中硫的存在和转化
学生活动2:讨论交流:根据硫元素在自然界的转化关系,思考硫
及其化合物的转化原理有哪些?
①不同价态硫元素之间的相互转化主要通过氧化还原反应实现,如:
-2
S
+4
S
2H2S+3O2=2SO2+2H2O;
2H2SO3+O2=2H2SO4
+4
S
+6
S
②相同价态硫元素之间的转化主要根据酸、碱、盐及其氧化物的性质实现。如:
SO3+H2O=H2SO4、SO2+2NaOH=Na2SO3+H2O。
对应训练
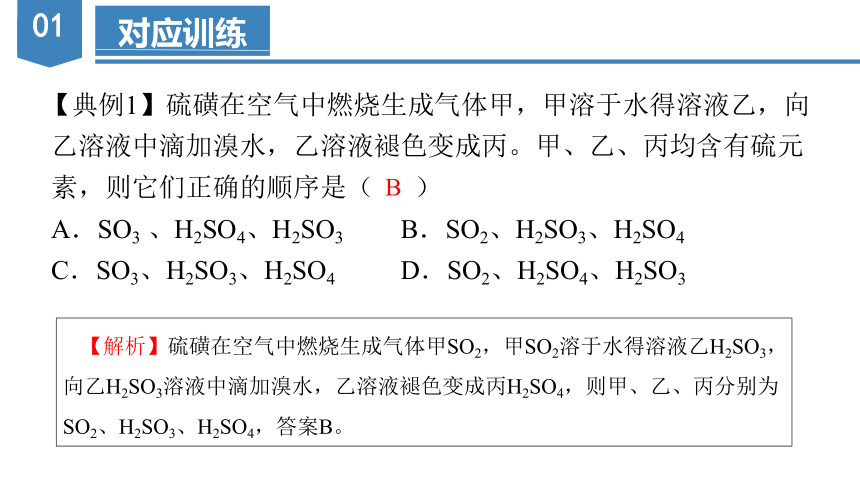
【典例1】硫磺在空气中燃烧生成气体甲,甲溶于水得溶液乙,向
乙溶液中滴加溴水,乙溶液褪色变成丙。甲、乙、丙均含有硫元
素,则它们正确的顺序是( )
A.SO3 、H2SO4、H2SO3 B.SO2、H2SO3、H2SO4
C.SO3、H2SO3、H2SO4 D.SO2、H2SO4、H2SO3
B
【解析】硫磺在空气中燃烧生成气体甲SO2,甲SO2溶于水得溶液乙H2SO3,向乙H2SO3溶液中滴加溴水,乙溶液褪色变成丙H2SO4,则甲、乙、丙分别为SO2、H2SO3、H2SO4,答案B。
对应训练
【典例2】关于反应H2SO4+Na2SO3=Na2SO4+SO2↑+H2O所涉及
的物质,下列说法错误的是( )
A.浓H2SO4能与SO2发生氧化还原反应
B.Na2SO3容易被空气中的O2氧化变质
C.浓硫酸与铜在常温下反应生成SO2
D.SO2是导致酸雨的主要有害污染物
A
【解析】反应中元素化合价不变,属于非氧化还原反应,故A错误; Na2SO3具有还原性,容易被空气中的O2氧化为 Na2SO4,故B正确;浓硫酸具有强氧化性与铜在常温下反应生成SO2,故C正确; SO2能和水反应生成H2SO3,是导致酸雨的主要有害污染物,故D正确;选A。
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
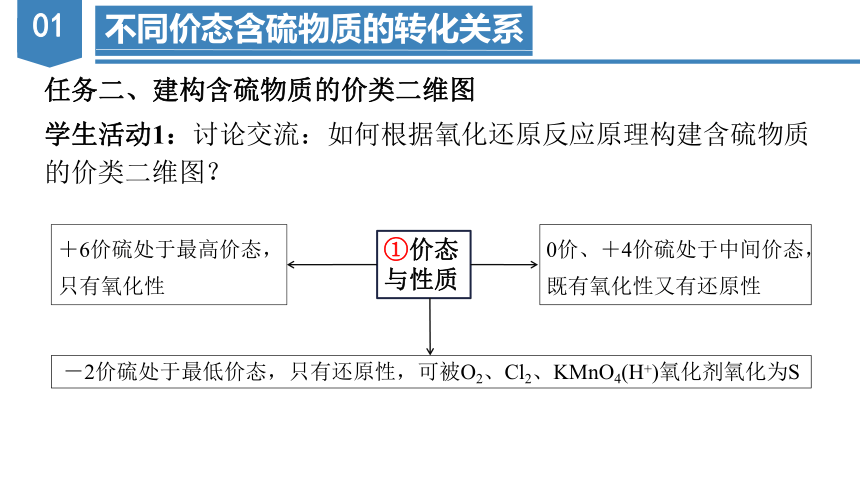
学生活动1:讨论交流:如何根据氧化还原反应原理构建含硫物质
的价类二维图?
①价态与性质
0价、+4价硫处于中间价态,既有氧化性又有还原性
+6价硫处于最高价态,只有氧化性
-2价硫处于最低价态,只有还原性,可被O2、Cl2、KMnO4(H+)氧化剂氧化为S
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
②价态规律
硫元素的化合价升高或降低时,一般到其相邻价态(只靠拢不交叉),即台阶式升降
相邻价态的同种元素的微粒间不发生氧化还原反应,如S和H2S、S和SO2、SO2和浓硫酸
不同价态硫元素间的转化,均属于氧化还原反应,需要选择合适的氧化剂或者还原剂。证明硫单质、SO2具有还原性要选择氧化剂,如酸性KMnO4溶液、氯水等;证明浓硫酸具有氧化性要选择还原剂,如金属单质、硫单质、H2S等;证明SO2具有氧化性要选择还原剂,如H2S、Na2S等
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
③价类二维图:
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
学生活动2:问题探究:根据含硫物质的价类二维图,不同价态硫
元素间转化的思维模型是什么?结合所学知识,思考含硫物质有哪
些不同转化关系?
①转化的思维模型:
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
②转化类型:
直线型转化关系:
S(固体)
SO2
O2
O2
SO3
H2O
H2SO4
H2S
S(固体)
O2
O2
SO2
H2O
H2SO4
O2
SO3
交叉型转化关系:
三角型转化关系:
对应训练
【典例1】下图是一种综合处理SO2废气的工艺流程。下列说法正
确的是( )
A.操作Ⅱ发生反应的离子方程式为:
2Fe2++4H++O2=2Fe3++2H2O
B.溶液b中阳离子只有Fe2+
C.溶液a转化为溶液b的反应中,SO2被氧化
D.加入FeO可以使溶液c转化为溶液a
C
对应训练
【解析】Fe3+有氧化性,SO2有还原性,Fe2(SO4)3被SO2还原为FeSO4,溶液b主要溶质为FeSO4、H2SO4,可能含Fe2(SO4)3或SO2,空气中氧气将FeSO4及可能存在的SO2氧化得溶液a循环使用。A.电荷不守恒,操作Ⅱ发生反应的离子方程式为:4Fe2++4H++O2= 4Fe3++2H2O,A错误;B.操作I中发生反应的离子方程式为:2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+,溶液中阳离子有Fe2+、H+,若SO2少量,则还有Fe3+,B错误;C.溶液a转化为溶液b的反应中,SO2被Fe3+氧化,C正确;D.溶液c中含有 Fe2(SO4)3、H2SO4等物质,加入FeO后会生成FeSO4,D错误。答案选C。
对应训练
【典例2】物质类别和核心元素的价态是学习元素及其化合物性质
的重要认识视角。如图是某元素的“价类二维图”,其中单质b
是黄色固体,f、h均为正盐,且焰色都是黄色。下列说法不正确
的是( )
A.a和c反应可以生成b
B.用BaCl2溶液可以鉴别f和h的溶液
C.e的浓溶液可用铝槽车运输
D.c能使品红溶液褪色
B
对应训练
【解析】单质b是黄色固体,所以b是硫,f、h均为正盐,且焰色都是黄色,根据示意图可知a是H2S,c是SO2,d是SO3,e是硫酸,f是硫酸钠,g是亚硫酸,h是亚硫酸钠,据此解答。A. 二氧化硫具有氧化性,能氧化硫化氢,二者反应可以生成单质硫,A正确;B. 亚硫酸钠和硫酸钠均能与氯化钡反应生成白色沉淀,不用BaCl2溶液鉴别二者,B错误;C. 常温下铝在浓硫酸中钝化,因此e的浓溶液可用铝槽车运输,C正确;D. 二氧化硫具有漂白性,能使品红溶液褪色,D正确;
实验探究不同价态含硫物质的转化
实验探究不同价态含硫物质的转化
任务一、实验室中研究不同价态含硫物质的转化原理
学生活动1、根据教材P8页“探究”内容,思考硫元素常见价态及其转
化关系是什么?
-2
S
0
S
+4
S
+6
S
FeS、H2S
Na2S、HgS
SO2、H2SO3
Na2SO3
SO3、H2SO4
Na2SO4、CuSO4
S
氧化剂
①硫元素常见价态(物质)及转化:
氧化剂
氧化剂
还原剂
还原剂
还原剂
②通过氧化还原反应实现不同价态含硫物质的相互转化,低价态的硫向高价态转化时需加入氧化剂,高价态的硫向低价态转化时需加入还原剂。
实验探究不同价态含硫物质的转化
任务一、实验室中研究不同价态含硫物质的转化原理
学生活动2、讨论交流:阅读检测P9页“方法导引”栏目内容,你是如
何理解化学实验设计及探究不同价态含硫物质的转化关系的?并填
写表格内容。
①化学实验设计:是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。
②遵循的原则:科学性、可行性、安全性和绿色化。化学实验设计一般以实验设计方案的形式呈现,通常包括实验课题、实验目的、实验原理、实验仪器与试剂、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。
实验探究不同价态含硫物质的转化
③含硫物质的转化实验方案设计:
预期转化 选择试剂 实验操作和现象 实验结论
H2S→S
SO2→S SO2→H2SO4
H2SO4→SO2
二氧化硫、硫化氢、蒸馏水
将H2S和SO2通入水中,生成淡黄色沉淀(或溶液变浑浊)
SO2与H2S反应生成单质硫
二氧化硫、新制氯水、BaCl2溶液
将SO2通入新制氯水中,溶液浅黄绿色褪去;再向溶液中滴入氯化钡溶液,产生白色沉淀
二氧化硫在水中能被强氧化剂氧化为SO42-
浓硫酸、铜片
加热铜片和浓硫酸的混合物,有刺激性气味气体生成
浓硫酸被金属铜还原为SO2
对应训练
【典例1】分别能实现下列从左到右转化的单质是( )
A.Mg和S B.Fe和Cl
C.Ca和C D.Cu和Si
C
对应训练
【解析】A.Mg与氧气反应生成MgO,MgO是碱性氧化物,MgO与水不反应;S与氧气反应生成SO2,SO2是酸性氧化物,SO2与水反应生成亚硫酸,亚硫酸与碱或碱性氧化物反应生成亚硫酸盐,故A不符合题意;B.Fe与氧气反应生成Fe3O4,Fe3O4不是碱性氧化物,且Fe3O4与水不反应,故B不符合题意;C.Ca与氧气反应生成CaO,CaO是碱性氧化物,CaO与水反应生成Ca(OH)2,Ca(OH)2是碱,Ca(OH)2与盐酸反应生成盐CaCl2;C与氧气反应生成CO2,CO2是酸性氧化物,CO2与水反应生成碳酸,碳酸与碱反应生成碳酸盐,故C符合题意;D.Cu与氧气反应生成CuO,CuO是碱性氧化物,但是CuO与水不反应,故D不符合题意。故选C。
对应训练
【典例2】含硫煤燃烧会产生大气污染物,为防治该污染,某工
厂设计了新的治污方法,同时可得到化工产品,该工艺流程如
图所示,下列叙述不正确的是( )
A.该工艺流程是用来除去煤燃烧时产生的SO2
B.该过程中可得到化工产品H2SO4
C.图中涉及的反应之一为
Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
D.该过程中化合价发生改变的元素只有Fe和S
D
对应训练
【解析】由图可知发生反应为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,同时4FeSO4+ 2H2SO4+O2=2Fe2(SO4)3+2H2O,总反应为2SO2+O2+2H2O=2H2SO4。A.根据总反应2SO2+O2+2H2O=2H2SO4可知该工艺流程是用来除去煤燃烧时产生的SO2,A正确;B.根据总反应为2SO2+O2+2H2O=2H2SO4可知该过程中可得到化工产品H2SO4,B正确;C.Fe2(SO4)3与SO2反应生成FeSO4和H2SO4,其反应的化学方程式为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,C正确;D.该过程中Fe2(SO4)3与SO2反应生成FeSO4和H2SO4,同时FeSO4、O2和H2SO4反应生成Fe2(SO4)3,则反应过程中Fe、O和S的化合价发生改变,D错误;故选项是D。
实验探究不同价态含硫物质的转化
任务二、实验验证含硫物质的转化
学生活动1、联系教材P8页“探究”栏目,根据下表实验步骤完成实验,
并填写表格内容。
实验操作 实验现象 原理分析
在一支试管中加入1mL Na2S溶液,边振荡边滴加H2SO3溶液,用浸NaOH溶液的棉团塞住试管口
在一支试管中加入1mL Na2S溶液,边振荡边滴加酸性KMnO4溶液
试管中产生淡黄色沉淀
紫红色褪去,试管中产生淡黄色沉淀
-2价硫与+4价硫发生归中反应,生成中间价态0价的硫单质。SO2与碱反应。2S2-+SO2+4H+=3S↓+2H2O
SO2+2OH-=SO32-+H2O
-2价硫被酸性KMnO4溶液氧化成硫单质,本身被还原成Mn2+。5S2-+2MnO4-+16H+=5S↓+2Mn2++8H2O
实验探究不同价态含硫物质的转化
任务二、实验验证含硫物质的转化
学生活动2、问题探究:将SO2气体分别通入BaCl2溶液、Ba(NO3)2
溶液能否产生沉淀?如何防止SO2可能对环境产生的污染?
①SO2气体通入BaCl2溶液无明显现象,因为酸性H2SO3②SO2气体有毒,为防止SO2对环境造成污染,可用强碱(如NaOH)溶液吸收:SO2+2OH-=SO32-+H2O。
对应训练
【典例1】已知含硫元素的几种物质间具有如图转化关系。NA表示阿
伏加德罗常数值,下列说法正确的是( )
C
A.反应①中3.2gS充分燃烧后生成2.24LSO2 B.NA个SO2分子与足量氧气经反应③可以制得NA个SO3分子 C.反应②中若转移2NA个电子,生成1.5molS D.只要氧气过量,硫可以一步转化为SO3
【解析】温度和压强未知导致气体摩尔体积未知,则无法计算反应①中生成的SO2体积,A错误;③为可逆反应,所以NA个SO2分子与足量氧气经反应③不能制得NA个SO3分子,选项B错误;反应②的方程式为2H2S+SO2=3S+2H2O,生成3molS转移电子的物质的量为4mol,转移2NA个电子时,转移电子的物质的量为2mol,生成S的物质的量=2mol×3mol/4mol=1.5mol,选项C正确;硫与氧气反应只能生成二氧化硫,不能一步转化为三氧化硫,选项D错误;答案选C。
对应训练
【典例2】下列有关含硫物质转化判断正确的是( )
A
A.0.1 mol Cu与足量的硫充分反应,生成物的质量比该单质的
质量增加了1.6 g
B.如图是铜与浓硫酸反应的实验装置。B中盛装的是浓硫酸,
作用是干燥SO2
C.Cu投入稀硫酸中加热,没有明显变化,加入一定量的H2O2
溶液,金属Cu逐渐溶解,反应中H2O2起催化作用
D.向铜与浓硫酸反应后的混合溶液中加水,判断有无铜离子
对应训练
【解析】A.Cu与S混合加热发生反应产生Cu2S,若Cu物质的量是0.1 mol,则反应产生0.05 mol Cu2S,消耗S的物质的量是0.05 mol,因此固体质量增加了0.05 mol×32 g/mol=1.6 g,A正确;B.在如图铜与浓硫酸反应的实验装置中,B中盛装的应该是饱和NaHSO3溶液,作用是储存SO2,并可作安全瓶,防止倒吸的作用,B错误;C.H2O2溶液具有强氧化性,在酸性条件下将Cu氧化为Cu2+,反应方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,在该反应中H2O2的作用是氧化剂,C错误;D.反应后溶液中含有大量浓硫酸,要根据硫酸的稀释原则进行操作,即应该待溶液冷却后,取少量溶液加入到盛有水的容器中,根据溶液是否变为蓝色,确定其中是否含有Cu2+,D错误;故合理选项是A。
1.硫元素的几种化合物及其单质存在下列转化关系(反应条件
省略)。
下列判断不正确的是( )
A.反应①中氧化剂与还原剂物质的量之比为1∶1
B.反应②表明SO2具有酸性氧化物的性质
C.反应③的原子利用率是100%
D.反应④中稀H2SO4作氧化剂
D
【解析】A.反应①为浓硫酸氧化铜单质的反应,浓硫酸作氧化剂被还原成SO2,化合价降低2价,Cu作还原剂被氧化成Cu2+,化合价升高2价,所以氧化剂与还原剂物质的量之比为1∶1,故A正确;B.二氧化硫与NaOH反应生成盐和水,表明二氧化硫为酸性氧化物,故B正确;C.反应③为Na2SO3+S=Na2S2O3,生成物只有一种,原子利用率是100%,故C正确;D.反应④的化学方程式:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,稀硫酸既不是氧化剂也不是还原剂,故D错误;综上所述答案为D。
2.如图是硫元素在自然界中的循环示意图,下列有关说法不正
确的是( )
A.硫元素在自然界中既有游离态又有化合态
B.过程⑤可在土壤的缺氧区实现
C.循环过程中硫元素只被还原
D.若生物体有机硫中硫元素为-2价,则过程③中发生的是还原
反应
C
【解析】A.硫元素在自然界中有游离态和化合态,两种存在形态,A正确;B.在缺氧的条件下可实现过程⑤的转化,B正确;C.①、②中硫元素均被氧化,C错误;D.若生物体有机硫中硫元素为-2价,SO42-中S为+6价,过程③中S的化合价降低,发生还原反应,D正确。答案选C。
3.如图中的字母代表硫及其化合物,相关推断不合理的是( )
A.ab溶液反应有d生成
B.e和f都存在酸式盐
C.硫酸型酸雨的形成过程涉及b→c的转化
D.检验g中阴离子所用试剂只需BaCl2溶液
D
【解析】根据硫及其化合物的转化关系图可知,a为H2S,b为H2SO3,c为H2SO4,d为S,e为硫化物,f为亚硫酸盐,g为硫酸盐。A项,H2S和H2SO3反应可以生成中间价态的S,正确;B项,若为钠盐,则e为-2价的Na2S或NaHS,f为Na2SO3或NaHSO3,正确;C项,b为H2SO3,c为H2SO4,硫酸型酸雨是H2SO3被空气中氧气氧化为H2SO4,正确;D项,检验硫酸根,应该用盐酸和BaCl2溶液,错误。
4.硫元素的价类二维图如图所示。下列说法错误的是( )
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e
C.盐g与盐f之间也可能发生反应
D.铜与e的浓溶液共热产生的气体通入BaCl2溶液中,无明显
现象
D
【解析】根据化合价以及物质的类别可知a为H2S、b为S、c为SO2、d为H2SO3、e为H2SO4、f为 亚硫酸盐、g为硫酸盐 。A.a为H2S,可以和SO2、H2SO3、H2SO4发生归中反应生成硫单质,A正确;B.H2SO3具有较强的还原性,在空气久置会被氧气氧化成硫酸,B正确;C.g为硫酸盐或酸式盐,f为亚硫酸盐,可能会发生反应生成二氧化硫,C正确;D.铜与浓硫酸共热产生的气体SO2,SO2通入 BaCl2 溶液中,SO2先与水反应生成亚硫酸,亚硫酸易被空气中的氧气氧化为硫酸,硫酸与BaCl2反应生成硫酸钡白色沉淀,D错误;答案选D。
延时符
不同价态含硫物质的转化
自然界中硫的存在:游离态(火山喷口附近或地壳的岩层里、煤)、化合态(矿石、含硫化合物)
自然界中硫及转化:S+O2=SO2、SO3+H2O=H2SO4等
实验探究不同价态含硫物质的转化
转化类型:直线型、交叉型、三角型
化学实验设计原则
价态与性质:价类二维图
第4课时 不同价态含硫物质的转化
第一节 硫及其化合物
第4课时:不同价态含硫物质的转化
第五章 化工生产中的重要非金属元素
不同价态含硫物质的转化关系
01
实验探究不同价态含硫物质的转化
02
学习目标
1.通过阅读教材“资料卡片—自然界中硫的存在和转化”内容,了解含硫物质进入大气的主要途径,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识,培养社会责任感。
2.根据硫元素的不同价态,了解硫元素不同价态间的转化及反应条件的控制,理解硫及其化合物的相互转化原理,熟悉常见的化学方程式
3.通过实验探究,知道含不同价态硫元素的物质可以相互转化,并能设计实验进行探究或验证,知道二氧化硫进入大气能形成酸雨危害环境,增强环保意识,培养社会责任感。
视频--不同含硫物质的转化
不同价态含硫物质的转化关系
不同价态含硫物质的转化关系
任务一、认识自然界中硫的存在和转化
H2S
CaSO4 2H2O
FeS2
SO3
SO2
H2SO3
H2SO4
CuFeS2
NaSO4 10H2O
自然界中硫元素的存在示意图
S
不同价态含硫物质的转化关系
任务一、认识自然界中硫的存在和转化
学生活动1:阅读教材P7页“资料卡片”内容,思考硫元素在自
然界的存在形态及转化关系分别什么?
自然界中硫的转化
①硫元素在自然界中的转化
可用右图表示:
硫元素广泛存在于自然界中,是
植物生长不可缺少的元素,组成
生命体的蛋白质中含有硫元素。
不同价态含硫物质的转化关系
任务一、认识自然界中硫的存在和转化
②自然界中游离态的硫存在于火山口附近或地壳的岩层里,煤中也含有少量硫。
③自然界中化合态的硫广泛存在于硫酸盐、硫化物、火山喷发时释放的气体中、地下水里、动植物体内。例如黄铁矿(FeS2)、黄铜矿(CuFeS2)、石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)。火山口附近的硫单质会被大气中是氧气氧化成二氧化硫,二氧化硫可被进一步氧化成三氧化硫,二氧化硫和三氧化硫遇水分别形成亚硫酸和硫酸。
学生活动1:阅读教材P7页“资料卡片”内容,思考硫元素在自
然界的存在形态及转化关系分别什么?
不同价态含硫物质的转化关系
任务一、认识自然界中硫的存在和转化
学生活动2:讨论交流:根据硫元素在自然界的转化关系,思考硫
及其化合物的转化原理有哪些?
①不同价态硫元素之间的相互转化主要通过氧化还原反应实现,如:
-2
S
+4
S
2H2S+3O2=2SO2+2H2O;
2H2SO3+O2=2H2SO4
+4
S
+6
S
②相同价态硫元素之间的转化主要根据酸、碱、盐及其氧化物的性质实现。如:
SO3+H2O=H2SO4、SO2+2NaOH=Na2SO3+H2O。
对应训练
【典例1】硫磺在空气中燃烧生成气体甲,甲溶于水得溶液乙,向
乙溶液中滴加溴水,乙溶液褪色变成丙。甲、乙、丙均含有硫元
素,则它们正确的顺序是( )
A.SO3 、H2SO4、H2SO3 B.SO2、H2SO3、H2SO4
C.SO3、H2SO3、H2SO4 D.SO2、H2SO4、H2SO3
B
【解析】硫磺在空气中燃烧生成气体甲SO2,甲SO2溶于水得溶液乙H2SO3,向乙H2SO3溶液中滴加溴水,乙溶液褪色变成丙H2SO4,则甲、乙、丙分别为SO2、H2SO3、H2SO4,答案B。
对应训练
【典例2】关于反应H2SO4+Na2SO3=Na2SO4+SO2↑+H2O所涉及
的物质,下列说法错误的是( )
A.浓H2SO4能与SO2发生氧化还原反应
B.Na2SO3容易被空气中的O2氧化变质
C.浓硫酸与铜在常温下反应生成SO2
D.SO2是导致酸雨的主要有害污染物
A
【解析】反应中元素化合价不变,属于非氧化还原反应,故A错误; Na2SO3具有还原性,容易被空气中的O2氧化为 Na2SO4,故B正确;浓硫酸具有强氧化性与铜在常温下反应生成SO2,故C正确; SO2能和水反应生成H2SO3,是导致酸雨的主要有害污染物,故D正确;选A。
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
学生活动1:讨论交流:如何根据氧化还原反应原理构建含硫物质
的价类二维图?
①价态与性质
0价、+4价硫处于中间价态,既有氧化性又有还原性
+6价硫处于最高价态,只有氧化性
-2价硫处于最低价态,只有还原性,可被O2、Cl2、KMnO4(H+)氧化剂氧化为S
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
②价态规律
硫元素的化合价升高或降低时,一般到其相邻价态(只靠拢不交叉),即台阶式升降
相邻价态的同种元素的微粒间不发生氧化还原反应,如S和H2S、S和SO2、SO2和浓硫酸
不同价态硫元素间的转化,均属于氧化还原反应,需要选择合适的氧化剂或者还原剂。证明硫单质、SO2具有还原性要选择氧化剂,如酸性KMnO4溶液、氯水等;证明浓硫酸具有氧化性要选择还原剂,如金属单质、硫单质、H2S等;证明SO2具有氧化性要选择还原剂,如H2S、Na2S等
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
③价类二维图:
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
学生活动2:问题探究:根据含硫物质的价类二维图,不同价态硫
元素间转化的思维模型是什么?结合所学知识,思考含硫物质有哪
些不同转化关系?
①转化的思维模型:
不同价态含硫物质的转化关系
任务二、建构含硫物质的价类二维图
②转化类型:
直线型转化关系:
S(固体)
SO2
O2
O2
SO3
H2O
H2SO4
H2S
S(固体)
O2
O2
SO2
H2O
H2SO4
O2
SO3
交叉型转化关系:
三角型转化关系:
对应训练
【典例1】下图是一种综合处理SO2废气的工艺流程。下列说法正
确的是( )
A.操作Ⅱ发生反应的离子方程式为:
2Fe2++4H++O2=2Fe3++2H2O
B.溶液b中阳离子只有Fe2+
C.溶液a转化为溶液b的反应中,SO2被氧化
D.加入FeO可以使溶液c转化为溶液a
C
对应训练
【解析】Fe3+有氧化性,SO2有还原性,Fe2(SO4)3被SO2还原为FeSO4,溶液b主要溶质为FeSO4、H2SO4,可能含Fe2(SO4)3或SO2,空气中氧气将FeSO4及可能存在的SO2氧化得溶液a循环使用。A.电荷不守恒,操作Ⅱ发生反应的离子方程式为:4Fe2++4H++O2= 4Fe3++2H2O,A错误;B.操作I中发生反应的离子方程式为:2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+,溶液中阳离子有Fe2+、H+,若SO2少量,则还有Fe3+,B错误;C.溶液a转化为溶液b的反应中,SO2被Fe3+氧化,C正确;D.溶液c中含有 Fe2(SO4)3、H2SO4等物质,加入FeO后会生成FeSO4,D错误。答案选C。
对应训练
【典例2】物质类别和核心元素的价态是学习元素及其化合物性质
的重要认识视角。如图是某元素的“价类二维图”,其中单质b
是黄色固体,f、h均为正盐,且焰色都是黄色。下列说法不正确
的是( )
A.a和c反应可以生成b
B.用BaCl2溶液可以鉴别f和h的溶液
C.e的浓溶液可用铝槽车运输
D.c能使品红溶液褪色
B
对应训练
【解析】单质b是黄色固体,所以b是硫,f、h均为正盐,且焰色都是黄色,根据示意图可知a是H2S,c是SO2,d是SO3,e是硫酸,f是硫酸钠,g是亚硫酸,h是亚硫酸钠,据此解答。A. 二氧化硫具有氧化性,能氧化硫化氢,二者反应可以生成单质硫,A正确;B. 亚硫酸钠和硫酸钠均能与氯化钡反应生成白色沉淀,不用BaCl2溶液鉴别二者,B错误;C. 常温下铝在浓硫酸中钝化,因此e的浓溶液可用铝槽车运输,C正确;D. 二氧化硫具有漂白性,能使品红溶液褪色,D正确;
实验探究不同价态含硫物质的转化
实验探究不同价态含硫物质的转化
任务一、实验室中研究不同价态含硫物质的转化原理
学生活动1、根据教材P8页“探究”内容,思考硫元素常见价态及其转
化关系是什么?
-2
S
0
S
+4
S
+6
S
FeS、H2S
Na2S、HgS
SO2、H2SO3
Na2SO3
SO3、H2SO4
Na2SO4、CuSO4
S
氧化剂
①硫元素常见价态(物质)及转化:
氧化剂
氧化剂
还原剂
还原剂
还原剂
②通过氧化还原反应实现不同价态含硫物质的相互转化,低价态的硫向高价态转化时需加入氧化剂,高价态的硫向低价态转化时需加入还原剂。
实验探究不同价态含硫物质的转化
任务一、实验室中研究不同价态含硫物质的转化原理
学生活动2、讨论交流:阅读检测P9页“方法导引”栏目内容,你是如
何理解化学实验设计及探究不同价态含硫物质的转化关系的?并填
写表格内容。
①化学实验设计:是指实验者在实施化学实验之前,根据一定的实验目的,运用化学知识与技能,按照一定的实验方法,对实验的原理、试剂、仪器与装置、步骤和方法等所进行的规划。
②遵循的原则:科学性、可行性、安全性和绿色化。化学实验设计一般以实验设计方案的形式呈现,通常包括实验课题、实验目的、实验原理、实验仪器与试剂、实验步骤及注意事项、实验数据及处理、实验结论与讨论等。
实验探究不同价态含硫物质的转化
③含硫物质的转化实验方案设计:
预期转化 选择试剂 实验操作和现象 实验结论
H2S→S
SO2→S SO2→H2SO4
H2SO4→SO2
二氧化硫、硫化氢、蒸馏水
将H2S和SO2通入水中,生成淡黄色沉淀(或溶液变浑浊)
SO2与H2S反应生成单质硫
二氧化硫、新制氯水、BaCl2溶液
将SO2通入新制氯水中,溶液浅黄绿色褪去;再向溶液中滴入氯化钡溶液,产生白色沉淀
二氧化硫在水中能被强氧化剂氧化为SO42-
浓硫酸、铜片
加热铜片和浓硫酸的混合物,有刺激性气味气体生成
浓硫酸被金属铜还原为SO2
对应训练
【典例1】分别能实现下列从左到右转化的单质是( )
A.Mg和S B.Fe和Cl
C.Ca和C D.Cu和Si
C
对应训练
【解析】A.Mg与氧气反应生成MgO,MgO是碱性氧化物,MgO与水不反应;S与氧气反应生成SO2,SO2是酸性氧化物,SO2与水反应生成亚硫酸,亚硫酸与碱或碱性氧化物反应生成亚硫酸盐,故A不符合题意;B.Fe与氧气反应生成Fe3O4,Fe3O4不是碱性氧化物,且Fe3O4与水不反应,故B不符合题意;C.Ca与氧气反应生成CaO,CaO是碱性氧化物,CaO与水反应生成Ca(OH)2,Ca(OH)2是碱,Ca(OH)2与盐酸反应生成盐CaCl2;C与氧气反应生成CO2,CO2是酸性氧化物,CO2与水反应生成碳酸,碳酸与碱反应生成碳酸盐,故C符合题意;D.Cu与氧气反应生成CuO,CuO是碱性氧化物,但是CuO与水不反应,故D不符合题意。故选C。
对应训练
【典例2】含硫煤燃烧会产生大气污染物,为防治该污染,某工
厂设计了新的治污方法,同时可得到化工产品,该工艺流程如
图所示,下列叙述不正确的是( )
A.该工艺流程是用来除去煤燃烧时产生的SO2
B.该过程中可得到化工产品H2SO4
C.图中涉及的反应之一为
Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4
D.该过程中化合价发生改变的元素只有Fe和S
D
对应训练
【解析】由图可知发生反应为:Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,同时4FeSO4+ 2H2SO4+O2=2Fe2(SO4)3+2H2O,总反应为2SO2+O2+2H2O=2H2SO4。A.根据总反应2SO2+O2+2H2O=2H2SO4可知该工艺流程是用来除去煤燃烧时产生的SO2,A正确;B.根据总反应为2SO2+O2+2H2O=2H2SO4可知该过程中可得到化工产品H2SO4,B正确;C.Fe2(SO4)3与SO2反应生成FeSO4和H2SO4,其反应的化学方程式为Fe2(SO4)3+SO2+2H2O=2FeSO4+2H2SO4,C正确;D.该过程中Fe2(SO4)3与SO2反应生成FeSO4和H2SO4,同时FeSO4、O2和H2SO4反应生成Fe2(SO4)3,则反应过程中Fe、O和S的化合价发生改变,D错误;故选项是D。
实验探究不同价态含硫物质的转化
任务二、实验验证含硫物质的转化
学生活动1、联系教材P8页“探究”栏目,根据下表实验步骤完成实验,
并填写表格内容。
实验操作 实验现象 原理分析
在一支试管中加入1mL Na2S溶液,边振荡边滴加H2SO3溶液,用浸NaOH溶液的棉团塞住试管口
在一支试管中加入1mL Na2S溶液,边振荡边滴加酸性KMnO4溶液
试管中产生淡黄色沉淀
紫红色褪去,试管中产生淡黄色沉淀
-2价硫与+4价硫发生归中反应,生成中间价态0价的硫单质。SO2与碱反应。2S2-+SO2+4H+=3S↓+2H2O
SO2+2OH-=SO32-+H2O
-2价硫被酸性KMnO4溶液氧化成硫单质,本身被还原成Mn2+。5S2-+2MnO4-+16H+=5S↓+2Mn2++8H2O
实验探究不同价态含硫物质的转化
任务二、实验验证含硫物质的转化
学生活动2、问题探究:将SO2气体分别通入BaCl2溶液、Ba(NO3)2
溶液能否产生沉淀?如何防止SO2可能对环境产生的污染?
①SO2气体通入BaCl2溶液无明显现象,因为酸性H2SO3
对应训练
【典例1】已知含硫元素的几种物质间具有如图转化关系。NA表示阿
伏加德罗常数值,下列说法正确的是( )
C
A.反应①中3.2gS充分燃烧后生成2.24LSO2 B.NA个SO2分子与足量氧气经反应③可以制得NA个SO3分子 C.反应②中若转移2NA个电子,生成1.5molS D.只要氧气过量,硫可以一步转化为SO3
【解析】温度和压强未知导致气体摩尔体积未知,则无法计算反应①中生成的SO2体积,A错误;③为可逆反应,所以NA个SO2分子与足量氧气经反应③不能制得NA个SO3分子,选项B错误;反应②的方程式为2H2S+SO2=3S+2H2O,生成3molS转移电子的物质的量为4mol,转移2NA个电子时,转移电子的物质的量为2mol,生成S的物质的量=2mol×3mol/4mol=1.5mol,选项C正确;硫与氧气反应只能生成二氧化硫,不能一步转化为三氧化硫,选项D错误;答案选C。
对应训练
【典例2】下列有关含硫物质转化判断正确的是( )
A
A.0.1 mol Cu与足量的硫充分反应,生成物的质量比该单质的
质量增加了1.6 g
B.如图是铜与浓硫酸反应的实验装置。B中盛装的是浓硫酸,
作用是干燥SO2
C.Cu投入稀硫酸中加热,没有明显变化,加入一定量的H2O2
溶液,金属Cu逐渐溶解,反应中H2O2起催化作用
D.向铜与浓硫酸反应后的混合溶液中加水,判断有无铜离子
对应训练
【解析】A.Cu与S混合加热发生反应产生Cu2S,若Cu物质的量是0.1 mol,则反应产生0.05 mol Cu2S,消耗S的物质的量是0.05 mol,因此固体质量增加了0.05 mol×32 g/mol=1.6 g,A正确;B.在如图铜与浓硫酸反应的实验装置中,B中盛装的应该是饱和NaHSO3溶液,作用是储存SO2,并可作安全瓶,防止倒吸的作用,B错误;C.H2O2溶液具有强氧化性,在酸性条件下将Cu氧化为Cu2+,反应方程式为:Cu+H2O2+H2SO4=CuSO4+2H2O,在该反应中H2O2的作用是氧化剂,C错误;D.反应后溶液中含有大量浓硫酸,要根据硫酸的稀释原则进行操作,即应该待溶液冷却后,取少量溶液加入到盛有水的容器中,根据溶液是否变为蓝色,确定其中是否含有Cu2+,D错误;故合理选项是A。
1.硫元素的几种化合物及其单质存在下列转化关系(反应条件
省略)。
下列判断不正确的是( )
A.反应①中氧化剂与还原剂物质的量之比为1∶1
B.反应②表明SO2具有酸性氧化物的性质
C.反应③的原子利用率是100%
D.反应④中稀H2SO4作氧化剂
D
【解析】A.反应①为浓硫酸氧化铜单质的反应,浓硫酸作氧化剂被还原成SO2,化合价降低2价,Cu作还原剂被氧化成Cu2+,化合价升高2价,所以氧化剂与还原剂物质的量之比为1∶1,故A正确;B.二氧化硫与NaOH反应生成盐和水,表明二氧化硫为酸性氧化物,故B正确;C.反应③为Na2SO3+S=Na2S2O3,生成物只有一种,原子利用率是100%,故C正确;D.反应④的化学方程式:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,稀硫酸既不是氧化剂也不是还原剂,故D错误;综上所述答案为D。
2.如图是硫元素在自然界中的循环示意图,下列有关说法不正
确的是( )
A.硫元素在自然界中既有游离态又有化合态
B.过程⑤可在土壤的缺氧区实现
C.循环过程中硫元素只被还原
D.若生物体有机硫中硫元素为-2价,则过程③中发生的是还原
反应
C
【解析】A.硫元素在自然界中有游离态和化合态,两种存在形态,A正确;B.在缺氧的条件下可实现过程⑤的转化,B正确;C.①、②中硫元素均被氧化,C错误;D.若生物体有机硫中硫元素为-2价,SO42-中S为+6价,过程③中S的化合价降低,发生还原反应,D正确。答案选C。
3.如图中的字母代表硫及其化合物,相关推断不合理的是( )
A.ab溶液反应有d生成
B.e和f都存在酸式盐
C.硫酸型酸雨的形成过程涉及b→c的转化
D.检验g中阴离子所用试剂只需BaCl2溶液
D
【解析】根据硫及其化合物的转化关系图可知,a为H2S,b为H2SO3,c为H2SO4,d为S,e为硫化物,f为亚硫酸盐,g为硫酸盐。A项,H2S和H2SO3反应可以生成中间价态的S,正确;B项,若为钠盐,则e为-2价的Na2S或NaHS,f为Na2SO3或NaHSO3,正确;C项,b为H2SO3,c为H2SO4,硫酸型酸雨是H2SO3被空气中氧气氧化为H2SO4,正确;D项,检验硫酸根,应该用盐酸和BaCl2溶液,错误。
4.硫元素的价类二维图如图所示。下列说法错误的是( )
A.a与c、d、e都有可能反应生成b
B.d溶液久置于空气中会生成e
C.盐g与盐f之间也可能发生反应
D.铜与e的浓溶液共热产生的气体通入BaCl2溶液中,无明显
现象
D
【解析】根据化合价以及物质的类别可知a为H2S、b为S、c为SO2、d为H2SO3、e为H2SO4、f为 亚硫酸盐、g为硫酸盐 。A.a为H2S,可以和SO2、H2SO3、H2SO4发生归中反应生成硫单质,A正确;B.H2SO3具有较强的还原性,在空气久置会被氧气氧化成硫酸,B正确;C.g为硫酸盐或酸式盐,f为亚硫酸盐,可能会发生反应生成二氧化硫,C正确;D.铜与浓硫酸共热产生的气体SO2,SO2通入 BaCl2 溶液中,SO2先与水反应生成亚硫酸,亚硫酸易被空气中的氧气氧化为硫酸,硫酸与BaCl2反应生成硫酸钡白色沉淀,D错误;答案选D。
延时符
不同价态含硫物质的转化
自然界中硫的存在:游离态(火山喷口附近或地壳的岩层里、煤)、化合态(矿石、含硫化合物)
自然界中硫及转化:S+O2=SO2、SO3+H2O=H2SO4等
实验探究不同价态含硫物质的转化
转化类型:直线型、交叉型、三角型
化学实验设计原则
价态与性质:价类二维图
第4课时 不同价态含硫物质的转化
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
