第一章:化学反应与能量转化(含解析)同步习题2023---2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第一章:化学反应与能量转化(含解析)同步习题2023---2024学年上学期高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 14:47:57 | ||
图片预览


文档简介
第一章:化学反应与能量转化 同步习题
一、单选题(共14题)
1.在党的领导下,新中国成立后,我国航天事业从无到有,举世瞩目。以下说法错误的是
A.1970年我国发射的第一颗人造地球卫星“东方红一号”采用银锌电池供电,锌做电池的负极
B.2003年“神舟五号”载人飞船遨游太空,飞船燃料偏二甲肼(CH3)2NNH2中C、N原子杂化方式相同
C.2007年“嫦娥一号”探月卫星任务之一是探测月球上3He含量及分布。3He与4He互为同素异形体
D.2021年“天问一号”探测器成功着陆火星,它搭载了新型纳米气凝胶做热控材料,气凝胶的分散剂是气体
2.如图所示装置中,电流表G指针发生偏转,同时Y极逐渐变粗,X极逐渐变细。下列判断正确的是
A.X是Zn,Y是Cu,Z为溶液
B.X是Cu,Y是Zn,Z为溶液
C.X是Zn,Y是Cu,Z为酒精溶液
D.X是Zn,Y是Cu,Z为溶液
3.为阿伏加德罗常数的值。下列说法正确的是
A.,完全反应转移的电子数为
B.用电解粗铜的方法精炼铜,当电路中通过的电子数为时,阳极应有转化为
C.与足量水完全反应,电子转移数为2
D.重水比水多个质子
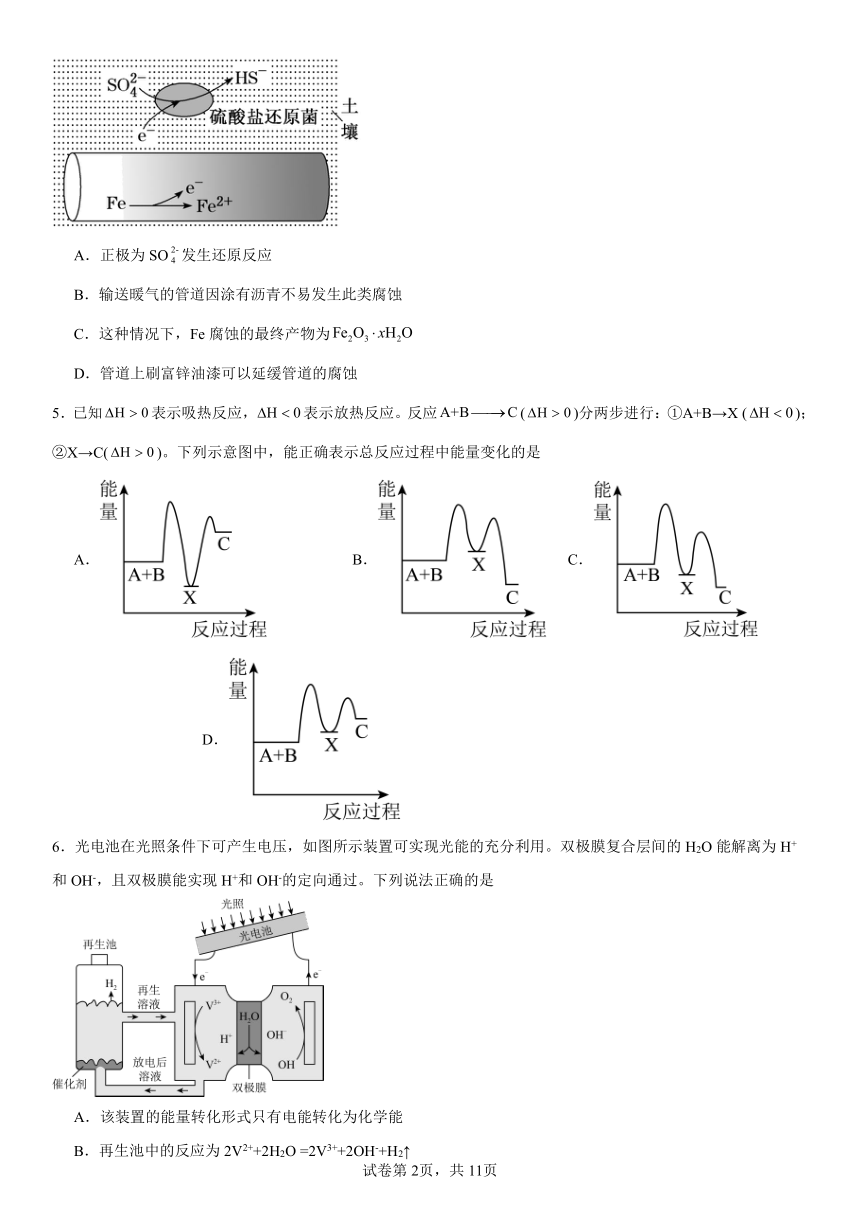
4.深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是
A.正极为SO发生还原反应
B.输送暖气的管道因涂有沥青不易发生此类腐蚀
C.这种情况下,Fe腐蚀的最终产物为
D.管道上刷富锌油漆可以延缓管道的腐蚀
5.已知表示吸热反应,表示放热反应。反应()分两步进行:①A+B→X ();②X→C()。下列示意图中,能正确表示总反应过程中能量变化的是
A. B. C. D.
6.光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+和OH-的定向通过。下列说法正确的是
A.该装置的能量转化形式只有电能转化为化学能
B.再生池中的反应为2V2++2H2O =2V3++2OH-+H2↑
C.标准状况下,当阳极生成22.4LO2时,电路中转移电子数为4NA
D.光照过程中阳极区溶液中的n(OH-)变大
7.下列热化学方程式正确的是
A.2SO2+O22SO3 ΔH=-196.6 kJ·mol-1
B.C(g)+O2(g)=CO(g)ΔH=+393.5 kJ·mol-1
C.H2(g)+O2(g)=H2O(g) ΔH=-241.8 kJ
D.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
8.下列说法正确的是( )
A.葡萄糖的摩尔燃烧焓是,则
B.在一定条件下将和置于密闭容器中充分反应生成,放出热量,则反应的热化学方程式为
C.已知稀溶液中,,则稀氨水与稀盐酸反应生成水时放出的热量
D.已知和反应的中和热,则稀硫酸与氢氧化钡溶液反应生成水时
9.下列说法不正确的是
A.电解精炼铜的过程中,电解质溶液中铜离子浓度保持不变
B.电镀时,应把镀件置于电解池的阴极
C.为防止水闸铁门被腐蚀, 可让其与直流电源的负极相连
D.电化学防护中牺牲阳极的阴极保护法是利用了原电池原理
10.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为: CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g)
②CO(g)+2H2(g)=CH3OH(g)
其能量曲线如下图所示,下列有关说法错误的是
A.反应①为吸热反应,反应②为放热反应
B.决定该总反应速率的是反应①
C.CO是该总反应的催化剂
D.该总反应用于工业生产,能促进碳中和
11.如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如下图所示,关于该装置的下列说法正确的是
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.电解质溶液中H+移向Y极
D.X极上发生的是还原反应,Y极上发生的是氧化反应
12.下列图示方法能完成相应实验的是
A B C D
配制一定物质的量浓度的NaOH溶液 实验室制取Cl2 验证铁的析氢腐蚀 验证氨气易溶于水
A.A B.B C.C D.D
13.如图所示。下列各装置能达到相应实验目的的是
A.图甲,中和热的测定 B.图乙,分离乙醇和水
C.图丙,在铁制品表面镀锌 D.图丁,除去二氧化碳中的氯化氢
14.双极膜能够在直流电场作用下将解离为和。以维生素C的钠盐(C6H7O6Na)为原料制各维生素C(,具有弱酸性和还原性)的装置如图。下列说法正确的是
A.a离子是,b离子是
B.此装置最终既可以得到维生素C,又可以得到NaOH
C.将X极区的替换为,可以提高维生素C的产率
D.极的电极反应式为
二、填空题(共8题)
15.减排是各个国家都在努力为之的事,和的处理是许多科学家都在着力研究的重点。有学者想以如图所示装置利用原电池原理将、转化为重要的化工原料。
(1)若A为,B为,C为,电池总反应方程式为,则正极的电极反应式为 。
(2)若A为,B为,C为,则负极的电极反应式为 ,电池的总反应方程式为 。
16.回答下列问题:
(1)一氧化碳催化加氢制甲醇,反应原理为: 。
①若已知CO、、的燃烧热分别为、、,则 。
②已知反应中相关的化学键键能数据如下:
化学键
436 413 343 465
且 ,试计算断开气体中的需提供的最低能量为 。
(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为。已知下列物质的燃烧热(25℃、):
燃料 (辛烷)
燃烧热/() 285.8 283.0 890.3 5518
据上表数据填写:
①试写出表示辛烷燃烧热的热化学方程式 。
②的热值为 。
③上表所列燃料的热值最大的是 (填化学式)。
(3)中和热是反应热的一种。
①取溶液和盐酸进行实验,若实验测得的反应前后温度差平均值,中和后生成溶液的比热容(若近似认为溶液和盐酸的密度都是)。则生成时的反应热 (取小数点后一位,下同)。
②强酸与强碱的稀溶液发生中和反应生成时的反应热。若用一定浓度的稀硫酸与含的稀碱溶液完全反应,反应放出的热量为 。
17.某兴趣小组利用如图所示装置进行实验。
(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;阳极电极反应式为 。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体 mL(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为 ;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上 (填“能”或“不能”)恢复原样。
18.某原电池构造如图所示。其电池的总反应是:Cu(s) + 2Ag+ (aq) = Cu2+ (aq) + 2Ag(s)。
请回答以下问题:
(1)若盐桥为琼脂-KOH组成,其作用是 。OH-离子移向 (填“A”或“B”)中的溶液。Cu为原电池的 极,其电极反应式是 。A中的电解质溶液在该电池工作一段时间后会出现 的现象。
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池)。
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。
19.能源是现代文明的原动力,通过化学方法可使能量按人们所期望的形式转化,从而开辟新能源和提高能量转化率。请回答下列问题:
Ⅰ.化学电源在生产、生活中有着广泛的应用。
(1)根据构成原电池本质判断,如下反应可以设计成原电池的是 (填字母)。
A.NaOH+HCl=NaCl+H2O B.2CO+O22CO2
C. 2H2O2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是 (填字母)。
A.图甲和图乙的气泡均产生于锌棒表面温
B.图乙中产生气体的速率比图甲快
C.图甲中温度计的示数高于图乙的示数
D.图甲和图乙中温度计的示数相等,且均高于室温
Ⅱ.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=CO+6H2O。则下列说法正确的是 (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
20.化学反应过程中,不仅有物质的变化,同时还伴随能量的变化。
(1)“即热饭盒”给人们生活带来方便,它可利用下面 (填字母序号)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水 C.钠和水
(2)2H2 (g) + O2(g) = 2H2O(l) △H= -572 kJ/mol,该反应的能量变化可用图中的 (填a或b)表示。
(3)已知常温下红磷比白磷稳定,在下列反应中:
①4P(红磷,s)+5O2(g)=P4O10(s) △H=﹣Q1kJ mol﹣1
②P4(白磷,s)+5O2(g)=P4O10(s) △H=﹣Q2kJ mol﹣1
若Q1、Q2均大于零,则Q1和Q2的关系为___________(填字母序号)。
A.Q1>Q2 B.Q1=Q2
C.Q1<Q2 D.无法确定
(4)已知拆开2molHCl分子中的化学键需要消耗862kJ的能量,则③、④的数值为:③ kJ;④ kJ。
(5)已知298 K时:
C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
CO(g)+O2(g)=CO2 (g) △H2= -283.0 kJ·mol-1
写出C与O2反应生成CO的热化学方程式: 。
21.钢铁很容易生锈腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。因此,该小组同学又进行了钢铁腐蚀探究,希望能找到防止钢铁腐蚀的好办法。如图,U形管内为红墨水,a、b试管内分别盛有氯化铵溶液(显酸性)和食盐水,各加入生铁块,放置一段时间均被腐蚀。红墨水柱两边液面变为:左低、右高。
(1)请猜测a试管中铁发生的是 (填“析氢”或“吸氧”)腐蚀。
(2)b管中生铁中碳上发生的电极反应式 。
22.回答下列问题
(1)已知完全燃烧ag乙炔(C2H2)气体时生成1molCO2和H2O(l),同时放出热量bkJ,则表示乙炔燃烧热的热化学方程式: 。
(2)某课外科学兴趣小组的同学用如图所示装置研究有关电化学的问题。图中是两个串联的甲烷燃料电池做电源对乙池丙池进行电解实验(各溶液溶质均足量),当闭合该装置的电键时,观察到电流表的指针发生了偏转。
①A电极上发生的电极反应式为: 。
②电解过程中丙池中发生的总反应方程式为: 。
③当两个燃料电池共消耗甲烷2240mL(标况),乙池中某极上析出Ag的质量为 g。
(3)如图所示是一种可实现氢气循环利用的新型电池的放电工作原理。
若以此新型电池为电源,用惰性电极电解制备硼酸[H3BO3或B(OH)3],其工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。
①新型电池放电时,负极电极反应式为: 。
②两池工作时,电池的电极M应与电解池的 (填a或b)极相连接;1、2、3膜为阳膜的是: 。
③产品室中发生的离子反应为: 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.银锌电池中锌做负极,氧化银做正极,故A正确;
B.偏二甲肼(CH3)2NNH2中,两个碳原子均为杂化,两个氮原子均为杂化,所以C、N原子杂化方式相同,故B正确;
C.3He与4He质子数相同,中子数不同,互为同位素,故C错误;
D.新型纳米气凝胶是将分散质分散到气态分散剂中,故D正确;
答案为C。
2.D
【详解】该原电池中,Y极逐渐变粗,X极逐渐变细,说明X作负极,Y作正极,X的活泼性必须大于Y的活泼性,所以排除B选项;酒精是非电解质,不能形成原电池,排除选项C;Y极逐渐变粗,说明Y极有金属析出,A选项析出氢气不是金属,D选项析出金属铜,所以D符合题意。
故选D。
3.A
【详解】A.HCHO中C元素的化合价为0价,反应后生成CO2,C元素的化合价为+4价,5molHCHO完全反应转移20mol电子,MnO中Mn元素化合价为+7价,反应后生成Mn2+,Mn元素的化合价为+2价,4mol MnO完全反应转移20mol电子,故完全反应转移的电子数为,A正确;
B.用电解粗铜的方法精炼铜,阳极除铜放电外,较铜活泼的金属锌等也会放电成为金属阳离子,故当电路中通过的电子数为时,阳极应有小于32gCu转化为,B错误;
C.过氧化钠与水反应生成氢氧化钠和氧气,则78g过氧化钠与足量水完全反应,电子转移数为×1×NAmol-1=NA,C错误;
D.1mol重水和1mol水的质子数相同,中子数不同,D错误;
故选A。
4.C
【详解】A.正极是硫酸根离子得到电子,发生还原反应,生成硫氢根离子,故A正确;
B.钢铁制造的暖气管道外常涂有一层沥青,使钢铁与空气和水隔离,不能形成电化学腐蚀,故B正确;
C.因存在还原菌所以铁最终是亚铁,而不是Fe2O3 xH2O,故C错误;
D.管道上刷富锌油漆,锌比铁活泼,所以腐蚀锌保护铁,所以管道上刷富锌油漆可以延缓管道的腐蚀,故D正确;
故选C。
5.A
【分析】根据题意可知,A+B→X是放热反应,A+B的总能量高于X的总能量,X→C为吸热反应,X的总能量低于C的总能量,且总反应为吸热反应,则A+B的总能量低于C的总能量。
【详解】A.由图可知,第一步反应为放热反应,第二步为吸热反应,总反应为吸热反应,故A符合题意;
B.图示的第一步反应为吸热反应,第二步为放热反应,故B不符合题意;
C.图示的第一步反应为放热反应,第二步为放热反应,故C不符合题意;
D.图示的第一步反应为吸热反应,第二步为吸热反应,故D不符合题意;
答案选A。
6.C
【分析】由图中电子的移动方向可知,右侧为电解池的阳极,左侧为电解池的阴极,阳极反应式为4OH--4e-=2H2O+O2↑,阴极反应式为 2V3++2e-=2V2+,双极性膜可将水解离为H+和OH-,H+进入阴极,OH-进入阳极,放电后的溶液进入再生池中在催化剂条件下发生反应放出氢气,反应方程式为2V2++2H+2V3++H2↑,据此分析解答。
【详解】A.由图可知,该装置将光能转化电能,然后分解水,则能量转化形式:光能→电能→化学能,A错误;
B.根据以上分析可知,酸性条件下再生池中发生的反应为2V2++2H+2V3++H2↑,B错误;
C.标准状况下,当阳极生成22.4L即=1molO2时,则电路中转移电子数为1mol×4×NAmol-1=4NA,C正确;
D.双极性膜可将水解离为H+和OH-,且双相膜能实现H+和OH-的定向通过,再生反应的方程式为2V2++2H+2V3++H2↑,再结合分析,则阳极转移电子的物质的量和再生池消耗H+的物质的量相等,所以光照过程中阳极区溶液中的n(OH-)和c(H+)基本不变,D错误;
故答案为:C。
7.D
【详解】A.在热化学方程式中应该注明物质的聚集状态,故A错误;
B.碳不完全燃烧是放热反应,放热反应的ΔH是负值,故B错误;
C.ΔH的单位是kJ·mol-1,故C错误;
D.物质的聚集状态、ΔH均正确,故D正确;
此题选D。
8.A
【详解】A.葡萄糖的摩尔燃烧焓是,表示1mol葡萄糖完全燃烧生成CO2和液态H2O放热2800kJ,故葡萄糖完全燃烧生成CO2和液态H2O放热2800kJ,热化学方程式 正确,A正确;
B.和置于密闭容器中充分反应生成,放出热量,该反应是可逆反应,而热化学方程式是指完全反应时的热效应,故 ,故B错误;
C.则稀氮水电离要吸热,与稀盐酸反应生成水时放出小于的热量,故C错误;
D.稀硫酸与氢氧化钡溶液反应时会生成硫酸钡沉淀,有沉淀生成热产生,故则稀硫酸与氢氧化钡溶液反应生成水时,故D错误。
答案选A。
9.A
【详解】A.电解精炼铜时,粗铜作阳极,精铜作阴极,CuSO4溶液作电解质溶液。阳极粗铜中含有少量的Fe、Zn,会优于Cu先失去电子,而阴极一直为Cu2++2e-=Cu,因此电解质溶液中Cu2+的浓度会有所减小,A项错误;
B.电镀时,在镀件上,镀层金属离子得到电子发生还原反应,为电解池的阴极,B项正确;
C.外接电源作电解池的阴极,金属不能失去电子被氧化,而被保护,C项正确;
D.电化学防护中牺牲阳极的阴极保护法,需要外接活泼金属,活泼金属失去电子被氧化而被腐蚀,利用的是原电池原理,D项正确;
答案选A。
10.C
【详解】A.由图可知反应物能量低于生成物的总能量,所以反应①为吸热反应;反应物能量高于生成物的总能量,所以反应②为放热反应,故A正确;
B.根据上述分析可知:反应①为吸热反应,反应②为放热反应,所以反应①比反应②慢,所以决定该总反应速率的是反应①,故B正确;
C.根据反应 ①CO2(g)+H2(g)=CO(g)+H2O(g)和②CO(g)+2H2(g)=CH3OH(g)可知,①+②得CO2(g)+3H2(g)=CH3OH(g)+H2O(g),所以CO是中间产物,故C错误;
D.二氧化碳加氢制甲醇的总反应可表示为: CO2(g)+3H2(g)=CH3OH(g)+H2O(g), 该总反应用于工业生产,有利于减少温室效应,促进碳中和,故D正确;
故答案:C。
11.C
【分析】根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,故X为负极,Y为正极。
【详解】A.根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,电流的流向与此相反,即Y→外电路→X,选项A错误;
B.原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,选项B错误;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,选项C正确;
D.X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,选项D错误;
答案选C。
12.D
【详解】A.容量瓶不能作为溶解、稀释、反应和长期贮存溶液的仪器,A不合题意;
B.实验室用MnO2和浓盐酸反应制备Cl2时需要加热,B不合题意;
C.钢铁在NaCl溶液等中性溶液中发生吸氧腐蚀,不会发生析氢腐蚀,C不合题意;
D.氨气的喷泉实验可以验证氨气易溶于水,D符合题意;
故答案为:D。
13.C
【详解】A.缺少环形玻璃搅拌棒,且两烧杯之间有空隙,碎纸条没有填充满,故A不符合题意;
B.乙醇与水是互溶的,不分层,故B不符合题意;
C.在铁制品表面镀锌,锌片为阳极,铁制品为阴极,电解液为含锌离子的盐溶液,故C符合题意;
D.氢氧化钠溶液同时吸收二氧化碳,应用饱和碳酸氢钠溶液除去氯化氢,故D不符合题意。
综上所述,答案为C。
14.B
【分析】由装置图知,X极区产生氧气,为阳极,在X电极,水失去电子生成氧气,同时生成氢离子,钠离子通过阳离子交换膜进入右侧区域与a离子即氢氧根离子构成NaOH,则b离子为氢离子,与结合为,Y极区产生氢气,为阴极,水得到电子生成氢气,同时生成氢氧根离子。
【详解】A.a离子是,b离子是,A错误;
B.由分析知,此装置最终既可以得到维生素C,又可以得到NaOH,B正确;
C.若将X极区的Na2SO4替换为C6H7O6Na,一方面生成的导电能力弱,另一方面维生素C易被生成的氧气氧化,不能提高维生素C的产率,C错误;
D.X极为阳极,发生氧化反应,电极反应式为,D错误;
故选B。
15.
【分析】根据原电池工作原理进行分析解答。燃料电池的燃料做负极发生氧化反应,氧气做正极发生还原反应,注意电解质溶液对电极反应式的影响。
【详解】(1)在负极失去电子,酸性条件下该电池负极的电极反应式为;在正极得到电子,一分子得到6个电子,转化为,故可得正极的电极反应式为,故答案:;
(2)SO2在负极失去电子,可得负极的电极反应式为。在正极获得电子,可得正极的电极反应式为,使正、负极得失电子总数相等并将正、负极电极反应式相加,可得电池的总反应方程式为,故答案:;。
16.(1)
(2)
(3)
【详解】(1)①由、、的燃烧热分别为、、,可写出三个对应的热化学方程式,分别为:
(反应Ⅰ)
(反应Ⅱ)
(反应Ⅲ)
根据盖斯定律,由反应Ⅰ+反应Ⅱ-反应Ⅲ可得。
②反应物中化学键的键能之和一生成物中的化学键键能之和得:,解得。
(2)①由于辛烷的燃烧热为,所以表示辛烷燃烧热的热化学方程式为: 。
②由于的燃烧热为,则其热值为。
③、、的热值分别为、、。所以热值最大的是氢气。
(3)①由,反应中生成0.025mol水,则。
②强酸与强碱的稀溶液发生中和反应生成时的反应热,即消耗40g放出热量57.3kJ,所以当有反应时放出的热量为。
17. 右边电极附近有白色沉淀生成 2Cl- - 2e-=Cl2↑ 11.2 H2+Cl2=2HCl 能
【详解】(1)断开K2、闭合K1,为电解池装置,氯离子在阳极(左边电极)失电子生成氯气,电极反应式为2Cl- - 2e-=Cl2↑;右边电极附近水电离的氢离子放电产生氢气,同时产生氢氧根离子和镁离子结合成白色的氢氧化镁沉淀;根据H2~2e-可知当电路中转移0.001mol电子时,则可生成0.0005molH2,在标况下的体积为11.2mL,故答案为:右边电极附近有白色沉淀生成;2Cl--2e-=Cl2↑;11.2;
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,分别为氯气和氢气,断开K1、闭合K2,可形成原电池反应,总方程式为H2+Cl2=2HCl,故答案为:H2+Cl2=2HCl;
(3)结合(1)可知,电解时产生等物质的量的氢气和氯气,假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,又可完全反应生成HCl,可使溶液恢复原状,故答案为:能。
18. 使两个烧杯中的溶液连成通路 A 负 Cu-2e-=== Cu2+ 出现蓝色沉淀 会 电解池 阳极 会 不变 不 两池都没有可自发进行的氧化还原反应
【详解】(1)盐桥的作用是使两个烧杯中的溶液连成通路,保持溶液的电中性;在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。铜比银活泼,所以铜是负极,银是正极,OH-离子移向负极移动,即向A电极移动;B是正极,溶液中的铜离子得到电子,电极反应式是Cu-2e-=== Cu2+;A中铜失去电子,生成铜离子,所以溶液显蓝色;
(2)如果把盐桥改为铁棒后,由于铜和铁的活泼性差别小于银与铁的,所以A装置就是电解池,B是原电池,其中铁是负极,银是正极,所以铜棒是阳极;
(3)如果把盐桥改为铜棒,则A装置是电解池,B装置是原电池。此时A装置相当于是粗铜的提纯,所以溶液中铜离子的浓度不变;
(4)由于银不能和硝酸铜反应,即此时两池都没有可自发进行的氧化还原反应,所以不能再构成原电池。
19. BD BC ②③
【详解】I.(1)原电池是将化学能转变为电能的装置,构成原电池条件之一是自发发生氧化还原反应,
A.酸碱中和反应为非氧化还原反应,故A不符合题意;
B.可设计成燃料电池,故B符合题意;
C.该反应虽然为氧化还原反应,但是该反应不能自发进行,不能设计成原电池,故C不符合题意;
D.该反应为自发的氧化还原反应,可设计成原电池,故D符合题意;
答案为BD;
(2)A.图甲锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+=Zn2++H2↑,气泡在锌棒上产生,而图乙中装置构成原电池,Zn易失电子作负极,Cu作正极,正极上H+得电子生成氢气,产生气泡的是铜棒,故A错误;
B.构成原电池可加快化学反应速率,则图乙中产生气体的速率比图甲快,故B正确;
C.图甲中化学能转化为热能,图乙中化学能转化为热能和电能,图甲中温度计的示数高于图乙的示数,故C正确,
D.根据选项C的分析,故D错误;
答案为BC;
Ⅱ.甲醇燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成,
①电池放电时,氧气得电子,则通入空气的电极为正极,故①错误;
②电池放电时,生成的CO2与KOH溶液反应生成碳酸钾,电解质溶液的碱性逐渐减弱,故②正确;
③6.4g甲醇的物质的量为0.2mol,根据CH3OH+8OH--6e-=CO+6H2O可知,电池放电时每消耗6.4gCH3OH转移1.2mol电子,故③正确;
答案为②③。
20.(1)A
(2)a
(3)C
(4) 679 862
(5)2C (s)+O2(g)=2CO(g) △H= -221.0 kJ·mol-1 或C(s)+ O2(g)=CO (g)△H= -110.5kJ·mol-1
【解析】(1)
A.生石灰和水反应放热,故选A;
B.浓硫酸溶于水放热,但是浓硫酸具有强腐蚀性,故不选B;
C.钠和水反应生成氢氧化钠和氢气,反应放热,但是氢氧化钠具有强腐蚀性,故不选C;
选A;
(2)
2H2 (g) + O2(g) = 2H2O(l) △H= -572 kJ/mol,反应放热,反应物的总能量大于生成物总能量,该反应的能量变化可用图中的a表示;
(3)
常温下红磷比白磷稳定,红磷的能量低于白磷,所以相同质量的白磷和氧气反应生成P4O10(s)放出的热量大于红磷,则Q1<Q2,选C;
(4)
拆开2molHCl分子中的化学键需要消耗862kJ的能量,则④的数值为862 kJ;根据盖斯定律,③的数值为(862-183)= 679kJ;
(5)
①C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
②CO(g)+O2(g)=CO2 (g) △H2= -283.0 kJ·mol-1
根据盖斯定律①-②得C(s)+ O2(g)=CO (g)△H= -110.5kJ·mol-1。
21.(1)析氢
(2)2H2O+O2+4e-=4OH-
【分析】生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,左边试管中是酸性溶液,发生析氢腐蚀,右边试管中是中性溶液发生吸氧腐蚀。
【详解】(1)U型管内红墨水左低右高,左边试管内气体的压强增大,右边试管内气体的气体压强减小,所以左边试管中是酸性溶液氯化铵(显酸性),发生析氢腐蚀,右边试管中是中性溶液食盐水,发生吸氧腐蚀,故a试管中铁发生的是析氢腐蚀,故答案为:析氢;
(2)b试管中是中性溶液食盐水,铁作负极,发生失电子的氧化反应,即Fe-2e-=Fe2+,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-。
22.(1)C2H2(g)+O2(g)=2CO2(g)+H2O(l) △H=-2bkJ mol-1
(2) CH4+10OH--8e-=CO+7H2O Fe+2H2OFe(OH)2+H2↑ 43.2
(3) H2+2OH--2e-=2H2O b 1、3 B(OH)+H+=H3BO3+H2O
【分析】由图可知,通入甲烷的电极发生还原反应为原电池的负极,通入氧气的电极为正极,则乙池和丙池为电解池,注意其中丙池中的铁电极为活泼电极,以此解题。
【详解】(1)ag乙炔燃烧放出热量bkJ,则1mol乙炔燃烧放出热量-2bkJ,故表示乙炔燃烧热的热化学方程式为:C2H2(g)+O2(g)=2CO2(g)+H2O(l) △H=-2bkJ mol-1;
(2)①通入甲烷的电极,甲烷失去电子发生氧化反应,故此电极为负极,电极反应式为:CH4+10OH--8e-=CO+7H2O;
②丙池中是铁做阳极的电解氯化钠溶液的反应,铁在阳极失去电子,水电离的氢离子离子在铂电极得到电子生成氢气,同时注意阳极生成的二价铁会和氢氧根离子反应生成氢氧化亚铁,总反应方程式为:Fe+2H2OFe(OH)2+H2↑;
③体积为2240mL(标况)的甲烷其物质的量为0.1mol,每个燃料电池消耗0.05mol甲烷,共失去电子0.4mol,则乙池中某电极上析出Ag也为0.4mol,其质量为43.2g;
(3)①由图可知,氢气在N电极失去电子,发生还原反应,则N电极为负极,电极反应为:H2+2OH--2e-=2H2O;
②通过①问分析可知,M为正极,通过图示可知,原料室中的钠离子向左移动,b极附近的氢离子向左移动,则a电极为阴极,b电极为阳极,则M应该与b电极连接;同时1、3为阳膜;
③在产品室中应该是原料室中的B(OH)向右进入产品室,和b极区进入产品室中的氢离子反应生成产品H3BO3,相应的离子反应为:B(OH)+H+=H3BO3+H2O。
答案第1页,共2页
答案第1页,共2页
一、单选题(共14题)
1.在党的领导下,新中国成立后,我国航天事业从无到有,举世瞩目。以下说法错误的是
A.1970年我国发射的第一颗人造地球卫星“东方红一号”采用银锌电池供电,锌做电池的负极
B.2003年“神舟五号”载人飞船遨游太空,飞船燃料偏二甲肼(CH3)2NNH2中C、N原子杂化方式相同
C.2007年“嫦娥一号”探月卫星任务之一是探测月球上3He含量及分布。3He与4He互为同素异形体
D.2021年“天问一号”探测器成功着陆火星,它搭载了新型纳米气凝胶做热控材料,气凝胶的分散剂是气体
2.如图所示装置中,电流表G指针发生偏转,同时Y极逐渐变粗,X极逐渐变细。下列判断正确的是
A.X是Zn,Y是Cu,Z为溶液
B.X是Cu,Y是Zn,Z为溶液
C.X是Zn,Y是Cu,Z为酒精溶液
D.X是Zn,Y是Cu,Z为溶液
3.为阿伏加德罗常数的值。下列说法正确的是
A.,完全反应转移的电子数为
B.用电解粗铜的方法精炼铜,当电路中通过的电子数为时,阳极应有转化为
C.与足量水完全反应,电子转移数为2
D.重水比水多个质子
4.深埋在潮湿土壤中的铁管道,在硫酸盐还原菌作用下,能被硫酸根腐蚀,其电化学腐蚀原理如图示,下列与此原理有关说法错误的是
A.正极为SO发生还原反应
B.输送暖气的管道因涂有沥青不易发生此类腐蚀
C.这种情况下,Fe腐蚀的最终产物为
D.管道上刷富锌油漆可以延缓管道的腐蚀
5.已知表示吸热反应,表示放热反应。反应()分两步进行:①A+B→X ();②X→C()。下列示意图中,能正确表示总反应过程中能量变化的是
A. B. C. D.
6.光电池在光照条件下可产生电压,如图所示装置可实现光能的充分利用。双极膜复合层间的H2O能解离为H+和OH-,且双极膜能实现H+和OH-的定向通过。下列说法正确的是
A.该装置的能量转化形式只有电能转化为化学能
B.再生池中的反应为2V2++2H2O =2V3++2OH-+H2↑
C.标准状况下,当阳极生成22.4LO2时,电路中转移电子数为4NA
D.光照过程中阳极区溶液中的n(OH-)变大
7.下列热化学方程式正确的是
A.2SO2+O22SO3 ΔH=-196.6 kJ·mol-1
B.C(g)+O2(g)=CO(g)ΔH=+393.5 kJ·mol-1
C.H2(g)+O2(g)=H2O(g) ΔH=-241.8 kJ
D.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
8.下列说法正确的是( )
A.葡萄糖的摩尔燃烧焓是,则
B.在一定条件下将和置于密闭容器中充分反应生成,放出热量,则反应的热化学方程式为
C.已知稀溶液中,,则稀氨水与稀盐酸反应生成水时放出的热量
D.已知和反应的中和热,则稀硫酸与氢氧化钡溶液反应生成水时
9.下列说法不正确的是
A.电解精炼铜的过程中,电解质溶液中铜离子浓度保持不变
B.电镀时,应把镀件置于电解池的阴极
C.为防止水闸铁门被腐蚀, 可让其与直流电源的负极相连
D.电化学防护中牺牲阳极的阴极保护法是利用了原电池原理
10.二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为: CO2(g)+3H2(g)=CH3OH(g)+H2O(g)。该反应一般认为通过如下步骤来实现:
①CO2(g)+H2(g)=CO(g)+H2O(g)
②CO(g)+2H2(g)=CH3OH(g)
其能量曲线如下图所示,下列有关说法错误的是
A.反应①为吸热反应,反应②为放热反应
B.决定该总反应速率的是反应①
C.CO是该总反应的催化剂
D.该总反应用于工业生产,能促进碳中和
11.如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如下图所示,关于该装置的下列说法正确的是
A.外电路的电流方向为X→外电路→Y
B.若两电极分别为Fe和碳棒,则X为碳棒,Y为Fe
C.电解质溶液中H+移向Y极
D.X极上发生的是还原反应,Y极上发生的是氧化反应
12.下列图示方法能完成相应实验的是
A B C D
配制一定物质的量浓度的NaOH溶液 实验室制取Cl2 验证铁的析氢腐蚀 验证氨气易溶于水
A.A B.B C.C D.D
13.如图所示。下列各装置能达到相应实验目的的是
A.图甲,中和热的测定 B.图乙,分离乙醇和水
C.图丙,在铁制品表面镀锌 D.图丁,除去二氧化碳中的氯化氢
14.双极膜能够在直流电场作用下将解离为和。以维生素C的钠盐(C6H7O6Na)为原料制各维生素C(,具有弱酸性和还原性)的装置如图。下列说法正确的是
A.a离子是,b离子是
B.此装置最终既可以得到维生素C,又可以得到NaOH
C.将X极区的替换为,可以提高维生素C的产率
D.极的电极反应式为
二、填空题(共8题)
15.减排是各个国家都在努力为之的事,和的处理是许多科学家都在着力研究的重点。有学者想以如图所示装置利用原电池原理将、转化为重要的化工原料。
(1)若A为,B为,C为,电池总反应方程式为,则正极的电极反应式为 。
(2)若A为,B为,C为,则负极的电极反应式为 ,电池的总反应方程式为 。
16.回答下列问题:
(1)一氧化碳催化加氢制甲醇,反应原理为: 。
①若已知CO、、的燃烧热分别为、、,则 。
②已知反应中相关的化学键键能数据如下:
化学键
436 413 343 465
且 ,试计算断开气体中的需提供的最低能量为 。
(2)燃料的热值是指单位质量某种燃料完全燃烧放出的热量,其常用单位为。已知下列物质的燃烧热(25℃、):
燃料 (辛烷)
燃烧热/() 285.8 283.0 890.3 5518
据上表数据填写:
①试写出表示辛烷燃烧热的热化学方程式 。
②的热值为 。
③上表所列燃料的热值最大的是 (填化学式)。
(3)中和热是反应热的一种。
①取溶液和盐酸进行实验,若实验测得的反应前后温度差平均值,中和后生成溶液的比热容(若近似认为溶液和盐酸的密度都是)。则生成时的反应热 (取小数点后一位,下同)。
②强酸与强碱的稀溶液发生中和反应生成时的反应热。若用一定浓度的稀硫酸与含的稀碱溶液完全反应,反应放出的热量为 。
17.某兴趣小组利用如图所示装置进行实验。
(1)断开K2、闭合K1,U形管内除电极上有气泡外,还可观察到的现象是 ;阳极电极反应式为 。当电路中转移0.001mol电子时,右侧注射器最多可以收集到气体 mL(折算为标准状况)。
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,断开K1、闭合K2,此时装置内化学能转化为电能。实现能量转化的化学方程式为 ;
(3)假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,U形管内的溶液理论上 (填“能”或“不能”)恢复原样。
18.某原电池构造如图所示。其电池的总反应是:Cu(s) + 2Ag+ (aq) = Cu2+ (aq) + 2Ag(s)。
请回答以下问题:
(1)若盐桥为琼脂-KOH组成,其作用是 。OH-离子移向 (填“A”或“B”)中的溶液。Cu为原电池的 极,其电极反应式是 。A中的电解质溶液在该电池工作一段时间后会出现 的现象。
(2)把盐桥改为铁棒后,电流计的指针 (填“会”、“不会”)发生偏转,A装置名称 (填“原电池”或“电解池”),铜棒的电极名称为 (填“正极”、“负极”、“阴极”或“阳极”)(提示:当两个原电池串联时,电极材料的金属活动性相差较大的为原电池,电极材料的金属活动性相差较小的为电解池)。
(3)把盐桥改为铜棒后,电流计的指针 (填“会”、“不会”)发生偏转,左边烧杯中的硝酸铜浓度 (填“增大”、“减小”或“不变”)
(4)把盐桥改为银棒后,电流计的指针 (填“会”、“不会”)发生偏转,理由是 。
19.能源是现代文明的原动力,通过化学方法可使能量按人们所期望的形式转化,从而开辟新能源和提高能量转化率。请回答下列问题:
Ⅰ.化学电源在生产、生活中有着广泛的应用。
(1)根据构成原电池本质判断,如下反应可以设计成原电池的是 (填字母)。
A.NaOH+HCl=NaCl+H2O B.2CO+O22CO2
C. 2H2O2H2↑+O2↑ D.Cu+2AgNO3=2Ag+Cu(NO3)2
(2)为了探究化学反应中的能量变化,某同学设计了如下两个实验(如图)。有关实验现象,下列说法正确的是 (填字母)。
A.图甲和图乙的气泡均产生于锌棒表面温
B.图乙中产生气体的速率比图甲快
C.图甲中温度计的示数高于图乙的示数
D.图甲和图乙中温度计的示数相等,且均高于室温
Ⅱ.CH3OH燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成。其中负极反应式为CH3OH+8OH--6e-=CO+6H2O。则下列说法正确的是 (填序号)。
①电池放电时通入空气的电极为负极
②电池放电时,电解质溶液的碱性逐渐减弱
③电池放电时每消耗6.4gCH3OH转移1.2mol电子
20.化学反应过程中,不仅有物质的变化,同时还伴随能量的变化。
(1)“即热饭盒”给人们生活带来方便,它可利用下面 (填字母序号)反应释放的热量加热食物。
A.生石灰和水 B.浓硫酸和水 C.钠和水
(2)2H2 (g) + O2(g) = 2H2O(l) △H= -572 kJ/mol,该反应的能量变化可用图中的 (填a或b)表示。
(3)已知常温下红磷比白磷稳定,在下列反应中:
①4P(红磷,s)+5O2(g)=P4O10(s) △H=﹣Q1kJ mol﹣1
②P4(白磷,s)+5O2(g)=P4O10(s) △H=﹣Q2kJ mol﹣1
若Q1、Q2均大于零,则Q1和Q2的关系为___________(填字母序号)。
A.Q1>Q2 B.Q1=Q2
C.Q1<Q2 D.无法确定
(4)已知拆开2molHCl分子中的化学键需要消耗862kJ的能量,则③、④的数值为:③ kJ;④ kJ。
(5)已知298 K时:
C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
CO(g)+O2(g)=CO2 (g) △H2= -283.0 kJ·mol-1
写出C与O2反应生成CO的热化学方程式: 。
21.钢铁很容易生锈腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。因此,该小组同学又进行了钢铁腐蚀探究,希望能找到防止钢铁腐蚀的好办法。如图,U形管内为红墨水,a、b试管内分别盛有氯化铵溶液(显酸性)和食盐水,各加入生铁块,放置一段时间均被腐蚀。红墨水柱两边液面变为:左低、右高。
(1)请猜测a试管中铁发生的是 (填“析氢”或“吸氧”)腐蚀。
(2)b管中生铁中碳上发生的电极反应式 。
22.回答下列问题
(1)已知完全燃烧ag乙炔(C2H2)气体时生成1molCO2和H2O(l),同时放出热量bkJ,则表示乙炔燃烧热的热化学方程式: 。
(2)某课外科学兴趣小组的同学用如图所示装置研究有关电化学的问题。图中是两个串联的甲烷燃料电池做电源对乙池丙池进行电解实验(各溶液溶质均足量),当闭合该装置的电键时,观察到电流表的指针发生了偏转。
①A电极上发生的电极反应式为: 。
②电解过程中丙池中发生的总反应方程式为: 。
③当两个燃料电池共消耗甲烷2240mL(标况),乙池中某极上析出Ag的质量为 g。
(3)如图所示是一种可实现氢气循环利用的新型电池的放电工作原理。
若以此新型电池为电源,用惰性电极电解制备硼酸[H3BO3或B(OH)3],其工作原理如图所示(阳膜和阴膜分别只允许阳离子和阴离子通过)。
①新型电池放电时,负极电极反应式为: 。
②两池工作时,电池的电极M应与电解池的 (填a或b)极相连接;1、2、3膜为阳膜的是: 。
③产品室中发生的离子反应为: 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.银锌电池中锌做负极,氧化银做正极,故A正确;
B.偏二甲肼(CH3)2NNH2中,两个碳原子均为杂化,两个氮原子均为杂化,所以C、N原子杂化方式相同,故B正确;
C.3He与4He质子数相同,中子数不同,互为同位素,故C错误;
D.新型纳米气凝胶是将分散质分散到气态分散剂中,故D正确;
答案为C。
2.D
【详解】该原电池中,Y极逐渐变粗,X极逐渐变细,说明X作负极,Y作正极,X的活泼性必须大于Y的活泼性,所以排除B选项;酒精是非电解质,不能形成原电池,排除选项C;Y极逐渐变粗,说明Y极有金属析出,A选项析出氢气不是金属,D选项析出金属铜,所以D符合题意。
故选D。
3.A
【详解】A.HCHO中C元素的化合价为0价,反应后生成CO2,C元素的化合价为+4价,5molHCHO完全反应转移20mol电子,MnO中Mn元素化合价为+7价,反应后生成Mn2+,Mn元素的化合价为+2价,4mol MnO完全反应转移20mol电子,故完全反应转移的电子数为,A正确;
B.用电解粗铜的方法精炼铜,阳极除铜放电外,较铜活泼的金属锌等也会放电成为金属阳离子,故当电路中通过的电子数为时,阳极应有小于32gCu转化为,B错误;
C.过氧化钠与水反应生成氢氧化钠和氧气,则78g过氧化钠与足量水完全反应,电子转移数为×1×NAmol-1=NA,C错误;
D.1mol重水和1mol水的质子数相同,中子数不同,D错误;
故选A。
4.C
【详解】A.正极是硫酸根离子得到电子,发生还原反应,生成硫氢根离子,故A正确;
B.钢铁制造的暖气管道外常涂有一层沥青,使钢铁与空气和水隔离,不能形成电化学腐蚀,故B正确;
C.因存在还原菌所以铁最终是亚铁,而不是Fe2O3 xH2O,故C错误;
D.管道上刷富锌油漆,锌比铁活泼,所以腐蚀锌保护铁,所以管道上刷富锌油漆可以延缓管道的腐蚀,故D正确;
故选C。
5.A
【分析】根据题意可知,A+B→X是放热反应,A+B的总能量高于X的总能量,X→C为吸热反应,X的总能量低于C的总能量,且总反应为吸热反应,则A+B的总能量低于C的总能量。
【详解】A.由图可知,第一步反应为放热反应,第二步为吸热反应,总反应为吸热反应,故A符合题意;
B.图示的第一步反应为吸热反应,第二步为放热反应,故B不符合题意;
C.图示的第一步反应为放热反应,第二步为放热反应,故C不符合题意;
D.图示的第一步反应为吸热反应,第二步为吸热反应,故D不符合题意;
答案选A。
6.C
【分析】由图中电子的移动方向可知,右侧为电解池的阳极,左侧为电解池的阴极,阳极反应式为4OH--4e-=2H2O+O2↑,阴极反应式为 2V3++2e-=2V2+,双极性膜可将水解离为H+和OH-,H+进入阴极,OH-进入阳极,放电后的溶液进入再生池中在催化剂条件下发生反应放出氢气,反应方程式为2V2++2H+2V3++H2↑,据此分析解答。
【详解】A.由图可知,该装置将光能转化电能,然后分解水,则能量转化形式:光能→电能→化学能,A错误;
B.根据以上分析可知,酸性条件下再生池中发生的反应为2V2++2H+2V3++H2↑,B错误;
C.标准状况下,当阳极生成22.4L即=1molO2时,则电路中转移电子数为1mol×4×NAmol-1=4NA,C正确;
D.双极性膜可将水解离为H+和OH-,且双相膜能实现H+和OH-的定向通过,再生反应的方程式为2V2++2H+2V3++H2↑,再结合分析,则阳极转移电子的物质的量和再生池消耗H+的物质的量相等,所以光照过程中阳极区溶液中的n(OH-)和c(H+)基本不变,D错误;
故答案为:C。
7.D
【详解】A.在热化学方程式中应该注明物质的聚集状态,故A错误;
B.碳不完全燃烧是放热反应,放热反应的ΔH是负值,故B错误;
C.ΔH的单位是kJ·mol-1,故C错误;
D.物质的聚集状态、ΔH均正确,故D正确;
此题选D。
8.A
【详解】A.葡萄糖的摩尔燃烧焓是,表示1mol葡萄糖完全燃烧生成CO2和液态H2O放热2800kJ,故葡萄糖完全燃烧生成CO2和液态H2O放热2800kJ,热化学方程式 正确,A正确;
B.和置于密闭容器中充分反应生成,放出热量,该反应是可逆反应,而热化学方程式是指完全反应时的热效应,故 ,故B错误;
C.则稀氮水电离要吸热,与稀盐酸反应生成水时放出小于的热量,故C错误;
D.稀硫酸与氢氧化钡溶液反应时会生成硫酸钡沉淀,有沉淀生成热产生,故则稀硫酸与氢氧化钡溶液反应生成水时,故D错误。
答案选A。
9.A
【详解】A.电解精炼铜时,粗铜作阳极,精铜作阴极,CuSO4溶液作电解质溶液。阳极粗铜中含有少量的Fe、Zn,会优于Cu先失去电子,而阴极一直为Cu2++2e-=Cu,因此电解质溶液中Cu2+的浓度会有所减小,A项错误;
B.电镀时,在镀件上,镀层金属离子得到电子发生还原反应,为电解池的阴极,B项正确;
C.外接电源作电解池的阴极,金属不能失去电子被氧化,而被保护,C项正确;
D.电化学防护中牺牲阳极的阴极保护法,需要外接活泼金属,活泼金属失去电子被氧化而被腐蚀,利用的是原电池原理,D项正确;
答案选A。
10.C
【详解】A.由图可知反应物能量低于生成物的总能量,所以反应①为吸热反应;反应物能量高于生成物的总能量,所以反应②为放热反应,故A正确;
B.根据上述分析可知:反应①为吸热反应,反应②为放热反应,所以反应①比反应②慢,所以决定该总反应速率的是反应①,故B正确;
C.根据反应 ①CO2(g)+H2(g)=CO(g)+H2O(g)和②CO(g)+2H2(g)=CH3OH(g)可知,①+②得CO2(g)+3H2(g)=CH3OH(g)+H2O(g),所以CO是中间产物,故C错误;
D.二氧化碳加氢制甲醇的总反应可表示为: CO2(g)+3H2(g)=CH3OH(g)+H2O(g), 该总反应用于工业生产,有利于减少温室效应,促进碳中和,故D正确;
故答案:C。
11.C
【分析】根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,故X为负极,Y为正极。
【详解】A.根据图片知该装置是原电池,外电路中电子从X电极流向Y电极,电流的流向与此相反,即Y→外电路→X,选项A错误;
B.原电池中较活泼的金属作负极,较不活泼的金属或导电的非金属作正极,若两电极分别为Fe和碳棒,则Y为碳棒,X为Fe,选项B错误;
C.原电池工作时,阳离子向正极移动,阴离子向负极移动,选项C正确;
D.X是负极,负极上发生氧化反应;Y是正极,正极上发生还原反应,选项D错误;
答案选C。
12.D
【详解】A.容量瓶不能作为溶解、稀释、反应和长期贮存溶液的仪器,A不合题意;
B.实验室用MnO2和浓盐酸反应制备Cl2时需要加热,B不合题意;
C.钢铁在NaCl溶液等中性溶液中发生吸氧腐蚀,不会发生析氢腐蚀,C不合题意;
D.氨气的喷泉实验可以验证氨气易溶于水,D符合题意;
故答案为:D。
13.C
【详解】A.缺少环形玻璃搅拌棒,且两烧杯之间有空隙,碎纸条没有填充满,故A不符合题意;
B.乙醇与水是互溶的,不分层,故B不符合题意;
C.在铁制品表面镀锌,锌片为阳极,铁制品为阴极,电解液为含锌离子的盐溶液,故C符合题意;
D.氢氧化钠溶液同时吸收二氧化碳,应用饱和碳酸氢钠溶液除去氯化氢,故D不符合题意。
综上所述,答案为C。
14.B
【分析】由装置图知,X极区产生氧气,为阳极,在X电极,水失去电子生成氧气,同时生成氢离子,钠离子通过阳离子交换膜进入右侧区域与a离子即氢氧根离子构成NaOH,则b离子为氢离子,与结合为,Y极区产生氢气,为阴极,水得到电子生成氢气,同时生成氢氧根离子。
【详解】A.a离子是,b离子是,A错误;
B.由分析知,此装置最终既可以得到维生素C,又可以得到NaOH,B正确;
C.若将X极区的Na2SO4替换为C6H7O6Na,一方面生成的导电能力弱,另一方面维生素C易被生成的氧气氧化,不能提高维生素C的产率,C错误;
D.X极为阳极,发生氧化反应,电极反应式为,D错误;
故选B。
15.
【分析】根据原电池工作原理进行分析解答。燃料电池的燃料做负极发生氧化反应,氧气做正极发生还原反应,注意电解质溶液对电极反应式的影响。
【详解】(1)在负极失去电子,酸性条件下该电池负极的电极反应式为;在正极得到电子,一分子得到6个电子,转化为,故可得正极的电极反应式为,故答案:;
(2)SO2在负极失去电子,可得负极的电极反应式为。在正极获得电子,可得正极的电极反应式为,使正、负极得失电子总数相等并将正、负极电极反应式相加,可得电池的总反应方程式为,故答案:;。
16.(1)
(2)
(3)
【详解】(1)①由、、的燃烧热分别为、、,可写出三个对应的热化学方程式,分别为:
(反应Ⅰ)
(反应Ⅱ)
(反应Ⅲ)
根据盖斯定律,由反应Ⅰ+反应Ⅱ-反应Ⅲ可得。
②反应物中化学键的键能之和一生成物中的化学键键能之和得:,解得。
(2)①由于辛烷的燃烧热为,所以表示辛烷燃烧热的热化学方程式为: 。
②由于的燃烧热为,则其热值为。
③、、的热值分别为、、。所以热值最大的是氢气。
(3)①由,反应中生成0.025mol水,则。
②强酸与强碱的稀溶液发生中和反应生成时的反应热,即消耗40g放出热量57.3kJ,所以当有反应时放出的热量为。
17. 右边电极附近有白色沉淀生成 2Cl- - 2e-=Cl2↑ 11.2 H2+Cl2=2HCl 能
【详解】(1)断开K2、闭合K1,为电解池装置,氯离子在阳极(左边电极)失电子生成氯气,电极反应式为2Cl- - 2e-=Cl2↑;右边电极附近水电离的氢离子放电产生氢气,同时产生氢氧根离子和镁离子结合成白色的氢氧化镁沉淀;根据H2~2e-可知当电路中转移0.001mol电子时,则可生成0.0005molH2,在标况下的体积为11.2mL,故答案为:右边电极附近有白色沉淀生成;2Cl--2e-=Cl2↑;11.2;
(2)断开K2、闭合K1一段时间,待注射器中充有一定量的气体后,分别为氯气和氢气,断开K1、闭合K2,可形成原电池反应,总方程式为H2+Cl2=2HCl,故答案为:H2+Cl2=2HCl;
(3)结合(1)可知,电解时产生等物质的量的氢气和氯气,假设实验装置不漏气,当(2)中注射器内气体全部参加反应后,又可完全反应生成HCl,可使溶液恢复原状,故答案为:能。
18. 使两个烧杯中的溶液连成通路 A 负 Cu-2e-=== Cu2+ 出现蓝色沉淀 会 电解池 阳极 会 不变 不 两池都没有可自发进行的氧化还原反应
【详解】(1)盐桥的作用是使两个烧杯中的溶液连成通路,保持溶液的电中性;在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。铜比银活泼,所以铜是负极,银是正极,OH-离子移向负极移动,即向A电极移动;B是正极,溶液中的铜离子得到电子,电极反应式是Cu-2e-=== Cu2+;A中铜失去电子,生成铜离子,所以溶液显蓝色;
(2)如果把盐桥改为铁棒后,由于铜和铁的活泼性差别小于银与铁的,所以A装置就是电解池,B是原电池,其中铁是负极,银是正极,所以铜棒是阳极;
(3)如果把盐桥改为铜棒,则A装置是电解池,B装置是原电池。此时A装置相当于是粗铜的提纯,所以溶液中铜离子的浓度不变;
(4)由于银不能和硝酸铜反应,即此时两池都没有可自发进行的氧化还原反应,所以不能再构成原电池。
19. BD BC ②③
【详解】I.(1)原电池是将化学能转变为电能的装置,构成原电池条件之一是自发发生氧化还原反应,
A.酸碱中和反应为非氧化还原反应,故A不符合题意;
B.可设计成燃料电池,故B符合题意;
C.该反应虽然为氧化还原反应,但是该反应不能自发进行,不能设计成原电池,故C不符合题意;
D.该反应为自发的氧化还原反应,可设计成原电池,故D符合题意;
答案为BD;
(2)A.图甲锌和稀硫酸反应生成硫酸锌和氢气,离子方程式为Zn+2H+=Zn2++H2↑,气泡在锌棒上产生,而图乙中装置构成原电池,Zn易失电子作负极,Cu作正极,正极上H+得电子生成氢气,产生气泡的是铜棒,故A错误;
B.构成原电池可加快化学反应速率,则图乙中产生气体的速率比图甲快,故B正确;
C.图甲中化学能转化为热能,图乙中化学能转化为热能和电能,图甲中温度计的示数高于图乙的示数,故C正确,
D.根据选项C的分析,故D错误;
答案为BC;
Ⅱ.甲醇燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成,
①电池放电时,氧气得电子,则通入空气的电极为正极,故①错误;
②电池放电时,生成的CO2与KOH溶液反应生成碳酸钾,电解质溶液的碱性逐渐减弱,故②正确;
③6.4g甲醇的物质的量为0.2mol,根据CH3OH+8OH--6e-=CO+6H2O可知,电池放电时每消耗6.4gCH3OH转移1.2mol电子,故③正确;
答案为②③。
20.(1)A
(2)a
(3)C
(4) 679 862
(5)2C (s)+O2(g)=2CO(g) △H= -221.0 kJ·mol-1 或C(s)+ O2(g)=CO (g)△H= -110.5kJ·mol-1
【解析】(1)
A.生石灰和水反应放热,故选A;
B.浓硫酸溶于水放热,但是浓硫酸具有强腐蚀性,故不选B;
C.钠和水反应生成氢氧化钠和氢气,反应放热,但是氢氧化钠具有强腐蚀性,故不选C;
选A;
(2)
2H2 (g) + O2(g) = 2H2O(l) △H= -572 kJ/mol,反应放热,反应物的总能量大于生成物总能量,该反应的能量变化可用图中的a表示;
(3)
常温下红磷比白磷稳定,红磷的能量低于白磷,所以相同质量的白磷和氧气反应生成P4O10(s)放出的热量大于红磷,则Q1<Q2,选C;
(4)
拆开2molHCl分子中的化学键需要消耗862kJ的能量,则④的数值为862 kJ;根据盖斯定律,③的数值为(862-183)= 679kJ;
(5)
①C(s)+O2(g)=CO2(g) △H1= -393.5 kJ·mol-1
②CO(g)+O2(g)=CO2 (g) △H2= -283.0 kJ·mol-1
根据盖斯定律①-②得C(s)+ O2(g)=CO (g)△H= -110.5kJ·mol-1。
21.(1)析氢
(2)2H2O+O2+4e-=4OH-
【分析】生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;a、b试管内分别盛有氯化铵(显酸性)溶液和食盐水,左边试管中是酸性溶液,发生析氢腐蚀,右边试管中是中性溶液发生吸氧腐蚀。
【详解】(1)U型管内红墨水左低右高,左边试管内气体的压强增大,右边试管内气体的气体压强减小,所以左边试管中是酸性溶液氯化铵(显酸性),发生析氢腐蚀,右边试管中是中性溶液食盐水,发生吸氧腐蚀,故a试管中铁发生的是析氢腐蚀,故答案为:析氢;
(2)b试管中是中性溶液食盐水,铁作负极,发生失电子的氧化反应,即Fe-2e-=Fe2+,碳作正极,正极上氧气得电子发生还原反应,电极反应式为:2H2O+O2+4e-=4OH-,故答案为:2H2O+O2+4e-=4OH-。
22.(1)C2H2(g)+O2(g)=2CO2(g)+H2O(l) △H=-2bkJ mol-1
(2) CH4+10OH--8e-=CO+7H2O Fe+2H2OFe(OH)2+H2↑ 43.2
(3) H2+2OH--2e-=2H2O b 1、3 B(OH)+H+=H3BO3+H2O
【分析】由图可知,通入甲烷的电极发生还原反应为原电池的负极,通入氧气的电极为正极,则乙池和丙池为电解池,注意其中丙池中的铁电极为活泼电极,以此解题。
【详解】(1)ag乙炔燃烧放出热量bkJ,则1mol乙炔燃烧放出热量-2bkJ,故表示乙炔燃烧热的热化学方程式为:C2H2(g)+O2(g)=2CO2(g)+H2O(l) △H=-2bkJ mol-1;
(2)①通入甲烷的电极,甲烷失去电子发生氧化反应,故此电极为负极,电极反应式为:CH4+10OH--8e-=CO+7H2O;
②丙池中是铁做阳极的电解氯化钠溶液的反应,铁在阳极失去电子,水电离的氢离子离子在铂电极得到电子生成氢气,同时注意阳极生成的二价铁会和氢氧根离子反应生成氢氧化亚铁,总反应方程式为:Fe+2H2OFe(OH)2+H2↑;
③体积为2240mL(标况)的甲烷其物质的量为0.1mol,每个燃料电池消耗0.05mol甲烷,共失去电子0.4mol,则乙池中某电极上析出Ag也为0.4mol,其质量为43.2g;
(3)①由图可知,氢气在N电极失去电子,发生还原反应,则N电极为负极,电极反应为:H2+2OH--2e-=2H2O;
②通过①问分析可知,M为正极,通过图示可知,原料室中的钠离子向左移动,b极附近的氢离子向左移动,则a电极为阴极,b电极为阳极,则M应该与b电极连接;同时1、3为阳膜;
③在产品室中应该是原料室中的B(OH)向右进入产品室,和b极区进入产品室中的氢离子反应生成产品H3BO3,相应的离子反应为:B(OH)+H+=H3BO3+H2O。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
