2.4 元素 第2课时 课件(共18张PPT) 2023-2024学年鲁教版化学九年级上册
文档属性
| 名称 | 2.4 元素 第2课时 课件(共18张PPT) 2023-2024学年鲁教版化学九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 17:46:16 | ||
图片预览






文档简介
(共18张PPT)
第四节 元素
第2课时
科学史话·门捷列夫与元素周期表
1661年英国化学家波义耳发表了题为“怀疑派的化学家”著作,第一次确立了化学元素的概念。自此之后,自然界的元素就一个接一个地相继被发现,到了1868年,人们一共掌握了63种化学元素。这些各不相同,纷纭复杂的元素,给人们带来了探索自然的勇气和力量。这六十多种元素各不相同,化学家们面对着这五光十色的元素,感到迷惑不解,好像迷失在茂密的丛林之中。
门捷列夫决心要揭开这个秘密,他花了差不多二十年的功夫终于在1868年发现了元素周期律,把化学元素从杂乱无章的迷官中分门别类地理出了一个头绪。
已经发现的元素固然可以按照周期进行排列,可是那些尚未发现的元素怎么办?
门捷列夫根据科学毫不踌躇地在周期表中留出许多空位,并以十分肯定的口气宣布:属于这些空位的元素将来一定会被发现,不仅如此,他还根据元素周期律,推算了这些空位中元素的原子量,预言了尚未发现的元素的性质。
在一篇介绍未知元素的论文中大胆地预言了三种未知元素的性质,这三种元素门捷列夫当时称之为亚硼、亚铝、亚硅,它们的性质分别类似于硼、铝、硅。
1875年法国科学家布瓦博德朗发现了一种新元素“镓”。它是门捷列夫曾预言的元素亚铝。门捷列夫果断地写信给布瓦博德朗,说明镓的比重应是水的六倍。之后,巴黎寄来了一封回信,说门捷列夫错了镓的比重不是6,而是4.7。而门捷列夫坚信自己是正确的,立即写信说:“镓就是我预言的亚铝,它的原子量是接近68,比重应该是5.9上下不是4.7,请再试验一下,也许您那块物质还不纯……”布瓦博德朗是位求实的科学家,他决心再做次试验,他十分小心地提纯了所得到的物质,重新测定了镓的比重,发现镓的比重正如门捷列夫所预言的那样,果然是5.96。
1.初步认识元素周期表,并能说出元素周期表的意义。
2.能运用元素周期表查询元素的有关信息,并能说出元素周期表中单元格包含的内容。
1.元素周期表
世界上已知的元素多达100多种,而且这
些元素的性质各异,为了更好地认识它们
的特点和用途,必须进行有序的分类。俄
国化学家门捷列夫发现把元素按原子量大
小排列,元素的性质会呈周期性的变化,
从而提出了元素周期表。
一、元素周期表简介
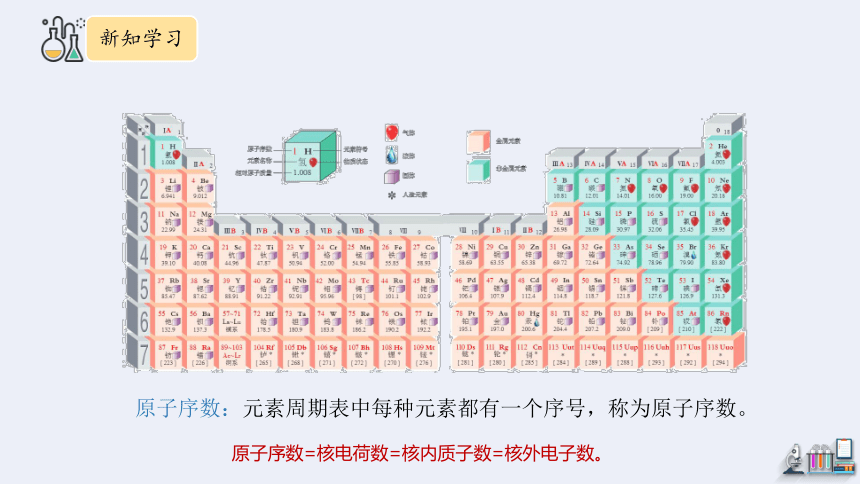
原子序数:元素周期表中每种元素都有一个序号,称为原子序数。
原子序数=核电荷数=核内质子数=核外电子数。
2.元素周期表中的结构
(1)周期:每一个横行叫做一个周期
(2)族:每一个纵行叫做一个族(其中8,9,10三个纵行共同组成一个族)
同一周期的元素具有相同的电子层数。
同一族最外层电子数相同。
共18个纵行,16个族
共7个周期
A代表主族,B代表副族
ⅠA~ⅦA 7个主族 (第1、2、13、14、15、16、17列)
ⅠB~ⅦB 7个副族 (第3、4、5、6、7、11、12列)
Ⅷ 1个第八族 (第8、9、10列)
0 族 1零族 (第18列)
第一周期
第二周期
第三周期
8 O
氧
16.00
原子序数
元素符号
元素名称
相对原子质量
(3)单元格
3.元素周期表的意义
1.发现新的元素和化合物;
2.为预测新元素的结构和性质提供了依据;
3.为我们深入学习和掌握物质性质及其变化规律提供了理论指导。
——学习和研究化学的重要工具
在元素周期表金属与非金属交界处寻找半导体材料
在元素周期表右上角寻找农药元素
1.在元素周期表中,非金属元素主要位于( )
A.左上方区域 B.右上方区域
C.左下方区域 D.右下方区域
2.发现元素周期律并编制出现在使用的元素周期表的科学家是( )
A.拉瓦锡 B.侯德榜 C.门捷列夫 D.道尔顿
B
C
3.元素周期表是化学学习和科学研究的重要工具,下列对于元素周期表的使用方法不正确的是( )
A.查阅某种元素的相对原子质量
B.确定元素的种类
C.利用元素周期表中的元素任意组合成我们希望得到的新物质
D.利用原子序数,在元素周期表中查找该元素的元素符号及元素名称
C
4.“元素周期表是学习和研究化学的重要工具”,A、B、C为周期表中1-18号元素,在周期表中的位置如图所示,已知A原子的核电荷数为8,三种元素原子的核电荷数之和为34。下列说法错误的是( )
A.A为氧元素
B.A、C处于同一周期
C.B、C的最外层电子数相同
D.C的原子序数为17
B
5.一种有趣的钟表式元素周期表如图所示,关于时刻所对应的元素说法中正确的是( )
A.12:00对应的元素为金属元素
B.10:00对应的元素易形成化合物
C.9:00对应元素的离子符号为F+
D.该钟表的整点时间与原子结构中的原子序数相等。
A
元素周期表
编制依据:原子的结构与性质
结构:横行(周期),纵行(族),单元格
第四节 元素
第2课时
科学史话·门捷列夫与元素周期表
1661年英国化学家波义耳发表了题为“怀疑派的化学家”著作,第一次确立了化学元素的概念。自此之后,自然界的元素就一个接一个地相继被发现,到了1868年,人们一共掌握了63种化学元素。这些各不相同,纷纭复杂的元素,给人们带来了探索自然的勇气和力量。这六十多种元素各不相同,化学家们面对着这五光十色的元素,感到迷惑不解,好像迷失在茂密的丛林之中。
门捷列夫决心要揭开这个秘密,他花了差不多二十年的功夫终于在1868年发现了元素周期律,把化学元素从杂乱无章的迷官中分门别类地理出了一个头绪。
已经发现的元素固然可以按照周期进行排列,可是那些尚未发现的元素怎么办?
门捷列夫根据科学毫不踌躇地在周期表中留出许多空位,并以十分肯定的口气宣布:属于这些空位的元素将来一定会被发现,不仅如此,他还根据元素周期律,推算了这些空位中元素的原子量,预言了尚未发现的元素的性质。
在一篇介绍未知元素的论文中大胆地预言了三种未知元素的性质,这三种元素门捷列夫当时称之为亚硼、亚铝、亚硅,它们的性质分别类似于硼、铝、硅。
1875年法国科学家布瓦博德朗发现了一种新元素“镓”。它是门捷列夫曾预言的元素亚铝。门捷列夫果断地写信给布瓦博德朗,说明镓的比重应是水的六倍。之后,巴黎寄来了一封回信,说门捷列夫错了镓的比重不是6,而是4.7。而门捷列夫坚信自己是正确的,立即写信说:“镓就是我预言的亚铝,它的原子量是接近68,比重应该是5.9上下不是4.7,请再试验一下,也许您那块物质还不纯……”布瓦博德朗是位求实的科学家,他决心再做次试验,他十分小心地提纯了所得到的物质,重新测定了镓的比重,发现镓的比重正如门捷列夫所预言的那样,果然是5.96。
1.初步认识元素周期表,并能说出元素周期表的意义。
2.能运用元素周期表查询元素的有关信息,并能说出元素周期表中单元格包含的内容。
1.元素周期表
世界上已知的元素多达100多种,而且这
些元素的性质各异,为了更好地认识它们
的特点和用途,必须进行有序的分类。俄
国化学家门捷列夫发现把元素按原子量大
小排列,元素的性质会呈周期性的变化,
从而提出了元素周期表。
一、元素周期表简介
原子序数:元素周期表中每种元素都有一个序号,称为原子序数。
原子序数=核电荷数=核内质子数=核外电子数。
2.元素周期表中的结构
(1)周期:每一个横行叫做一个周期
(2)族:每一个纵行叫做一个族(其中8,9,10三个纵行共同组成一个族)
同一周期的元素具有相同的电子层数。
同一族最外层电子数相同。
共18个纵行,16个族
共7个周期
A代表主族,B代表副族
ⅠA~ⅦA 7个主族 (第1、2、13、14、15、16、17列)
ⅠB~ⅦB 7个副族 (第3、4、5、6、7、11、12列)
Ⅷ 1个第八族 (第8、9、10列)
0 族 1零族 (第18列)
第一周期
第二周期
第三周期
8 O
氧
16.00
原子序数
元素符号
元素名称
相对原子质量
(3)单元格
3.元素周期表的意义
1.发现新的元素和化合物;
2.为预测新元素的结构和性质提供了依据;
3.为我们深入学习和掌握物质性质及其变化规律提供了理论指导。
——学习和研究化学的重要工具
在元素周期表金属与非金属交界处寻找半导体材料
在元素周期表右上角寻找农药元素
1.在元素周期表中,非金属元素主要位于( )
A.左上方区域 B.右上方区域
C.左下方区域 D.右下方区域
2.发现元素周期律并编制出现在使用的元素周期表的科学家是( )
A.拉瓦锡 B.侯德榜 C.门捷列夫 D.道尔顿
B
C
3.元素周期表是化学学习和科学研究的重要工具,下列对于元素周期表的使用方法不正确的是( )
A.查阅某种元素的相对原子质量
B.确定元素的种类
C.利用元素周期表中的元素任意组合成我们希望得到的新物质
D.利用原子序数,在元素周期表中查找该元素的元素符号及元素名称
C
4.“元素周期表是学习和研究化学的重要工具”,A、B、C为周期表中1-18号元素,在周期表中的位置如图所示,已知A原子的核电荷数为8,三种元素原子的核电荷数之和为34。下列说法错误的是( )
A.A为氧元素
B.A、C处于同一周期
C.B、C的最外层电子数相同
D.C的原子序数为17
B
5.一种有趣的钟表式元素周期表如图所示,关于时刻所对应的元素说法中正确的是( )
A.12:00对应的元素为金属元素
B.10:00对应的元素易形成化合物
C.9:00对应元素的离子符号为F+
D.该钟表的整点时间与原子结构中的原子序数相等。
A
元素周期表
编制依据:原子的结构与性质
结构:横行(周期),纵行(族),单元格
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
