第四单元 我们周围的空气 复习 课件(共26张PPT) 2023-2024学年鲁教版化学九年级上册
文档属性
| 名称 | 第四单元 我们周围的空气 复习 课件(共26张PPT) 2023-2024学年鲁教版化学九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 400.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 20:04:44 | ||
图片预览






文档简介
(共26张PPT)
第四单元复习
1.能概述空气的成分、用途、污染和防治;
2.能概述测定氧气含量的实验原理、装置、现象、结论及误差产生的原因;
3.能概述氧气的物理性质、化学性质;
4.能描述碳、蜡烛、铁丝与氧气反应的现象并写出文字表达式;
5.能概述实验室制取氧气的原理、药品、装置、操作步骤、检验、验满方法;
6.能区分氧化物和氧化反应;
7.能识别催化剂和催化作用。
空气的成分
【知识点1】
氮气占 ,氧气占 ,氩气占 ,二氧化碳占 ,其他气体占 。
①空气中的成分指的是气体的体积分数,不是质量分数。
【注意】
78%
21%
0.934%
0.034%
0.002%
空气中氧气成分的测定
【知识点2】
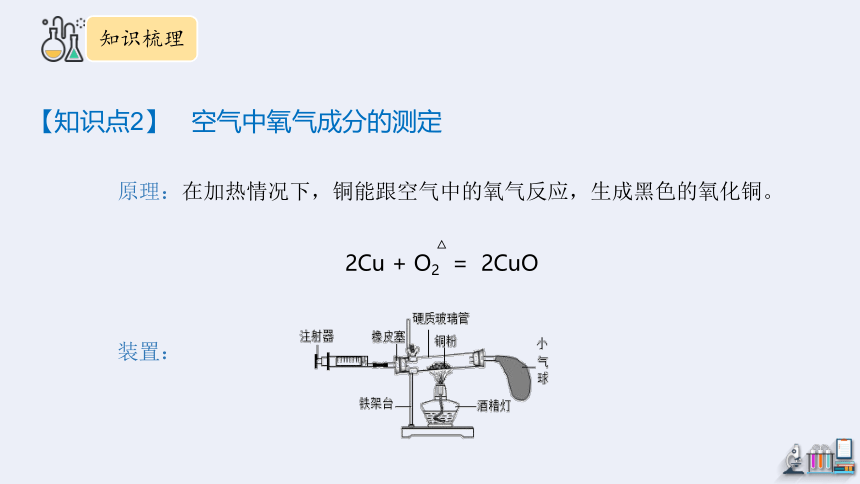
原理:在加热情况下,铜能跟空气中的氧气反应,生成黑色的氧化铜。
2Cu + O2 = 2CuO
△
装置:
现象:
(1)红色铜逐渐变成黑色。
(2)停止加热冷却至室温,注射器内的体积大约减少6 mL。
反应前注射器内气体的体积 反应后注射器内气体的体积 消耗掉的氧气体积
30 mL 24 mL 6 mL
结论:
(1)铜加热生成氧化铜,说明空气中含有氧气。
(2)注射器内空气的体积减少了1/5,说明空气中的氧气约占空气总体积的1/5。
①装置气密性良好;
②反应物必须过量;
③所选的反应物只能与空气中的氧气反应;
④反应后生成物必须为固体。
【注意事项】
准确测定空气中氧气含量的应注意:
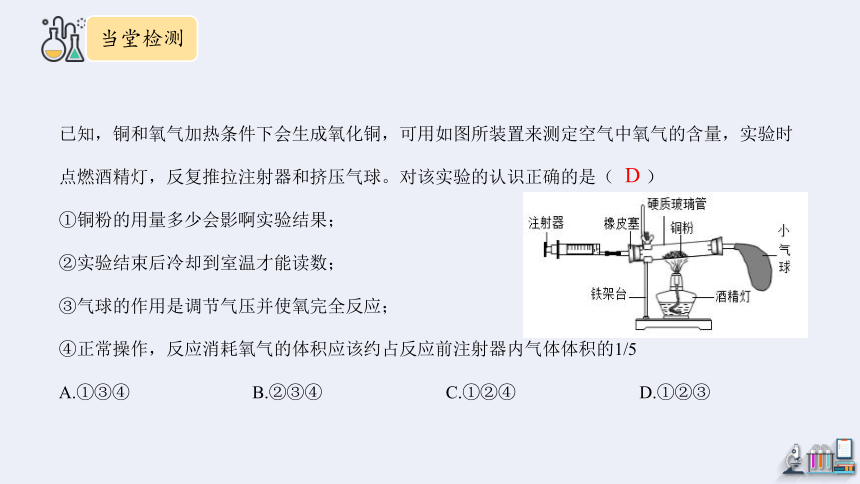
已知,铜和氧气加热条件下会生成氧化铜,可用如图所装置来测定空气中氧气的含量,实验时点燃酒精灯,反复推拉注射器和挤压气球。对该实验的认识正确的是( )
①铜粉的用量多少会影啊实验结果;
②实验结束后冷却到室温才能读数;
③气球的作用是调节气压并使氧完全反应;
④正常操作,反应消耗氧气的体积应该约占反应前注射器内气体体积的1/5
A.①③④ B.②③④ C.①②④ D.①②③
D
分离空气中各种成分的原理是:分是利用氮气、氧气等的_____不同
空气
加压
蒸发
降温
液态空气
适当升温或减压
氮气先挥发
剩下为液态氧气
沸点
空气是一种重要的资源
【知识点3】
氮气
氩气
氧气
制造肥料、用作保护气、冷藏血液
保护气、电光源
供给呼吸、支持燃烧、钢铁冶炼、金属焊接
1.薯片等易碎食品宜采用充气袋包装,下列气体中最不适宜充入的是( )
A.O2 B.N2 C.CO2 D.空气
A
2.下列有关氮气的用途中,错误的是( )
A.制氮肥 B.直接做燃料
C.做灯泡填充气 D.做瓜果保护气
B
空气的污染及防治
【知识点4】
空气污染物主要是指 、 、 、 、 等。
防治空气污染可以从两方面考虑:
①减少污染物的产生。 如:改进生产工艺、改善燃料结构等。
②有效转化有害物质。 如:在汽车上安装尾气净化装置等。
SO2
NO2
CO
O3
可吸入颗粒物
1.大气中PM2.5(指大气中直径不超过2.5×10-6 m的颗粒物)的增多会导致雾霾天气,对人体健康和环境质量的影响较大。下列措施中不利于PM2.5治理的是( )
A.禁止焚烧秸秆 B.开发新能源汽车
C.发展燃煤发电 D.加强建筑工地扬尘控制
C
2.下列物质中,不是“空气污染指数”项目的是( )
A.二氧化硫 B.二氧化碳 C.二氧化氮 D.可吸入颗粒物
B
氧气的性质
【知识点5】
物理性质:通常状况下,是 色 味, 溶于水,密度比空气略 ,液态或固态时颜色变为 色。
化学性质:氧气是一种化学性质 的气体,在点燃的条件下,能跟木炭、石蜡、铁等物质反应,同时放出热量。
无
无
不易
大
淡蓝
活泼
氧气与几种常见物质的反应比较表
物质 反应现象 化学方程式 注意事项
木炭 ①燃烧发出耀眼白光 ②生成的气体能使 变浑浊 ③放出热量 碳 + 氧气 → 二氧化碳(充分燃烧) 夹木炭的坩埚钳应由上而下慢慢伸入瓶中
铁丝 ①剧烈燃烧,火星四射 ②生成黑色固体 ③放出大量的热 铁 + 氧气 → 四氧化三铁 ①把铁丝绕成螺旋状,裹一根火柴,引燃铁丝
②集气瓶底部先放一些细沙或水
蜡烛 ① 剧烈燃烧,放热 ②烧杯壁上产生白雾 ③生成气体能使 变浑浊 石蜡 + 氧气 → 二氧化碳 + 水 放有蜡烛的燃烧匙应由上而下慢慢伸入瓶中
点燃
点燃
点燃
澄清石灰水
澄清石灰水
1.下列实验现象的描述中,正确的是( )
A.木炭在氧气中燃烧,生成黑色物质
B.硫在氧气中燃烧,发出淡蓝色火焰
C.红磷在空气中燃烧产生大量的白雾
D.铁丝在氧气中燃烧,火星四射,生成黑色固体
D
氧气的实验室制法
【知识点6】
反应原理
过氧化氢 水 +氧气
二氧化锰
H2O2 H2O + O2
加热
高锰酸钾
KMnO4
锰酸钾
K2MnO4
O2
氧气
+
+
二氧化锰
MnO2
氯酸钾 氯化钾 + 氧气
二氧化锰
KClO3 KCl O2
加热
发生装置 固+液不加热型装置 固体加热型装置
反应类型 分解反应
收集方法 排水法或向上排空气法
验满方法 用带火星的木条放在瓶口,若木条复燃,证明氧气已经收集满
【用过氧化氢溶液制取注意事项】:
①可通过控制过氧化氢溶液的滴加速度来调节反应速度
②分液漏斗内液体滴加完要及时关闭活塞
③排水法收集的气体纯净,但不干燥;排空气法收集的气体不纯净,但比较干燥,应根据实际需求选择收集装置。
1.在进行“氧气的实验室制取与性质实验时,某同学制得的氧气不纯。你认为可能的原因是( )
A.用排水法收集O2时,集气瓶装满水
B.用向上排空气法收集O2时,导管伸入到集气瓶的底部
C.用排水法收集O2时,导管冒出气泡,立即收集
D.用排水法收集O2,收集满后,在水下盖上玻璃片
C
2.下列关于制取氧气的说法正确的是( )
A.使用过氧化氢、氯酸钾、高锰酸钾制氧气的共同原因是因为三种物质当中都含有氧气
B.在不加入二氧化锰的情况下,过氧化氢、氯酸钾都不能产生氧气
C.使用过氧化氢分解的方法制氧气更加节约能源,也几乎没有污染
D.工业上采用分离液态空气制取氧气的方法发生了分解反应
C
氧化物与氧化反应
【知识点7】
氧化反应:氧气是一种化学性质比较活泼的气体,许多物质都可以与氧气发生化学反应,这类反应属于氧化反应。
氧化物:由两种元素组成的化合物,如果其中一种元素是氧,这样的化合物叫做氧化物。如:水(H2O)、二氧化碳(CO2)、四氧化三铁(Fe3O4)等。
1.下列变化,不属于缓慢氧化的是( )
A.铁生锈 B.食物腐烂 C.酿酒 D.蜡烛燃烧
D
2.在生物体内发生着许多化学反应,其中有“葡萄糖+氧气→二氧化碳+水”。关于该反应的下列说法,正确的是( )
①是化合反应; ②是分解反应;
③是氧化反应; ④既不是分解反应也不是化合反应。
A.③和④ B.①和② C.①和③ D.②和④
A
催化剂:这种能改变化学反应的速率,而本身的质量和化学性质在反应前后没有发生变化的物质。
催化剂在反应中的作用:__________
催化剂
【知识点8】
一变、二不变
改变反应速率
本身质量、化学性质反应前后不变
【注意】催化剂在化学反应前后的物理性质可能变也可能不变
催化作用
太空舱中一般利用铁酸镍(NiFe2O4)将航天员呼出的二氧化碳转化为氧气,而铁酸镍的质量和化学性质都不变。则铁酸镍在该过程中是( )
A.反应物 B.生成物 C.催化剂 D.消毒剂
C
我们周围的空气
空气
氧气的含量的测定
氧气
催化剂
成分:氮气、氧气等
性质
制取
氧化物和氧化反应
污染和防治
原理
装置
操作步骤
检验和验满
物理性质
化学性质
与碳反应
与铁丝反应
与蜡烛反应
第四单元复习
1.能概述空气的成分、用途、污染和防治;
2.能概述测定氧气含量的实验原理、装置、现象、结论及误差产生的原因;
3.能概述氧气的物理性质、化学性质;
4.能描述碳、蜡烛、铁丝与氧气反应的现象并写出文字表达式;
5.能概述实验室制取氧气的原理、药品、装置、操作步骤、检验、验满方法;
6.能区分氧化物和氧化反应;
7.能识别催化剂和催化作用。
空气的成分
【知识点1】
氮气占 ,氧气占 ,氩气占 ,二氧化碳占 ,其他气体占 。
①空气中的成分指的是气体的体积分数,不是质量分数。
【注意】
78%
21%
0.934%
0.034%
0.002%
空气中氧气成分的测定
【知识点2】
原理:在加热情况下,铜能跟空气中的氧气反应,生成黑色的氧化铜。
2Cu + O2 = 2CuO
△
装置:
现象:
(1)红色铜逐渐变成黑色。
(2)停止加热冷却至室温,注射器内的体积大约减少6 mL。
反应前注射器内气体的体积 反应后注射器内气体的体积 消耗掉的氧气体积
30 mL 24 mL 6 mL
结论:
(1)铜加热生成氧化铜,说明空气中含有氧气。
(2)注射器内空气的体积减少了1/5,说明空气中的氧气约占空气总体积的1/5。
①装置气密性良好;
②反应物必须过量;
③所选的反应物只能与空气中的氧气反应;
④反应后生成物必须为固体。
【注意事项】
准确测定空气中氧气含量的应注意:
已知,铜和氧气加热条件下会生成氧化铜,可用如图所装置来测定空气中氧气的含量,实验时点燃酒精灯,反复推拉注射器和挤压气球。对该实验的认识正确的是( )
①铜粉的用量多少会影啊实验结果;
②实验结束后冷却到室温才能读数;
③气球的作用是调节气压并使氧完全反应;
④正常操作,反应消耗氧气的体积应该约占反应前注射器内气体体积的1/5
A.①③④ B.②③④ C.①②④ D.①②③
D
分离空气中各种成分的原理是:分是利用氮气、氧气等的_____不同
空气
加压
蒸发
降温
液态空气
适当升温或减压
氮气先挥发
剩下为液态氧气
沸点
空气是一种重要的资源
【知识点3】
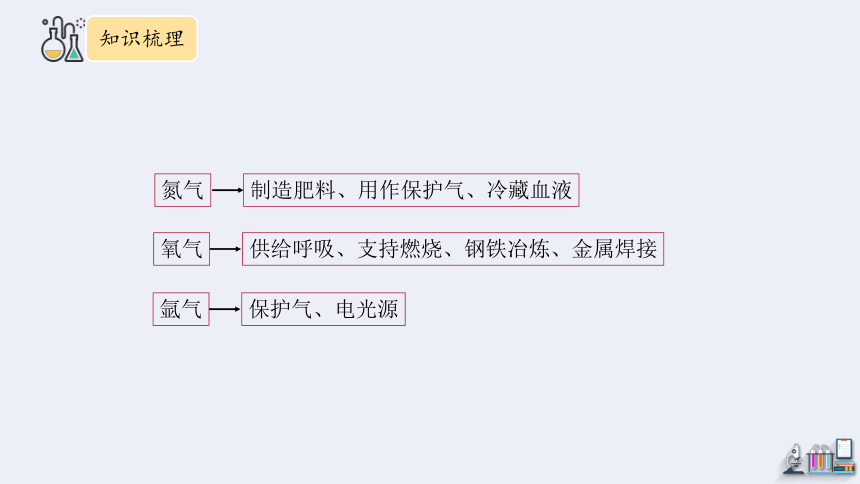
氮气
氩气
氧气
制造肥料、用作保护气、冷藏血液
保护气、电光源
供给呼吸、支持燃烧、钢铁冶炼、金属焊接
1.薯片等易碎食品宜采用充气袋包装,下列气体中最不适宜充入的是( )
A.O2 B.N2 C.CO2 D.空气
A
2.下列有关氮气的用途中,错误的是( )
A.制氮肥 B.直接做燃料
C.做灯泡填充气 D.做瓜果保护气
B
空气的污染及防治
【知识点4】
空气污染物主要是指 、 、 、 、 等。
防治空气污染可以从两方面考虑:
①减少污染物的产生。 如:改进生产工艺、改善燃料结构等。
②有效转化有害物质。 如:在汽车上安装尾气净化装置等。
SO2
NO2
CO
O3
可吸入颗粒物
1.大气中PM2.5(指大气中直径不超过2.5×10-6 m的颗粒物)的增多会导致雾霾天气,对人体健康和环境质量的影响较大。下列措施中不利于PM2.5治理的是( )
A.禁止焚烧秸秆 B.开发新能源汽车
C.发展燃煤发电 D.加强建筑工地扬尘控制
C
2.下列物质中,不是“空气污染指数”项目的是( )
A.二氧化硫 B.二氧化碳 C.二氧化氮 D.可吸入颗粒物
B
氧气的性质
【知识点5】
物理性质:通常状况下,是 色 味, 溶于水,密度比空气略 ,液态或固态时颜色变为 色。
化学性质:氧气是一种化学性质 的气体,在点燃的条件下,能跟木炭、石蜡、铁等物质反应,同时放出热量。
无
无
不易
大
淡蓝
活泼
氧气与几种常见物质的反应比较表
物质 反应现象 化学方程式 注意事项
木炭 ①燃烧发出耀眼白光 ②生成的气体能使 变浑浊 ③放出热量 碳 + 氧气 → 二氧化碳(充分燃烧) 夹木炭的坩埚钳应由上而下慢慢伸入瓶中
铁丝 ①剧烈燃烧,火星四射 ②生成黑色固体 ③放出大量的热 铁 + 氧气 → 四氧化三铁 ①把铁丝绕成螺旋状,裹一根火柴,引燃铁丝
②集气瓶底部先放一些细沙或水
蜡烛 ① 剧烈燃烧,放热 ②烧杯壁上产生白雾 ③生成气体能使 变浑浊 石蜡 + 氧气 → 二氧化碳 + 水 放有蜡烛的燃烧匙应由上而下慢慢伸入瓶中
点燃
点燃
点燃
澄清石灰水
澄清石灰水
1.下列实验现象的描述中,正确的是( )
A.木炭在氧气中燃烧,生成黑色物质
B.硫在氧气中燃烧,发出淡蓝色火焰
C.红磷在空气中燃烧产生大量的白雾
D.铁丝在氧气中燃烧,火星四射,生成黑色固体
D
氧气的实验室制法
【知识点6】
反应原理
过氧化氢 水 +氧气
二氧化锰
H2O2 H2O + O2
加热
高锰酸钾
KMnO4
锰酸钾
K2MnO4
O2
氧气
+
+
二氧化锰
MnO2
氯酸钾 氯化钾 + 氧气
二氧化锰
KClO3 KCl O2
加热
发生装置 固+液不加热型装置 固体加热型装置
反应类型 分解反应
收集方法 排水法或向上排空气法
验满方法 用带火星的木条放在瓶口,若木条复燃,证明氧气已经收集满
【用过氧化氢溶液制取注意事项】:
①可通过控制过氧化氢溶液的滴加速度来调节反应速度
②分液漏斗内液体滴加完要及时关闭活塞
③排水法收集的气体纯净,但不干燥;排空气法收集的气体不纯净,但比较干燥,应根据实际需求选择收集装置。
1.在进行“氧气的实验室制取与性质实验时,某同学制得的氧气不纯。你认为可能的原因是( )
A.用排水法收集O2时,集气瓶装满水
B.用向上排空气法收集O2时,导管伸入到集气瓶的底部
C.用排水法收集O2时,导管冒出气泡,立即收集
D.用排水法收集O2,收集满后,在水下盖上玻璃片
C
2.下列关于制取氧气的说法正确的是( )
A.使用过氧化氢、氯酸钾、高锰酸钾制氧气的共同原因是因为三种物质当中都含有氧气
B.在不加入二氧化锰的情况下,过氧化氢、氯酸钾都不能产生氧气
C.使用过氧化氢分解的方法制氧气更加节约能源,也几乎没有污染
D.工业上采用分离液态空气制取氧气的方法发生了分解反应
C
氧化物与氧化反应
【知识点7】
氧化反应:氧气是一种化学性质比较活泼的气体,许多物质都可以与氧气发生化学反应,这类反应属于氧化反应。
氧化物:由两种元素组成的化合物,如果其中一种元素是氧,这样的化合物叫做氧化物。如:水(H2O)、二氧化碳(CO2)、四氧化三铁(Fe3O4)等。
1.下列变化,不属于缓慢氧化的是( )
A.铁生锈 B.食物腐烂 C.酿酒 D.蜡烛燃烧
D
2.在生物体内发生着许多化学反应,其中有“葡萄糖+氧气→二氧化碳+水”。关于该反应的下列说法,正确的是( )
①是化合反应; ②是分解反应;
③是氧化反应; ④既不是分解反应也不是化合反应。
A.③和④ B.①和② C.①和③ D.②和④
A
催化剂:这种能改变化学反应的速率,而本身的质量和化学性质在反应前后没有发生变化的物质。
催化剂在反应中的作用:__________
催化剂
【知识点8】
一变、二不变
改变反应速率
本身质量、化学性质反应前后不变
【注意】催化剂在化学反应前后的物理性质可能变也可能不变
催化作用
太空舱中一般利用铁酸镍(NiFe2O4)将航天员呼出的二氧化碳转化为氧气,而铁酸镍的质量和化学性质都不变。则铁酸镍在该过程中是( )
A.反应物 B.生成物 C.催化剂 D.消毒剂
C
我们周围的空气
空气
氧气的含量的测定
氧气
催化剂
成分:氮气、氧气等
性质
制取
氧化物和氧化反应
污染和防治
原理
装置
操作步骤
检验和验满
物理性质
化学性质
与碳反应
与铁丝反应
与蜡烛反应
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
