9.2 金属的化学性质 第2课时 课件 (共15张PPT 内嵌视频) 2023-2024学年鲁教版化学九年级下册
文档属性
| 名称 | 9.2 金属的化学性质 第2课时 课件 (共15张PPT 内嵌视频) 2023-2024学年鲁教版化学九年级下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 17.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-06 12:07:32 | ||
图片预览




文档简介
(共15张PPT)
第二节 金属的化学性质
第2课时
西汉淮南王刘安的《淮南万毕术》记载“曾青得铁则化为铜”,意思为向胆矾中加入铁可以得到金属铜,曾青就是胆矾,即五水硫酸铜。
铁与铜的盐溶液之间发生了怎么样的反应呢?
1.初步认识常见金属盐溶液的置换反应,能用置换反应解释一些与日常生活有关的化学问题。
2.能用金属活动性顺序对置换反应进行判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。
3.初步学会如何比较判断两种金属的活动性。
1.金属与盐溶液的反应
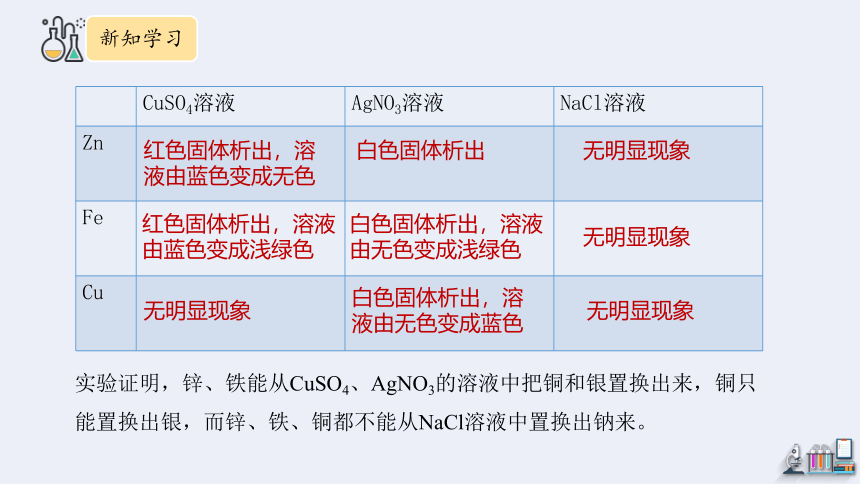
将锌片、铁丝、铜丝三种金属分别放入硫酸铜、硝酸银、氯化钠溶液中,观察并记录实验现象。
CuSO4溶液 AgNO3溶液 NaCl溶液
Zn
Fe
Cu
红色固体析出,溶液由蓝色变成无色
红色固体析出,溶液由蓝色变成浅绿色
无明显现象
白色固体析出
白色固体析出,溶液由无色变成浅绿色
白色固体析出,溶液由无色变成蓝色
无明显现象
无明显现象
无明显现象
实验证明,锌、铁能从CuSO4、AgNO3的溶液中把铜和银置换出来,铜只能置换出银,而锌、铁、铜都不能从NaCl溶液中置换出钠来。
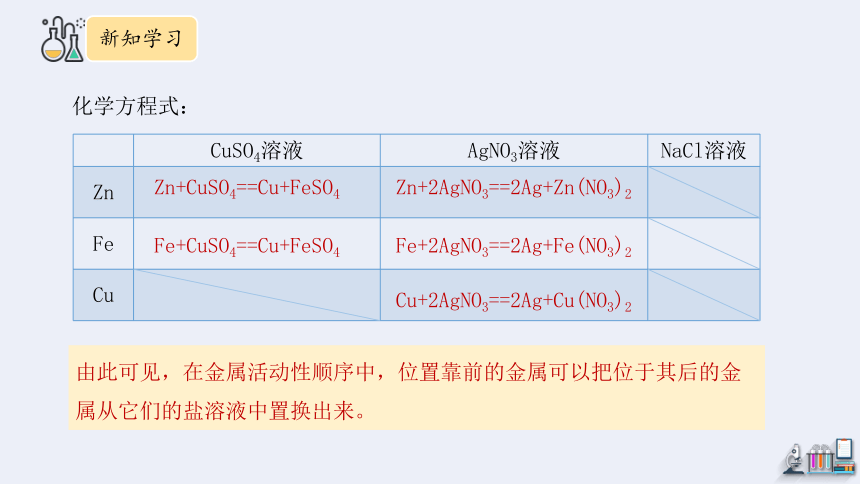
化学方程式:
CuSO4溶液 AgNO3溶液 NaCl溶液
Zn
Fe
Cu
Zn+CuSO4==Cu+FeSO4
Fe+CuSO4==Cu+FeSO4
Zn+2AgNO3==2Ag+Zn(NO3)2
Fe+2AgNO3==2Ag+Fe(NO3)2
Cu+2AgNO3==2Ag+Cu(NO3)2
由此可见,在金属活动性顺序中,位置靠前的金属可以把位于其后的金属从它们的盐溶液中置换出来。
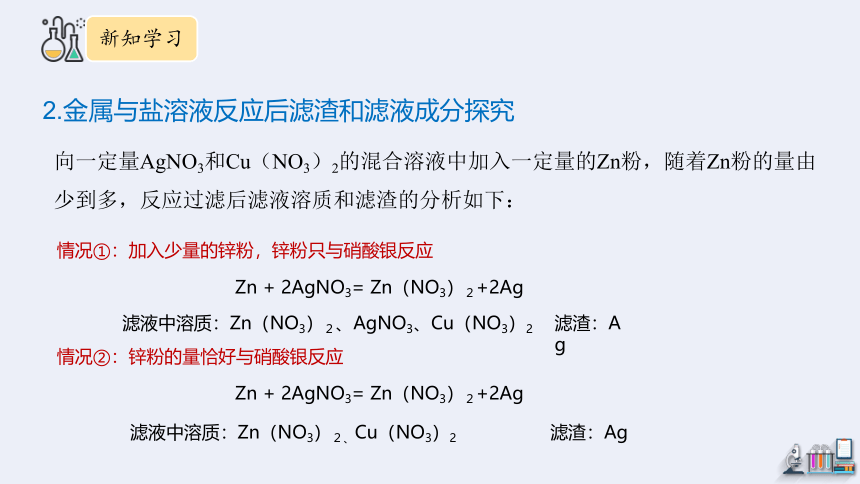
向一定量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,随着Zn粉的量由少到多,反应过滤后滤液溶质和滤渣的分析如下:
2.金属与盐溶液反应后滤渣和滤液成分探究
情况①:加入少量的锌粉,锌粉只与硝酸银反应
Zn + 2AgNO3= Zn(NO3)2+2Ag
滤液中溶质:Zn(NO3)2、AgNO3、Cu(NO3)2
滤渣:Ag
情况②:锌粉的量恰好与硝酸银反应
Zn + 2AgNO3= Zn(NO3)2+2Ag
滤液中溶质:Zn(NO3)2、Cu(NO3)2
滤渣:Ag
情况③:锌粉的量恰好与硝酸银反应之后多出的一部分与硝酸铜反应
Zn + 2AgNO3= Zn(NO3)2+2Ag
Zn + Cu(NO3)2= Zn(NO3)2+Cu
滤液中溶质:Zn(NO3)2、Cu(NO3)2
滤渣:Ag、Cu
情况④:锌粉的量恰好与硝酸银反应之后多出的一部分恰好与硝酸铜完全反应
Zn + 2AgNO3= Zn(NO3)2+2Ag
Zn + Cu(NO3)2= Zn(NO3)2+Cu
滤液中溶质:Zn(NO3)2
情况⑤:锌粉与硝酸银、硝酸铜完全反应后仍过量
Zn + 2AgNO3= Zn(NO3)2+2Ag
Zn + Cu(NO3)2= Zn(NO3)2+Cu
滤渣:Ag、Cu
滤液中溶质:Zn(NO3)2
滤渣:Ag、Cu、Zn
3.验证金属的活动性强弱
设计实验方案验证Zn、Cu、Ag三种金属的活动性顺序。
设计原理:金属与酸或盐溶液发生置换反应。
设计方案1:“两金夹一盐”(盐中金属元素为活动性位于中间的金属)
药品:
操作:
判断:
锌片、银片、CuSO4溶液。
将锌片、银片分别放入CuSO4溶液中。
根据是否有紫红色固体被置换出来确定金属活动性顺序。
设计方案2:“两盐夹一金”(被夹的金属为活动性位于中间的金属)
药品:
操作:
判断:
设计方案3:“两金一盐夹一酸”。
药品:锌片、铜丝、AgNO3溶液、稀盐酸。
操作与判断:将取锌片、铜丝分别放入稀盐酸中,验证Zn和Cu的活动性顺序;然后再将铜丝放入AgNO3溶液中,验证Cu和Ag的活动性顺序。
Zn(NO3)2溶液、AgNO3溶液、铜丝。
将铜丝分别放入Zn(NO3)2溶液、AgNO3溶液中。
根据是否有金属被置换出来确定金属活动性顺序。
4.金属活动性顺序的应用
金属活动性顺序在工农业生产和科学研究中有着广泛的应用。我国古代即有湿法冶金技术,利用金属与盐溶液发生置换反应的原理来冶炼金属,并一直沿用至今。
▲古代湿法炼铜术
1.在氯化镁和氯化铜的混合溶液中加入过量的铁粉,充分反应后过滤,在滤纸上的物质是( )
A.铜 B.铜和铁
C.铜、铁、镁 D.铁
B
2.已知金属X能从CuSO4溶液中置换出铜,但不能从金属Y的硫酸盐溶液中置换出Y,则X、Cu、Y的金属活动性由强到弱的顺序为( )
A.X、Y、Cu B.Cu、X、Y
C.Y、X、Cu D.Y、Cu、X
C
3.下列比较金属活动性强弱的实验设计、现象和结论均正确的是( )
C
实验设计 现象 金属活动性
A 将铝丝放入硫酸铜溶液中 无现象 Cu>Al
B 分别将相同形状的镁条和铝条点燃放入盛氧气的集气瓶中 镁条燃烧的更剧烈 Mg>Al
C 分别将锌粉与铁丝放入相同浓度的稀盐酸中 锌粉产生气泡速率比铁丝快 Zn>Fe
D 分别将铁粉与铝丝放入相同浓度的稀盐酸中 铁粉表面产生气泡比铝丝快 Fe>Al
(1)金属活动性顺序表中的X是 元素
(2)把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过了一会儿,观察到的现象有
,该反应的化学方程式 。
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图所示,图中b点溶液中含有的溶质 。
4.金属在日常生活中有着广泛的用途,常见金属的活动性顺序如图所示:
Hg
铝丝表面有红色物质析出,溶液由蓝色变为无色
2Al + 3CuSO4==Al2(SO4)3 + 3Cu
Cu(NO3)2 、 Zn(NO3)2
X
金属活动性顺序的应用
活泼金属可把不活泼金属从它的盐溶液中置换出来
金属与盐溶液反应
第二节 金属的化学性质
第2课时
西汉淮南王刘安的《淮南万毕术》记载“曾青得铁则化为铜”,意思为向胆矾中加入铁可以得到金属铜,曾青就是胆矾,即五水硫酸铜。
铁与铜的盐溶液之间发生了怎么样的反应呢?
1.初步认识常见金属盐溶液的置换反应,能用置换反应解释一些与日常生活有关的化学问题。
2.能用金属活动性顺序对置换反应进行判断,并能利用金属活动性顺序解释一些与日常生活有关的化学问题。
3.初步学会如何比较判断两种金属的活动性。
1.金属与盐溶液的反应
将锌片、铁丝、铜丝三种金属分别放入硫酸铜、硝酸银、氯化钠溶液中,观察并记录实验现象。
CuSO4溶液 AgNO3溶液 NaCl溶液
Zn
Fe
Cu
红色固体析出,溶液由蓝色变成无色
红色固体析出,溶液由蓝色变成浅绿色
无明显现象
白色固体析出
白色固体析出,溶液由无色变成浅绿色
白色固体析出,溶液由无色变成蓝色
无明显现象
无明显现象
无明显现象
实验证明,锌、铁能从CuSO4、AgNO3的溶液中把铜和银置换出来,铜只能置换出银,而锌、铁、铜都不能从NaCl溶液中置换出钠来。
化学方程式:
CuSO4溶液 AgNO3溶液 NaCl溶液
Zn
Fe
Cu
Zn+CuSO4==Cu+FeSO4
Fe+CuSO4==Cu+FeSO4
Zn+2AgNO3==2Ag+Zn(NO3)2
Fe+2AgNO3==2Ag+Fe(NO3)2
Cu+2AgNO3==2Ag+Cu(NO3)2
由此可见,在金属活动性顺序中,位置靠前的金属可以把位于其后的金属从它们的盐溶液中置换出来。
向一定量AgNO3和Cu(NO3)2的混合溶液中加入一定量的Zn粉,随着Zn粉的量由少到多,反应过滤后滤液溶质和滤渣的分析如下:
2.金属与盐溶液反应后滤渣和滤液成分探究
情况①:加入少量的锌粉,锌粉只与硝酸银反应
Zn + 2AgNO3= Zn(NO3)2+2Ag
滤液中溶质:Zn(NO3)2、AgNO3、Cu(NO3)2
滤渣:Ag
情况②:锌粉的量恰好与硝酸银反应
Zn + 2AgNO3= Zn(NO3)2+2Ag
滤液中溶质:Zn(NO3)2、Cu(NO3)2
滤渣:Ag
情况③:锌粉的量恰好与硝酸银反应之后多出的一部分与硝酸铜反应
Zn + 2AgNO3= Zn(NO3)2+2Ag
Zn + Cu(NO3)2= Zn(NO3)2+Cu
滤液中溶质:Zn(NO3)2、Cu(NO3)2
滤渣:Ag、Cu
情况④:锌粉的量恰好与硝酸银反应之后多出的一部分恰好与硝酸铜完全反应
Zn + 2AgNO3= Zn(NO3)2+2Ag
Zn + Cu(NO3)2= Zn(NO3)2+Cu
滤液中溶质:Zn(NO3)2
情况⑤:锌粉与硝酸银、硝酸铜完全反应后仍过量
Zn + 2AgNO3= Zn(NO3)2+2Ag
Zn + Cu(NO3)2= Zn(NO3)2+Cu
滤渣:Ag、Cu
滤液中溶质:Zn(NO3)2
滤渣:Ag、Cu、Zn
3.验证金属的活动性强弱
设计实验方案验证Zn、Cu、Ag三种金属的活动性顺序。
设计原理:金属与酸或盐溶液发生置换反应。
设计方案1:“两金夹一盐”(盐中金属元素为活动性位于中间的金属)
药品:
操作:
判断:
锌片、银片、CuSO4溶液。
将锌片、银片分别放入CuSO4溶液中。
根据是否有紫红色固体被置换出来确定金属活动性顺序。
设计方案2:“两盐夹一金”(被夹的金属为活动性位于中间的金属)
药品:
操作:
判断:
设计方案3:“两金一盐夹一酸”。
药品:锌片、铜丝、AgNO3溶液、稀盐酸。
操作与判断:将取锌片、铜丝分别放入稀盐酸中,验证Zn和Cu的活动性顺序;然后再将铜丝放入AgNO3溶液中,验证Cu和Ag的活动性顺序。
Zn(NO3)2溶液、AgNO3溶液、铜丝。
将铜丝分别放入Zn(NO3)2溶液、AgNO3溶液中。
根据是否有金属被置换出来确定金属活动性顺序。
4.金属活动性顺序的应用
金属活动性顺序在工农业生产和科学研究中有着广泛的应用。我国古代即有湿法冶金技术,利用金属与盐溶液发生置换反应的原理来冶炼金属,并一直沿用至今。
▲古代湿法炼铜术
1.在氯化镁和氯化铜的混合溶液中加入过量的铁粉,充分反应后过滤,在滤纸上的物质是( )
A.铜 B.铜和铁
C.铜、铁、镁 D.铁
B
2.已知金属X能从CuSO4溶液中置换出铜,但不能从金属Y的硫酸盐溶液中置换出Y,则X、Cu、Y的金属活动性由强到弱的顺序为( )
A.X、Y、Cu B.Cu、X、Y
C.Y、X、Cu D.Y、Cu、X
C
3.下列比较金属活动性强弱的实验设计、现象和结论均正确的是( )
C
实验设计 现象 金属活动性
A 将铝丝放入硫酸铜溶液中 无现象 Cu>Al
B 分别将相同形状的镁条和铝条点燃放入盛氧气的集气瓶中 镁条燃烧的更剧烈 Mg>Al
C 分别将锌粉与铁丝放入相同浓度的稀盐酸中 锌粉产生气泡速率比铁丝快 Zn>Fe
D 分别将铁粉与铝丝放入相同浓度的稀盐酸中 铁粉表面产生气泡比铝丝快 Fe>Al
(1)金属活动性顺序表中的X是 元素
(2)把一根用砂纸打磨过的铝丝浸入硫酸铜溶液中,过了一会儿,观察到的现象有
,该反应的化学方程式 。
(3)向一定质量AgNO3和Cu(NO3)2的混合溶液中加入过量的Zn粉,溶液质量随反应时间的变化情况如图所示,图中b点溶液中含有的溶质 。
4.金属在日常生活中有着广泛的用途,常见金属的活动性顺序如图所示:
Hg
铝丝表面有红色物质析出,溶液由蓝色变为无色
2Al + 3CuSO4==Al2(SO4)3 + 3Cu
Cu(NO3)2 、 Zn(NO3)2
X
金属活动性顺序的应用
活泼金属可把不活泼金属从它的盐溶液中置换出来
金属与盐溶液反应
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
