第八单元 海水中的化学 复习课件(共37张PPT) 2023-2024学年鲁教版化学九年级下册
文档属性
| 名称 | 第八单元 海水中的化学 复习课件(共37张PPT) 2023-2024学年鲁教版化学九年级下册 |
|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 00:00:00 | ||
图片预览











文档简介
(共37张PPT)
第八单元复习
海水中的化学
1.能列举海洋化学资源,并认识海洋化学资源的重要性。
2.能理解溶解度的含义,并能用溶解度曲线解释海水晒盐等现象。
3.能概述氨碱法制碱的过程和原理。
4.能说出碳酸钠和碳酸氢钠的性质和用途。
5.能概述除去粗盐中不溶性杂质和可溶性杂质的方法。
6.能从微观角度认识复分解反应的本质。
7.能根据复分解反应的条件判断酸、碱、盐能否反应,离子能否共存。
8.能列举盐的化学性质,并能书写化学方程式。
第一节 海洋化学资源
水96.5%
溶解的盐 3.5%
Cl- 55.06%
Na+ 30.61%
SO42- 7.67%
Mg2+ 3.69%
Ca2+ 1.15%
K+ 1.10%
其他 0.72%
海水中含量最多的元素是______
海水中含量最多的金属元素是______
O
Na
【知识点1】海水中的化学资源
海水或卤水
石灰乳
氢氧化镁
盐酸
氯化镁
通电
镁
MgCl2 + Ca(OH)2 = Mg(OH)2↓ + CaCl2
MgCl2 === Mg + Cl2↑
通电
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
【知识点2】海底矿物资源
煤
石油
天然气
1.化石燃料
可燃冰
2.新能源
优点:热值大,无污染。
CH4·nH2O+O2 = CO2+(2+n)H2O
点燃
锰结核
3.金属矿物
多金属结核又称锰结核,是由包围核心的铁、锰氢氧化物壳层组成的、形如土豆的结核状软矿物体,外表呈暗褐色,直径一般为3 ~ 7厘米。锰结核中含有锰、铁、镍、钴、铜等几十种元素。
第二节 海水“晒盐”
【知识点1】溶解度
溶解度
四要素
一定温度
100g水
饱和状态
单位:g
固体溶解度的概念:一定温度下,某固体物质在100克溶剂中达到饱和 时所溶解的质量。
气体溶解度
相同情况下,温度越高,溶解度越_____
相同情况下,压强越大,溶解度越_____
小
大
溶质质量∶溶剂质量∶溶液质量
20℃时,溶解度为36g的氯化钠饱和溶液
20%的氯化钠溶液
36∶100∶136
20∶80∶100
溶解度和溶质质量分数的关系
溶质的质量分数=
溶解度
溶解度+100克
×100%
联系:在一定温度下的饱和溶液中
溶解度曲线的意义和应用
点:曲线上的点均表示某物质在该温度下的溶解度。
线:物质溶解度随温度改变的变化趋势。
面:在曲线上方的点表示饱和溶液,且有固体析出,
在曲线上 的点表示恰好为饱和溶液,
在曲线下方的点表示不饱和溶液。
意义
1.比较相同温度下,不同物质溶解度的大小
2.一定温度下,判断物质形成溶液的状态(饱和或不饱和)
3.判断饱和溶液和不饱和溶液的转化方法
5.混合溶液的分离、提纯方法(如KNO3混有NaCl,采用_________提纯)
4.固体物质的结晶方法
(陡升型适合________,平缓型适合_______)
降温结晶
降温结晶
蒸发结晶
应用
t1℃下,A、B、C的溶解度大小:__________
A、B、C的饱和溶液分别从t3℃降温至t2℃,溶质质量分数大小关系:__________
A中混有少量的B,采用___________提纯。
C>B>A
B>A>C
降温结晶
等质量的A、B的饱和溶液分别从t3℃降温至t2℃,析出固体质量大小:__________
A>B
母液
海水
蒸发池
结晶池
粗盐
多种化工原料
提取
日晒
【知识点2】海水“晒盐”的过程
日晒
风吹
1. 你认为哪些自然条件有利于海水“晒盐”?为什么?
气温高、湿度低、风力大、阳光充足、雨量少等。这些条件有利于水分的蒸发,形成食盐的饱和溶液。
2. 海水“晒盐”应用了氯化钠的哪些性质?
氯化钠易溶于水,且氯化钠溶解度随温度变化影响不大的性质
1.实验步骤及注意事项
(1)称量时,要注意遵循“左物右码”的原则,且在托盘的两端各放一张相同的称量纸。
(2)溶解时玻璃棒的作用是 。
(3)过滤时“一贴、二低、三靠”。
搅拌,加快粗盐溶解
【知识点3】粗盐提纯
(4)蒸发时,玻璃棒的作用是 。当蒸发皿中
时要停止加热,利用蒸发皿的余热将剩余的滤液蒸干;停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
(5)计算产率:
搅拌以防滤液局部过热引起液滴飞溅
有大量晶体析出
产率= ×100%
精盐质量
粗盐质量
2.误差分析
精盐产率偏低的原因:
(1)溶解搅拌不充分或搅拌时液滴溅出;
(2)蒸发时未用玻璃棒搅拌,液滴飞溅;
(3)转移时有部分精盐沾在蒸发皿上。
精盐产率偏高的原因:
(1)过滤后得到的滤液不澄清就蒸发;
(2)蒸发时,没完全蒸干就称量。
精盐
3.除去食盐水中的可溶性杂质
得到的精盐中除了NaCl,还有少量的MgCl2、CaCl2、Na2SO4等可溶性杂质,如何除去杂质得到纯净的NaCl呢?
加入过量的BaCl2溶液
加入过量的NaOH溶液
加入过量的Na2CO3溶液
过滤
加入适量的稀盐酸
蒸发
NaCl
加入的试剂的顺序有没有要求?
BaCl2溶液在Na2CO3溶液之前加入
2NaOH+MgCl2==Mg(OH)2↓+2NaCl
Na2CO3+CaCl2==CaCO3↓+2NaCl
Na2CO3+BaCl2==BaCO3↓+2NaCl
(1)加入BaCl2溶液:__________________________________
(2)加入NaOH溶液:__________________________________
(3)加入Na2CO3溶液
提纯过程中加入下列试剂发生反应的化学方程式
(4)加入稀盐酸
NaOH+HCl==NaCl+H2O
Na2CO3+2HCl==2NaCl+H2O+CO2↑
BaCl2+Na2SO4==BaSO4↓+2NaCl
____________________________________________
____________________________________________
____________________________________________
____________________________________________
在粗盐的提纯实验中:
(1)其主要操作步骤顺序是 ;
①过滤 ②溶解 ③蒸发 ④计算产率
(2)如图是某同学过滤的操作图,指出图中的明显错误
;过滤后,如果滤液仍然浑浊,其原
因可能是_____________________________________
(填一种);
(3)蒸发时,当蒸发皿内出现 时应停止加热;
没有用玻璃棒引流
液面高于滤纸边缘(或滤纸破损,或仪器不干净)
②①③④
较多固体
第三节 海水“制碱”
【知识点1】氨碱法制碱
盐水
精制
饱和食盐水
吸氨
饱和氨盐水
碳酸氢钠
2NaHCO3 === Na2CO3+CO2↑+H2O
△
NaCl+NH3+CO2+H2O === NaHCO3+NH4Cl
纯碱
碳酸化
过滤、热解
思考:
1. 请从酸碱反应的角度分析:在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
2. 氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
氨气是一种极易溶于水的气体,其水溶液显碱性,更易吸收二氧化碳,且吸收的量也较食盐水多。
碳酸氢钠先析出,因为在同样的条件下,碳酸氢钠的溶解度比氯化铵小,易结晶。
1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的侯氏制碱法,即向滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥,NaCl溶液可循环使用。
思考:
1.滤出NaHCO3晶体后的NH4Cl溶液溶质有哪些?
2.为什么加入食盐可以使其中的NH4Cl结晶析出?
1.溶质有NaHCO3、NH4Cl,还有未反应完的NaCl。
2.同离子效应,增大溶液中氯离子浓度,能使NH4Cl析出。
碳酸钠 碳酸氢钠
化学式
俗名
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色晶体
白色粉末
可溶
显碱性
灭火器、制饮料、发酵粉、治疗胃酸
石油精炼、洗涤剂、制造玻璃等。
易溶
显弱碱性
受热不易分解
受热易分解
纯碱的化学性质
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
Na2CO3 +2HCl =2NaCl + CO2↑+ H2O
Na2CO3+BaCl2=BaCO3↓+ 2NaCl
Na2CO3 +H2SO4 =Na2SO4 + CO2↑+ H2O
【知识点2】复分解反应
(1)定义:两种化合物互相交换成分,生成另外两种化合物的反应。
(2)通式:AB+CD __________
(3)特点:“双交换,价不变”,反应物仅交换成分,元素化合价不发生变化。
AD+CB
沉淀
(4)发生条件:
反应类型 反应物的条件 生成物的条件
酸+碱 盐+水 反应物可不溶于水 有 、 或 生成(至少有其一)
酸+盐 新盐+新酸
碱+盐 新盐+新碱 反应物均溶于水
盐+盐 新盐+新盐
气体
水
沉淀
AgCl、BaSO4、CaCO3、BaCO3
Fe(OH)3、Mg(OH)2、Al(OH)3、Cu(OH)2
气体
NH3
CO2
初中化学常见的沉淀和气体
【知识点3】盐的化学性质
规律 示例 备注
与金属 反应 盐+金属 新盐+新金属 Fe+CuSO4 _____________________ 该反应为置换反应,活动性较强的金属可以置换出活动性较弱的金属;作为反应物的盐必须可溶;K、Na、Ca等活泼金属与盐溶液反应不能置换出金属
与酸 反应 盐+酸 新盐+新酸 CaCO3+2HCl __________________ 碳酸盐与酸反应生成二氧化碳,常用于检验碳酸盐
与碱 反应 盐+碱 新盐+新碱 CuSO4+2NaOH ___________________ 盐与碱反应常生成沉淀,但是铵盐与碱反应会放出氨气(氨气可使湿润的红色石蕊试纸变蓝)
与盐 反应 盐1+盐2 新盐1+新盐2 Na2SO4+BaCl2 _________________________________ 反应物中的两种盐需要都溶于水,生成物中有沉淀
Cu+FeSO4
CaCl2+CO2↑+H2O
Cu(OH)2↓+Na2SO4
BaSO4↓+2NaCl
学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成,主要有以下八种反应:
1.某同学在学习了酸、碱、盐之间的转化规律后,绘制了可以通过一步反应制取MgCl2的思维导图。
(1)若反应①中的盐是CuCl2,且反应①为置换反应,
则另一种反应物的化学式为 。
(2)请写出符合反应⑤的化学方程式:
。
(3)已知A不同于图中其他物质类别,它属于 (填物质类别),反应③的化学方程式为 。
Mg
2HCl+Mg(OH)2 MgCl2+2H2O
金属氧化物
MgO+2HCl MgCl2+H2O
2.下列各组物质在水中能大量共存且溶液为无色的是( )
A.NH4Cl、K2CO3、NaOH、Na2SO4
B.MgSO4、NaCl、Ba(NO3)2、FeCl3
C.KNO3、Na2SO4、HCl、NaHCO3
D.HCl、NaNO3、K2SO4、NH4Cl
D
海水中的化学
海水化学资源
海水“晒盐”
复分解反应
海水“制碱”
氨碱法制碱
盐的化学性质
溶解度
海水晒盐
粗盐提纯
海水化学资源
海矿产资源
第八单元复习
海水中的化学
1.能列举海洋化学资源,并认识海洋化学资源的重要性。
2.能理解溶解度的含义,并能用溶解度曲线解释海水晒盐等现象。
3.能概述氨碱法制碱的过程和原理。
4.能说出碳酸钠和碳酸氢钠的性质和用途。
5.能概述除去粗盐中不溶性杂质和可溶性杂质的方法。
6.能从微观角度认识复分解反应的本质。
7.能根据复分解反应的条件判断酸、碱、盐能否反应,离子能否共存。
8.能列举盐的化学性质,并能书写化学方程式。
第一节 海洋化学资源
水96.5%
溶解的盐 3.5%
Cl- 55.06%
Na+ 30.61%
SO42- 7.67%
Mg2+ 3.69%
Ca2+ 1.15%
K+ 1.10%
其他 0.72%
海水中含量最多的元素是______
海水中含量最多的金属元素是______
O
Na
【知识点1】海水中的化学资源
海水或卤水
石灰乳
氢氧化镁
盐酸
氯化镁
通电
镁
MgCl2 + Ca(OH)2 = Mg(OH)2↓ + CaCl2
MgCl2 === Mg + Cl2↑
通电
Mg(OH)2 + 2HCl = MgCl2 + 2H2O
【知识点2】海底矿物资源
煤
石油
天然气
1.化石燃料
可燃冰
2.新能源
优点:热值大,无污染。
CH4·nH2O+O2 = CO2+(2+n)H2O
点燃
锰结核
3.金属矿物
多金属结核又称锰结核,是由包围核心的铁、锰氢氧化物壳层组成的、形如土豆的结核状软矿物体,外表呈暗褐色,直径一般为3 ~ 7厘米。锰结核中含有锰、铁、镍、钴、铜等几十种元素。
第二节 海水“晒盐”
【知识点1】溶解度
溶解度
四要素
一定温度
100g水
饱和状态
单位:g
固体溶解度的概念:一定温度下,某固体物质在100克溶剂中达到饱和 时所溶解的质量。
气体溶解度
相同情况下,温度越高,溶解度越_____
相同情况下,压强越大,溶解度越_____
小
大
溶质质量∶溶剂质量∶溶液质量
20℃时,溶解度为36g的氯化钠饱和溶液
20%的氯化钠溶液
36∶100∶136
20∶80∶100
溶解度和溶质质量分数的关系
溶质的质量分数=
溶解度
溶解度+100克
×100%
联系:在一定温度下的饱和溶液中
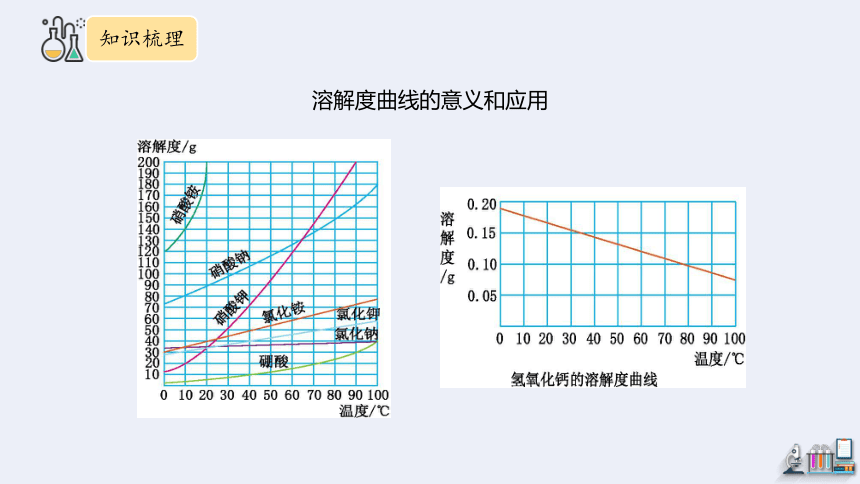
溶解度曲线的意义和应用
点:曲线上的点均表示某物质在该温度下的溶解度。
线:物质溶解度随温度改变的变化趋势。
面:在曲线上方的点表示饱和溶液,且有固体析出,
在曲线上 的点表示恰好为饱和溶液,
在曲线下方的点表示不饱和溶液。
意义
1.比较相同温度下,不同物质溶解度的大小
2.一定温度下,判断物质形成溶液的状态(饱和或不饱和)
3.判断饱和溶液和不饱和溶液的转化方法
5.混合溶液的分离、提纯方法(如KNO3混有NaCl,采用_________提纯)
4.固体物质的结晶方法
(陡升型适合________,平缓型适合_______)
降温结晶
降温结晶
蒸发结晶
应用
t1℃下,A、B、C的溶解度大小:__________
A、B、C的饱和溶液分别从t3℃降温至t2℃,溶质质量分数大小关系:__________
A中混有少量的B,采用___________提纯。
C>B>A
B>A>C
降温结晶
等质量的A、B的饱和溶液分别从t3℃降温至t2℃,析出固体质量大小:__________
A>B
母液
海水
蒸发池
结晶池
粗盐
多种化工原料
提取
日晒
【知识点2】海水“晒盐”的过程
日晒
风吹
1. 你认为哪些自然条件有利于海水“晒盐”?为什么?
气温高、湿度低、风力大、阳光充足、雨量少等。这些条件有利于水分的蒸发,形成食盐的饱和溶液。
2. 海水“晒盐”应用了氯化钠的哪些性质?
氯化钠易溶于水,且氯化钠溶解度随温度变化影响不大的性质
1.实验步骤及注意事项
(1)称量时,要注意遵循“左物右码”的原则,且在托盘的两端各放一张相同的称量纸。
(2)溶解时玻璃棒的作用是 。
(3)过滤时“一贴、二低、三靠”。
搅拌,加快粗盐溶解
【知识点3】粗盐提纯
(4)蒸发时,玻璃棒的作用是 。当蒸发皿中
时要停止加热,利用蒸发皿的余热将剩余的滤液蒸干;停止加热时,不要立即把蒸发皿直接放在实验台上,以免烫坏实验台。
(5)计算产率:
搅拌以防滤液局部过热引起液滴飞溅
有大量晶体析出
产率= ×100%
精盐质量
粗盐质量
2.误差分析
精盐产率偏低的原因:
(1)溶解搅拌不充分或搅拌时液滴溅出;
(2)蒸发时未用玻璃棒搅拌,液滴飞溅;
(3)转移时有部分精盐沾在蒸发皿上。
精盐产率偏高的原因:
(1)过滤后得到的滤液不澄清就蒸发;
(2)蒸发时,没完全蒸干就称量。
精盐
3.除去食盐水中的可溶性杂质
得到的精盐中除了NaCl,还有少量的MgCl2、CaCl2、Na2SO4等可溶性杂质,如何除去杂质得到纯净的NaCl呢?
加入过量的BaCl2溶液
加入过量的NaOH溶液
加入过量的Na2CO3溶液
过滤
加入适量的稀盐酸
蒸发
NaCl
加入的试剂的顺序有没有要求?
BaCl2溶液在Na2CO3溶液之前加入
2NaOH+MgCl2==Mg(OH)2↓+2NaCl
Na2CO3+CaCl2==CaCO3↓+2NaCl
Na2CO3+BaCl2==BaCO3↓+2NaCl
(1)加入BaCl2溶液:__________________________________
(2)加入NaOH溶液:__________________________________
(3)加入Na2CO3溶液
提纯过程中加入下列试剂发生反应的化学方程式
(4)加入稀盐酸
NaOH+HCl==NaCl+H2O
Na2CO3+2HCl==2NaCl+H2O+CO2↑
BaCl2+Na2SO4==BaSO4↓+2NaCl
____________________________________________
____________________________________________
____________________________________________
____________________________________________
在粗盐的提纯实验中:
(1)其主要操作步骤顺序是 ;
①过滤 ②溶解 ③蒸发 ④计算产率
(2)如图是某同学过滤的操作图,指出图中的明显错误
;过滤后,如果滤液仍然浑浊,其原
因可能是_____________________________________
(填一种);
(3)蒸发时,当蒸发皿内出现 时应停止加热;
没有用玻璃棒引流
液面高于滤纸边缘(或滤纸破损,或仪器不干净)
②①③④
较多固体
第三节 海水“制碱”
【知识点1】氨碱法制碱
盐水
精制
饱和食盐水
吸氨
饱和氨盐水
碳酸氢钠
2NaHCO3 === Na2CO3+CO2↑+H2O
△
NaCl+NH3+CO2+H2O === NaHCO3+NH4Cl
纯碱
碳酸化
过滤、热解
思考:
1. 请从酸碱反应的角度分析:在用氨碱法生产纯碱的过程中,为什么要先向饱和食盐水中通入氨气,制成饱和氨盐水,再向其中通入二氧化碳?
2. 氨盐水吸收二氧化碳后生成的碳酸氢钠和氯化铵,哪种物质首先结晶析出?为什么?
氨气是一种极易溶于水的气体,其水溶液显碱性,更易吸收二氧化碳,且吸收的量也较食盐水多。
碳酸氢钠先析出,因为在同样的条件下,碳酸氢钠的溶解度比氯化铵小,易结晶。
1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的侯氏制碱法,即向滤出NaHCO3晶体后的NH4Cl溶液中加入食盐,使其中的NH4Cl单独结晶析出,用作氮肥,NaCl溶液可循环使用。
思考:
1.滤出NaHCO3晶体后的NH4Cl溶液溶质有哪些?
2.为什么加入食盐可以使其中的NH4Cl结晶析出?
1.溶质有NaHCO3、NH4Cl,还有未反应完的NaCl。
2.同离子效应,增大溶液中氯离子浓度,能使NH4Cl析出。
碳酸钠 碳酸氢钠
化学式
俗名
颜色、状态
溶解性
水溶液酸碱性
热稳定性
用途
Na2CO3
NaHCO3
纯碱、苏打
小苏打、酸式碳酸钠
白色晶体
白色粉末
可溶
显碱性
灭火器、制饮料、发酵粉、治疗胃酸
石油精炼、洗涤剂、制造玻璃等。
易溶
显弱碱性
受热不易分解
受热易分解
纯碱的化学性质
Na2CO3+Ca(OH)2 = CaCO3↓+2NaOH
Na2CO3 +2HCl =2NaCl + CO2↑+ H2O
Na2CO3+BaCl2=BaCO3↓+ 2NaCl
Na2CO3 +H2SO4 =Na2SO4 + CO2↑+ H2O
【知识点2】复分解反应
(1)定义:两种化合物互相交换成分,生成另外两种化合物的反应。
(2)通式:AB+CD __________
(3)特点:“双交换,价不变”,反应物仅交换成分,元素化合价不发生变化。
AD+CB
沉淀
(4)发生条件:
反应类型 反应物的条件 生成物的条件
酸+碱 盐+水 反应物可不溶于水 有 、 或 生成(至少有其一)
酸+盐 新盐+新酸
碱+盐 新盐+新碱 反应物均溶于水
盐+盐 新盐+新盐
气体
水
沉淀
AgCl、BaSO4、CaCO3、BaCO3
Fe(OH)3、Mg(OH)2、Al(OH)3、Cu(OH)2
气体
NH3
CO2
初中化学常见的沉淀和气体
【知识点3】盐的化学性质
规律 示例 备注
与金属 反应 盐+金属 新盐+新金属 Fe+CuSO4 _____________________ 该反应为置换反应,活动性较强的金属可以置换出活动性较弱的金属;作为反应物的盐必须可溶;K、Na、Ca等活泼金属与盐溶液反应不能置换出金属
与酸 反应 盐+酸 新盐+新酸 CaCO3+2HCl __________________ 碳酸盐与酸反应生成二氧化碳,常用于检验碳酸盐
与碱 反应 盐+碱 新盐+新碱 CuSO4+2NaOH ___________________ 盐与碱反应常生成沉淀,但是铵盐与碱反应会放出氨气(氨气可使湿润的红色石蕊试纸变蓝)
与盐 反应 盐1+盐2 新盐1+新盐2 Na2SO4+BaCl2 _________________________________ 反应物中的两种盐需要都溶于水,生成物中有沉淀
Cu+FeSO4
CaCl2+CO2↑+H2O
Cu(OH)2↓+Na2SO4
BaSO4↓+2NaCl
学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成,主要有以下八种反应:
1.某同学在学习了酸、碱、盐之间的转化规律后,绘制了可以通过一步反应制取MgCl2的思维导图。
(1)若反应①中的盐是CuCl2,且反应①为置换反应,
则另一种反应物的化学式为 。
(2)请写出符合反应⑤的化学方程式:
。
(3)已知A不同于图中其他物质类别,它属于 (填物质类别),反应③的化学方程式为 。
Mg
2HCl+Mg(OH)2 MgCl2+2H2O
金属氧化物
MgO+2HCl MgCl2+H2O
2.下列各组物质在水中能大量共存且溶液为无色的是( )
A.NH4Cl、K2CO3、NaOH、Na2SO4
B.MgSO4、NaCl、Ba(NO3)2、FeCl3
C.KNO3、Na2SO4、HCl、NaHCO3
D.HCl、NaNO3、K2SO4、NH4Cl
D
海水中的化学
海水化学资源
海水“晒盐”
复分解反应
海水“制碱”
氨碱法制碱
盐的化学性质
溶解度
海水晒盐
粗盐提纯
海水化学资源
海矿产资源
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
