化学人教版(2019)必修第一册3.1铁及其化合物(共19张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1铁及其化合物(共19张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 19:19:21 | ||
图片预览




文档简介
(共19张PPT)
基于“价—类”观的教学设计
-----以铁的化合物为例
铁锈的主要成分是什么?自然界中铁器上的铁锈是怎么形成的?
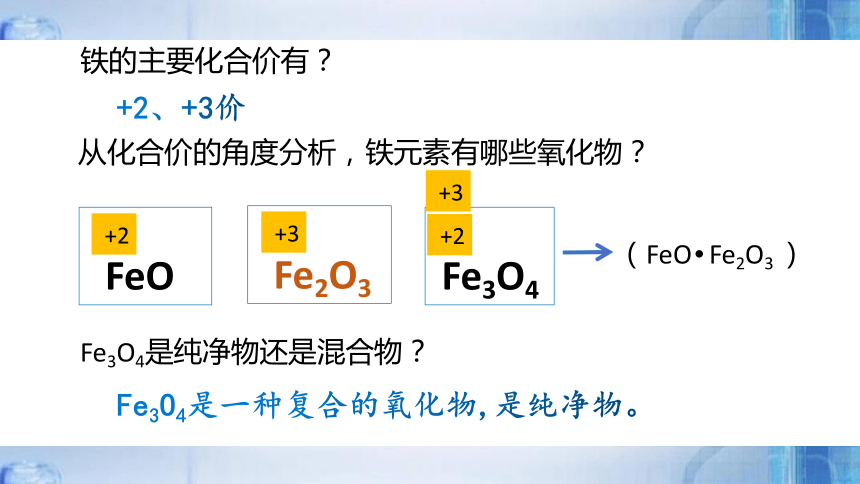
从化合价的角度分析,铁元素有哪些氧化物?
FeO
+2
Fe2O3
Fe3O4
+2
+3
+3
铁的主要化合价有?
+2、+3价
(FeO Fe2O3 )
●
Fe3O4是纯净物还是混合物?
Fe3O4是一种复合的氧化物,是纯净物。
Fe2O3
FeO
Fe3O4
颜色状态:
黑色
俗称: 铁红
俗称:磁性氧化铁
红棕色
粉末
颜色:
状态:
颜色:
状态:
粉末
晶体
黑色
Fe2O3
溶解性:
用途:
稳定性:
油漆和涂料
难溶于水
稳定
Fe3O4
用途:打印机或复印机的墨粉
稳定性:
溶解性:
难溶于水
稳定
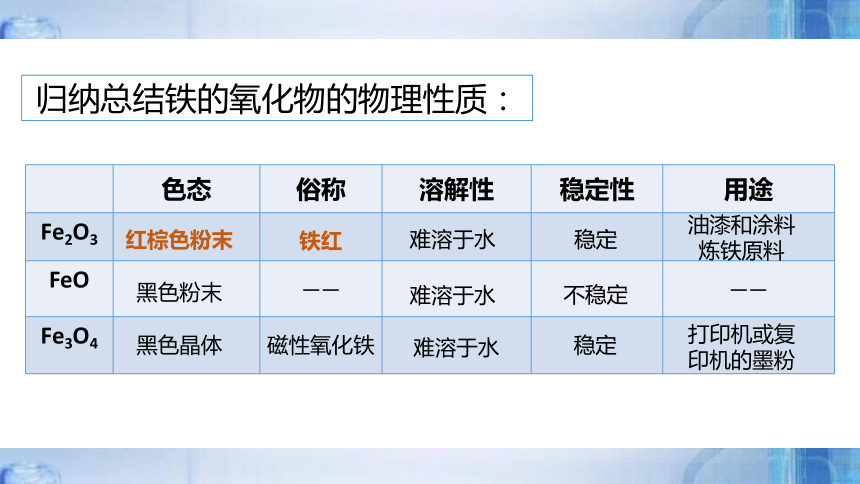
色态 俗称 溶解性 稳定性 用途
Fe2O3
FeO —— ——
Fe3O4
红棕色粉末
铁红
稳定
炼铁原料
难溶于水
油漆和涂料
黑色粉末
不稳定
难溶于水
黑色晶体
磁性氧化铁
稳定
难溶于水
打印机或复印机的墨粉
归纳总结铁的氧化物的物理性质:
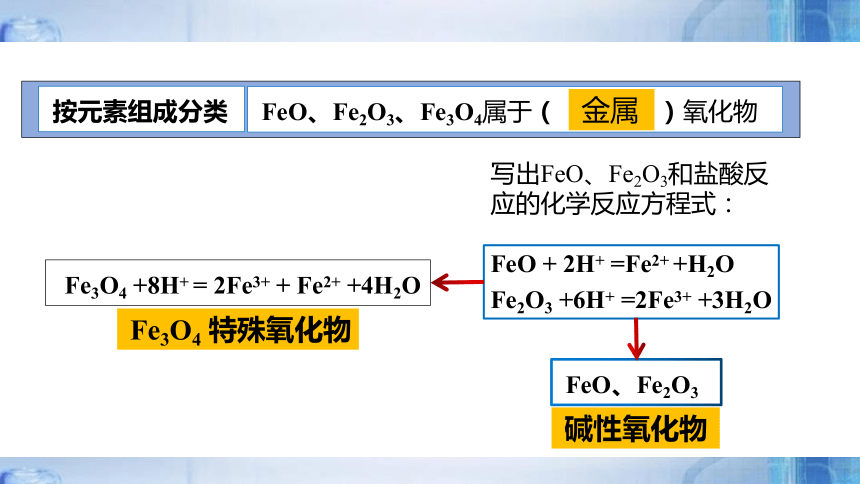
FeO、Fe2O3
Fe3O4 +8H+ = 2Fe3+ + Fe2+ +4H2O
FeO + 2H+ =Fe2+ +H2O
Fe2O3 +6H+ =2Fe3+ +3H2O
按元素组成分类
FeO、Fe2O3、Fe3O4属于( )氧化物
金属
碱性氧化物
Fe3O4 特殊氧化物
写出FeO、Fe2O3和盐酸反应的化学反应方程式:
从化合价的角度分析,铁元素有哪些氢氧化物?
氢氧化亚铁 Fe(OH)2 氢氧化铁 Fe(OH)3
1、 碱性氧化物 + H2O == 碱
Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2
如何制备Fe(OH)2 和Fe(OH)3?
是否可以用FeO、Fe2O3与水反应来制取Fe(OH)2 和Fe(OH)3?
2、 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
不可以,FeO、Fe2O3难溶于水
盐 + 碱 == 新盐 + 新碱
【实验3-1 】在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察现象并写出离子反应方程式。
红褐色
红褐色沉淀
灰绿色沉淀
白色沉淀
Fe3+ + 3OH- = Fe(OH)3↓
铁盐------FeCl3和Fe2(SO4)3
亚铁盐---FeCl2和FeSO4
+ 碱 (NaOH、KOH)
思考1:为什么在FeSO4溶液中加入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后会生成红褐色物质呢?
Fe2++2OH-==Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(红褐色)
空气中氧气具有氧化性,氢氧化亚铁表现还原性
思考2:从价态角度分析,氢氧化亚铁具有什么样的性质呢?
思考3:在空气中氢氧化亚铁表现什么性质?
氢氧化亚铁中铁的化合价为+2价,既具有氧化性又具有还原性
思考4:如何防止生成的氢氧化亚铁变色?
关键
在制备氢氧化亚铁的过程中,氧化Fe(OH)2的氧气来自哪些部分?
隔绝氧气(空气)
空气中的氧气
思考1:为什么将滴管伸入FeSO4溶液的液面以下?
防止NaOH溶液滴落过程中带入氧气
思考2:植物油的作用是什么?
防止FeSO4溶液与空气接触
试剂中的氧气
植物油
新制的,FeSO4溶液在空气中很容易被氧化
思考3:如何除去溶解在试剂中的氧气?
思考4:从化合价的角度分析,应该选择新制的FeSO4溶液还是久置的FeSO4溶液,为什么?
思考5: 配制NaOH溶液和FeSO4溶液的蒸馏水要煮沸并迅速冷却,这样做的目的是什么?
除去溶解在蒸馏水中的氧气
实验开始,先打开止水夹a,反应一段时间后,检验试管B出口处排出的氢气的纯度。当排出的H2纯净时,夹紧止水夹a
Fe+H2SO4 = FeSO4 +H2
思考1:A试管中发生反应的化学方程式是?
思考2:实验开始时,应先( )(填“打开”或“关闭”)止水夹a,为什么?
思考3:FeSO4溶液如何进入到NaOH溶液中?
打开
利用生成的氢气排出A、B两支试管中的空气
产生的氢气使A试管中的压强增大,FeSO4溶液被压入B试管中
植物油
铁的氢氧化物有哪些性质?请完成以下表格。
铁的氢氧化物 氢氧化铁 氢氧化亚铁
化学式
色、态
水溶性 与盐酸反应离子方程式
稳定性
转化关系 4Fe(OH)2 + O2 +2H2O==4Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)3
Fe(OH)2
红褐色固体
白色固体
难溶于水
Fe(OH)3 + 3H+ ==Fe3+ +3H2O
Fe(OH)2 + 2H+ =Fe2+ + 2H2O
2Fe(OH)3 ==Fe2O3 + 3H2O
用本节课所学知识解释铁锈形成的过程并写出反应方程式:
1、铁制品暴露在空气中与空气中的水蒸气和氧气发生反应生成氢氧化亚铁
4Fe(OH)2 + O2 +2H2O==4Fe(OH)3
2Fe(OH)3 ==Fe2O3 + 3H2O
2Fe+2H2O+O2===2Fe(OH)2
2、氢氧化亚铁被空气中的氧气氧化生成氢氧化铁
3、氢氧化铁分解成氧化铁和水。
铁生锈主要分三个过程:
1、下列关于铁的氧化物说法正确的是( )
A.“雨过天晴云破处”所描述的瓷器青色,可能是来自氧化亚铁
B.Fe2O3是红棕色粉末,俗称磁性氧化铁,常用作红色油漆和涂料
C.Fe3O4中Fe元素的化合价有+2价和+3价,因而Fe3O4是FeO与Fe2O3的混合物D.FeO在空气中受热,能迅速被氧化成Fe2O3
A
3、将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A.最终生成白色沉淀 B.最终生成红褐色沉淀
C.有黄绿色气体产生 D.无明显变化
4、在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是( )
A.生成物为氢氧化铁 B.该反应是化合反应
C.该反应是氧化还原反应 D.氢氧化亚铁作氧化剂
B
D
1、苯的作用是( )
防止FeSO4 溶液与空气接触
2、装有氢氧化钠溶液的长滴管为什么伸入液面以下( )
防止NaOH溶液滴落过程中带入氧气
3、烧杯的作用( )
防止空气进入试管
作业
课时跟踪检测(十四)
1—12题,15题,
基于“价—类”观的教学设计
-----以铁的化合物为例
铁锈的主要成分是什么?自然界中铁器上的铁锈是怎么形成的?
从化合价的角度分析,铁元素有哪些氧化物?
FeO
+2
Fe2O3
Fe3O4
+2
+3
+3
铁的主要化合价有?
+2、+3价
(FeO Fe2O3 )
●
Fe3O4是纯净物还是混合物?
Fe3O4是一种复合的氧化物,是纯净物。
Fe2O3
FeO
Fe3O4
颜色状态:
黑色
俗称: 铁红
俗称:磁性氧化铁
红棕色
粉末
颜色:
状态:
颜色:
状态:
粉末
晶体
黑色
Fe2O3
溶解性:
用途:
稳定性:
油漆和涂料
难溶于水
稳定
Fe3O4
用途:打印机或复印机的墨粉
稳定性:
溶解性:
难溶于水
稳定
色态 俗称 溶解性 稳定性 用途
Fe2O3
FeO —— ——
Fe3O4
红棕色粉末
铁红
稳定
炼铁原料
难溶于水
油漆和涂料
黑色粉末
不稳定
难溶于水
黑色晶体
磁性氧化铁
稳定
难溶于水
打印机或复印机的墨粉
归纳总结铁的氧化物的物理性质:
FeO、Fe2O3
Fe3O4 +8H+ = 2Fe3+ + Fe2+ +4H2O
FeO + 2H+ =Fe2+ +H2O
Fe2O3 +6H+ =2Fe3+ +3H2O
按元素组成分类
FeO、Fe2O3、Fe3O4属于( )氧化物
金属
碱性氧化物
Fe3O4 特殊氧化物
写出FeO、Fe2O3和盐酸反应的化学反应方程式:
从化合价的角度分析,铁元素有哪些氢氧化物?
氢氧化亚铁 Fe(OH)2 氢氧化铁 Fe(OH)3
1、 碱性氧化物 + H2O == 碱
Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2
如何制备Fe(OH)2 和Fe(OH)3?
是否可以用FeO、Fe2O3与水反应来制取Fe(OH)2 和Fe(OH)3?
2、 2NaOH + CuSO4 = Cu(OH)2 + Na2SO4
不可以,FeO、Fe2O3难溶于水
盐 + 碱 == 新盐 + 新碱
【实验3-1 】在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察现象并写出离子反应方程式。
红褐色
红褐色沉淀
灰绿色沉淀
白色沉淀
Fe3+ + 3OH- = Fe(OH)3↓
铁盐------FeCl3和Fe2(SO4)3
亚铁盐---FeCl2和FeSO4
+ 碱 (NaOH、KOH)
思考1:为什么在FeSO4溶液中加入NaOH溶液时,生成的白色沉淀迅速变成灰绿色,最后会生成红褐色物质呢?
Fe2++2OH-==Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O=4Fe(OH)3(红褐色)
空气中氧气具有氧化性,氢氧化亚铁表现还原性
思考2:从价态角度分析,氢氧化亚铁具有什么样的性质呢?
思考3:在空气中氢氧化亚铁表现什么性质?
氢氧化亚铁中铁的化合价为+2价,既具有氧化性又具有还原性
思考4:如何防止生成的氢氧化亚铁变色?
关键
在制备氢氧化亚铁的过程中,氧化Fe(OH)2的氧气来自哪些部分?
隔绝氧气(空气)
空气中的氧气
思考1:为什么将滴管伸入FeSO4溶液的液面以下?
防止NaOH溶液滴落过程中带入氧气
思考2:植物油的作用是什么?
防止FeSO4溶液与空气接触
试剂中的氧气
植物油
新制的,FeSO4溶液在空气中很容易被氧化
思考3:如何除去溶解在试剂中的氧气?
思考4:从化合价的角度分析,应该选择新制的FeSO4溶液还是久置的FeSO4溶液,为什么?
思考5: 配制NaOH溶液和FeSO4溶液的蒸馏水要煮沸并迅速冷却,这样做的目的是什么?
除去溶解在蒸馏水中的氧气
实验开始,先打开止水夹a,反应一段时间后,检验试管B出口处排出的氢气的纯度。当排出的H2纯净时,夹紧止水夹a
Fe+H2SO4 = FeSO4 +H2
思考1:A试管中发生反应的化学方程式是?
思考2:实验开始时,应先( )(填“打开”或“关闭”)止水夹a,为什么?
思考3:FeSO4溶液如何进入到NaOH溶液中?
打开
利用生成的氢气排出A、B两支试管中的空气
产生的氢气使A试管中的压强增大,FeSO4溶液被压入B试管中
植物油
铁的氢氧化物有哪些性质?请完成以下表格。
铁的氢氧化物 氢氧化铁 氢氧化亚铁
化学式
色、态
水溶性 与盐酸反应离子方程式
稳定性
转化关系 4Fe(OH)2 + O2 +2H2O==4Fe(OH)3
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
Fe(OH)3
Fe(OH)2
红褐色固体
白色固体
难溶于水
Fe(OH)3 + 3H+ ==Fe3+ +3H2O
Fe(OH)2 + 2H+ =Fe2+ + 2H2O
2Fe(OH)3 ==Fe2O3 + 3H2O
用本节课所学知识解释铁锈形成的过程并写出反应方程式:
1、铁制品暴露在空气中与空气中的水蒸气和氧气发生反应生成氢氧化亚铁
4Fe(OH)2 + O2 +2H2O==4Fe(OH)3
2Fe(OH)3 ==Fe2O3 + 3H2O
2Fe+2H2O+O2===2Fe(OH)2
2、氢氧化亚铁被空气中的氧气氧化生成氢氧化铁
3、氢氧化铁分解成氧化铁和水。
铁生锈主要分三个过程:
1、下列关于铁的氧化物说法正确的是( )
A.“雨过天晴云破处”所描述的瓷器青色,可能是来自氧化亚铁
B.Fe2O3是红棕色粉末,俗称磁性氧化铁,常用作红色油漆和涂料
C.Fe3O4中Fe元素的化合价有+2价和+3价,因而Fe3O4是FeO与Fe2O3的混合物D.FeO在空气中受热,能迅速被氧化成Fe2O3
A
3、将过氧化钠投入到氯化亚铁溶液中,可观察到的现象是( )
A.最终生成白色沉淀 B.最终生成红褐色沉淀
C.有黄绿色气体产生 D.无明显变化
4、在空气中氢氧化亚铁白色沉淀可转化为红褐色沉淀。关于该反应的下列叙述中不正确的是( )
A.生成物为氢氧化铁 B.该反应是化合反应
C.该反应是氧化还原反应 D.氢氧化亚铁作氧化剂
B
D
1、苯的作用是( )
防止FeSO4 溶液与空气接触
2、装有氢氧化钠溶液的长滴管为什么伸入液面以下( )
防止NaOH溶液滴落过程中带入氧气
3、烧杯的作用( )
防止空气进入试管
作业
课时跟踪检测(十四)
1—12题,15题,
