化学人教版(2019)选择性必修2 1.2.1原子结构与元素周期表课件(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.2.1原子结构与元素周期表课件(共33张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 19:20:39 | ||
图片预览








文档简介
(共33张PPT)
第二节 原子结构与元素的性质
第一章 原子结构与性质
第1课时 原子结构与元素周期表
1、元素周期律、元素周期系和元素周期表
2、构造原理与元素周期表
3、对角线规则
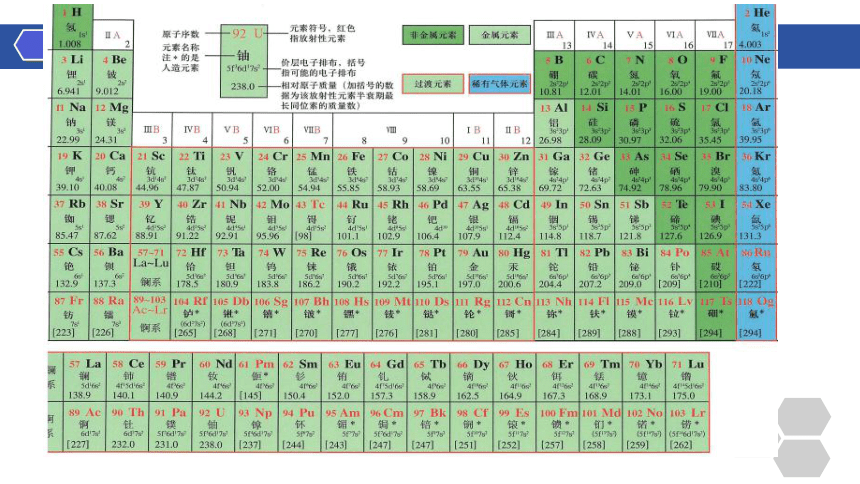
一、原子结构与元素周期表
元素周期律
元素的性质随元素
原子的核电荷数递增发生周期性递变规律
元素周期系
元素按其原子核电荷数递增排列的序列
元素周期表
呈现周期系的表格,元素周期系只有一个,元素周期表多种多样
1、元素周期律、元素周期系和元素周期表
门捷列夫制作了历史上第一张元素周期表
周
期
表
7个横行(七个周期)
18个列(16个族)
3个短周期
4个长周期
7个主族 (IA~VIIA)
0族: 稀有气体元素
8个副族
第VIII族 ( 第8、9、10这三个纵行)
(ⅠB~VIIB)
主族序数 =原子的最外层电子数
周期序数 =原子的电子层数
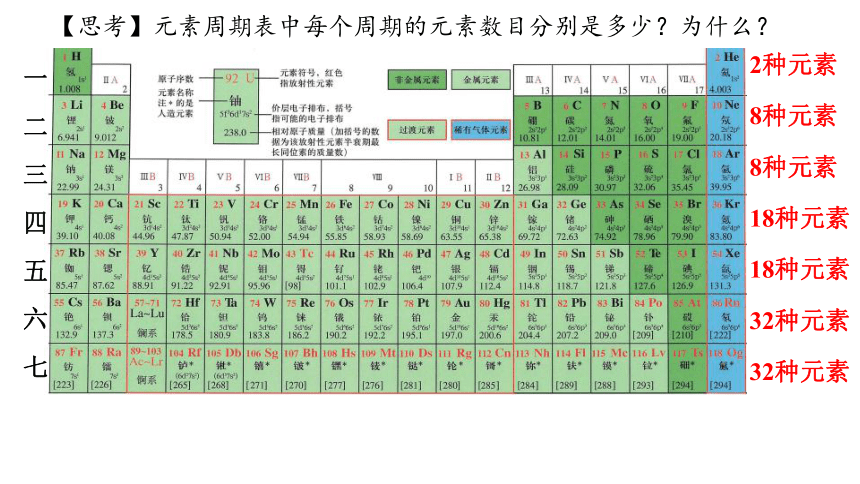
【思考】元素周期表中每个周期的元素数目分别是多少?为什么?
一
二
三
四
五
六
七
2种元素
8种元素
8种元素
18种元素
18种元素
32种元素
32种元素
2、构造原理与元素周期表
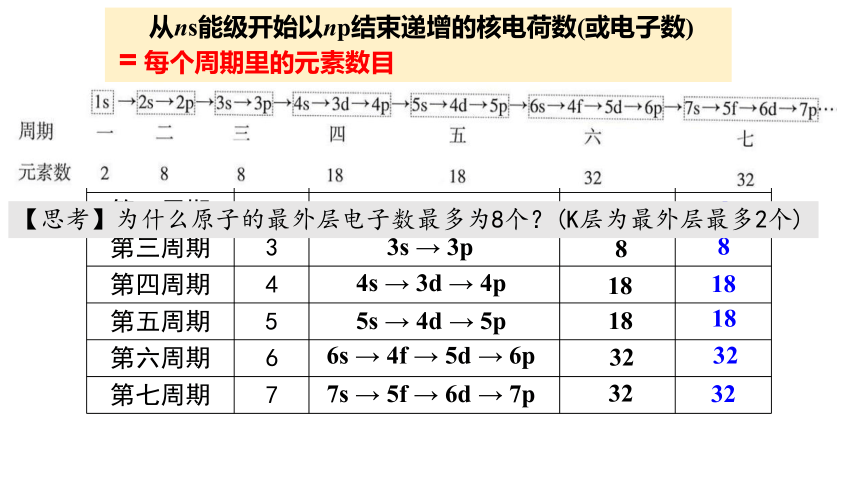
电子填入能级的顺序:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d
→5p→6s→4f→5d→6p→7s→5f→6d→7p
ns→(n-2)f→(n-1)d→np
【思考】请你回忆第一周期到第四周期的元素的基态原子的价电子排布式,能找出什么规律?
第一周期:
电子排布从 开始,以 结束
1s1
1s2
各周期:
除第一周期外(1s1→1s2)
从 开始,以 结束
ns1
ns2np6
(n为能层序数=周期序数)
【思考】根据构造原理电子填入ns到np结束,中间可能还需要填入哪些能级?
ns → (n-2)f → (n-1)d → np
周期 序数 电子 层数 各周期电子填充从ns→np的能级 递增的 电子数 元素
数目
第一周期 1
第二周期 2
第三周期 3
第四周期 4
第五周期 5
第六周期 6
第七周期 7
2s→2p
3s → 3p
4s → 3d → 4p
5s → 4d → 5p
6s → 4f → 5d → 6p
7s → 5f → 6d → 7p
2
8
8
18
18
32
32
2
8
8
18
18
32
32
从ns能级开始以np结束递增的核电荷数(或电子数)
= 每个周期里的元素数目
1s
【思考】为什么原子的最外层电子数最多为8个?(K层为最外层最多2个)
七 个
2,8,8,18,18,32,32
第一能层的能级只有1s能级,最多排2个电子
18
基本相等
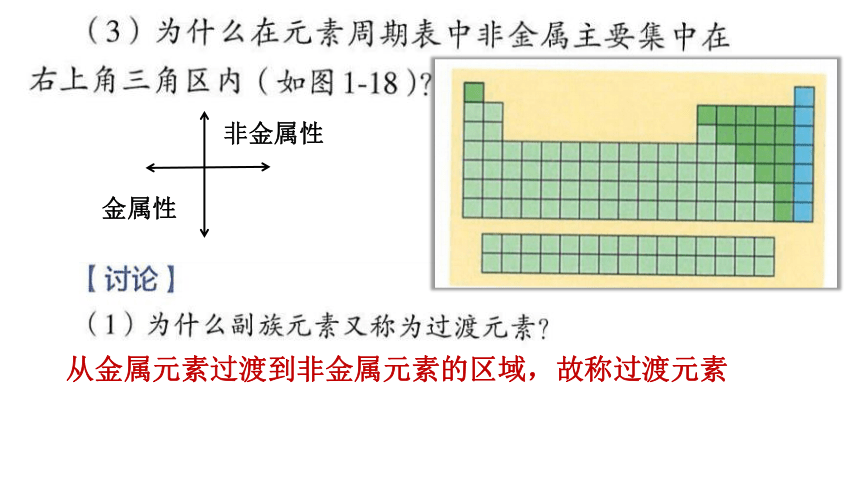
Ⅰ~ⅦA族、Ⅰ~ⅦB 和Ⅷ、0族
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0族
非金属性
金属性
从金属元素过渡到非金属元素的区域,故称过渡元素
主族 价层电子
排布通式
族的划分与原子的价电子数目和价电子排布密切相关。
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
(1)主族序数=价电子数=基态原子的最外层电子数
0族 价层电子
排布通式
价电子排布:ns1~2或ns2np1~5
ns2np6
He除外,为1s2
(2)0族的价电子排布式为ns2np6
He为1s2
副族 价层电子排布通式
Ⅰ B
Ⅱ B
Ⅲ B
Ⅳ B
Ⅴ B
Ⅵ B
Ⅶ B
Ⅷ
(n-1)d1ns2
(n-1)d2ns2
(n-1)d3ns2
(n-1)d5ns1
(n-1)d5ns2
(n-1)d6~8ns2
(n-1)d10ns1
(n-1)d10ns2
ⅢB-ⅦB:族序数 = 价层电子数
=(n-1)d+ns电子总数
ⅠB-ⅡB:族序数 = ns的电子数=最外层电子数
(3)副族序数
过渡元素:价电子排布:(n-1)d1~10ns1~2
(镧系、锕系、Pd除外)
族的划分与原子的价电子数目和价电子排布密切相关。
ds区的价层电子排布通式
(n-1)d10ns1
(n-1)d10ns2
可认为核外电子因先填满了_______能级而后再填充 能级,得名ds区。
(n-1)d
ns
元素周期表可分为5个区。
f区
s 区
d 区
ds 区
p 区
电子填充的最后一个能级是s能级
电子填充的最后
一个能级是d能级
电子填充的最后
一个能级是p能级
先填满了(n-1)d能级而后填充ns能级
最外层电子数均不超过 ,容易 电子(H除外),
在化学反应中表现出 .
2
失去
s区有2列,d区有8列,ds区有2列、 p区有6列。
还原性(金属性)
非金属性
金属性
从原子结构方面来说,元素周期表中右上角三角区的元素,大多数的价层电子排布为ns2np1~5 。最外层电子数较多,得电子相对容易,失去电子相对较困难。从元素周期表中元素性质递变规律来说,同周期元素从左到右非金属性逐渐增强(不包括0族元素),同主族元素从下向上非金属性逐渐减弱。
问题
非金属性
金属性
处于非金属与金属分界线上的元素:
既能表现出一定的非金属性,又能表现出一定的金属性
Nb、Mo、Ru、Pd、Ag、Pt、Au等
不符合;
8s1
从ns开始到np结束:ns→(n-3)g→(n-2)f→(n-1)d→np
2 + 18 + 14 + 10 + 6 = 50 种
1s 2s→ 2p 3s→ 3p 4s→3d →4p 5s→ 4d→5p 6s→4f→ 5d→6p 7s→5f→
6d→7p
周期 一 二 三 四 五 六 七
元素数 2 8 8 18 18 32 32
原子结构与
元素周期表
电子排布与周期
电子排布与族
电子排布与元素分区
0族
ⅠA∽ⅦA; ⅢB∽ⅦB族序数=价电子数
s区:ⅠA∽ⅡA
d区:ⅢB∽ⅦB、Ⅷ
ds区:ⅠB∽ⅡB
p区: ⅢA∽ⅦA
f区:镧系和锕系
ⅠB∽ⅡB=ns电子数
周期序数=能层数
结构
位置 (以Sc为例)
决定
反应
对角线规则:某些主族元素与其右下方的主族元素的有些性质是相似的。Li与Mg,Be与Al,B与Si
(2)在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物,并且Li2O和MgO与水反应都十分缓慢。
元素 Li Na Be Mg
沸点/℃ 1 341 881.4 2 467 1 100
1、锂和镁的相似性
(1)锂与镁的沸点较为接近:
(3)能直接与氮气反应:
(4)锂和镁的氢氧化物加热分解:
生成相应的氮化物Li3N和Mg3N2。
Li2O、H2O和MgO、H2O。
(5)在碱金属的氟化物、碳酸盐和磷酸盐中:
只有锂盐是难溶于水的,
相应的镁盐也难溶于水。
2、铍和铝的相似性
(2)都可与酸、碱反应放出氢气
(3)铍在浓硝酸中也发生钝化
(1)二者的氧化物Al2O3和BeO的熔点和硬度都很高
(4)氧化物和氢氧化物都具有两性:
既能溶于强酸又能溶于强碱溶液
Al(OH)3+3HCl=AlCl3+3H2O
Be(OH)2+2HCl=BeCl2+2H2O
Al(OH)3+NaOH===Na[Al(OH)4]
Be(OH)2+2NaOH === Na2Be(OH)4
3、硼和硅的相似性
(1)自然界中B与Si均以化合物的形式存在。
(2)B与Si的单质都易与强碱反应,且不与稀酸反应:
2B+2KOH+2H2O = 2KBO2+3H2↑,
Si+2KOH+H2O= K2SiO3+2H2↑
B
主族的价层电子是最外层电子,副族的价层电子包含次外层的d或f能级
(1)第三周期第ⅦA族,P区
(2)第五周期第ⅣA族,P区
(3)第四周期第ⅤB族,d区
(4)第四周期第ⅠB族,ds区
(5)第四周期第ⅠA族,s区
(2022·湖南卷,2)B.化学家门捷列夫编制了第一张元素周期表
(2022·天津卷,2)C.Fe位于元素周期表的p区
(2022·北京卷,3)A. 38Sr(锶)位于元素周期表中第六周期第ⅡA族
(2022·湖南卷,5)D.原子序数为82的元素与Si位于同一主族
(2022·山东卷,16)(1)基态Ni原子的价电子排布式为_______,
在元素周期表中位置为_______。
(2021·广东卷,20)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
六
1s22s22p63s23p63d84s2
第四周期第Ⅷ族
(2021·浙江1月选考,16)现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如下表:
元素 相关信息
X 最外层电子数是核外电子总数的一半
Y 最高化合价和最低化合价之和为零
Z 单质为淡黄色固体,常存在于火山喷口附近
Q 同周期元素中原子半径最小
A.常温时,X单质能与水发生剧烈反应
D.第五周期且与Q同主族元素的单质在常温常压下呈液态
(2021·重庆卷,7)元素X、Y和Z可形成化合物X3Y3Z6, X的原子序数是Z的原子序数的5倍,1 mol X3Y3Z6含42mol质子,
A. X位于周期表的第二周期第VA族
(2021·河北卷,17)(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。
K+和P3-
谢谢观看
第二节 原子结构与元素的性质
第一章 原子结构与性质
第1课时 原子结构与元素周期表
1、元素周期律、元素周期系和元素周期表
2、构造原理与元素周期表
3、对角线规则
一、原子结构与元素周期表
元素周期律
元素的性质随元素
原子的核电荷数递增发生周期性递变规律
元素周期系
元素按其原子核电荷数递增排列的序列
元素周期表
呈现周期系的表格,元素周期系只有一个,元素周期表多种多样
1、元素周期律、元素周期系和元素周期表
门捷列夫制作了历史上第一张元素周期表
周
期
表
7个横行(七个周期)
18个列(16个族)
3个短周期
4个长周期
7个主族 (IA~VIIA)
0族: 稀有气体元素
8个副族
第VIII族 ( 第8、9、10这三个纵行)
(ⅠB~VIIB)
主族序数 =原子的最外层电子数
周期序数 =原子的电子层数
【思考】元素周期表中每个周期的元素数目分别是多少?为什么?
一
二
三
四
五
六
七
2种元素
8种元素
8种元素
18种元素
18种元素
32种元素
32种元素
2、构造原理与元素周期表
电子填入能级的顺序:1s→2s→2p→3s→3p→4s→3d→4p→5s→4d
→5p→6s→4f→5d→6p→7s→5f→6d→7p
ns→(n-2)f→(n-1)d→np
【思考】请你回忆第一周期到第四周期的元素的基态原子的价电子排布式,能找出什么规律?
第一周期:
电子排布从 开始,以 结束
1s1
1s2
各周期:
除第一周期外(1s1→1s2)
从 开始,以 结束
ns1
ns2np6
(n为能层序数=周期序数)
【思考】根据构造原理电子填入ns到np结束,中间可能还需要填入哪些能级?
ns → (n-2)f → (n-1)d → np
周期 序数 电子 层数 各周期电子填充从ns→np的能级 递增的 电子数 元素
数目
第一周期 1
第二周期 2
第三周期 3
第四周期 4
第五周期 5
第六周期 6
第七周期 7
2s→2p
3s → 3p
4s → 3d → 4p
5s → 4d → 5p
6s → 4f → 5d → 6p
7s → 5f → 6d → 7p
2
8
8
18
18
32
32
2
8
8
18
18
32
32
从ns能级开始以np结束递增的核电荷数(或电子数)
= 每个周期里的元素数目
1s
【思考】为什么原子的最外层电子数最多为8个?(K层为最外层最多2个)
七 个
2,8,8,18,18,32,32
第一能层的能级只有1s能级,最多排2个电子
18
基本相等
Ⅰ~ⅦA族、Ⅰ~ⅦB 和Ⅷ、0族
ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0族
非金属性
金属性
从金属元素过渡到非金属元素的区域,故称过渡元素
主族 价层电子
排布通式
族的划分与原子的价电子数目和价电子排布密切相关。
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
(1)主族序数=价电子数=基态原子的最外层电子数
0族 价层电子
排布通式
价电子排布:ns1~2或ns2np1~5
ns2np6
He除外,为1s2
(2)0族的价电子排布式为ns2np6
He为1s2
副族 价层电子排布通式
Ⅰ B
Ⅱ B
Ⅲ B
Ⅳ B
Ⅴ B
Ⅵ B
Ⅶ B
Ⅷ
(n-1)d1ns2
(n-1)d2ns2
(n-1)d3ns2
(n-1)d5ns1
(n-1)d5ns2
(n-1)d6~8ns2
(n-1)d10ns1
(n-1)d10ns2
ⅢB-ⅦB:族序数 = 价层电子数
=(n-1)d+ns电子总数
ⅠB-ⅡB:族序数 = ns的电子数=最外层电子数
(3)副族序数
过渡元素:价电子排布:(n-1)d1~10ns1~2
(镧系、锕系、Pd除外)
族的划分与原子的价电子数目和价电子排布密切相关。
ds区的价层电子排布通式
(n-1)d10ns1
(n-1)d10ns2
可认为核外电子因先填满了_______能级而后再填充 能级,得名ds区。
(n-1)d
ns
元素周期表可分为5个区。
f区
s 区
d 区
ds 区
p 区
电子填充的最后一个能级是s能级
电子填充的最后
一个能级是d能级
电子填充的最后
一个能级是p能级
先填满了(n-1)d能级而后填充ns能级
最外层电子数均不超过 ,容易 电子(H除外),
在化学反应中表现出 .
2
失去
s区有2列,d区有8列,ds区有2列、 p区有6列。
还原性(金属性)
非金属性
金属性
从原子结构方面来说,元素周期表中右上角三角区的元素,大多数的价层电子排布为ns2np1~5 。最外层电子数较多,得电子相对容易,失去电子相对较困难。从元素周期表中元素性质递变规律来说,同周期元素从左到右非金属性逐渐增强(不包括0族元素),同主族元素从下向上非金属性逐渐减弱。
问题
非金属性
金属性
处于非金属与金属分界线上的元素:
既能表现出一定的非金属性,又能表现出一定的金属性
Nb、Mo、Ru、Pd、Ag、Pt、Au等
不符合;
8s1
从ns开始到np结束:ns→(n-3)g→(n-2)f→(n-1)d→np
2 + 18 + 14 + 10 + 6 = 50 种
1s 2s→ 2p 3s→ 3p 4s→3d →4p 5s→ 4d→5p 6s→4f→ 5d→6p 7s→5f→
6d→7p
周期 一 二 三 四 五 六 七
元素数 2 8 8 18 18 32 32
原子结构与
元素周期表
电子排布与周期
电子排布与族
电子排布与元素分区
0族
ⅠA∽ⅦA; ⅢB∽ⅦB族序数=价电子数
s区:ⅠA∽ⅡA
d区:ⅢB∽ⅦB、Ⅷ
ds区:ⅠB∽ⅡB
p区: ⅢA∽ⅦA
f区:镧系和锕系
ⅠB∽ⅡB=ns电子数
周期序数=能层数
结构
位置 (以Sc为例)
决定
反应
对角线规则:某些主族元素与其右下方的主族元素的有些性质是相似的。Li与Mg,Be与Al,B与Si
(2)在过量的氧气中燃烧均生成正常氧化物,而不是过氧化物,并且Li2O和MgO与水反应都十分缓慢。
元素 Li Na Be Mg
沸点/℃ 1 341 881.4 2 467 1 100
1、锂和镁的相似性
(1)锂与镁的沸点较为接近:
(3)能直接与氮气反应:
(4)锂和镁的氢氧化物加热分解:
生成相应的氮化物Li3N和Mg3N2。
Li2O、H2O和MgO、H2O。
(5)在碱金属的氟化物、碳酸盐和磷酸盐中:
只有锂盐是难溶于水的,
相应的镁盐也难溶于水。
2、铍和铝的相似性
(2)都可与酸、碱反应放出氢气
(3)铍在浓硝酸中也发生钝化
(1)二者的氧化物Al2O3和BeO的熔点和硬度都很高
(4)氧化物和氢氧化物都具有两性:
既能溶于强酸又能溶于强碱溶液
Al(OH)3+3HCl=AlCl3+3H2O
Be(OH)2+2HCl=BeCl2+2H2O
Al(OH)3+NaOH===Na[Al(OH)4]
Be(OH)2+2NaOH === Na2Be(OH)4
3、硼和硅的相似性
(1)自然界中B与Si均以化合物的形式存在。
(2)B与Si的单质都易与强碱反应,且不与稀酸反应:
2B+2KOH+2H2O = 2KBO2+3H2↑,
Si+2KOH+H2O= K2SiO3+2H2↑
B
主族的价层电子是最外层电子,副族的价层电子包含次外层的d或f能级
(1)第三周期第ⅦA族,P区
(2)第五周期第ⅣA族,P区
(3)第四周期第ⅤB族,d区
(4)第四周期第ⅠB族,ds区
(5)第四周期第ⅠA族,s区
(2022·湖南卷,2)B.化学家门捷列夫编制了第一张元素周期表
(2022·天津卷,2)C.Fe位于元素周期表的p区
(2022·北京卷,3)A. 38Sr(锶)位于元素周期表中第六周期第ⅡA族
(2022·湖南卷,5)D.原子序数为82的元素与Si位于同一主族
(2022·山东卷,16)(1)基态Ni原子的价电子排布式为_______,
在元素周期表中位置为_______。
(2021·广东卷,20)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
六
1s22s22p63s23p63d84s2
第四周期第Ⅷ族
(2021·浙江1月选考,16)现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如下表:
元素 相关信息
X 最外层电子数是核外电子总数的一半
Y 最高化合价和最低化合价之和为零
Z 单质为淡黄色固体,常存在于火山喷口附近
Q 同周期元素中原子半径最小
A.常温时,X单质能与水发生剧烈反应
D.第五周期且与Q同主族元素的单质在常温常压下呈液态
(2021·重庆卷,7)元素X、Y和Z可形成化合物X3Y3Z6, X的原子序数是Z的原子序数的5倍,1 mol X3Y3Z6含42mol质子,
A. X位于周期表的第二周期第VA族
(2021·河北卷,17)(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。
K+和P3-
谢谢观看
