第3章物质的性质与转化章节测试(含解析)2023-2024学年高一上学期化学鲁科版(2019)必修第一册
文档属性
| 名称 | 第3章物质的性质与转化章节测试(含解析)2023-2024学年高一上学期化学鲁科版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 769.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 20:37:41 | ||
图片预览



文档简介
第3章 物质的性质与转化 章节测试
一、单选题(共12题)
1.下列有关物质的性质与用途具有对应关系的是
A.氨气具有还原性,可用作烟气中NOx脱除
B.Al2O3熔点高,可用作电解冶炼铝的原料
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.次氯酸具有弱酸性,可用作有色物质的漂白剂
2.下列有关化学反应的叙述正确的是
A.将Na2O2投入NH4Cl溶液中只可能生成一种气体
B.铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
C.SO2通入BaCl2溶液有白色沉淀BaSO3生成
D.向滴有酚酞的Na2CO3溶液中加入足量CaCl2溶液,溶液红色褪去
3.根据实验操作和现象得出的结论正确的是
选项 实验操作和现象 实验结论
A 用铂丝蘸取少量某溶液进行焰色试验,火焰呈黄色 溶液中一定不含
B 向某溶液中滴加盐酸酸化的溶液,有白色沉淀生成 该溶液中一定含有
C 向蔗糖中滴加浓硫酸,蔗糖变黑 浓硫酸具有吸水性
D 向KI溶液中滴加少量氯水,溶液变为棕黄色 氧化性:
A.A B.B C.C D.D
4.金属和合金是生活中常用的材料。下列说法正确的是
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2形成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
5.下列有关叙述正确的是
①氧化镁:可用作耐火材料;②二氧化硅:制造计算机芯片;③水玻璃:可作木材防火剂;④铝热反应既可用于焊接钢轨,也可用于工业上冶炼铁;⑤水煤气属于清洁能源;⑥浓硫酸:可用于干燥Cl2、SO 2、H2S 等气体;⑦“84”消毒液主要成分为次氯酸钠,使用时加入浓盐酸可以增强消毒效果;⑧用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
A.②③④⑤ B.②④⑤⑥ C.①③⑤⑧ D.①③⑥⑦
6.下列关于常见物质的说法不正确的是( )
A.以NaCl为原料,工业上可制备纯碱和烧碱
B.二氧化硫具有漂白性,可用于漂白纸浆及草帽等编织物
C.碳酸钡难溶于水,不易被X射线透过,可用作医学检查肠胃的内服药
D.铜盐能杀死某些细菌,可用作游泳馆池水消毒剂
7.“中国名片”、“中国制造”发展在众多领域受到世界瞩目,下列说法不正确的是
A.五彩缤纷的烟花利用焰色试验的原理
B.漂白粉漂白原理和SO2使品红溶液褪色的原理相同
C.氨易液化,汽化时会吸收大量热,可作制冷剂
D.抗击“新型冠状病毒”过程中用到的“84”消毒液的有效成分是NaClO
8.类推思想在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证。以下类推的结论中正确的是( )
A.SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色
B.盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气
C.SO2能使品红溶液褪色,故CO2也能使品红溶液褪色
D.常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化
9.化学与生产、生活密切相关。下列叙述正确的是
A.为推动生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属于一次能源
B.打印机墨粉中常加有,这是利用了其有颜色和具有磁性的特点,可用CuO替代
C.“天和”号核心舱上使用了目前世界上最先进的三结砷化镓太阳能电池翼,砷化镓属于半导体材料
D.煤经过气化和液化两个物理变化,可变为清洁能源
10.下列离子方程式中正确的是
A.向碳酸钠溶液中逐滴加入稀盐酸:CO+2H+=CO2↑+H2O
B.氧化铁粉末溶于稀盐酸:Fe2O3+6H+=2Fe3++3H2O
C.硫酸滴加到氢氧化钡溶液中:H++OH-=H2O
D.钠与水反应:Na+H2O=Na++OH-+H2↑
11.下列有关除杂的操作中不正确的是
A.溶液中含少量杂质:加入过量的粉,过滤
B.除去溶液中少量的:加入新制氯水
C.除溶液中少量的杂质可以向溶液中加入过量铁粉,然后过滤
D.除溶液中的杂质可以向溶液中加入过量铁粉
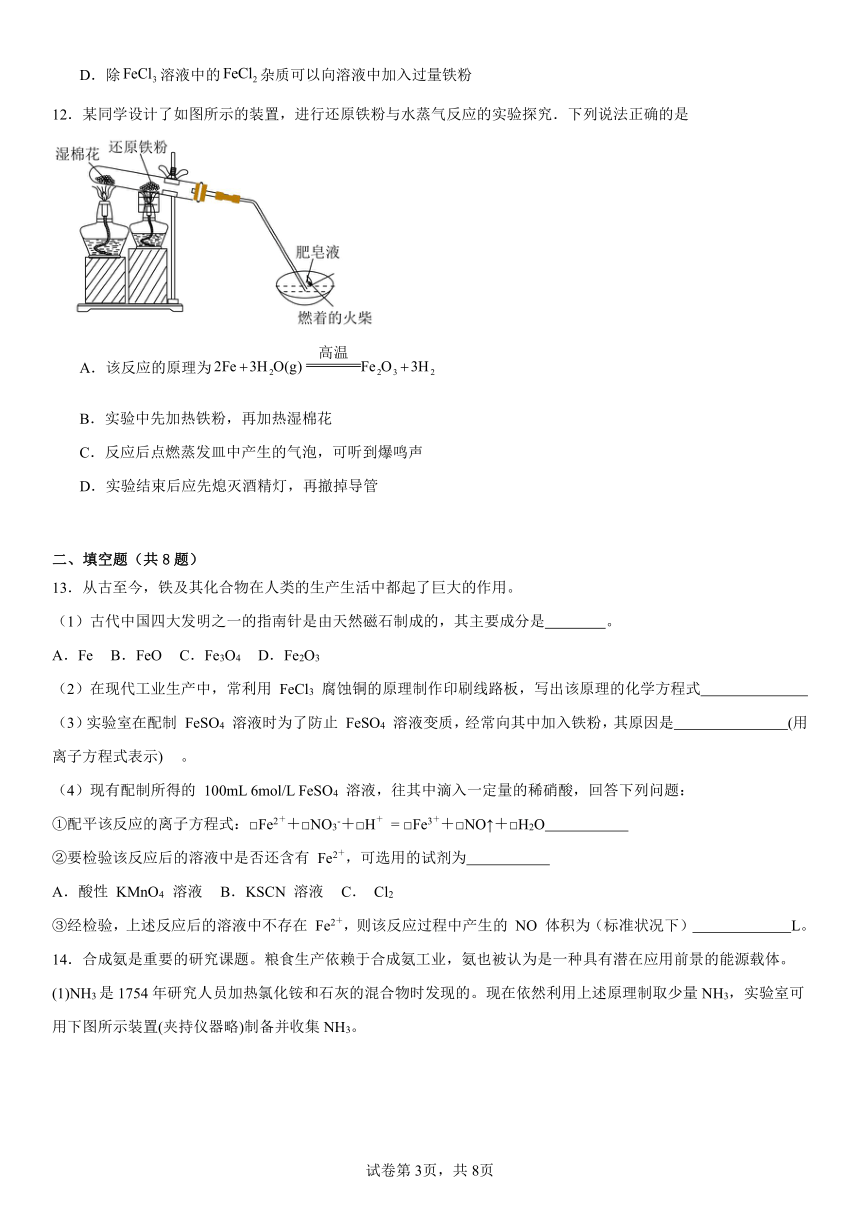
12.某同学设计了如图所示的装置,进行还原铁粉与水蒸气反应的实验探究.下列说法正确的是
A.该反应的原理为
B.实验中先加热铁粉,再加热湿棉花
C.反应后点燃蒸发皿中产生的气泡,可听到爆鸣声
D.实验结束后应先熄灭酒精灯,再撤掉导管
二、填空题(共8题)
13.从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是 (用离子方程式表示) 。
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,回答下列问题:
①配平该反应的离子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O
②要检验该反应后的溶液中是否还含有 Fe2+,可选用的试剂为
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下) L。
14.合成氨是重要的研究课题。粮食生产依赖于合成氨工业,氨也被认为是一种具有潜在应用前景的能源载体。
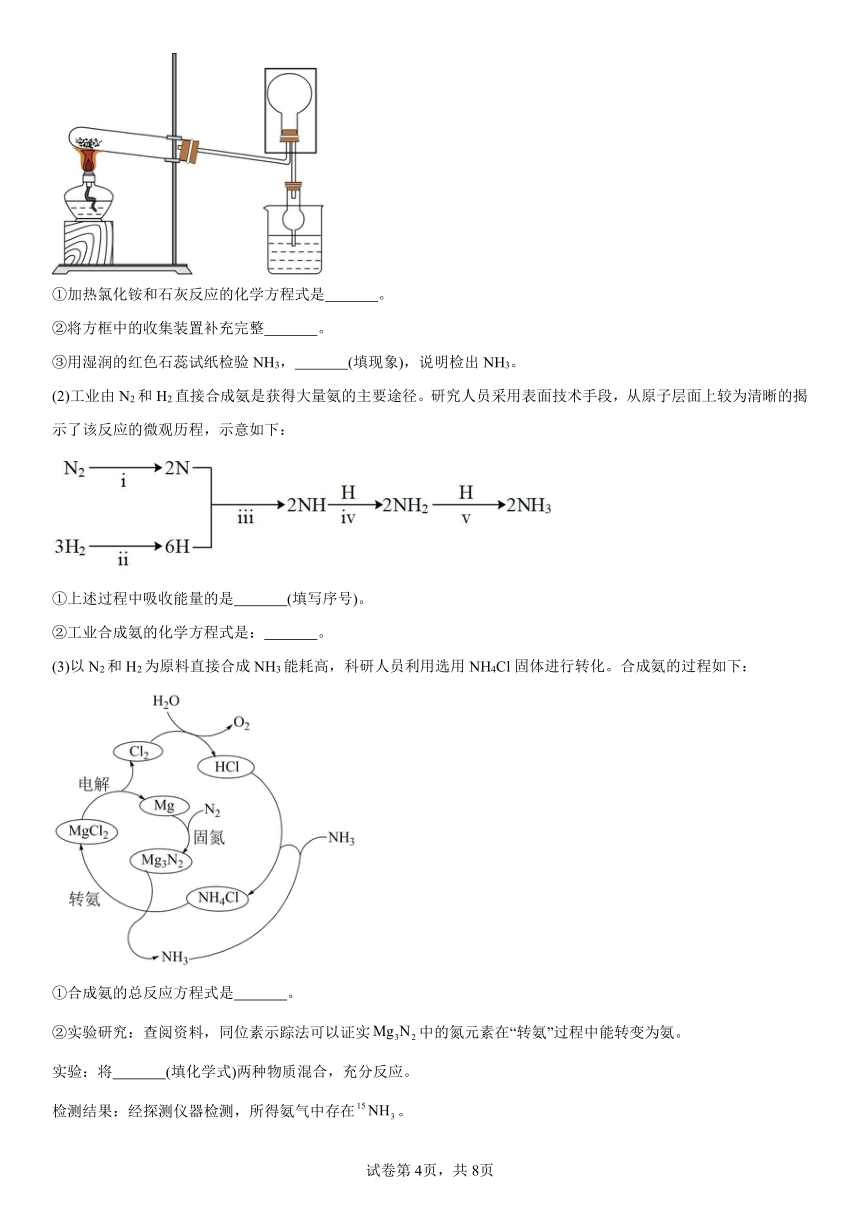
(1)NH3是1754年研究人员加热氯化铵和石灰的混合物时发现的。现在依然利用上述原理制取少量NH3,实验室可用下图所示装置(夹持仪器略)制备并收集NH3。
①加热氯化铵和石灰反应的化学方程式是 。
②将方框中的收集装置补充完整 。
③用湿润的红色石蕊试纸检验NH3, (填现象),说明检出NH3。
(2)工业由N2和H2直接合成氨是获得大量氨的主要途径。研究人员采用表面技术手段,从原子层面上较为清晰的揭示了该反应的微观历程,示意如下:
①上述过程中吸收能量的是 (填写序号)。
②工业合成氨的化学方程式是: 。
(3)以N2和H2为原料直接合成NH3能耗高,科研人员利用选用NH4Cl固体进行转化。合成氨的过程如下:
①合成氨的总反应方程式是 。
②实验研究:查阅资料,同位素示踪法可以证实中的氮元素在“转氨”过程中能转变为氨。
实验:将 (填化学式)两种物质混合,充分反应。
检测结果:经探测仪器检测,所得氨气中存在。
③测量的转化率:取固体、NH4Cl的混合物,混匀,充分反应。生成的NH3与的H2SO4恰好完全反应。的转化率为 。(摩尔质量为、摩尔质量为)
15.下列说法正确的是 。
①因为NH4HCO3受热易分解,故可用作氮肥
②下列物质间的转化能够实现:N2NH3NH4Cl(aq)
③NH4Cl溶液与Ca(OH)2溶液混合的离子方程式为H++OH-===H2O
④用生石灰与浓氨水制得的气体能使湿润的红色石蕊试纸变蓝,说明NH3为碱性气体
⑤检验溶液中是否含有:取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
⑥加热盛有NH4Cl的试管,试管底部有固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华
⑦实验室用NH4Cl制取氨气:
⑧施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
⑨加热NH4Cl和Ca(OH)2混合物,并将产生的气体通入酚酞溶液中,酚酞溶液变成红色
⑩测0.1mol/L氨水的pH为11的,氨水的电离方程式:NH3·H2O+OH-
向Al2(SO4)3溶液中加入过量氨水的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3
NH3、O2和HNO3三种物质中,任意两种物质在一定条件下均能发生反应
16.一定条件下,氮元素可发生如图所示的循环转化。
图中属于“氮的固定”的是 (填字母);转化过程为非氧化还原反应的是 ,过程h的化学方程式为: 。
17.化学物质在生活、生产中扮演着非常重要的角色。现有下列物质:①硅胶、②浓硫酸、③Na2O2、④NaClO、⑤SO2、⑥NaHCO3,按要求填空(填序号)。
(1)可用作食品干燥剂的是 。
(2)"84"消毒液的有效成分是 。
(3)既能与酸反应,又能与碱反应的是 。
(4)能使蔗糖变黑的是 。
(5)可以作为供氧剂的是 。
(6)能使品红溶液褪色的气体是 。
18.磷元素是生命体中重要的元素之一
(1)磷是某种核素中,中子数比质子数多一,则该核素的原子符号为 。
(2)磷化氢气体制取原理类似于实验室制取氨气,在加热的条件下用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式为 。
(3)实验室用硫酸铜溶液吸收PH3的化学方程式为24CuSO4+11PH3+12H2O=8Cu3P↓+3H2PO4+24H2SO4,其中还原剂 ,当生成196克H2SO4时,转移电子 mol。
(4)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1:1:1,写出相应的化学方程式: 。
(5)氧硫化碳水解及部分应用流程如图所示(部分产物已略去)COSH2SNa2S溶液M溶液+H2
①组成氧硫化碳的各原子中,原子半径最大的元素在周期表中的物质是 .
②已知M溶液中硫元素的主要存在形式为,则反应Ⅲ中生成的离子方程式为 。
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol)。由图象分析可知,a点时M溶液中除外,还有 (填含硫微粒的离子符号)
19.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知中铬元素是+3价,则其中铁元素是 价。是一种酸根离子,则属于 (填“酸”“碱”“盐”或“氧化物”)。
(2)明胶的水溶液和溶液共同具备的性质是 (填序号)。
a.都不稳定,密封放置沉淀 b.能产生丁达尔效应 c.分散质粒子可通过滤纸
(3)现有10mL明胶的水溶液与5mLK2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明SO能够透过半透膜: 。
20.为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”,其中包括8位中国青年化学家。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)上图为汞的原子结构示意图,汞在第 周期。
(2)①叠氮化钠可用于汽车安全气囊的产气药,在撞击时能发生分解反应生成两种单质。计算理论上完全分解,释放出标准状况下的气体体积 L。
②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平,并用单线桥表示电子转移情况 。
___________________ ________AlN+________CO
(3)利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的“价—类”二维图:
①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有 (填化学式)。
②Z的浓溶液与铝单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为 ,可用 法收集Y(填序号)
A.向上排空气 B.向下排空气 C.排饱和食盐水 D.排饱和溶液
③Y和均能使品红溶液褪色,但两种气体按一定比例同时通入品红溶液中无明显现象。请用离子方程式解释原因 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.NH3与NO及NO2在催化剂条件下反应生成N2和H2O,实现氮氧化物脱除,描述正确,符合题意;
B.电解铝选择Al2O3是因为Al2O3是离子化合物,而AlCl3是共价化合物,熔融态下是分子结构而不是离子结构,AlCl3无法作为电解铝材料;Al2O3熔点高,所以电解氧化铝时需加助剂冰晶石来降低固体的熔化温度,对应错误,不符题意;
C.浓硫酸作为酯化反应的催化剂是利用浓硫酸的脱水性和吸水性,对应错误,不符题意;
D.次氯酸具有漂白性,用于有色有机物质的漂白,对应错误,不符题意;
综上,本题选A。
2.D
【详解】A.过氧化钠和水反应得到氢氧化钠和氧气,氢氧化钠和铵盐反应可以得到氨气,因此一共有两种气体,A项错误;
B.铁和稀盐酸反应得到的是,铁和氯气反应得到的是最高价氯化物,B项错误;
C.氯化钡溶液不吸收、,因为弱酸不能制强酸,C项错误;
D.纯碱溶液中,由于发生水解反应CO32-+H2OHCO3-+OH-显碱性遇酚酞变红,向溶液中加入CaCl2与CO32-结合生成难溶的碳酸钙,平衡逆向移动,使红色褪去,D项正确;
答案选D。
3.D
【详解】A.用铂丝蘸取少量某溶液进行焰色试验,火焰呈黄色,说明溶液中一定含有Na+,是否含有K+需要透过蓝色钴玻璃再观察火焰是否呈紫色,A错误;
B.向某溶液中滴加盐酸酸化的溶液,有白色沉淀生成,不能说明该溶液中一定含有,可能还有Ag+的干扰,B错误;
C.向蔗糖中滴加浓硫酸,蔗糖变黑,说明浓硫酸具有脱水性而不是吸水性,C错误;
D.向KI溶液中滴加少量氯水,溶液变为棕黄色,说明发生了反应:Cl2+2KI=2KCl+I2,故能得出氧化性:的结论,D正确;
故答案为:D。
4.B
【详解】A.不锈钢中含碳元素,所以A选项错误;
B.镧合金能大量吸收H2形成金属氢化物,将这些金属氢化物加热,它们又会分解,将储存在其中的氢释放出来,可作储氢材料,B选项正确;
C.目前世界上使用量最大的合金是钢铁,C选项错误;
D.铁粉和水在高温条件下才能发生置换反应得到氢气,D选项错误;
答案选B。
5.C
【分析】①氧化镁是离子化合物,离子键强,熔点高;
②二氧化硅能全反射光,可作光纤;
③水玻璃是硅酸钠溶液的俗名,不能燃烧和支持燃烧;
④铝热反应原理是铝与氧化铁反应生成铁和氧化铝,工业上冶炼铁原理是CO还原铁的氧化物得到铁;
⑤水煤气主要成分是H2和CO,燃烧产物是H2O和CO2;
⑥浓硫酸与Cl2、SO2等不反应,能氧化H2S生成S或SO2;
⑦次氯酸钠和盐酸可发生有毒气体氯气;
⑧白色污染是塑料制品降解程度差、对环境造成的污染。
【详解】①氧化镁具有较高熔点,可用作耐火材料,故①正确;
②二氧化硅能全反射光,可作光纤,Si是良好的半导体材料,可制造计算机芯片,故②错误;
③水玻璃是硅酸钠溶液的俗名,不能燃烧和支持燃烧,可作木材防火剂,故③正确;
④铝热反应原理是铝与氧化铁反应生成铁和氧化铝,液态铁用于焊接钢轨,但不用于工业上冶炼铁,工业上冶炼铁原理CO还原铁的氧化物得到铁,故④错误;
⑤水煤气主要成分是H2和CO,完全燃烧产物是H2O和CO2,无污染,所以水煤气属于清洁能源,故⑤正确;
⑥浓硫酸能氧化H2S生成S或SO2,会造成二次污染,不能用于干燥H2S气体,故⑥错误;
⑦“84”消毒液主要成分为次氯酸钠,次氯酸钠和盐酸可发生有毒气体氯气,所以二者不能混用,故⑦错误;
⑧白色污染是塑料制品不能降解从而对环境造成的污染,若用CO2合成的是可降解的聚碳酸酯塑料,降解生成二氧化碳,可以减少白色污染和危害,故⑧正确;
故答案选C。
6.C
【详解】A.侯氏制碱法原料为二氧化碳、氨气、水、NaCl,电解饱和食盐水可制得烧碱,故以NaCl为原料,工业上可制备纯碱和烧碱, A正确;
B.二氧化硫具有漂白性,可用于漂白纸浆及草帽等编织物,B正确;
C.碳酸钡能和胃液中的HCl反应产生Ba2+,Ba2+是重金属离子,能使蛋白质变性而使人中毒,不可服用,C错误;
D.铜盐属于重金属盐,能使细菌蛋白质变性,可用作游泳馆池水消毒剂,D正确。
答案选C。
7.B
【详解】A.不同的金属在灼烧时会产生不同的焰色,五彩缤纷的烟花是由多种金属离子发生焰色试验产生的结果,A正确;
B.漂白粉漂白原理是利用ClO-的强氧化性,发生氧化还原反应,SO2使品红溶液褪色的原理是利用二氧化硫与品红结合生成无色化合物,发生非氧化还原反应,B不正确;
C.氨易液化,表明氨分子间作用力较大,汽化时需要消耗较多的能量,需要从周围环境中吸收大量热,所以可作制冷剂,C正确;
D.“84”消毒液是用Cl2通入NaOH溶液中制得的,其有效成分是NaClO,D正确;
故选B。
8.D
【详解】A.SO2能使酸性KMnO4溶液褪色,是因为其具有还原性,二氧化碳没有还原性,不能与KMnO4反应,故A错误;
B.硝酸具有强的氧化性,与活泼金属反应得不到氢气,故B错误;
C.SO2能使品红溶液褪色,是因为其具有漂白性,二氧化碳没有漂白性,所以CO2不能使品红溶液褪色,故C错误;
D.浓硫酸与浓硝酸都具有强的氧化性,室温下,都能使铁和铝发生钝化,故D正确;
答案选D。
9.C
【详解】A.核电、电能属于二次能源,故A错误;
B.打印机墨粉中常加有Fe3O4,这是利用了其有颜色和具有磁性的特点,CuO不具有磁性,不能替代Fe3O4,故B错误;
C.砷化镓最外层平均4个电子类似于硅,是优良的第三代半导体材料,故C正确;
D.煤的气化和液化均生成新物质,为化学变化,故D错误;
故选C。
10.B
【详解】A.向碳酸钠溶液中逐滴加入稀盐酸,应该先生成碳酸氢钠,再生成水和二氧化碳,,离子方程式为:CO+H+= HCO,H++ HCO= CO2↑+H2O,故A错误;
B.氧化铁粉末溶于稀盐酸反应产生氯化铁和水,反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,故B正确;
C.硫酸滴加到氢氧化钡溶液中,发生反应产生硫酸钡沉淀和水,反应的离子方程式是:2H++SO42-+ Ba2++2OH-= BaSO4↓+2H2O,故C错误;
D.钠与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故D错误。
答案选B。
11.D
【详解】A.加入过量的铁粉,发生反应,再经过过滤,能够除去杂质,A正确;
B.新制氯水与反应:,可以除去杂质,B正确;
C.向含有少量的溶液中加入过量粉:,过滤即可除杂,C正确;
D.与氯化铁反应,将原物质除去,不能除杂,应向该溶液中通入足量的氯气,D错误;
故选D。
12.C
【详解】A.反应的化学方程式为:,故A错误;
B.实验中应该先加热湿棉花,产生水蒸气,再加热铁粉,故B错误;
C.加热时试管内铁粉红热,点燃肥皂泡,因混有空气可听到爆鸣声,故C正确;
D.实验结束后为防止倒吸应该先撤导管后熄灭酒精灯,故D错误。
故选C。
13. C 2FeCl3 + Cu = 2FeCl2 + CuCl2 Fe +2Fe3+ = 3Fe2+ 3Fe2++NO3-+4H+ = 3Fe3++NO↑+2H2O A 4.48
【分析】(1)四氧化三铁是一种具有磁性的黑色晶体;
(2)三价铁可以氧化铜单质为铜离子;
(3)亚铁离子具有还原性;
(4)①根据电荷守恒和原子守恒配平方程式;
②亚铁离子具有还原性;
③依据方程式进行计算;
【详解】(1)指南针是由天然磁石制成的,其主要成分是四氧化三铁,选项C符合,
故选:C。
(2)利用 FeCl3 腐蚀铜的原理制作印刷线路板,铁离子把铜单质氧化成铜离子,化学方程式是2FeCl3 + Cu = 2FeCl2 + CuCl2,
故答案为:2FeCl3 + Cu = 2FeCl2 + CuCl2;
(3)配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是Fe +2Fe3+ = 3Fe2+,
故答案为:Fe +2Fe3+ = 3Fe2+;
(4)①铁元素的化合价有+2价升高为+3价,氮元素的化合价由+5价降低到+2价,有电子,电荷及原子守恒可知离子反应为3Fe2++NO3-+4H+ = 3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+ = 3Fe3++NO↑+2H2O;
②亚铁离子具有还原性,可以使酸性高锰酸钾溶液褪色,
故选:A。
③反应后的溶液中不含有亚铁离子,说明亚铁离子全部参与反应,n(Fe2+)=c×V=0.1L×6mol/L=0.6mol,依据物质的量之比等于化学计量数之比,可得n(NO)= n(Fe2+)=0.2mol,V(n(Fe2+))=n×Vm=0.2mol×22.4L/mol=4.48L,
故答案为:4.48
14.(1) 或 试纸变蓝
(2) ⅰ,ⅱ
(3)
【详解】(1)①根据题意可知,热氯化铵和石灰的混合物可以制取氨气,反应的化学方程式:2NH4Cl+Ca(OH)2CaCl2+2NH3+2H2O(或2NH4Cl+CaOCaCl2+2NH3↑+H2O);
②根据NH3的物理性质,氨气密度比空气小,收集NH3时导管应长进短出,如图所示;
③NH3的水溶液显碱性,NH3能使湿润的红色石蕊试纸变蓝;
(2)①过程ⅰ、ⅱ分别是N22N和H22H,依据化学反应中,断裂化学键吸收能量,形成化学键放出能量,可知过程ⅰ、ⅱ为吸收能量;
②工业合成氨的化学方程式:N2+3H22NH3;
(3)①由NH4Cl固体转化图可知,合成氨总反应方程式是:2N2+6H2O4NH3+3O2;
②为了证实了Mg3N2中的氮元素在“转氨”过程中能转变为NH3,可以利用同位素对Mg3N2中的N元素进行同位素标记,通过检验NH3中是否含有该同位素即可,所以需要将Mg315N2和14NH4Cl混合,充分反应;
③依据:Mg3N2+6NH4Cl=3MgCl2+8NH3,由于生成的NH3与v mL cmol L 1的H2SO4恰好完全反应,n(NH3)=2cv×10 3mol,依据Mg3N2+6NH4Cl=3MgCl2+8NH3,Mg3N2~8NH3,可知,反应的n(Mg3N2)=cv×10 3mol,Mg3N2转化率=;
15.②④⑤⑧⑨⑩
【详解】①NH4HCO3用作氮肥是因为其中含有氮元素,易被农作物吸收,与热稳定性无关,①错误;
②N2+3H22NH3、NH3+HCl=NH4Cl,②正确;
③NH4Cl溶液与Ca(OH) 2溶液混合产生NH3·H2O,③错误;
④NH3制备可以采取浓氨水和生石灰制取,可用湿润的红色石蕊试纸检验,试纸变蓝则说明NH3为碱性气体,④正确;
⑤检验氨气的方法正确,⑤正确;
⑥不是升华,试管底部NH4Cl分解生成NH3和HCl,试管口NH3与HCl反应生成了NH4Cl,发生了化学反应,⑥错误;
⑦NH4Cl受热分解,离开热源又会重新生成NH4Cl,得不到氨气,且氨气极易溶于水,不能用排水法收集,⑦错误;
⑧草木灰的有效成分K2CO3是强碱弱酸盐,水解使溶液显碱性,而NH4Cl是强酸弱碱盐,水解使溶液显酸性,当施肥时若把草木灰(有效成分为K2CO3)与NH4Cl混合使用,则二者的水解作用相互促进,发生的双水解反应的离子方程式为:CO32-+2NH4+= CO2↑+NH3↑ +H2O,这样N元素就会以氨气的形式逸出从而使肥效会降低,⑧正确;
⑨加热氯化铵和氢氧化钙混合物,通入酚酞溶液变红,说明有碱性气体产生,⑨正确;
⑩0.1mol/L氨水的pH为11,说明氨水为弱电解质,存在电离平衡,故电离方程式应用可逆号连接,⑩错正确;
氨水是弱碱不能溶解氢氧化铝,则向Al2(SO4)3溶液中加入过量氨水的离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH4+, 正确;
O2和HNO3二者不能反应, 错误;
综上所述,答案为②④⑤⑧⑨⑩ 。
16. k、c a、d 3NO2+H2O=2HNO3+NO
【详解】氮的固定是将游离态的氮转化为化合态的氮的过程。k过程是氮气转化为氨气,c过程是氮气转化为N2O,属于氮的固定;a和d是氨气和铵根离子间的转化,氮元素的化合价均为-3价,转化过程中没有化合价的变化,是非氧化还原反应;过程h是NO2转化为,可以是NO2和水反应生成硝酸和NO,反应的化学方程式为:3NO2+H2O=2HNO3+NO。
17.(1)①
(2)④
(3)⑥
(4)②
(5)③
(6)⑤
【详解】(1)硅胶具有吸水性,且无毒,可以用作食品干燥剂,浓硫酸虽然也能作干燥剂,但由于其强烈的腐蚀性,故不能用作食品干燥剂,故此处选①;
(2)“84”消毒液由Cl2和NaOH溶液反应得到,即Cl2+2NaOH=NaClO+NaCl+H2O,故“84”消毒液含有成分NaClO、NaCl,其中有效成分是NaClO,故此处选④;
(3)由反应和,知NaHCO3符合题意,故此处选⑥;
(4)蔗糖为含有C、H、O三种元素的有机物,浓硫酸具有脱水性,可将蔗糖组成中的H、O元素脱出形成水,从而使蔗糖碳化变黑,故此处选②;
(5)过氧化钠能和水或二氧化碳反应生成氧气,故此处选③;
(6)二氧化硫气体具有漂白性,能使有色物质褪色,故此处选⑤。
18. PH4I+NaOH PH3↑+NaI+H2O PH3 2 KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑ 第三周期第ⅥA族 2S2 +5H2O +4H2↑+2OH-
【详解】(1)磷是某种核素中,中子数比质子数多一即为16,质量数为31,则该核素的原子符号为;故答案为:。
(2)加热的条件下用碘化磷(PH4I)和烧碱反应制取PH3、NaI和H2O,其化学方程式为PH4I+NaOH PH3↑+NaI+H2O;故答案为:PH4I+NaOH PH3↑+NaI+H2O。
(3)24CuSO4+11PH3+12H2O=8Cu3P↓+3H2PO4+24H2SO4,PH3中P化合价升高,PH3作还原剂,CuSO4中Cu化合价降低,根据反应方程式分析转移了24mol电子,生成24mol硫酸,当生成196克H2SO4即物质的量为2mol,转移电子2mol;故答案为:PH3;2。
(4)粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1:1:1,说明KSCN与浓硫酸反应生成KHSO4、NH4HSO4和COS,其化学方程式:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑;故答案为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑。
(5)①组成氧硫化碳的各原子中,原子半径最大的元素是S,S在周期表中的物质是第三周期第ⅥA族;故答案为:第三周期第ⅥA族。
②已知M溶液中硫元素的主要存在形式为,说明S2 化合价升高变为,则H2O 中H化合价降低变为H2,因此根据得失电子守恒得到反应Ⅲ中生成的离子方程式为2S2 +5H2O +4H2↑+2OH-;故答案为:2S2 +5H2O +4H2↑+2OH-。
③Na2S初始含量为3mmol,如果只发生2S2 +5H2O +4H2↑+2OH-,则会生成氢气。但图中H2有10mmol,说明化合价降低总数为20mmol电子,则失去电子总数也应该为20mmol电子,则说明S2 升高的价态比价态还高,故还有;故答案为:。
19.(1) +2 盐
(2)c
(3)取少许半透膜袋外的蒸馏水于试管中,滴加BaCl2溶液产生白色沉淀,说明SO能够透过半透膜
【解析】(1)
根据化合物中元素化合价的代数和等于零计算出铁元素的化合价为+2价,盐是由金属离子或铵根离子和酸根离子组成的化合物,所以Fe(CrO2)2属于盐;
(2)
a.溶液很稳定,a项错误;
b.胶体具有丁达尔效应而溶液没有,b项错误;
C.胶体和溶液中的分散质都能透过滤纸,c项正确;
故选c;
(3)
检验SO可用可溶性钡盐,但需用盐酸酸化,具体操作为:取少许半透膜袋外的蒸馏水于试管中,滴加BaCl2溶液产生白色沉淀,说明SO能够透过半透膜。
20.(1)六
(2) 33.6
(3) SO2、H2SO3、Na2SO3 2Al +6H2SO4(浓) 3SO2↑+Al2(SO4)3+6H2O AD SO2+Cl2+2H2O =2Cl-++4H+
【详解】(1)上图为汞的原子结构示意图,汞原子核外电子有6个电子层,说明汞在第六周期;故答案为:六。
(2)①在撞击时能发生分解反应生成两种单质即氮气和钠,其方程式为,(物质的量为1mol)完全分解,释放出氮气1.5mol,则标准状况下的气体体积1.5mol×22.4 L mol 1=33.6L;故答案为:33.6。
②氮气中由0价变为 3价,降低6个价态,碳化合价升高,升高2个价态,根据化合价升降守恒得到氮气系数为1,碳系数为3,一氧化碳系数为3,氮化铝系数为2,氧化铝系数为1,得到1132AlN+3CO,单线桥表示电子转移为 ;故答案为: 。
(3)①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物,说明该化合物中硫处于中间价态即有SO2、H2SO3、Na2SO3;故答案为:SO2、H2SO3、Na2SO3。
②Z的浓溶液与铝单质在加热条件下可以发生化学反应生成Y(SO2)、硫酸铝和水,该反应的化学方程式为2Al +6H2SO4(浓) 3SO2↑+Al2(SO4)3+6H2O,二氧化硫密度比空气大,可采用向上排空气法收集,二氧化硫易溶于水,不能采用排水法收集,但可采用排饱和亚硫酸氢钠溶液法收集二氧化硫;故答案为:2Al +6H2SO4(浓) 3SO2↑+Al2(SO4)3+6H2O;AD。
③Y和均能使品红溶液褪色,但两种气体按一定比例同时通入品红溶液中无明显现象,主要两者反应在水中生成硫酸和盐酸而没有漂白性,其离子方程式为SO2+Cl2+2H2O =2Cl-++4H+;故答案为:SO2+Cl2+2H2O =2Cl-++4H+。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.下列有关物质的性质与用途具有对应关系的是
A.氨气具有还原性,可用作烟气中NOx脱除
B.Al2O3熔点高,可用作电解冶炼铝的原料
C.浓硫酸具有强氧化性,可用作酯化反应的催化剂
D.次氯酸具有弱酸性,可用作有色物质的漂白剂
2.下列有关化学反应的叙述正确的是
A.将Na2O2投入NH4Cl溶液中只可能生成一种气体
B.铁分别与稀盐酸和氯气反应,产物中铁元素的化合价相同
C.SO2通入BaCl2溶液有白色沉淀BaSO3生成
D.向滴有酚酞的Na2CO3溶液中加入足量CaCl2溶液,溶液红色褪去
3.根据实验操作和现象得出的结论正确的是
选项 实验操作和现象 实验结论
A 用铂丝蘸取少量某溶液进行焰色试验,火焰呈黄色 溶液中一定不含
B 向某溶液中滴加盐酸酸化的溶液,有白色沉淀生成 该溶液中一定含有
C 向蔗糖中滴加浓硫酸,蔗糖变黑 浓硫酸具有吸水性
D 向KI溶液中滴加少量氯水,溶液变为棕黄色 氧化性:
A.A B.B C.C D.D
4.金属和合金是生活中常用的材料。下列说法正确的是
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2形成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
5.下列有关叙述正确的是
①氧化镁:可用作耐火材料;②二氧化硅:制造计算机芯片;③水玻璃:可作木材防火剂;④铝热反应既可用于焊接钢轨,也可用于工业上冶炼铁;⑤水煤气属于清洁能源;⑥浓硫酸:可用于干燥Cl2、SO 2、H2S 等气体;⑦“84”消毒液主要成分为次氯酸钠,使用时加入浓盐酸可以增强消毒效果;⑧用CO2合成可降解的聚碳酸酯塑料,能减少白色污染及其危害
A.②③④⑤ B.②④⑤⑥ C.①③⑤⑧ D.①③⑥⑦
6.下列关于常见物质的说法不正确的是( )
A.以NaCl为原料,工业上可制备纯碱和烧碱
B.二氧化硫具有漂白性,可用于漂白纸浆及草帽等编织物
C.碳酸钡难溶于水,不易被X射线透过,可用作医学检查肠胃的内服药
D.铜盐能杀死某些细菌,可用作游泳馆池水消毒剂
7.“中国名片”、“中国制造”发展在众多领域受到世界瞩目,下列说法不正确的是
A.五彩缤纷的烟花利用焰色试验的原理
B.漂白粉漂白原理和SO2使品红溶液褪色的原理相同
C.氨易液化,汽化时会吸收大量热,可作制冷剂
D.抗击“新型冠状病毒”过程中用到的“84”消毒液的有效成分是NaClO
8.类推思想在化学学习与研究中经常被采用,但类推出的结论是否正确最终要经过实验的验证。以下类推的结论中正确的是( )
A.SO2能使酸性KMnO4溶液褪色,故CO2也能使酸性KMnO4溶液褪色
B.盐酸与镁反应生成氢气,故硝酸与镁反应也生成氢气
C.SO2能使品红溶液褪色,故CO2也能使品红溶液褪色
D.常温下浓硫酸能使铁和铝钝化,故常温下浓硝酸也能使铁和铝钝化
9.化学与生产、生活密切相关。下列叙述正确的是
A.为推动生态文明建设,我国近年来大力发展核电、光电、风电、水电,电能属于一次能源
B.打印机墨粉中常加有,这是利用了其有颜色和具有磁性的特点,可用CuO替代
C.“天和”号核心舱上使用了目前世界上最先进的三结砷化镓太阳能电池翼,砷化镓属于半导体材料
D.煤经过气化和液化两个物理变化,可变为清洁能源
10.下列离子方程式中正确的是
A.向碳酸钠溶液中逐滴加入稀盐酸:CO+2H+=CO2↑+H2O
B.氧化铁粉末溶于稀盐酸:Fe2O3+6H+=2Fe3++3H2O
C.硫酸滴加到氢氧化钡溶液中:H++OH-=H2O
D.钠与水反应:Na+H2O=Na++OH-+H2↑
11.下列有关除杂的操作中不正确的是
A.溶液中含少量杂质:加入过量的粉,过滤
B.除去溶液中少量的:加入新制氯水
C.除溶液中少量的杂质可以向溶液中加入过量铁粉,然后过滤
D.除溶液中的杂质可以向溶液中加入过量铁粉
12.某同学设计了如图所示的装置,进行还原铁粉与水蒸气反应的实验探究.下列说法正确的是
A.该反应的原理为
B.实验中先加热铁粉,再加热湿棉花
C.反应后点燃蒸发皿中产生的气泡,可听到爆鸣声
D.实验结束后应先熄灭酒精灯,再撤掉导管
二、填空题(共8题)
13.从古至今,铁及其化合物在人类的生产生活中都起了巨大的作用。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 。
A.Fe B.FeO C.Fe3O4 D.Fe2O3
(2)在现代工业生产中,常利用 FeCl3 腐蚀铜的原理制作印刷线路板,写出该原理的化学方程式
(3)实验室在配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是 (用离子方程式表示) 。
(4)现有配制所得的 100mL 6mol/L FeSO4 溶液,往其中滴入一定量的稀硝酸,回答下列问题:
①配平该反应的离子方程式:□Fe2++□NO3-+□H+ = □Fe3++□NO↑+□H2O
②要检验该反应后的溶液中是否还含有 Fe2+,可选用的试剂为
A.酸性 KMnO4 溶液 B.KSCN 溶液 C. Cl2
③经检验,上述反应后的溶液中不存在 Fe2+,则该反应过程中产生的 NO 体积为(标准状况下) L。
14.合成氨是重要的研究课题。粮食生产依赖于合成氨工业,氨也被认为是一种具有潜在应用前景的能源载体。
(1)NH3是1754年研究人员加热氯化铵和石灰的混合物时发现的。现在依然利用上述原理制取少量NH3,实验室可用下图所示装置(夹持仪器略)制备并收集NH3。
①加热氯化铵和石灰反应的化学方程式是 。
②将方框中的收集装置补充完整 。
③用湿润的红色石蕊试纸检验NH3, (填现象),说明检出NH3。
(2)工业由N2和H2直接合成氨是获得大量氨的主要途径。研究人员采用表面技术手段,从原子层面上较为清晰的揭示了该反应的微观历程,示意如下:
①上述过程中吸收能量的是 (填写序号)。
②工业合成氨的化学方程式是: 。
(3)以N2和H2为原料直接合成NH3能耗高,科研人员利用选用NH4Cl固体进行转化。合成氨的过程如下:
①合成氨的总反应方程式是 。
②实验研究:查阅资料,同位素示踪法可以证实中的氮元素在“转氨”过程中能转变为氨。
实验:将 (填化学式)两种物质混合,充分反应。
检测结果:经探测仪器检测,所得氨气中存在。
③测量的转化率:取固体、NH4Cl的混合物,混匀,充分反应。生成的NH3与的H2SO4恰好完全反应。的转化率为 。(摩尔质量为、摩尔质量为)
15.下列说法正确的是 。
①因为NH4HCO3受热易分解,故可用作氮肥
②下列物质间的转化能够实现:N2NH3NH4Cl(aq)
③NH4Cl溶液与Ca(OH)2溶液混合的离子方程式为H++OH-===H2O
④用生石灰与浓氨水制得的气体能使湿润的红色石蕊试纸变蓝,说明NH3为碱性气体
⑤检验溶液中是否含有:取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
⑥加热盛有NH4Cl的试管,试管底部有固体消失,试管口有晶体凝结,说明NH4Cl固体可以升华
⑦实验室用NH4Cl制取氨气:
⑧施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用,是因为K2CO3与NH4Cl反应生成氨气会降低肥效
⑨加热NH4Cl和Ca(OH)2混合物,并将产生的气体通入酚酞溶液中,酚酞溶液变成红色
⑩测0.1mol/L氨水的pH为11的,氨水的电离方程式:NH3·H2O+OH-
向Al2(SO4)3溶液中加入过量氨水的离子方程式:Al3++3NH3·H2O=Al(OH)3↓+3
NH3、O2和HNO3三种物质中,任意两种物质在一定条件下均能发生反应
16.一定条件下,氮元素可发生如图所示的循环转化。
图中属于“氮的固定”的是 (填字母);转化过程为非氧化还原反应的是 ,过程h的化学方程式为: 。
17.化学物质在生活、生产中扮演着非常重要的角色。现有下列物质:①硅胶、②浓硫酸、③Na2O2、④NaClO、⑤SO2、⑥NaHCO3,按要求填空(填序号)。
(1)可用作食品干燥剂的是 。
(2)"84"消毒液的有效成分是 。
(3)既能与酸反应,又能与碱反应的是 。
(4)能使蔗糖变黑的是 。
(5)可以作为供氧剂的是 。
(6)能使品红溶液褪色的气体是 。
18.磷元素是生命体中重要的元素之一
(1)磷是某种核素中,中子数比质子数多一,则该核素的原子符号为 。
(2)磷化氢气体制取原理类似于实验室制取氨气,在加热的条件下用碘化磷(PH4I)和烧碱反应制取PH3的化学方程式为 。
(3)实验室用硫酸铜溶液吸收PH3的化学方程式为24CuSO4+11PH3+12H2O=8Cu3P↓+3H2PO4+24H2SO4,其中还原剂 ,当生成196克H2SO4时,转移电子 mol。
(4)氧硫化碳(COS)可替代磷化氢而被用作熏蒸剂.粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1:1:1,写出相应的化学方程式: 。
(5)氧硫化碳水解及部分应用流程如图所示(部分产物已略去)COSH2SNa2S溶液M溶液+H2
①组成氧硫化碳的各原子中,原子半径最大的元素在周期表中的物质是 .
②已知M溶液中硫元素的主要存在形式为,则反应Ⅲ中生成的离子方程式为 。
③如图是反应Ⅲ中,在不同反应温度下,反应时间与H2产量的关系(Na2S初始含量为3mmol)。由图象分析可知,a点时M溶液中除外,还有 (填含硫微粒的离子符号)
19.央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。由工业明胶制成的胶囊往往含有超标重金属铬,会对人体造成伤害。明胶是水溶性蛋白质混合物,溶于水形成胶体。
(1)已知中铬元素是+3价,则其中铁元素是 价。是一种酸根离子,则属于 (填“酸”“碱”“盐”或“氧化物”)。
(2)明胶的水溶液和溶液共同具备的性质是 (填序号)。
a.都不稳定,密封放置沉淀 b.能产生丁达尔效应 c.分散质粒子可通过滤纸
(3)现有10mL明胶的水溶液与5mLK2SO4溶液混合装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中,设计实验证明SO能够透过半透膜: 。
20.为纪念元素周期表诞生150周年,IUPAC等向世界介绍118位优秀青年化学家,并形成一张“青年化学家元素周期表”,其中包括8位中国青年化学家。中国学者雷晓光、姜雪峰、刘庄分别成为“N、S、Hg”元素的代言人。回答下列问题:
(1)上图为汞的原子结构示意图,汞在第 周期。
(2)①叠氮化钠可用于汽车安全气囊的产气药,在撞击时能发生分解反应生成两种单质。计算理论上完全分解,释放出标准状况下的气体体积 L。
②氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,工业将氧化铝、氮气和碳在一定条件下反应制得AlN和CO,请将下列的化学反应方程式配平,并用单线桥表示电子转移情况 。
___________________ ________AlN+________CO
(3)利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的“价—类”二维图:
①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有 (填化学式)。
②Z的浓溶液与铝单质在加热条件下可以发生化学反应生成Y,该反应的化学方程式为 ,可用 法收集Y(填序号)
A.向上排空气 B.向下排空气 C.排饱和食盐水 D.排饱和溶液
③Y和均能使品红溶液褪色,但两种气体按一定比例同时通入品红溶液中无明显现象。请用离子方程式解释原因 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.NH3与NO及NO2在催化剂条件下反应生成N2和H2O,实现氮氧化物脱除,描述正确,符合题意;
B.电解铝选择Al2O3是因为Al2O3是离子化合物,而AlCl3是共价化合物,熔融态下是分子结构而不是离子结构,AlCl3无法作为电解铝材料;Al2O3熔点高,所以电解氧化铝时需加助剂冰晶石来降低固体的熔化温度,对应错误,不符题意;
C.浓硫酸作为酯化反应的催化剂是利用浓硫酸的脱水性和吸水性,对应错误,不符题意;
D.次氯酸具有漂白性,用于有色有机物质的漂白,对应错误,不符题意;
综上,本题选A。
2.D
【详解】A.过氧化钠和水反应得到氢氧化钠和氧气,氢氧化钠和铵盐反应可以得到氨气,因此一共有两种气体,A项错误;
B.铁和稀盐酸反应得到的是,铁和氯气反应得到的是最高价氯化物,B项错误;
C.氯化钡溶液不吸收、,因为弱酸不能制强酸,C项错误;
D.纯碱溶液中,由于发生水解反应CO32-+H2OHCO3-+OH-显碱性遇酚酞变红,向溶液中加入CaCl2与CO32-结合生成难溶的碳酸钙,平衡逆向移动,使红色褪去,D项正确;
答案选D。
3.D
【详解】A.用铂丝蘸取少量某溶液进行焰色试验,火焰呈黄色,说明溶液中一定含有Na+,是否含有K+需要透过蓝色钴玻璃再观察火焰是否呈紫色,A错误;
B.向某溶液中滴加盐酸酸化的溶液,有白色沉淀生成,不能说明该溶液中一定含有,可能还有Ag+的干扰,B错误;
C.向蔗糖中滴加浓硫酸,蔗糖变黑,说明浓硫酸具有脱水性而不是吸水性,C错误;
D.向KI溶液中滴加少量氯水,溶液变为棕黄色,说明发生了反应:Cl2+2KI=2KCl+I2,故能得出氧化性:的结论,D正确;
故答案为:D。
4.B
【详解】A.不锈钢中含碳元素,所以A选项错误;
B.镧合金能大量吸收H2形成金属氢化物,将这些金属氢化物加热,它们又会分解,将储存在其中的氢释放出来,可作储氢材料,B选项正确;
C.目前世界上使用量最大的合金是钢铁,C选项错误;
D.铁粉和水在高温条件下才能发生置换反应得到氢气,D选项错误;
答案选B。
5.C
【分析】①氧化镁是离子化合物,离子键强,熔点高;
②二氧化硅能全反射光,可作光纤;
③水玻璃是硅酸钠溶液的俗名,不能燃烧和支持燃烧;
④铝热反应原理是铝与氧化铁反应生成铁和氧化铝,工业上冶炼铁原理是CO还原铁的氧化物得到铁;
⑤水煤气主要成分是H2和CO,燃烧产物是H2O和CO2;
⑥浓硫酸与Cl2、SO2等不反应,能氧化H2S生成S或SO2;
⑦次氯酸钠和盐酸可发生有毒气体氯气;
⑧白色污染是塑料制品降解程度差、对环境造成的污染。
【详解】①氧化镁具有较高熔点,可用作耐火材料,故①正确;
②二氧化硅能全反射光,可作光纤,Si是良好的半导体材料,可制造计算机芯片,故②错误;
③水玻璃是硅酸钠溶液的俗名,不能燃烧和支持燃烧,可作木材防火剂,故③正确;
④铝热反应原理是铝与氧化铁反应生成铁和氧化铝,液态铁用于焊接钢轨,但不用于工业上冶炼铁,工业上冶炼铁原理CO还原铁的氧化物得到铁,故④错误;
⑤水煤气主要成分是H2和CO,完全燃烧产物是H2O和CO2,无污染,所以水煤气属于清洁能源,故⑤正确;
⑥浓硫酸能氧化H2S生成S或SO2,会造成二次污染,不能用于干燥H2S气体,故⑥错误;
⑦“84”消毒液主要成分为次氯酸钠,次氯酸钠和盐酸可发生有毒气体氯气,所以二者不能混用,故⑦错误;
⑧白色污染是塑料制品不能降解从而对环境造成的污染,若用CO2合成的是可降解的聚碳酸酯塑料,降解生成二氧化碳,可以减少白色污染和危害,故⑧正确;
故答案选C。
6.C
【详解】A.侯氏制碱法原料为二氧化碳、氨气、水、NaCl,电解饱和食盐水可制得烧碱,故以NaCl为原料,工业上可制备纯碱和烧碱, A正确;
B.二氧化硫具有漂白性,可用于漂白纸浆及草帽等编织物,B正确;
C.碳酸钡能和胃液中的HCl反应产生Ba2+,Ba2+是重金属离子,能使蛋白质变性而使人中毒,不可服用,C错误;
D.铜盐属于重金属盐,能使细菌蛋白质变性,可用作游泳馆池水消毒剂,D正确。
答案选C。
7.B
【详解】A.不同的金属在灼烧时会产生不同的焰色,五彩缤纷的烟花是由多种金属离子发生焰色试验产生的结果,A正确;
B.漂白粉漂白原理是利用ClO-的强氧化性,发生氧化还原反应,SO2使品红溶液褪色的原理是利用二氧化硫与品红结合生成无色化合物,发生非氧化还原反应,B不正确;
C.氨易液化,表明氨分子间作用力较大,汽化时需要消耗较多的能量,需要从周围环境中吸收大量热,所以可作制冷剂,C正确;
D.“84”消毒液是用Cl2通入NaOH溶液中制得的,其有效成分是NaClO,D正确;
故选B。
8.D
【详解】A.SO2能使酸性KMnO4溶液褪色,是因为其具有还原性,二氧化碳没有还原性,不能与KMnO4反应,故A错误;
B.硝酸具有强的氧化性,与活泼金属反应得不到氢气,故B错误;
C.SO2能使品红溶液褪色,是因为其具有漂白性,二氧化碳没有漂白性,所以CO2不能使品红溶液褪色,故C错误;
D.浓硫酸与浓硝酸都具有强的氧化性,室温下,都能使铁和铝发生钝化,故D正确;
答案选D。
9.C
【详解】A.核电、电能属于二次能源,故A错误;
B.打印机墨粉中常加有Fe3O4,这是利用了其有颜色和具有磁性的特点,CuO不具有磁性,不能替代Fe3O4,故B错误;
C.砷化镓最外层平均4个电子类似于硅,是优良的第三代半导体材料,故C正确;
D.煤的气化和液化均生成新物质,为化学变化,故D错误;
故选C。
10.B
【详解】A.向碳酸钠溶液中逐滴加入稀盐酸,应该先生成碳酸氢钠,再生成水和二氧化碳,,离子方程式为:CO+H+= HCO,H++ HCO= CO2↑+H2O,故A错误;
B.氧化铁粉末溶于稀盐酸反应产生氯化铁和水,反应的离子方程式是Fe2O3+6H+=2Fe3++3H2O,故B正确;
C.硫酸滴加到氢氧化钡溶液中,发生反应产生硫酸钡沉淀和水,反应的离子方程式是:2H++SO42-+ Ba2++2OH-= BaSO4↓+2H2O,故C错误;
D.钠与水反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故D错误。
答案选B。
11.D
【详解】A.加入过量的铁粉,发生反应,再经过过滤,能够除去杂质,A正确;
B.新制氯水与反应:,可以除去杂质,B正确;
C.向含有少量的溶液中加入过量粉:,过滤即可除杂,C正确;
D.与氯化铁反应,将原物质除去,不能除杂,应向该溶液中通入足量的氯气,D错误;
故选D。
12.C
【详解】A.反应的化学方程式为:,故A错误;
B.实验中应该先加热湿棉花,产生水蒸气,再加热铁粉,故B错误;
C.加热时试管内铁粉红热,点燃肥皂泡,因混有空气可听到爆鸣声,故C正确;
D.实验结束后为防止倒吸应该先撤导管后熄灭酒精灯,故D错误。
故选C。
13. C 2FeCl3 + Cu = 2FeCl2 + CuCl2 Fe +2Fe3+ = 3Fe2+ 3Fe2++NO3-+4H+ = 3Fe3++NO↑+2H2O A 4.48
【分析】(1)四氧化三铁是一种具有磁性的黑色晶体;
(2)三价铁可以氧化铜单质为铜离子;
(3)亚铁离子具有还原性;
(4)①根据电荷守恒和原子守恒配平方程式;
②亚铁离子具有还原性;
③依据方程式进行计算;
【详解】(1)指南针是由天然磁石制成的,其主要成分是四氧化三铁,选项C符合,
故选:C。
(2)利用 FeCl3 腐蚀铜的原理制作印刷线路板,铁离子把铜单质氧化成铜离子,化学方程式是2FeCl3 + Cu = 2FeCl2 + CuCl2,
故答案为:2FeCl3 + Cu = 2FeCl2 + CuCl2;
(3)配制 FeSO4 溶液时为了防止 FeSO4 溶液变质,经常向其中加入铁粉,其原因是Fe +2Fe3+ = 3Fe2+,
故答案为:Fe +2Fe3+ = 3Fe2+;
(4)①铁元素的化合价有+2价升高为+3价,氮元素的化合价由+5价降低到+2价,有电子,电荷及原子守恒可知离子反应为3Fe2++NO3-+4H+ = 3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+ = 3Fe3++NO↑+2H2O;
②亚铁离子具有还原性,可以使酸性高锰酸钾溶液褪色,
故选:A。
③反应后的溶液中不含有亚铁离子,说明亚铁离子全部参与反应,n(Fe2+)=c×V=0.1L×6mol/L=0.6mol,依据物质的量之比等于化学计量数之比,可得n(NO)= n(Fe2+)=0.2mol,V(n(Fe2+))=n×Vm=0.2mol×22.4L/mol=4.48L,
故答案为:4.48
14.(1) 或 试纸变蓝
(2) ⅰ,ⅱ
(3)
【详解】(1)①根据题意可知,热氯化铵和石灰的混合物可以制取氨气,反应的化学方程式:2NH4Cl+Ca(OH)2CaCl2+2NH3+2H2O(或2NH4Cl+CaOCaCl2+2NH3↑+H2O);
②根据NH3的物理性质,氨气密度比空气小,收集NH3时导管应长进短出,如图所示;
③NH3的水溶液显碱性,NH3能使湿润的红色石蕊试纸变蓝;
(2)①过程ⅰ、ⅱ分别是N22N和H22H,依据化学反应中,断裂化学键吸收能量,形成化学键放出能量,可知过程ⅰ、ⅱ为吸收能量;
②工业合成氨的化学方程式:N2+3H22NH3;
(3)①由NH4Cl固体转化图可知,合成氨总反应方程式是:2N2+6H2O4NH3+3O2;
②为了证实了Mg3N2中的氮元素在“转氨”过程中能转变为NH3,可以利用同位素对Mg3N2中的N元素进行同位素标记,通过检验NH3中是否含有该同位素即可,所以需要将Mg315N2和14NH4Cl混合,充分反应;
③依据:Mg3N2+6NH4Cl=3MgCl2+8NH3,由于生成的NH3与v mL cmol L 1的H2SO4恰好完全反应,n(NH3)=2cv×10 3mol,依据Mg3N2+6NH4Cl=3MgCl2+8NH3,Mg3N2~8NH3,可知,反应的n(Mg3N2)=cv×10 3mol,Mg3N2转化率=;
15.②④⑤⑧⑨⑩
【详解】①NH4HCO3用作氮肥是因为其中含有氮元素,易被农作物吸收,与热稳定性无关,①错误;
②N2+3H22NH3、NH3+HCl=NH4Cl,②正确;
③NH4Cl溶液与Ca(OH) 2溶液混合产生NH3·H2O,③错误;
④NH3制备可以采取浓氨水和生石灰制取,可用湿润的红色石蕊试纸检验,试纸变蓝则说明NH3为碱性气体,④正确;
⑤检验氨气的方法正确,⑤正确;
⑥不是升华,试管底部NH4Cl分解生成NH3和HCl,试管口NH3与HCl反应生成了NH4Cl,发生了化学反应,⑥错误;
⑦NH4Cl受热分解,离开热源又会重新生成NH4Cl,得不到氨气,且氨气极易溶于水,不能用排水法收集,⑦错误;
⑧草木灰的有效成分K2CO3是强碱弱酸盐,水解使溶液显碱性,而NH4Cl是强酸弱碱盐,水解使溶液显酸性,当施肥时若把草木灰(有效成分为K2CO3)与NH4Cl混合使用,则二者的水解作用相互促进,发生的双水解反应的离子方程式为:CO32-+2NH4+= CO2↑+NH3↑ +H2O,这样N元素就会以氨气的形式逸出从而使肥效会降低,⑧正确;
⑨加热氯化铵和氢氧化钙混合物,通入酚酞溶液变红,说明有碱性气体产生,⑨正确;
⑩0.1mol/L氨水的pH为11,说明氨水为弱电解质,存在电离平衡,故电离方程式应用可逆号连接,⑩错正确;
氨水是弱碱不能溶解氢氧化铝,则向Al2(SO4)3溶液中加入过量氨水的离子方程式为Al3++3NH3·H2O===Al(OH)3↓+3NH4+, 正确;
O2和HNO3二者不能反应, 错误;
综上所述,答案为②④⑤⑧⑨⑩ 。
16. k、c a、d 3NO2+H2O=2HNO3+NO
【详解】氮的固定是将游离态的氮转化为化合态的氮的过程。k过程是氮气转化为氨气,c过程是氮气转化为N2O,属于氮的固定;a和d是氨气和铵根离子间的转化,氮元素的化合价均为-3价,转化过程中没有化合价的变化,是非氧化还原反应;过程h是NO2转化为,可以是NO2和水反应生成硝酸和NO,反应的化学方程式为:3NO2+H2O=2HNO3+NO。
17.(1)①
(2)④
(3)⑥
(4)②
(5)③
(6)⑤
【详解】(1)硅胶具有吸水性,且无毒,可以用作食品干燥剂,浓硫酸虽然也能作干燥剂,但由于其强烈的腐蚀性,故不能用作食品干燥剂,故此处选①;
(2)“84”消毒液由Cl2和NaOH溶液反应得到,即Cl2+2NaOH=NaClO+NaCl+H2O,故“84”消毒液含有成分NaClO、NaCl,其中有效成分是NaClO,故此处选④;
(3)由反应和,知NaHCO3符合题意,故此处选⑥;
(4)蔗糖为含有C、H、O三种元素的有机物,浓硫酸具有脱水性,可将蔗糖组成中的H、O元素脱出形成水,从而使蔗糖碳化变黑,故此处选②;
(5)过氧化钠能和水或二氧化碳反应生成氧气,故此处选③;
(6)二氧化硫气体具有漂白性,能使有色物质褪色,故此处选⑤。
18. PH4I+NaOH PH3↑+NaI+H2O PH3 2 KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑ 第三周期第ⅥA族 2S2 +5H2O +4H2↑+2OH-
【详解】(1)磷是某种核素中,中子数比质子数多一即为16,质量数为31,则该核素的原子符号为;故答案为:。
(2)加热的条件下用碘化磷(PH4I)和烧碱反应制取PH3、NaI和H2O,其化学方程式为PH4I+NaOH PH3↑+NaI+H2O;故答案为:PH4I+NaOH PH3↑+NaI+H2O。
(3)24CuSO4+11PH3+12H2O=8Cu3P↓+3H2PO4+24H2SO4,PH3中P化合价升高,PH3作还原剂,CuSO4中Cu化合价降低,根据反应方程式分析转移了24mol电子,生成24mol硫酸,当生成196克H2SO4即物质的量为2mol,转移电子2mol;故答案为:PH3;2。
(4)粉末状的KSCN与浓硫酸在一定条件下可得到COS和两种硫酸氢盐,生成物的物质的量之比为1:1:1,说明KSCN与浓硫酸反应生成KHSO4、NH4HSO4和COS,其化学方程式:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑;故答案为:KSCN+2H2SO4(浓)+H2O=KHSO4+NH4HSO4+COS↑。
(5)①组成氧硫化碳的各原子中,原子半径最大的元素是S,S在周期表中的物质是第三周期第ⅥA族;故答案为:第三周期第ⅥA族。
②已知M溶液中硫元素的主要存在形式为,说明S2 化合价升高变为,则H2O 中H化合价降低变为H2,因此根据得失电子守恒得到反应Ⅲ中生成的离子方程式为2S2 +5H2O +4H2↑+2OH-;故答案为:2S2 +5H2O +4H2↑+2OH-。
③Na2S初始含量为3mmol,如果只发生2S2 +5H2O +4H2↑+2OH-,则会生成氢气。但图中H2有10mmol,说明化合价降低总数为20mmol电子,则失去电子总数也应该为20mmol电子,则说明S2 升高的价态比价态还高,故还有;故答案为:。
19.(1) +2 盐
(2)c
(3)取少许半透膜袋外的蒸馏水于试管中,滴加BaCl2溶液产生白色沉淀,说明SO能够透过半透膜
【解析】(1)
根据化合物中元素化合价的代数和等于零计算出铁元素的化合价为+2价,盐是由金属离子或铵根离子和酸根离子组成的化合物,所以Fe(CrO2)2属于盐;
(2)
a.溶液很稳定,a项错误;
b.胶体具有丁达尔效应而溶液没有,b项错误;
C.胶体和溶液中的分散质都能透过滤纸,c项正确;
故选c;
(3)
检验SO可用可溶性钡盐,但需用盐酸酸化,具体操作为:取少许半透膜袋外的蒸馏水于试管中,滴加BaCl2溶液产生白色沉淀,说明SO能够透过半透膜。
20.(1)六
(2) 33.6
(3) SO2、H2SO3、Na2SO3 2Al +6H2SO4(浓) 3SO2↑+Al2(SO4)3+6H2O AD SO2+Cl2+2H2O =2Cl-++4H+
【详解】(1)上图为汞的原子结构示意图,汞原子核外电子有6个电子层,说明汞在第六周期;故答案为:六。
(2)①在撞击时能发生分解反应生成两种单质即氮气和钠,其方程式为,(物质的量为1mol)完全分解,释放出氮气1.5mol,则标准状况下的气体体积1.5mol×22.4 L mol 1=33.6L;故答案为:33.6。
②氮气中由0价变为 3价,降低6个价态,碳化合价升高,升高2个价态,根据化合价升降守恒得到氮气系数为1,碳系数为3,一氧化碳系数为3,氮化铝系数为2,氧化铝系数为1,得到1132AlN+3CO,单线桥表示电子转移为 ;故答案为: 。
(3)①从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物,说明该化合物中硫处于中间价态即有SO2、H2SO3、Na2SO3;故答案为:SO2、H2SO3、Na2SO3。
②Z的浓溶液与铝单质在加热条件下可以发生化学反应生成Y(SO2)、硫酸铝和水,该反应的化学方程式为2Al +6H2SO4(浓) 3SO2↑+Al2(SO4)3+6H2O,二氧化硫密度比空气大,可采用向上排空气法收集,二氧化硫易溶于水,不能采用排水法收集,但可采用排饱和亚硫酸氢钠溶液法收集二氧化硫;故答案为:2Al +6H2SO4(浓) 3SO2↑+Al2(SO4)3+6H2O;AD。
③Y和均能使品红溶液褪色,但两种气体按一定比例同时通入品红溶液中无明显现象,主要两者反应在水中生成硫酸和盐酸而没有漂白性,其离子方程式为SO2+Cl2+2H2O =2Cl-++4H+;故答案为:SO2+Cl2+2H2O =2Cl-++4H+。
答案第1页,共2页
答案第1页,共2页
