吉林省辽源市友好学校七十六届2023-2024学年高一上学期1月期末联考化学试题(含解析)
文档属性
| 名称 | 吉林省辽源市友好学校七十六届2023-2024学年高一上学期1月期末联考化学试题(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 213.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-05 21:29:00 | ||
图片预览




文档简介
友好学校第七十六届期末联考
高一化学试题
说明:本试卷共24题,满分100分,共8页。考试用时90分钟。
注意事项:
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码粘贴到条形码区域内。
2.选择题必须用2B铅笔填涂;非选择题必须用0.5mm黑色中性笔书写,字体工整,笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效,在草纸、试题卷上答题无效。
可能用到的相对原子质量:H:1 O: 16 S:32 Al:27 Na:23 Cu:64
一、选择题:本题共10小题,每小题2分,共20分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列实验操作规范的是
A.钠的燃烧 B.排空气法收集CO2
C.混合浓硫酸和乙醇 D.溶液的转移
2.科学家们于1997年发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6~9nm,在低于-183℃时,泡沫具有永久磁性。下列叙述错误的是
A. “碳纳米泡沫”是碳的同素异形体 B. “碳纳米泡沫”是一种新型的碳化合物
C. “碳纳米泡沫”在一定条件下能吸引磁铁 D.“碳纳米泡沫”与石墨的相互转化属于化学反应
3.下列离子方程式表示正确的是
A.Na2O2与水反应:2Na2O2+2H2O=Na++OH-+O2↑
B.将Al溶于NaOH溶液中:2Al+2OH-+3H2O=2Al(OH)3+H2↑
C.将Fe3O4溶于稀盐酸中:Fe3O4+8H+=2Fe3++Fe2++4H2O
D.向Ba(OH)2溶液中加入NaHSO4溶液使溶液呈中性:Ba2++OH-+H++=BaSO4↓+H2O
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氮原子的氨气在标准状况下的体积约为11.2L
B.25℃、1.01×105Pa,64gSO2中含有的原子数为3NA
C.常温常压下,11.2LCl2含有的分子数为0.5 NA
D.标准状况下,11.2LH2O含有的分子数为0.5 NA
5.下列排列顺序不正确的是
A.还原性:F->Cl->Br- B.酸性:HClO4>H2SO4>H2SiO3
C.热稳定性:HF>HCl>PH3 D.碱性:KOH>Ca(OH)2>Mg(OH)2
6.下列有关化学用语表示正确的是
A.S2-的结构示意图:
B.电离方程式:NaHCO3=Na++H++
C.KCl形成过程:
D.质子数为53,中子数为78的碘原子:
7.下图是氯及其化合物的“价-类”二维图,a、b、c、d、e均为含氯元素的物质。下列叙述不正确的是
A.e可由b与碱的溶液反应得到 B.b能使湿润的有色布条褪色,因为b有漂白性
C.a和d的溶液均呈酸性 D.化合物c的化学式为ClO2,可作自来水消毒剂
8.下列叙述不正确的是
A.在周期表中金属与非金属的分界处可以找到半导体材料
B.在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素
C.熔融的MgCl2能导电,所以MgCl2是电解质
D.NaCl溶于水,在通电条件下才能发生电离
9.下列除杂试剂和分离方法都正确的是
选项 物质(括号内为杂质) 除杂试剂 分离方法
A Fe(Cu) 盐酸 过滤
B CO2(HCl) NaOH溶液 洗气
C FeCl2溶液(FeCl3) 铁粉 过滤
D Na2CO3(NaHCO3)溶液 CO2 通入过量CO2
A.A B.B C.C D.D
10.将13.5g金属铝与1L2mol/L的NaOH溶液充分反应,生成的气体在标准状况下的体积为
A.11.2L B.16.8L C.33.6L D.44.8L
二、选择题:本题共10小题,每小题3分,共30分,在每小题给出的四个选项中,只有一项是符合题目要求的。
11.常温下,下列各离子组在指定溶液中能大量存在的是
A.无色溶液中:K+、、、Cl-
B.c(Fe+)=0.1mol/L的溶液中:H+、I-、Br-、
C.使石蕊变红的溶液中:Na+、、、
D.碱性溶液中:Na+、ClO-、、
12.下列离子方程式书写正确的是
A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2+++OH-=CaCO3↓+H2O
B.向沸水中滴加饱和氯化铁溶液得到胶体:Fe3++3H2O=Fe(OH)3↓+3H+
C.氧化铁溶于氢碘酸溶液:Fe2O3+6H+=3Fe3++3H2O
D.向氢氧化钠溶液中通入少量CO2:OH-+CO2=
13.铁基脱硫剂常用于水泥、石化领域中硫化物的脱除,其转化关系如下图所示。
下列说法中,不正确的是
A.过程Ⅰ中,铁元素的化合价降低 B.过程Ⅱ中,只有硫元素被氧化
C.通过过程Ⅰ和Ⅱ,硫元素被脱除 D.Fe(OH)3可以循环利用.
14.设NA为阿伏伽德罗常数的值,以下说法正确的是
A.18gT2O中含有的质子数为10NA
B.在25℃时,0.01mol/L的Ba(OH)2溶液中含有OH-数目0.02NA
C.25℃,101kPa,3.4g硫化氢中含有原子总数为0.3NA
D.标准状况下,将2.24L氯气溶于水,转移的电子数目为0.1NA
15.已知有如下反应:
①2NaBrO3+Cl2=Br2+2NaClO3
②NaClO3+6HCl=NaCl+3Cl2↑+3H2O
根据上述反应,下列说法正确的是
A.反应①中NaBrO3中Br的化合价为+3
B.反应①中氧化性:NaClO3>NaBrO3
C.反应②中氧化产物与还原产物的物质的量之比为1:5
D.反应②中每生成3molCl2,转移5mol电子
16.抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。下列劳动与所涉及的化学知识不相符的是
选项 家务劳动 化学知识
A 用白醋除去水壶中的水垢 白醋可溶解CaCO3沉淀
B 用小苏打粉作膨松剂焙制糕点 NaHCO3会中和发面产生的酸放出CO2
C 用含NaClO的84消毒液拖地 NaClO有还原性
D 用洁厕灵洗马桶 洁厕灵中含有盐酸,可以与尿垢反应
A.A B.B C.C D.D
17.在FeCl3和CuCl2的混合溶液中加入铁粉,充分反应后有固体剩余,经过滤后滤液中的可能含有的离子有:①Fe2+ ②Fe2+和Fe3+ ③Fe2+和Cu2+ ④Fe3+和Cu2+
A.①③ B.②④ C.①④ D.②③
18.甲、乙、丙、丁分别是Al2(SO4)3、FeCl2、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此可推断丙物质是
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeCl2
19.有A、B、C、D、E五种元素,质子数都小于18。B原子的最外层电子数是其电子层数的3倍;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构;D是地壳中含量最多的金属元素;E的最高正价与最低负价的代数和为6;A单质可以在E单质中燃烧,生成AE,燃烧时火焰呈苍白色。下列说法错误的是
A.A2B中只含极性共价键
B.B和C两种元素形成的化合物一定含有离子键也可能含有共价键
C.E单质可以使干燥的红色布条褪色
D.D单质常温下既能溶于稀盐酸也能溶于氢氧化钠溶液
20.当溶液中与离子个数比为5:2时,溶液中离子中X元素恰好被氧化为较高价态,同时生成Mn2+,则反应后X元素的化合价为
A.+1 B.+2 C.+3 D.+4
三、非选择题,共50分。
21.(10分)现有下列七种物质:①CO2 ②过氧化钠 ③氧化铁 ④0.5mol/LNaOH溶液 ⑤碳酸氢钠 ⑥0.5mol/LNaHSO4溶液 ⑦次氯酸钠。请根据上述物质回答下列问题:
(1)在上述物质中属于电解质的有___________(填①~⑦序号)
(2)含有0.4mol氧原子的②与足量①反应,产生气体在标准状况下的体积为_______L。
(3)写出③物质的一种用途_____________。
(4)某同学帮助水质检测站配制240mL④溶液以备使用。
①该同学应用托盘天平称取NaOH固体_______g。
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_________。
③定容时仰视刻度线,则所配制的溶液的浓度会______(填“偏高”、“偏低”、“不变”)。
(5)⑤⑥两种溶液混合可以发生反应,离子方程式为_______________。
(6)废水脱氨工艺有一种方法是在废水中加入过量⑦使完全转化为N2,此方法可用离子方程式表示为:2+3ClO-=N2↑+3Cl-+2H++3H2O。用单线桥法在离子方程式上标出电子转移的方向和数目_____;该反应中氧化剂与还原剂的物质的量之比为______________。
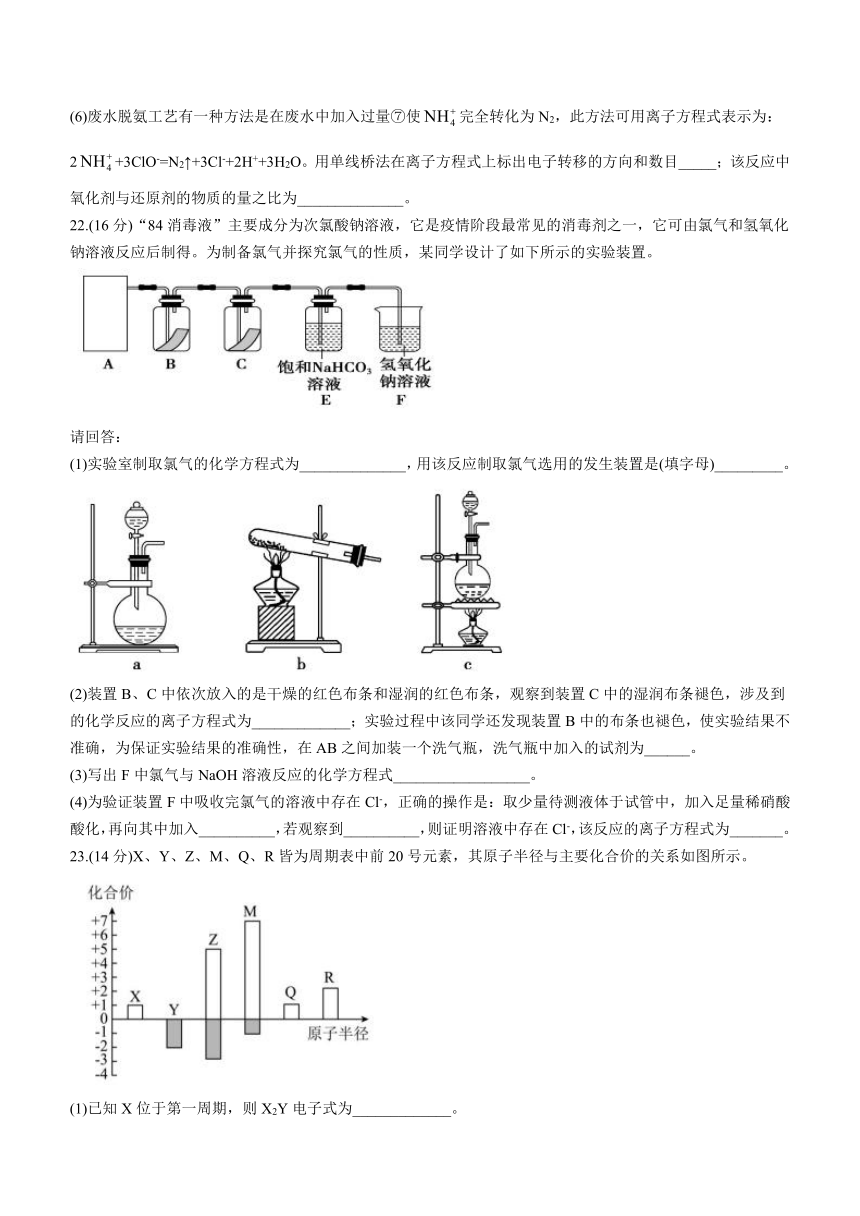
22.(16分)“84消毒液”主要成分为次氯酸钠溶液,它是疫情阶段最常见的消毒剂之一,它可由氯气和氢氧化钠溶液反应后制得。为制备氯气并探究氯气的性质,某同学设计了如下所示的实验装置。
请回答:
(1)实验室制取氯气的化学方程式为______________,用该反应制取氯气选用的发生装置是(填字母)_________。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,观察到装置C中的湿润布条褪色,涉及到的化学反应的离子方程式为_____________;实验过程中该同学还发现装置B中的布条也褪色,使实验结果不准确,为保证实验结果的准确性,在AB之间加装一个洗气瓶,洗气瓶中加入的试剂为______。
(3)写出F中氯气与NaOH溶液反应的化学方程式__________________。
(4)为验证装置F中吸收完氯气的溶液中存在Cl-,正确的操作是:取少量待测液体于试管中,加入足量稀硝酸酸化,再向其中加入__________,若观察到__________,则证明溶液中存在Cl-,该反应的离子方程式为_______。
23.(14分)X、Y、Z、M、Q、R皆为周期表中前20号元素,其原子半径与主要化合价的关系如图所示。
(1)已知X位于第一周期,则X2Y电子式为_____________。
(2)比较Y和Z的简单氢化物,更稳定的是(填化学式)____________。
(3)已知Q位于第三周期,则R在元素周期表中的位置是___________。
(4)下列推断正确的是___________。
a.简单离子半径:M->Q+>R2+
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式___________________,比较I-和M的阴离子,还原性更强的是______(填离子符号),从原子结构的角度解释原因_____________。
24.(10分)已知有以下物质相互转化:
试回答下列问题:
(1)写出B的化学式:___________,D的化学式:___________。
(2)写出由E转变成F的化学方程式:____________________。
(3)写出用KSCN鉴别G溶液的离子方程式:________________。向G溶液中加入A的有关反应的离子方程式:________________。
友好学校第七十六届期末联考
高一化学参考答案
一、选择题:本题共10小题,每小题2分,共20分,在每小题给出的四个选项中,只有一项是符合题目要
求的。
1.B 2.B 3.C 4.B 5.A 6.D
7. B
【分析】根据氯元素的价类二维图可以推知,a为HCl,氯元素为-1价,属于氢化物;b为Cl2,属于单质,氯元素的化合价为0;c为C1O2,氯元素的化合价为+4价,属于氧化物;d为HClO,氯元素为+1价,属于弱酸;e为次氯酸盐,氯元素为+1价;
【详解】A.次氯酸盐可由Cl2与碱的溶液反应得到,比如Cl2+2NaOH=NaC1O+NaCl+H2O,A项正确;
B.b为Cl2,潮湿的氯气具有漂白性是由于C12+H2O=HC1O+HCl,HC1O具有漂白性,能使湿润的有色布条褪色,B项错误;
C.a为HC1,为溶液为强酸,d为HC10,为弱酸,a、d溶液均具有酸性,C项正确;
D.化合物c为ClO2,具有氧化作用,能消毒杀菌,可作自来水消毒剂,D项正确;
答案选B。
8.D 9.C 10.B
二、选择题:本题共10小题,每小题3分,共30分,在每小题给出的四个选项中,只有-项是符合题目要求的。
11. D
[详解]A.在水溶液中显紫色,不符合题意要求,A错误;
B.Fe3+与I-发生氧化还原反应,不能共存,B错误;
C.使石蕊变红的溶液为酸性溶液,与H+反应生成亚硫酸,不能共存,C错误;
D.碱性溶液,Na+、ClO-、、均能共存,D正确:
故答案为:D。
12.A
13. B
【分析】过程Ⅰ是H2S与Fe(OH)3反应生成S单质和FeS,过程Ⅱ是FeS与O2作用生成S单质与Fe(OH)3,Fe(OH)3循环利用。
【详解】A.过程Ⅰ中,铁元素的化合价由+3价降低到+2价,故A正确;
B.过程Ⅱ硫元素和铁元素化合价都升高,都被氧化,故B错误;
C.通过过程Ⅰ和Ⅱ,H2S被氧化为S单质除去,故C正确;
D.通过图示得出Fe(OH)3被循环利用,故D正确;
14.C
15. D
【详解】A.NaBrO3中Br的化合价为+5,选项A错误;
B.反应①2NaBrO3+Cl2=Br2+2NaClO3中Br的化合价降低,NaBrO3为氧化剂,Br2为还原产物,C1的化合价升高,Cl2为还原剂,NaClO3为氧化产物,则氧化性:NaBrO3>NaClO3,选项B错误;
C.反应②NaCO3+6HCl=NaCl+3Cl2↑+3H2O中,NaClO3中C1的化合价由+5降到0,HC1中Cl的化合价由-1升高到0,氧化产物和还原产物的物质的量之比为5:1,选项C错误;
D.每生成3molCl2,转移5mol电子,选项D正确;
答案选D。
16.C
17. A
【详解】在FeCl3和CuCl2的混合溶液中加入铁粉,Fe先和Fe3+反应Ⅰ:2Fe3++Fe=3Fe2+,然后Fe和Cu2+反应ⅡCu2++Fe=Fe2++Cu,所以充分反应后若有固体剩余,则固体中一定含有Cu,溶液中一定无Fe2+,若反应Ⅱ恰好完全反应或铁粉过量,则溶液中只含Fe*,若反应II铁粉不足,
溶液中含有Fe2+和Cu2+,所以经过滤后滤液中的可能含有的离子①或③,故答案选A。
18.D
【详解】将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,说明乙为硫酸铝,丁为氢氧化钠,硫酸铝和少量的氢氧化钠反应生成氢氧化铝沉淀,加入过量的氢氧化钠,氢氧化铝溶解。丁溶液滴入甲溶液时,无明显现象发生,说明甲为氯化钡,则丙为氯化亚铁。
故选D。
19. C
【分析】B原子的最外层电子数是其电子层数的3倍,则B为氧元素;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构,则C原子核外有11个电子,即核电荷数为11,C为钠元素;地壳中含量最多的金属元素是铝,D为铝元素;氯的最高正价+7价与最低负价-1价,代数和为6,E为氯元素;氢气可以在氯气中燃烧,火焰呈苍白色,所以A为氢元素。
即A、B、C、D、E分别为H、O、Na、A1、C1。
【详解】A.A2B为H2O,水分子结构式为H-O-H,所以水分子中只含极性共价键,A项正确;
B.B和C两种元素形成的化合物Na20,是离子化合物,只含有离子键,B和C两种元素形成的化合物Na2O2是离子化合物,既含有离子键又含有共价键,B项正确;
C.氯气和水反应生成的次氯酸有漂白性,氯气使湿润红色布条褪色,干燥的氯气不能使干
燥的红色布条褪色,C项错误;
D.铝单质常温下与稀盐酸生成氯化铝和氢气,铝单质常温下和氢氧化钠溶液反应生成偏铝酸钠和氢气,D项正确;
答案选C。
20. D
【详解】离子中X元素恰好被氧化,则是氧化剂,Mn2+是还原产物,是还原剂,假设反应后X的化合价为x,则根据得失电子守恒有5×2×(x-3)=2×1×5,解得x=+4,即反应后X元素的化合价为+4;
答案选D。
三、非选择题,共50分。
21.(共10分)
(1)②③⑤.........分
(2)2.2......分
(3)油漆、涂料、油墨和橡胶的红色颜料(写出一种)........分
(4)①5.......分
②250mL容量瓶.......分
③偏低.......分
(5)+H+=H2O+CO2↑..........1分
(6)①....1分
②3:2.......2分
22.(共16分,每空2分)
(1)MnO2+4HC1(浓)MnC12+C12↑+2H2O(或高锰酸钾与浓盐酸反应) c(a)
(2)Cl2+H2O=H++C1-+HClO
(3)2NaOH+Cl2=NaCl+NaClO+H2O
(4)硝酸银溶液 有白色沉淀产生(或溶液变浑浊)
Ag++Cl-=AgCl↓
【分析】(1)实验室用二氧化锰和浓盐酸在加热条件下反应制备氯气,属于固液加热制取气体。
(2)红布条褪色说明有次氯酸生成;浓硫酸可以用来干燥氯气;
(3)氯气与NaOH溶液反应生成氯化钠、次氯酸钠、水;
(4)氯离子和银离子反应生成氯化银沉淀;
【详解】(1)二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气、水,反应的化学方程式为MnO2+4HC1(浓)MnC12+C12↑+2H2O,固液加热制取气体,选用的发生装置是c;
(2)装置C中的湿润布条褪色,说明氯气和水反应生成次氯酸,化学反应的方程式为Cl2+H2O=HCl+HC1O;从A中产生的氯气中混有水蒸气,氯气和水反应生成具有漂白性的HC1O,所以实验过程中该同学还发现装置B中的布条也褪色,在AB之间加装一个洗气瓶,除去氯气中的水蒸气,洗气瓶中加入的试剂为浓硫酸;
(3)氯气与NaOH溶液反应生成氯化钠、次氯酸钠、水,F中反应方程式是2NaOH+Cl2=NaC1+NaC1O+H2O;
(4)氯离子和银离子反应生成氯化银沉淀,为验证装置F中吸收完氯气的溶液中存在C1-,取少量待测液体于试管中,加入足量稀硝酸酸化,再向其中加入硝酸银,若观察到白色沉淀,则证明溶液中存在C1-;该反应的离子方程式为Ag++Cl-=AgCl↓。
23.(共14分,每空2分)
(1)
(2)H2O
(3)第四周期第ⅡA族
(4)bc
(5)Cl2+2I-=2Cl-+I2 I- Cl、I为同主族元素,电子层数I>Cl,离子半径I>C1,失电子能力I->Cl-,还原性I->Cl-
【分析】X、Y、Z、M、Q、R皆为周期表中前20号元素,X位于第一周期,根据原子半径与主要化合价的关系图,可知X是H元素;Y是0元素;Z是N元素;M是Cl元素;Q是Na元素;R是Ca元素。
【详解】(1)X2Y是共价化合物H2O,电子式为
(2)同周期元素从左到右,气态氢化物稳定性增强,H2O、NH3中更稳定的是H2O。
(3)R是Ca元素,在元素周期表中的位置是第四周期第ⅡA族;
(4)a.电子层数越多半径越大,电子层数相同时,质子数越多半径越小,简单离子半径:Cl->Ca2+>Na+,故a错误;
b.由H、N、O三种元素组成的化合物可能是NH4NO3或NH3·H2O,故b正确;
c.HNO3与HC1O,均为强酸,故c正确;
选bc。
(5)氯气通入淀粉-KI溶液,溶液变蓝,说明有碘单质生成,该反应的离子方程式Cl2+2I-=2Cl-+I2;
Cl、I为同主族元素,电子层数I>Cl,离子半径I>Cl,失电子能力I>Cl,还原性I->Cl-。
24.(共10分,每空2分)
(1)FeCl2
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Fe3++3SCN-=Fe(SCN)3 2Fe3++Fe=3Fe2+
【分析】仔细分析转化关系,由白色沉淀E在空气中转化为红褐色沉淀F可以推出,E为Fe(OH)2,F为Fe(OH)3,氢氧化铁与盐酸反应生成氯化铁和水,则G是FeCl3;由D溶液加硝酸酸化的硝酸银溶液产生白色沉淀H,可推出H为AgC1,溶液焰色反应呈紫色,则D中含有K+,故D为KC1,B中含有Fe2+和C1-,C溶液为KOH溶液,A应为Fe,Fe与盐酸反应生成氯化亚铁和氢气符合转化关系,以此分析解答。
【详解】(1)通过以上分析可知B为氯化亚铁,化学式为FeCl2,D为氯化钾,化学式为KC1;
(2)由E转变成F是氢氧化亚铁被氧气氧化成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G溶液FeCl3溶液,含有Fe3+,加入KSCN溶液出现血红色,用于鉴别FeCl3溶液,离子方程式Fe3++3SCN-=Fe(SCN)3;向FeCl3溶液加入Fe生成FeCl2,离子反应方程式为2Fe3++Fe=3Fe2+。
高一化学试题
说明:本试卷共24题,满分100分,共8页。考试用时90分钟。
注意事项:
1.答题前,考生先将自己的姓名、准考证号填写清楚,将条形码粘贴到条形码区域内。
2.选择题必须用2B铅笔填涂;非选择题必须用0.5mm黑色中性笔书写,字体工整,笔迹清楚。
3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效,在草纸、试题卷上答题无效。
可能用到的相对原子质量:H:1 O: 16 S:32 Al:27 Na:23 Cu:64
一、选择题:本题共10小题,每小题2分,共20分,在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列实验操作规范的是
A.钠的燃烧 B.排空气法收集CO2
C.混合浓硫酸和乙醇 D.溶液的转移
2.科学家们于1997年发现了纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6~9nm,在低于-183℃时,泡沫具有永久磁性。下列叙述错误的是
A. “碳纳米泡沫”是碳的同素异形体 B. “碳纳米泡沫”是一种新型的碳化合物
C. “碳纳米泡沫”在一定条件下能吸引磁铁 D.“碳纳米泡沫”与石墨的相互转化属于化学反应
3.下列离子方程式表示正确的是
A.Na2O2与水反应:2Na2O2+2H2O=Na++OH-+O2↑
B.将Al溶于NaOH溶液中:2Al+2OH-+3H2O=2Al(OH)3+H2↑
C.将Fe3O4溶于稀盐酸中:Fe3O4+8H+=2Fe3++Fe2++4H2O
D.向Ba(OH)2溶液中加入NaHSO4溶液使溶液呈中性:Ba2++OH-+H++=BaSO4↓+H2O
4.用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.含有NA个氮原子的氨气在标准状况下的体积约为11.2L
B.25℃、1.01×105Pa,64gSO2中含有的原子数为3NA
C.常温常压下,11.2LCl2含有的分子数为0.5 NA
D.标准状况下,11.2LH2O含有的分子数为0.5 NA
5.下列排列顺序不正确的是
A.还原性:F->Cl->Br- B.酸性:HClO4>H2SO4>H2SiO3
C.热稳定性:HF>HCl>PH3 D.碱性:KOH>Ca(OH)2>Mg(OH)2
6.下列有关化学用语表示正确的是
A.S2-的结构示意图:
B.电离方程式:NaHCO3=Na++H++
C.KCl形成过程:
D.质子数为53,中子数为78的碘原子:
7.下图是氯及其化合物的“价-类”二维图,a、b、c、d、e均为含氯元素的物质。下列叙述不正确的是
A.e可由b与碱的溶液反应得到 B.b能使湿润的有色布条褪色,因为b有漂白性
C.a和d的溶液均呈酸性 D.化合物c的化学式为ClO2,可作自来水消毒剂
8.下列叙述不正确的是
A.在周期表中金属与非金属的分界处可以找到半导体材料
B.在过渡元素中寻找制造催化剂和耐高温、耐腐蚀合金的元素
C.熔融的MgCl2能导电,所以MgCl2是电解质
D.NaCl溶于水,在通电条件下才能发生电离
9.下列除杂试剂和分离方法都正确的是
选项 物质(括号内为杂质) 除杂试剂 分离方法
A Fe(Cu) 盐酸 过滤
B CO2(HCl) NaOH溶液 洗气
C FeCl2溶液(FeCl3) 铁粉 过滤
D Na2CO3(NaHCO3)溶液 CO2 通入过量CO2
A.A B.B C.C D.D
10.将13.5g金属铝与1L2mol/L的NaOH溶液充分反应,生成的气体在标准状况下的体积为
A.11.2L B.16.8L C.33.6L D.44.8L
二、选择题:本题共10小题,每小题3分,共30分,在每小题给出的四个选项中,只有一项是符合题目要求的。
11.常温下,下列各离子组在指定溶液中能大量存在的是
A.无色溶液中:K+、、、Cl-
B.c(Fe+)=0.1mol/L的溶液中:H+、I-、Br-、
C.使石蕊变红的溶液中:Na+、、、
D.碱性溶液中:Na+、ClO-、、
12.下列离子方程式书写正确的是
A.Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2+++OH-=CaCO3↓+H2O
B.向沸水中滴加饱和氯化铁溶液得到胶体:Fe3++3H2O=Fe(OH)3↓+3H+
C.氧化铁溶于氢碘酸溶液:Fe2O3+6H+=3Fe3++3H2O
D.向氢氧化钠溶液中通入少量CO2:OH-+CO2=
13.铁基脱硫剂常用于水泥、石化领域中硫化物的脱除,其转化关系如下图所示。
下列说法中,不正确的是
A.过程Ⅰ中,铁元素的化合价降低 B.过程Ⅱ中,只有硫元素被氧化
C.通过过程Ⅰ和Ⅱ,硫元素被脱除 D.Fe(OH)3可以循环利用.
14.设NA为阿伏伽德罗常数的值,以下说法正确的是
A.18gT2O中含有的质子数为10NA
B.在25℃时,0.01mol/L的Ba(OH)2溶液中含有OH-数目0.02NA
C.25℃,101kPa,3.4g硫化氢中含有原子总数为0.3NA
D.标准状况下,将2.24L氯气溶于水,转移的电子数目为0.1NA
15.已知有如下反应:
①2NaBrO3+Cl2=Br2+2NaClO3
②NaClO3+6HCl=NaCl+3Cl2↑+3H2O
根据上述反应,下列说法正确的是
A.反应①中NaBrO3中Br的化合价为+3
B.反应①中氧化性:NaClO3>NaBrO3
C.反应②中氧化产物与还原产物的物质的量之比为1:5
D.反应②中每生成3molCl2,转移5mol电子
16.抗疫居家期间,同学们在参与家务劳动的过程中体会到化学知识无处不在。下列劳动与所涉及的化学知识不相符的是
选项 家务劳动 化学知识
A 用白醋除去水壶中的水垢 白醋可溶解CaCO3沉淀
B 用小苏打粉作膨松剂焙制糕点 NaHCO3会中和发面产生的酸放出CO2
C 用含NaClO的84消毒液拖地 NaClO有还原性
D 用洁厕灵洗马桶 洁厕灵中含有盐酸,可以与尿垢反应
A.A B.B C.C D.D
17.在FeCl3和CuCl2的混合溶液中加入铁粉,充分反应后有固体剩余,经过滤后滤液中的可能含有的离子有:①Fe2+ ②Fe2+和Fe3+ ③Fe2+和Cu2+ ④Fe3+和Cu2+
A.①③ B.②④ C.①④ D.②③
18.甲、乙、丙、丁分别是Al2(SO4)3、FeCl2、NaOH、BaCl2四种物质中的一种。若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生。据此可推断丙物质是
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeCl2
19.有A、B、C、D、E五种元素,质子数都小于18。B原子的最外层电子数是其电子层数的3倍;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构;D是地壳中含量最多的金属元素;E的最高正价与最低负价的代数和为6;A单质可以在E单质中燃烧,生成AE,燃烧时火焰呈苍白色。下列说法错误的是
A.A2B中只含极性共价键
B.B和C两种元素形成的化合物一定含有离子键也可能含有共价键
C.E单质可以使干燥的红色布条褪色
D.D单质常温下既能溶于稀盐酸也能溶于氢氧化钠溶液
20.当溶液中与离子个数比为5:2时,溶液中离子中X元素恰好被氧化为较高价态,同时生成Mn2+,则反应后X元素的化合价为
A.+1 B.+2 C.+3 D.+4
三、非选择题,共50分。
21.(10分)现有下列七种物质:①CO2 ②过氧化钠 ③氧化铁 ④0.5mol/LNaOH溶液 ⑤碳酸氢钠 ⑥0.5mol/LNaHSO4溶液 ⑦次氯酸钠。请根据上述物质回答下列问题:
(1)在上述物质中属于电解质的有___________(填①~⑦序号)
(2)含有0.4mol氧原子的②与足量①反应,产生气体在标准状况下的体积为_______L。
(3)写出③物质的一种用途_____________。
(4)某同学帮助水质检测站配制240mL④溶液以备使用。
①该同学应用托盘天平称取NaOH固体_______g。
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_________。
③定容时仰视刻度线,则所配制的溶液的浓度会______(填“偏高”、“偏低”、“不变”)。
(5)⑤⑥两种溶液混合可以发生反应,离子方程式为_______________。
(6)废水脱氨工艺有一种方法是在废水中加入过量⑦使完全转化为N2,此方法可用离子方程式表示为:2+3ClO-=N2↑+3Cl-+2H++3H2O。用单线桥法在离子方程式上标出电子转移的方向和数目_____;该反应中氧化剂与还原剂的物质的量之比为______________。
22.(16分)“84消毒液”主要成分为次氯酸钠溶液,它是疫情阶段最常见的消毒剂之一,它可由氯气和氢氧化钠溶液反应后制得。为制备氯气并探究氯气的性质,某同学设计了如下所示的实验装置。
请回答:
(1)实验室制取氯气的化学方程式为______________,用该反应制取氯气选用的发生装置是(填字母)_________。
(2)装置B、C中依次放入的是干燥的红色布条和湿润的红色布条,观察到装置C中的湿润布条褪色,涉及到的化学反应的离子方程式为_____________;实验过程中该同学还发现装置B中的布条也褪色,使实验结果不准确,为保证实验结果的准确性,在AB之间加装一个洗气瓶,洗气瓶中加入的试剂为______。
(3)写出F中氯气与NaOH溶液反应的化学方程式__________________。
(4)为验证装置F中吸收完氯气的溶液中存在Cl-,正确的操作是:取少量待测液体于试管中,加入足量稀硝酸酸化,再向其中加入__________,若观察到__________,则证明溶液中存在Cl-,该反应的离子方程式为_______。
23.(14分)X、Y、Z、M、Q、R皆为周期表中前20号元素,其原子半径与主要化合价的关系如图所示。
(1)已知X位于第一周期,则X2Y电子式为_____________。
(2)比较Y和Z的简单氢化物,更稳定的是(填化学式)____________。
(3)已知Q位于第三周期,则R在元素周期表中的位置是___________。
(4)下列推断正确的是___________。
a.简单离子半径:M->Q+>R2+
b.由X、Y、Z三种元素组成的化合物可能是盐或碱
c.Z与M的最高价氧化物对应水化物均为强酸
(5)M的单质通入淀粉-KI溶液,溶液变蓝,写出该反应的离子方程式___________________,比较I-和M的阴离子,还原性更强的是______(填离子符号),从原子结构的角度解释原因_____________。
24.(10分)已知有以下物质相互转化:
试回答下列问题:
(1)写出B的化学式:___________,D的化学式:___________。
(2)写出由E转变成F的化学方程式:____________________。
(3)写出用KSCN鉴别G溶液的离子方程式:________________。向G溶液中加入A的有关反应的离子方程式:________________。
友好学校第七十六届期末联考
高一化学参考答案
一、选择题:本题共10小题,每小题2分,共20分,在每小题给出的四个选项中,只有一项是符合题目要
求的。
1.B 2.B 3.C 4.B 5.A 6.D
7. B
【分析】根据氯元素的价类二维图可以推知,a为HCl,氯元素为-1价,属于氢化物;b为Cl2,属于单质,氯元素的化合价为0;c为C1O2,氯元素的化合价为+4价,属于氧化物;d为HClO,氯元素为+1价,属于弱酸;e为次氯酸盐,氯元素为+1价;
【详解】A.次氯酸盐可由Cl2与碱的溶液反应得到,比如Cl2+2NaOH=NaC1O+NaCl+H2O,A项正确;
B.b为Cl2,潮湿的氯气具有漂白性是由于C12+H2O=HC1O+HCl,HC1O具有漂白性,能使湿润的有色布条褪色,B项错误;
C.a为HC1,为溶液为强酸,d为HC10,为弱酸,a、d溶液均具有酸性,C项正确;
D.化合物c为ClO2,具有氧化作用,能消毒杀菌,可作自来水消毒剂,D项正确;
答案选B。
8.D 9.C 10.B
二、选择题:本题共10小题,每小题3分,共30分,在每小题给出的四个选项中,只有-项是符合题目要求的。
11. D
[详解]A.在水溶液中显紫色,不符合题意要求,A错误;
B.Fe3+与I-发生氧化还原反应,不能共存,B错误;
C.使石蕊变红的溶液为酸性溶液,与H+反应生成亚硫酸,不能共存,C错误;
D.碱性溶液,Na+、ClO-、、均能共存,D正确:
故答案为:D。
12.A
13. B
【分析】过程Ⅰ是H2S与Fe(OH)3反应生成S单质和FeS,过程Ⅱ是FeS与O2作用生成S单质与Fe(OH)3,Fe(OH)3循环利用。
【详解】A.过程Ⅰ中,铁元素的化合价由+3价降低到+2价,故A正确;
B.过程Ⅱ硫元素和铁元素化合价都升高,都被氧化,故B错误;
C.通过过程Ⅰ和Ⅱ,H2S被氧化为S单质除去,故C正确;
D.通过图示得出Fe(OH)3被循环利用,故D正确;
14.C
15. D
【详解】A.NaBrO3中Br的化合价为+5,选项A错误;
B.反应①2NaBrO3+Cl2=Br2+2NaClO3中Br的化合价降低,NaBrO3为氧化剂,Br2为还原产物,C1的化合价升高,Cl2为还原剂,NaClO3为氧化产物,则氧化性:NaBrO3>NaClO3,选项B错误;
C.反应②NaCO3+6HCl=NaCl+3Cl2↑+3H2O中,NaClO3中C1的化合价由+5降到0,HC1中Cl的化合价由-1升高到0,氧化产物和还原产物的物质的量之比为5:1,选项C错误;
D.每生成3molCl2,转移5mol电子,选项D正确;
答案选D。
16.C
17. A
【详解】在FeCl3和CuCl2的混合溶液中加入铁粉,Fe先和Fe3+反应Ⅰ:2Fe3++Fe=3Fe2+,然后Fe和Cu2+反应ⅡCu2++Fe=Fe2++Cu,所以充分反应后若有固体剩余,则固体中一定含有Cu,溶液中一定无Fe2+,若反应Ⅱ恰好完全反应或铁粉过量,则溶液中只含Fe*,若反应II铁粉不足,
溶液中含有Fe2+和Cu2+,所以经过滤后滤液中的可能含有的离子①或③,故答案选A。
18.D
【详解】将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,说明乙为硫酸铝,丁为氢氧化钠,硫酸铝和少量的氢氧化钠反应生成氢氧化铝沉淀,加入过量的氢氧化钠,氢氧化铝溶解。丁溶液滴入甲溶液时,无明显现象发生,说明甲为氯化钡,则丙为氯化亚铁。
故选D。
19. C
【分析】B原子的最外层电子数是其电子层数的3倍,则B为氧元素;C原子失去1个电子所得到的微粒具有与氖原子相同的电子层结构,则C原子核外有11个电子,即核电荷数为11,C为钠元素;地壳中含量最多的金属元素是铝,D为铝元素;氯的最高正价+7价与最低负价-1价,代数和为6,E为氯元素;氢气可以在氯气中燃烧,火焰呈苍白色,所以A为氢元素。
即A、B、C、D、E分别为H、O、Na、A1、C1。
【详解】A.A2B为H2O,水分子结构式为H-O-H,所以水分子中只含极性共价键,A项正确;
B.B和C两种元素形成的化合物Na20,是离子化合物,只含有离子键,B和C两种元素形成的化合物Na2O2是离子化合物,既含有离子键又含有共价键,B项正确;
C.氯气和水反应生成的次氯酸有漂白性,氯气使湿润红色布条褪色,干燥的氯气不能使干
燥的红色布条褪色,C项错误;
D.铝单质常温下与稀盐酸生成氯化铝和氢气,铝单质常温下和氢氧化钠溶液反应生成偏铝酸钠和氢气,D项正确;
答案选C。
20. D
【详解】离子中X元素恰好被氧化,则是氧化剂,Mn2+是还原产物,是还原剂,假设反应后X的化合价为x,则根据得失电子守恒有5×2×(x-3)=2×1×5,解得x=+4,即反应后X元素的化合价为+4;
答案选D。
三、非选择题,共50分。
21.(共10分)
(1)②③⑤.........分
(2)2.2......分
(3)油漆、涂料、油墨和橡胶的红色颜料(写出一种)........分
(4)①5.......分
②250mL容量瓶.......分
③偏低.......分
(5)+H+=H2O+CO2↑..........1分
(6)①....1分
②3:2.......2分
22.(共16分,每空2分)
(1)MnO2+4HC1(浓)MnC12+C12↑+2H2O(或高锰酸钾与浓盐酸反应) c(a)
(2)Cl2+H2O=H++C1-+HClO
(3)2NaOH+Cl2=NaCl+NaClO+H2O
(4)硝酸银溶液 有白色沉淀产生(或溶液变浑浊)
Ag++Cl-=AgCl↓
【分析】(1)实验室用二氧化锰和浓盐酸在加热条件下反应制备氯气,属于固液加热制取气体。
(2)红布条褪色说明有次氯酸生成;浓硫酸可以用来干燥氯气;
(3)氯气与NaOH溶液反应生成氯化钠、次氯酸钠、水;
(4)氯离子和银离子反应生成氯化银沉淀;
【详解】(1)二氧化锰和浓盐酸在加热条件下反应生成氯化锰、氯气、水,反应的化学方程式为MnO2+4HC1(浓)MnC12+C12↑+2H2O,固液加热制取气体,选用的发生装置是c;
(2)装置C中的湿润布条褪色,说明氯气和水反应生成次氯酸,化学反应的方程式为Cl2+H2O=HCl+HC1O;从A中产生的氯气中混有水蒸气,氯气和水反应生成具有漂白性的HC1O,所以实验过程中该同学还发现装置B中的布条也褪色,在AB之间加装一个洗气瓶,除去氯气中的水蒸气,洗气瓶中加入的试剂为浓硫酸;
(3)氯气与NaOH溶液反应生成氯化钠、次氯酸钠、水,F中反应方程式是2NaOH+Cl2=NaC1+NaC1O+H2O;
(4)氯离子和银离子反应生成氯化银沉淀,为验证装置F中吸收完氯气的溶液中存在C1-,取少量待测液体于试管中,加入足量稀硝酸酸化,再向其中加入硝酸银,若观察到白色沉淀,则证明溶液中存在C1-;该反应的离子方程式为Ag++Cl-=AgCl↓。
23.(共14分,每空2分)
(1)
(2)H2O
(3)第四周期第ⅡA族
(4)bc
(5)Cl2+2I-=2Cl-+I2 I- Cl、I为同主族元素,电子层数I>Cl,离子半径I>C1,失电子能力I->Cl-,还原性I->Cl-
【分析】X、Y、Z、M、Q、R皆为周期表中前20号元素,X位于第一周期,根据原子半径与主要化合价的关系图,可知X是H元素;Y是0元素;Z是N元素;M是Cl元素;Q是Na元素;R是Ca元素。
【详解】(1)X2Y是共价化合物H2O,电子式为
(2)同周期元素从左到右,气态氢化物稳定性增强,H2O、NH3中更稳定的是H2O。
(3)R是Ca元素,在元素周期表中的位置是第四周期第ⅡA族;
(4)a.电子层数越多半径越大,电子层数相同时,质子数越多半径越小,简单离子半径:Cl->Ca2+>Na+,故a错误;
b.由H、N、O三种元素组成的化合物可能是NH4NO3或NH3·H2O,故b正确;
c.HNO3与HC1O,均为强酸,故c正确;
选bc。
(5)氯气通入淀粉-KI溶液,溶液变蓝,说明有碘单质生成,该反应的离子方程式Cl2+2I-=2Cl-+I2;
Cl、I为同主族元素,电子层数I>Cl,离子半径I>Cl,失电子能力I>Cl,还原性I->Cl-。
24.(共10分,每空2分)
(1)FeCl2
(2)4Fe(OH)2+O2+2H2O=4Fe(OH)3
(3)Fe3++3SCN-=Fe(SCN)3 2Fe3++Fe=3Fe2+
【分析】仔细分析转化关系,由白色沉淀E在空气中转化为红褐色沉淀F可以推出,E为Fe(OH)2,F为Fe(OH)3,氢氧化铁与盐酸反应生成氯化铁和水,则G是FeCl3;由D溶液加硝酸酸化的硝酸银溶液产生白色沉淀H,可推出H为AgC1,溶液焰色反应呈紫色,则D中含有K+,故D为KC1,B中含有Fe2+和C1-,C溶液为KOH溶液,A应为Fe,Fe与盐酸反应生成氯化亚铁和氢气符合转化关系,以此分析解答。
【详解】(1)通过以上分析可知B为氯化亚铁,化学式为FeCl2,D为氯化钾,化学式为KC1;
(2)由E转变成F是氢氧化亚铁被氧气氧化成氢氧化铁,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)G溶液FeCl3溶液,含有Fe3+,加入KSCN溶液出现血红色,用于鉴别FeCl3溶液,离子方程式Fe3++3SCN-=Fe(SCN)3;向FeCl3溶液加入Fe生成FeCl2,离子反应方程式为2Fe3++Fe=3Fe2+。
同课章节目录
