化学人教版(2019)选择性必修2 3.2.1分子晶体与共价晶体(共91张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2.1分子晶体与共价晶体(共91张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 27.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-08 09:32:07 | ||
图片预览







文档简介
(共91张PPT)
梦想很轻,却因此拥有飞向蓝天的力量。
——屠呦呦
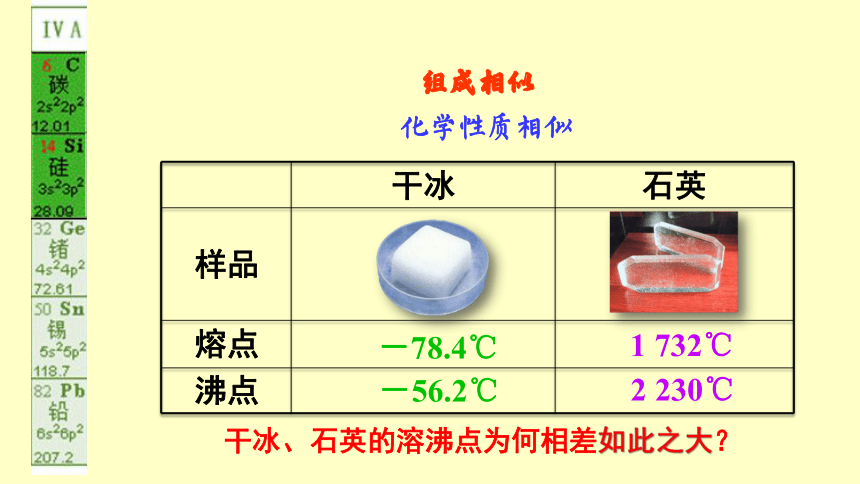
组成相似
化学性质相似
干冰 石英
样品
熔点
沸点
干冰、石英的溶沸点为何相差如此之大?
分子晶体和共价晶体
孙先辉PPT
学习目标
A
B
分子晶体
共价晶体
概念
分子晶体
物理通性
类别
A
概念
共价晶体
物理通性
类别
B
晶胞中粒子数
构成晶体的微粒及晶体类型
学习任务一
孙先辉PPT
如何解释:
组成和化学性质相似的干冰和石英晶体的熔点等物理性质有如此大的差异?
需要从微观角度认识
问题探究
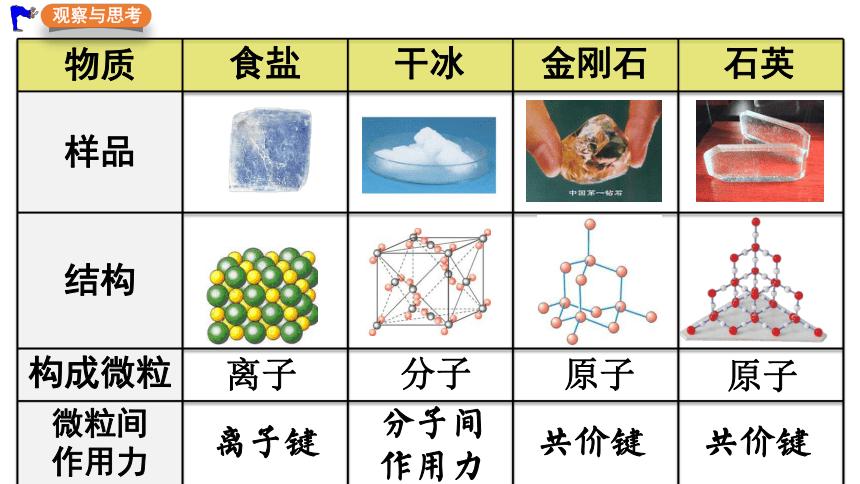
构成晶体的微粒及微粒间的作用力
物质 食盐 干冰 金刚石 石英
样品
结构
构成微粒
微粒间 作用力
离子
分子
原子
原子
观察与思考
离子键
分子间作用力
共价键
共价键
晶体构成微粒及类型
1
构成三微粒
分子、原子、离子
各类晶体的物理性质
晶体 氯化钠 干冰 金刚石 二氧化硅 氯化钡 白磷
熔点/℃ 801 -78.5 3500 1732 1560 44.1
硬度 较硬 较软 很硬 硬而脆 较硬 软
晶体 导电性 不导电 不导电 不导电 不导电 不导电 不导电
熔融 导电性 导电 不导电 不导电 不导电 导电 不导电
构成 微粒
哪些晶体可归为一类?
晶体构成微粒及类型
1
构成三微粒
分子、原子、离子
晶体四类型
分子晶体
离子晶体
共价晶体
金属晶体
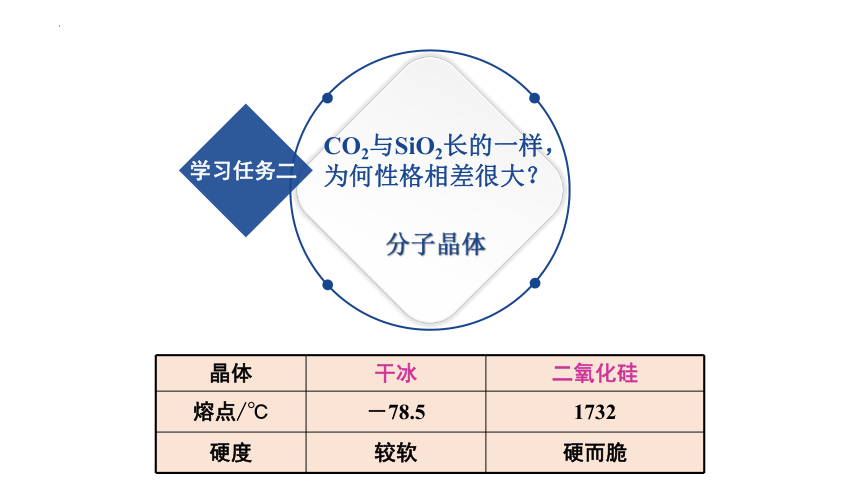
CO2与SiO2长的一样,为何性格相差很大?
学习任务二
分子晶体
晶体 干冰 二氧化硅
熔点/℃ -78.5 1732
硬度 较软 硬而脆
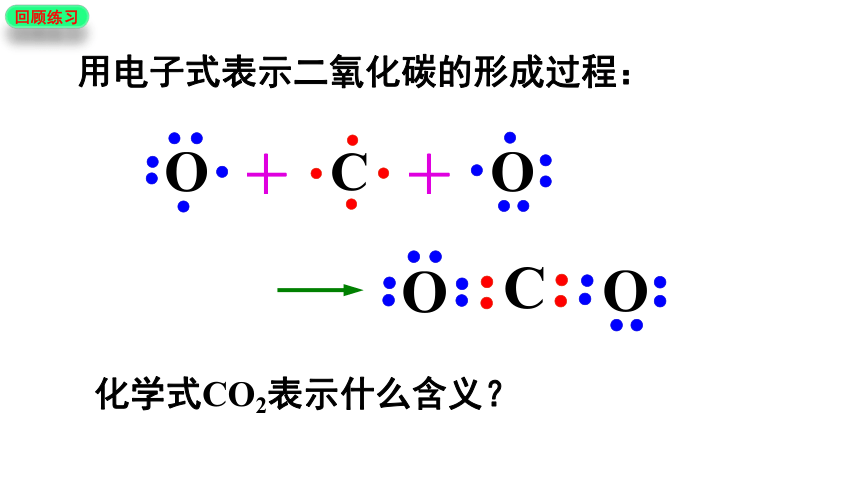
用电子式表示二氧化碳的形成过程:
化学式CO2表示什么含义?
回顾练习
干冰的晶体结构示意图
孙先辉PPT
观察与思考
干冰晶体晶体是由什么微粒构成的?
孙先辉PPT
2.1 概念及构成微粒
概念
分子晶体
2
分子间通过分子间作用力按一定规则排列而成的晶体
构成微粒
分子
由于分子晶体的构成微粒是分子,所以分子晶体的化学式是分子式。
温馨提醒
1.碳氧原子间通过什么作用力结合在一起构成二氧化碳分子?
问题解决
共价键
2.二氧化碳分子间通过什么作用力结合在一起?
1.碳氧原子间通过什么作用力结合在一起构成二氧化碳分子?
问题解决
分子间作用力
共价键
范德华力
观察与思考
干冰晶体中存在哪些作用力
2.2 微粒间作用力
分子晶体
2
分子间作用力
分子晶体中不一定只存在分子间作用力!
易错警示
1.干冰熔化时破坏什么作用力?
2.干冰熔化时有没有破坏碳氧原子间共价键?
感受﹒ 理解
推测:分子晶体的熔点是高还是低?
问题探究
2 .分子晶体在固态和熔融状态下是否能够导电?
1 .根据干冰和碘晶体结构特点分析干冰易气化,碘易升华的原因?
思考﹒ 讨论
2.3 物理性质
分子晶体
2
熔沸点较低
01
硬度较小
02
熔融不导电
03
滑冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
硬度小
分子间作用力较弱,容易被克服
哪类物质属于分子晶体?
孙先辉PPT
交流讨论
2.5 类别
分子晶体
2
1
2
3
4
5
H2O、H2S、NH3、CH4、HX
所有非金属氢化物
X2、N2、 O2、 H2、 S8、 P4、C60
大多数非金属单质
CO2、 SO2、N2O4、P4O6、P4O10
大多数非金属氧化物
H2SO4 、HNO3 、H3PO4
大多数的酸
乙醇、冰醋酸、蔗糖
大多数有机物
6
AlCl3、FeCl3
少数盐
而一水合高氯酸固体中以H3O+和ClO4-形式存在
观察与思考
1. 晶体中微粒是__________
2. ___个位于立方体的顶点
3. ___个位于面心
4. 晶胞中含有___个CO2分子
CO2分子
8
6
4
问题探究
若以一个二氧化碳分子为中心,其周围最多可以有几个紧邻的二氧化碳分子
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
x
y
z
干冰
CO2
问题探究
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
x
y
z
干冰
CO2
问题探究
最紧密
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
最紧密
问题探究
问题探究
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
x-z面4个
问题探究
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
y-z面4个
问题探究
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
x-y面4个
问题探究
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
12个
2.6 晶胞特征
分子晶体
2
若 如果分子间作用力只是范德华力, 若 1 个分子为中心,其周围最多有 12 个紧邻分子。
分子密堆积
若分子间除了存在范德华力,还存在氢键,那么,这对分子晶体的结构有什么影响呢?
问题探究
根据冰晶体的结构模型每个H2O周围有几个紧密相邻的H2O?
观察与思考
水分子之间的主要作用力是氢键(当然也存在范德华力),尽管氢键比共价键弱得多,不属于化学键,却跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
冰中一个水分子周围有4个水分子
为什么冰刚刚融化时,密度变大?
思考﹒ 讨论
为什么冰刚刚融化时,密度变大?
思考﹒ 讨论
冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水的小。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。
问题探究
分子晶体的结构特征
分子密堆积 分子非密堆积
微粒间作用力
空间特点 通常每个分子周围 有12个紧邻的分子 每个分子周围紧邻的分子数
小于12个,空间利用率不高
举例 C60、干冰、I2、O2 HF、NH3、冰
范德华力
范德华力和氢键
干冰
密堆积
冰
非密堆积
2.6 晶胞特征
分子晶体
2
若 如果分子间作用力只是范德华力, 若 1 个分子为中心,其周围最多有 12 个紧邻分子。
分子密堆积
若分子间作用力主要为氢键时,氢键具有方向性,使晶体中的空间利用率不高,留有相当大的空隙。。
分子非密堆积
干冰能让镁持续燃烧吗?
可燃冰
20 世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体,这种晶体的主要成分是甲烷,因而又称甲烷水合物,它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
天然气在水合物晶体中,装在以氢键相连的几个水分子构成的笼中,因而又称笼状化合物。天然气水合物晶体中的水分子笼也是多种多样的,它们是一类笼状的分子晶体。
金刚石为何硬度很大?
学习任务三
共价晶体
金刚石晶体是由什么微粒构成的?
问题探究
109 28
金刚石的晶体结构示意图
金刚石晶体的结构特点
碳采取 sp3 杂化轨道形成共价键三维骨架结构
每个碳原子以四个共价键对称地与相邻的 4 个碳原子相结合
键角为 109 28
请你给晶体起个名字?
3.1 概念与构成微粒
相邻原子间以共价键结合而形成空间网状结构的晶体
共价晶体
3
空间构型
构成微粒
微粒间的相互作用
概念
构成微粒
原子
感受﹒ 理解
用Si代替C原子形成的是什么晶体?
如果Si原子间插入O原子呢?
180
109 28
Si
O
共价键
二氧化硅晶体结构示意图
感受﹒ 理解
用Si代替部分C原子形成的是什么晶体?
碳化硅又称金钢砂或耐火砂,英文名 Silicon Carbide,化学式 SiC。 纯碳化硅是无色透明的晶体。
3.2 结构特点
共价晶体
3
三维骨架结构
1
空间网状结构
1. 晶体中每个Si原子周围有____个O原子
2. 晶体中每个O原子周围有___个Si原子
观察与思考
为何晶体中Si、O原子个数比为不是1∶ 4 ?
观察与思考
观察与思考
1
4
观察与思考
Si
1
O
4
×
=
2
晶体中Si、O原子个数比为_______
1∶2
观察与思考
1. 二氧化硅晶体中存在SiO2分子吗?
观察下图中石英晶体中氧原子、硅原子的构成方式与排列方式,回答:
2. 化学式SiO2表示什么含义?
观察与思考
孙先辉PPT
在低温石英的结构中,顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构,这一结构决定了它具有手性(左、右型),被广泛用作压电材料,如制作石英手表。
二氧化硅晶体——低温石英
石英晶体中的硅氧四面体相连构成的螺旋链
石英的左、右型晶体
石英手表
3.2 结构特点
共价晶体
3
三维骨架结构
1
空间网状结构
2
晶体中无单个分子,化学式表示原子的个数比
如: SiO2为化学式,而非分子式!
晶体 金刚石 二氧化硅 碳化硅 硅 硼
熔点/℃ 3 500 1 732 2 700 1 410 2 180
硬度 很硬 硬 很硬 硬 硬
几种原子晶体的物理性质
为什么原子晶体的熔点高、硬度高?
思考﹒ 运用
感受·理解
通过金刚石晶体的结构认识
共价晶体结构组成共价晶体的粒子和粒子间的作用力
组成的粒子:原子
粒子间的作用力:共价键
金刚石的多面体外形
晶体结构
晶胞示意图
晶胞示意图
3.3 微粒间作用力
共价晶体
3
共价键
键长 154 pm
键能 347.7 kJ/mol
金刚石晶熔沸点很高
感受﹒ 理解
3.4 物理性质
原子晶体
3
三高
1
高熔点 高沸点 高硬度
一般不导电
1 410 ℃
1 732 ℃
硅
二氧化硅
问题探究
请解释熔点的差异
3.4 物理性质
原子晶体
3
三高
1
高熔点 高沸点 高硬度
一般不导电
2
熔沸点变化规律
原子半径越小
晶体熔沸点越高
键长越短
键能越大
哪类物质属于共价晶体?
SiO2
问题解决
孙先辉PPT
除了金刚石、二氧化硅,还有哪些物质属于共价晶体呢?
让我们沿着元素周期表一起寻找。
孙先辉PPT
共价晶体
3
3.5 类别
少数单质
1
金刚石、硅、
锗、灰锡
硼
高聚氮
感受﹒ 理解
替换
碳化硅
替换
SiO2
孙先辉PPT
原子晶体
3
3.5 类别
少数单质
1
金刚石、硅
2
某些非金属化合物
SiO2 SiC Si3N4 BN AlN
以 Si3N4 为基础,用 Al 取代部分 Si, 用 O 取代部分 N 而获得结构多样化的陶瓷,用于制作 LED 发光材料。
锗、灰锡
硼
高聚氮
金刚石再硬、智慧能使它变软;
拥有智慧,平凡的石墨也能变成璀璨的钻石。
第三代半导体:中国半导体的希望!
锗Ge硅Si
主要应用:低压、低频、中功率晶体管、光电探测器,取代了笨重的电子管,导致了集成电路的可能性
砷化镓GaAs 磷化铟InP
主要应用:毫米波器件、发光器件、卫星通讯、移动通讯、光通讯、GPS导航等,较好的电子迁移率、带隙等材料特性,资源稀缺,有毒性,污染环境
碳化硅Sic、氮化铝AlN、氮化镓GaN、氧化锌ZnO、金刚石C
主要应用:高温、高频、抗辐射、大功率器件;蓝、绿、紫光二极管、半导体激光器,更优的电子迁移率、带隙、击穿电压 、高频、高温特性
第一代
半导体
第二代
半导体
第三代
半导体
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
认识了不同类型的晶体在构成微粒、微粒间的相互作用和性质(熔沸点、硬度、导电性)等方面的差异。
学会运用列表对比的方法,找出不同对象的异同点。
学会运用“结构决定性质、性质体现结构”的观点来解释不同类型的晶体在性质的差异。
知识方面
方法方面
1
2
VS
分子晶体与原子晶体
分子晶体
原子晶体
构成微粒
作用力
熔沸点
硬 度
导电性
有无分子
熔融断键
分子
原子
分子间作用力
共价键
较低
很高
低
高
不导电
不导电
硅半导体
有
无
不断键
断键
比较晶体的熔点的方法
有氢键
只有
范德华力
键能越大
熔点越高
氢键的数目多少
相对分子质量大小
判断
键能的大小
判断
分子间的作用力
规律方法点拨
共价晶体
分子晶体
键能
键长
原子半径
分子晶体熔沸点判断
① 组成和结构相似的分子晶体,相对分子质量越大,分 子间作用力越大,熔沸点越高
② 具有分子间氢键的分子晶体,分子间作用力显著增大,熔沸点升高
③ 相对分子质量相近的分子晶体,分子极性越大,分子间作用力越大,熔沸点越高
规律方法点拨
共价晶体熔沸点判断
原子半径
键长
键能
溶沸点
共价晶体
晶体中的作用力
分子晶体
范德华力
晶体 干冰 二氧化硅
熔点/℃ -78.5 1732
硬度 较软 硬而脆
组成和化学性质如此相似的干冰和石英晶体,其熔点和硬度等物理性质上为何有如此大的差异?
干冰熔化克服的CO2分子间作用力,石英晶体熔化时克服的硅氧共价键,化学键的作用力远大于分子间作用力。
看谁做得既准又快
下列说法中,错误的是
A.只含分子的晶体一定是分子晶体
B.碘晶体升华时破坏了共价键
C. 几乎所有的酸都属于分子晶体
D. 稀有气体分子中只含原子,但稀有气体的晶体属于 分子晶体
牛刀小试
孙先辉PPT
下列说法中,正确的是
A. 冰融化时,分子中 H-O 键发生断裂
B. 共价晶体中,共价键越强,熔点越高
C. 分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高
D. 分子晶体中,分子间作用力越大,对应的物质越稳定
考考你自己
下列说法中,正确的是
A. 分子晶体一定存在分子间作用力和共价键
B. 分子晶体的熔点一般比共价晶体的熔点高
C. 稀有气体形成的晶体属于分子晶体
D. CO2 晶体是分子晶体,可推测 SiO2 晶体也是分子晶体
成功体验
下列事实能说明刚玉(Al2O3)是共价晶体的是
①Al2O3 是两性氧化物
②硬度很大
③它的熔点是 2045 ℃
④自然界中的刚玉有红宝石和蓝宝石
A. ①②
B. ②③
C. ①④
D. ③④
思考﹒ 运用
我们要象金刚石哪样,紧密团结,则战无不胜!
梦想很轻,却因此拥有飞向蓝天的力量。
——屠呦呦
组成相似
化学性质相似
干冰 石英
样品
熔点
沸点
干冰、石英的溶沸点为何相差如此之大?
分子晶体和共价晶体
孙先辉PPT
学习目标
A
B
分子晶体
共价晶体
概念
分子晶体
物理通性
类别
A
概念
共价晶体
物理通性
类别
B
晶胞中粒子数
构成晶体的微粒及晶体类型
学习任务一
孙先辉PPT
如何解释:
组成和化学性质相似的干冰和石英晶体的熔点等物理性质有如此大的差异?
需要从微观角度认识
问题探究
构成晶体的微粒及微粒间的作用力
物质 食盐 干冰 金刚石 石英
样品
结构
构成微粒
微粒间 作用力
离子
分子
原子
原子
观察与思考
离子键
分子间作用力
共价键
共价键
晶体构成微粒及类型
1
构成三微粒
分子、原子、离子
各类晶体的物理性质
晶体 氯化钠 干冰 金刚石 二氧化硅 氯化钡 白磷
熔点/℃ 801 -78.5 3500 1732 1560 44.1
硬度 较硬 较软 很硬 硬而脆 较硬 软
晶体 导电性 不导电 不导电 不导电 不导电 不导电 不导电
熔融 导电性 导电 不导电 不导电 不导电 导电 不导电
构成 微粒
哪些晶体可归为一类?
晶体构成微粒及类型
1
构成三微粒
分子、原子、离子
晶体四类型
分子晶体
离子晶体
共价晶体
金属晶体
CO2与SiO2长的一样,为何性格相差很大?
学习任务二
分子晶体
晶体 干冰 二氧化硅
熔点/℃ -78.5 1732
硬度 较软 硬而脆
用电子式表示二氧化碳的形成过程:
化学式CO2表示什么含义?
回顾练习
干冰的晶体结构示意图
孙先辉PPT
观察与思考
干冰晶体晶体是由什么微粒构成的?
孙先辉PPT
2.1 概念及构成微粒
概念
分子晶体
2
分子间通过分子间作用力按一定规则排列而成的晶体
构成微粒
分子
由于分子晶体的构成微粒是分子,所以分子晶体的化学式是分子式。
温馨提醒
1.碳氧原子间通过什么作用力结合在一起构成二氧化碳分子?
问题解决
共价键
2.二氧化碳分子间通过什么作用力结合在一起?
1.碳氧原子间通过什么作用力结合在一起构成二氧化碳分子?
问题解决
分子间作用力
共价键
范德华力
观察与思考
干冰晶体中存在哪些作用力
2.2 微粒间作用力
分子晶体
2
分子间作用力
分子晶体中不一定只存在分子间作用力!
易错警示
1.干冰熔化时破坏什么作用力?
2.干冰熔化时有没有破坏碳氧原子间共价键?
感受﹒ 理解
推测:分子晶体的熔点是高还是低?
问题探究
2 .分子晶体在固态和熔融状态下是否能够导电?
1 .根据干冰和碘晶体结构特点分析干冰易气化,碘易升华的原因?
思考﹒ 讨论
2.3 物理性质
分子晶体
2
熔沸点较低
01
硬度较小
02
熔融不导电
03
滑冰时,冰面上常常容易留下划痕,这说明冰晶体的硬度较大还是较小?
硬度小
分子间作用力较弱,容易被克服
哪类物质属于分子晶体?
孙先辉PPT
交流讨论
2.5 类别
分子晶体
2
1
2
3
4
5
H2O、H2S、NH3、CH4、HX
所有非金属氢化物
X2、N2、 O2、 H2、 S8、 P4、C60
大多数非金属单质
CO2、 SO2、N2O4、P4O6、P4O10
大多数非金属氧化物
H2SO4 、HNO3 、H3PO4
大多数的酸
乙醇、冰醋酸、蔗糖
大多数有机物
6
AlCl3、FeCl3
少数盐
而一水合高氯酸固体中以H3O+和ClO4-形式存在
观察与思考
1. 晶体中微粒是__________
2. ___个位于立方体的顶点
3. ___个位于面心
4. 晶胞中含有___个CO2分子
CO2分子
8
6
4
问题探究
若以一个二氧化碳分子为中心,其周围最多可以有几个紧邻的二氧化碳分子
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
x
y
z
干冰
CO2
问题探究
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
x
y
z
干冰
CO2
问题探究
最紧密
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
最紧密
问题探究
问题探究
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
x-z面4个
问题探究
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
y-z面4个
问题探究
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
x-y面4个
问题探究
x
y
z
干冰
CO2
利用干冰晶体的结构模型认识分子晶体的结构特征,每个CO2周围有几个紧密相邻的CO2
12个
2.6 晶胞特征
分子晶体
2
若 如果分子间作用力只是范德华力, 若 1 个分子为中心,其周围最多有 12 个紧邻分子。
分子密堆积
若分子间除了存在范德华力,还存在氢键,那么,这对分子晶体的结构有什么影响呢?
问题探究
根据冰晶体的结构模型每个H2O周围有几个紧密相邻的H2O?
观察与思考
水分子之间的主要作用力是氢键(当然也存在范德华力),尽管氢键比共价键弱得多,不属于化学键,却跟共价键一样具有方向性,即氢键的存在迫使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
冰中一个水分子周围有4个水分子
为什么冰刚刚融化时,密度变大?
思考﹒ 讨论
为什么冰刚刚融化时,密度变大?
思考﹒ 讨论
冰晶体中的水分子的空间利用率不高,留有相当大的空隙,其密度比液态水的小。当冰刚刚融化为液态水时,热运动使冰的结构部分解体,水分子间的空隙减小,密度反而增大。
问题探究
分子晶体的结构特征
分子密堆积 分子非密堆积
微粒间作用力
空间特点 通常每个分子周围 有12个紧邻的分子 每个分子周围紧邻的分子数
小于12个,空间利用率不高
举例 C60、干冰、I2、O2 HF、NH3、冰
范德华力
范德华力和氢键
干冰
密堆积
冰
非密堆积
2.6 晶胞特征
分子晶体
2
若 如果分子间作用力只是范德华力, 若 1 个分子为中心,其周围最多有 12 个紧邻分子。
分子密堆积
若分子间作用力主要为氢键时,氢键具有方向性,使晶体中的空间利用率不高,留有相当大的空隙。。
分子非密堆积
干冰能让镁持续燃烧吗?
可燃冰
20 世纪末,科学家发现海底和大陆冰川或永久冻土底部存在大量天然气水合物晶体,这种晶体的主要成分是甲烷,因而又称甲烷水合物,它的外形像冰,而且在常温常压下会迅速分解释放出可燃的甲烷,因而又称“可燃冰”。
天然气在水合物晶体中,装在以氢键相连的几个水分子构成的笼中,因而又称笼状化合物。天然气水合物晶体中的水分子笼也是多种多样的,它们是一类笼状的分子晶体。
金刚石为何硬度很大?
学习任务三
共价晶体
金刚石晶体是由什么微粒构成的?
问题探究
109 28
金刚石的晶体结构示意图
金刚石晶体的结构特点
碳采取 sp3 杂化轨道形成共价键三维骨架结构
每个碳原子以四个共价键对称地与相邻的 4 个碳原子相结合
键角为 109 28
请你给晶体起个名字?
3.1 概念与构成微粒
相邻原子间以共价键结合而形成空间网状结构的晶体
共价晶体
3
空间构型
构成微粒
微粒间的相互作用
概念
构成微粒
原子
感受﹒ 理解
用Si代替C原子形成的是什么晶体?
如果Si原子间插入O原子呢?
180
109 28
Si
O
共价键
二氧化硅晶体结构示意图
感受﹒ 理解
用Si代替部分C原子形成的是什么晶体?
碳化硅又称金钢砂或耐火砂,英文名 Silicon Carbide,化学式 SiC。 纯碳化硅是无色透明的晶体。
3.2 结构特点
共价晶体
3
三维骨架结构
1
空间网状结构
1. 晶体中每个Si原子周围有____个O原子
2. 晶体中每个O原子周围有___个Si原子
观察与思考
为何晶体中Si、O原子个数比为不是1∶ 4 ?
观察与思考
观察与思考
1
4
观察与思考
Si
1
O
4
×
=
2
晶体中Si、O原子个数比为_______
1∶2
观察与思考
1. 二氧化硅晶体中存在SiO2分子吗?
观察下图中石英晶体中氧原子、硅原子的构成方式与排列方式,回答:
2. 化学式SiO2表示什么含义?
观察与思考
孙先辉PPT
在低温石英的结构中,顶角相连的硅氧四面体形成螺旋上升的长链,而没有封闭的环状结构,这一结构决定了它具有手性(左、右型),被广泛用作压电材料,如制作石英手表。
二氧化硅晶体——低温石英
石英晶体中的硅氧四面体相连构成的螺旋链
石英的左、右型晶体
石英手表
3.2 结构特点
共价晶体
3
三维骨架结构
1
空间网状结构
2
晶体中无单个分子,化学式表示原子的个数比
如: SiO2为化学式,而非分子式!
晶体 金刚石 二氧化硅 碳化硅 硅 硼
熔点/℃ 3 500 1 732 2 700 1 410 2 180
硬度 很硬 硬 很硬 硬 硬
几种原子晶体的物理性质
为什么原子晶体的熔点高、硬度高?
思考﹒ 运用
感受·理解
通过金刚石晶体的结构认识
共价晶体结构组成共价晶体的粒子和粒子间的作用力
组成的粒子:原子
粒子间的作用力:共价键
金刚石的多面体外形
晶体结构
晶胞示意图
晶胞示意图
3.3 微粒间作用力
共价晶体
3
共价键
键长 154 pm
键能 347.7 kJ/mol
金刚石晶熔沸点很高
感受﹒ 理解
3.4 物理性质
原子晶体
3
三高
1
高熔点 高沸点 高硬度
一般不导电
1 410 ℃
1 732 ℃
硅
二氧化硅
问题探究
请解释熔点的差异
3.4 物理性质
原子晶体
3
三高
1
高熔点 高沸点 高硬度
一般不导电
2
熔沸点变化规律
原子半径越小
晶体熔沸点越高
键长越短
键能越大
哪类物质属于共价晶体?
SiO2
问题解决
孙先辉PPT
除了金刚石、二氧化硅,还有哪些物质属于共价晶体呢?
让我们沿着元素周期表一起寻找。
孙先辉PPT
共价晶体
3
3.5 类别
少数单质
1
金刚石、硅、
锗、灰锡
硼
高聚氮
感受﹒ 理解
替换
碳化硅
替换
SiO2
孙先辉PPT
原子晶体
3
3.5 类别
少数单质
1
金刚石、硅
2
某些非金属化合物
SiO2 SiC Si3N4 BN AlN
以 Si3N4 为基础,用 Al 取代部分 Si, 用 O 取代部分 N 而获得结构多样化的陶瓷,用于制作 LED 发光材料。
锗、灰锡
硼
高聚氮
金刚石再硬、智慧能使它变软;
拥有智慧,平凡的石墨也能变成璀璨的钻石。
第三代半导体:中国半导体的希望!
锗Ge硅Si
主要应用:低压、低频、中功率晶体管、光电探测器,取代了笨重的电子管,导致了集成电路的可能性
砷化镓GaAs 磷化铟InP
主要应用:毫米波器件、发光器件、卫星通讯、移动通讯、光通讯、GPS导航等,较好的电子迁移率、带隙等材料特性,资源稀缺,有毒性,污染环境
碳化硅Sic、氮化铝AlN、氮化镓GaN、氧化锌ZnO、金刚石C
主要应用:高温、高频、抗辐射、大功率器件;蓝、绿、紫光二极管、半导体激光器,更优的电子迁移率、带隙、击穿电压 、高频、高温特性
第一代
半导体
第二代
半导体
第三代
半导体
这节课我学到了什么?
(用一句话表示)
还有什么疑问?
课堂小结
课堂小结
认识了不同类型的晶体在构成微粒、微粒间的相互作用和性质(熔沸点、硬度、导电性)等方面的差异。
学会运用列表对比的方法,找出不同对象的异同点。
学会运用“结构决定性质、性质体现结构”的观点来解释不同类型的晶体在性质的差异。
知识方面
方法方面
1
2
VS
分子晶体与原子晶体
分子晶体
原子晶体
构成微粒
作用力
熔沸点
硬 度
导电性
有无分子
熔融断键
分子
原子
分子间作用力
共价键
较低
很高
低
高
不导电
不导电
硅半导体
有
无
不断键
断键
比较晶体的熔点的方法
有氢键
只有
范德华力
键能越大
熔点越高
氢键的数目多少
相对分子质量大小
判断
键能的大小
判断
分子间的作用力
规律方法点拨
共价晶体
分子晶体
键能
键长
原子半径
分子晶体熔沸点判断
① 组成和结构相似的分子晶体,相对分子质量越大,分 子间作用力越大,熔沸点越高
② 具有分子间氢键的分子晶体,分子间作用力显著增大,熔沸点升高
③ 相对分子质量相近的分子晶体,分子极性越大,分子间作用力越大,熔沸点越高
规律方法点拨
共价晶体熔沸点判断
原子半径
键长
键能
溶沸点
共价晶体
晶体中的作用力
分子晶体
范德华力
晶体 干冰 二氧化硅
熔点/℃ -78.5 1732
硬度 较软 硬而脆
组成和化学性质如此相似的干冰和石英晶体,其熔点和硬度等物理性质上为何有如此大的差异?
干冰熔化克服的CO2分子间作用力,石英晶体熔化时克服的硅氧共价键,化学键的作用力远大于分子间作用力。
看谁做得既准又快
下列说法中,错误的是
A.只含分子的晶体一定是分子晶体
B.碘晶体升华时破坏了共价键
C. 几乎所有的酸都属于分子晶体
D. 稀有气体分子中只含原子,但稀有气体的晶体属于 分子晶体
牛刀小试
孙先辉PPT
下列说法中,正确的是
A. 冰融化时,分子中 H-O 键发生断裂
B. 共价晶体中,共价键越强,熔点越高
C. 分子晶体中,共价键键能越大,该分子晶体的熔沸点一定越高
D. 分子晶体中,分子间作用力越大,对应的物质越稳定
考考你自己
下列说法中,正确的是
A. 分子晶体一定存在分子间作用力和共价键
B. 分子晶体的熔点一般比共价晶体的熔点高
C. 稀有气体形成的晶体属于分子晶体
D. CO2 晶体是分子晶体,可推测 SiO2 晶体也是分子晶体
成功体验
下列事实能说明刚玉(Al2O3)是共价晶体的是
①Al2O3 是两性氧化物
②硬度很大
③它的熔点是 2045 ℃
④自然界中的刚玉有红宝石和蓝宝石
A. ①②
B. ②③
C. ①④
D. ③④
思考﹒ 运用
我们要象金刚石哪样,紧密团结,则战无不胜!
