化学人教版(2019)选择性必修2 1.1.1构造原理与电子排布式(共16张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.1.1构造原理与电子排布式(共16张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-06 08:36:26 | ||
图片预览





文档简介
(共16张PPT)
第一章
原子结构与性质
构造原理与电子排布式
学习
目标
PART
01
PART
02
能正确书写1-36号元素基态原子的核外电子排布式和简化的电子排布式。
了解构造原理,熟记基态原子核外电子填入能级的顺序。
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
在多电子原子中,电子在能级上的排布顺序:电子最先排布在能量低的能级上,然后依次排布在能量高的能级上。
1.含义:
一、构造原理
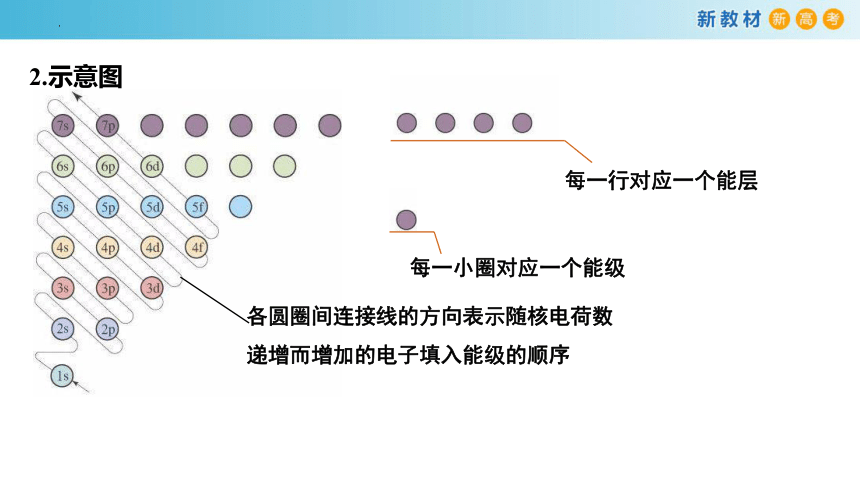
每一行对应一个能层
每一小圈对应一个能级
各圆圈间连接线的方向表示随核电荷数递增而增加的电子填入能级的顺序
2.示意图
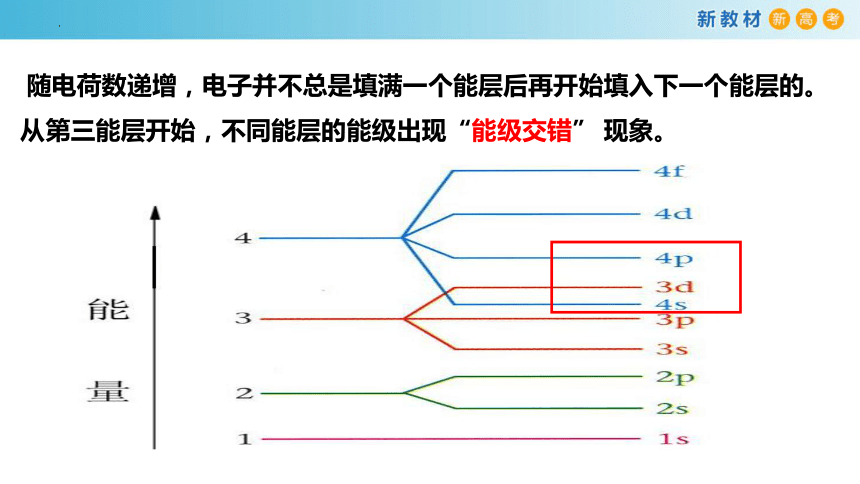
随电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的。从第三能层开始,不同能层的能级出现“能级交错” 现象。
构造原理排布顺序:
1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p;
6s 4f 5d 6p;7s 5f 6d 7p
规律:ns<(n-2)f<(n-1)d<np
写一写
随堂练习
【1】构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)E(4s)>E(4f)>E(3d)
B
随堂练习
【2】构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序。若以E表示某能级的能量,下列能量大小顺序中不正确的是( )
A.E(3d)>E(3p)>E(3s) B.E(3s)>E(2s)>E(1s)
C.E(4f)>E(3d)>E(4s) D.E(5s)>E(4s)>E(4f)
D
N:1s2 2s22p3
能层序数
能级符号
该能级上排布的电子数
二、电子排布式
1.含义:将能级上所容纳的电子数标在该能级符号右上角,并按照能层从左到右的顺序排列的式子称为电子排布式。
2、简单原子电子排布式书写:按照构造原理将电子依次填入
能量逐渐升高的能级中。如11Na,其电子排布式为1s22s22p63s1
练一练
1H: ; 6C: ;
8O: ; 17Cl: ;
3、复杂原子电子排布式书写:先按照构造原理从低到高排列,
然后将同能层的能级移到一起。
如19K,其电子排布式为 1s22s22p63s23p64s1
26Fe:_________________________
4、特殊原子电子排布式书写:当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。
如24Cr:,其电子排布式为 1s22s22p63s23p63d54s1
29Cu:_________________________
1、离子的电子排布式:阴离子是因为基态原子得到了电子,所以把电子加上,阳离子是因为基态原子失去了电子,所以要减去电子。如17Cl-:1s22s22p63s23p6;
练一练
Fe2+:_____________________
Fe3+: __________________________
三、离子电子排布式的书写及简化电子排布式
2、简化电子排布式:利用上一周期稀有气体的核外电子排布代替内层电子的式子。如Na的电子排布式为1s22s22p63s1,可简化为[Ne]3s1;又如K:1s22s22p63s23p64s1,其简化电子排布式可表示为[Ar]4s1
练一练
Mg: 。
Br: 。
Fe2+:_____________________________
3、价层电子排布式:写出带稀有气体“原子实”的简化核外电子排布式。如Na、28Ni的电子排布式为[Ne]3s1 、[Ar]3d84s2 1-30号元素删去稀有气体,即得价层电子排布式,则Na、28Ni的价层电子排布式为3s1 、3d84s2
31-36号元素删去稀有气体和内层电子,即得价层电子排布式,如34Se的简化电子排布式为[Ar]3d104s24p4 则删去之后34Se的价层电子排布式为 4s24p4
①13Al:__ ______;
②32Ge:______ __;
1.构造原理
2.简单原子的电子排布式
3.复杂原子、特殊原子的电子排布式
4.离子的电子排布式
5.简化的电子排布式
6.价层电子排布式
课堂小结
谢谢观看
第一章
原子结构与性质
构造原理与电子排布式
学习
目标
PART
01
PART
02
能正确书写1-36号元素基态原子的核外电子排布式和简化的电子排布式。
了解构造原理,熟记基态原子核外电子填入能级的顺序。
以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为构造原理。
在多电子原子中,电子在能级上的排布顺序:电子最先排布在能量低的能级上,然后依次排布在能量高的能级上。
1.含义:
一、构造原理
每一行对应一个能层
每一小圈对应一个能级
各圆圈间连接线的方向表示随核电荷数递增而增加的电子填入能级的顺序
2.示意图
随电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层的。从第三能层开始,不同能层的能级出现“能级交错” 现象。
构造原理排布顺序:
1s;2s 2p;3s 3p;4s 3d 4p;5s 4d 5p;
6s 4f 5d 6p;7s 5f 6d 7p
规律:ns<(n-2)f<(n-1)d<np
写一写
随堂练习
【1】构造原理揭示的电子排布能级顺序,实质是各能级能量高低。若以E(nl)表示某能级的能量,以下各式中正确的是( )
A.E(5s)>E(4f)>E(4s)>E(3d) B.E(3d)>E(4s)>E(3p)>E(3s)
C.E(4s)
B
随堂练习
【2】构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序。若以E表示某能级的能量,下列能量大小顺序中不正确的是( )
A.E(3d)>E(3p)>E(3s) B.E(3s)>E(2s)>E(1s)
C.E(4f)>E(3d)>E(4s) D.E(5s)>E(4s)>E(4f)
D
N:1s2 2s22p3
能层序数
能级符号
该能级上排布的电子数
二、电子排布式
1.含义:将能级上所容纳的电子数标在该能级符号右上角,并按照能层从左到右的顺序排列的式子称为电子排布式。
2、简单原子电子排布式书写:按照构造原理将电子依次填入
能量逐渐升高的能级中。如11Na,其电子排布式为1s22s22p63s1
练一练
1H: ; 6C: ;
8O: ; 17Cl: ;
3、复杂原子电子排布式书写:先按照构造原理从低到高排列,
然后将同能层的能级移到一起。
如19K,其电子排布式为 1s22s22p63s23p64s1
26Fe:_________________________
4、特殊原子电子排布式书写:当p、d、f能级处于全空、全充满或半充满状态时,能量相对较低,原子结构较稳定。
如24Cr:,其电子排布式为 1s22s22p63s23p63d54s1
29Cu:_________________________
1、离子的电子排布式:阴离子是因为基态原子得到了电子,所以把电子加上,阳离子是因为基态原子失去了电子,所以要减去电子。如17Cl-:1s22s22p63s23p6;
练一练
Fe2+:_____________________
Fe3+: __________________________
三、离子电子排布式的书写及简化电子排布式
2、简化电子排布式:利用上一周期稀有气体的核外电子排布代替内层电子的式子。如Na的电子排布式为1s22s22p63s1,可简化为[Ne]3s1;又如K:1s22s22p63s23p64s1,其简化电子排布式可表示为[Ar]4s1
练一练
Mg: 。
Br: 。
Fe2+:_____________________________
3、价层电子排布式:写出带稀有气体“原子实”的简化核外电子排布式。如Na、28Ni的电子排布式为[Ne]3s1 、[Ar]3d84s2 1-30号元素删去稀有气体,即得价层电子排布式,则Na、28Ni的价层电子排布式为3s1 、3d84s2
31-36号元素删去稀有气体和内层电子,即得价层电子排布式,如34Se的简化电子排布式为[Ar]3d104s24p4 则删去之后34Se的价层电子排布式为 4s24p4
①13Al:__ ______;
②32Ge:______ __;
1.构造原理
2.简单原子的电子排布式
3.复杂原子、特殊原子的电子排布式
4.离子的电子排布式
5.简化的电子排布式
6.价层电子排布式
课堂小结
谢谢观看
