专题1《化学反应与能量》单元检测题(含解析) 2023-2024学年高二上学期化学苏科版(2019)选择性必修1
文档属性
| 名称 | 专题1《化学反应与能量》单元检测题(含解析) 2023-2024学年高二上学期化学苏科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 374.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-06 13:33:02 | ||
图片预览



文档简介
专题1《化学反应与能量》单元检测题
一、单选题
1.下列电池不属于化学电池的是( )
A.一次电池 B.二次电池 C.燃料电池 D.太阳能电池
2.在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1的NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1的NaOH 溶液中充分反应,放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(l)=2NaHCO3(l) ΔH=-(8x-2y)kJ·mol-1
3.下列反应属于放热反应的是( )
A.氢氧化钡晶体和氯化铵晶体的反应
B.能量变化如上图所示的反应
C.化学键断裂吸收的热量比化学键生成放出的热量多的反应
D.燃烧反应和酸碱中和反应
4.粗铜中含有少量的Zn、Fe、Ag、Au等,采用电解法提纯,下列说法错误的是( )
A.可用硫酸铜溶液作电解质溶液
B.粗铜与电源的正极相连
C.在精炼过程中,Ag、Au沉积于阳极底部
D.在精炼过程中,阳极、阴极的质量变化量相等
5.下列说法错误的是( )
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.物质的燃烧一定是放热反应
C.放热的化学反应不需要加热就能发生
D.化学能与光能之间可以相互转化
6.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )
A.电源B极是正极
B.(甲)(乙)装置的C,D,E,F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
7.已知2mol H2(g)燃烧生成液态水放出的热量为571.6lkJ,而2molH2 (g)完全燃烧生成气态水放的热量为483.6kJ.下列说法正确的是( )
A.1molH2O (I)变成1molH2O (g),向外界释放能量
B.1molH2O (g)分解成H2(g)和O2(g),吸收241. 8kJ能量
C.2mol H2(g)和1mol O2(g)的总能量小于2molH2O(1)的能量
D.断裂2molH2O (g)中所有的O﹣H键,吸收483.6 kJ能量
8.下列电极反应式正确的是( )
A.以惰性材料为电极,KOH溶液为电解质构成原电池,负极反应式为H2﹣2e﹣=2H+
B.铜、锌在稀硫酸溶液中构成原电池,正极反应式为2H++2e﹣=H2↑
C.以铜为电极将2Fe3++Cu=2Fe2++Cu2+设计成原电池,正极反应式为Cu﹣2e﹣=Cu2+
D.以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应式为Al﹣3e﹣=Al3+
9.某原电池的总反应的离子方程式为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
选项 正极 负极 电解质溶液
A Cu Fe FeCl3溶液
B C Fe Fe(NO3)3溶液
C Fe Zn Fe2(SO4)3溶液
D Ag Fe Fe2(SO4)3溶液
A.A B.B C.C D.D
10.下列反应属于吸热反应的是( )
A.碳与水蒸气制水煤气的反应 B.生石灰和水的反应
C.盐酸与氢氧化钠溶液的反应 D.木炭在氧气中燃烧
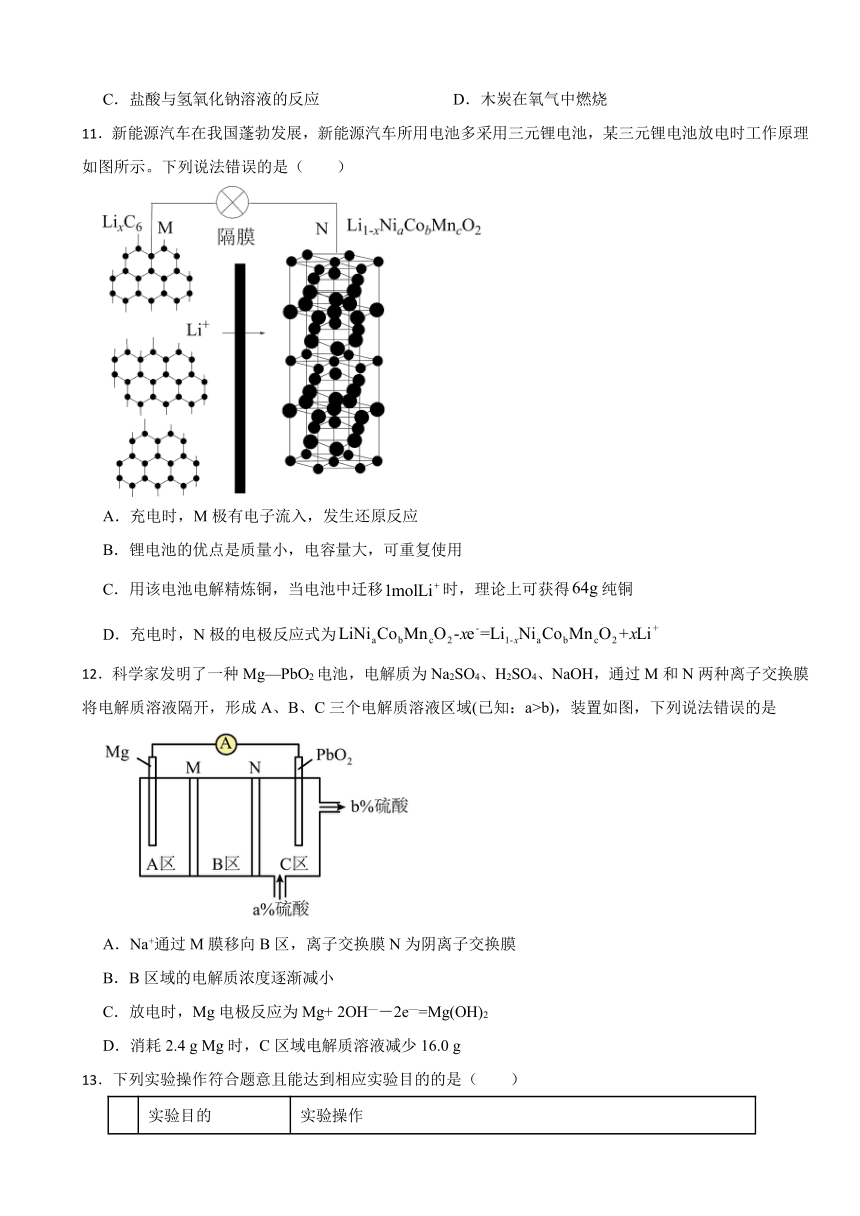
11.新能源汽车在我国蓬勃发展,新能源汽车所用电池多采用三元锂电池,某三元锂电池放电时工作原理如图所示。下列说法错误的是( )
A.充电时,M极有电子流入,发生还原反应
B.锂电池的优点是质量小,电容量大,可重复使用
C.用该电池电解精炼铜,当电池中迁移时,理论上可获得纯铜
D.充电时,N极的电极反应式为
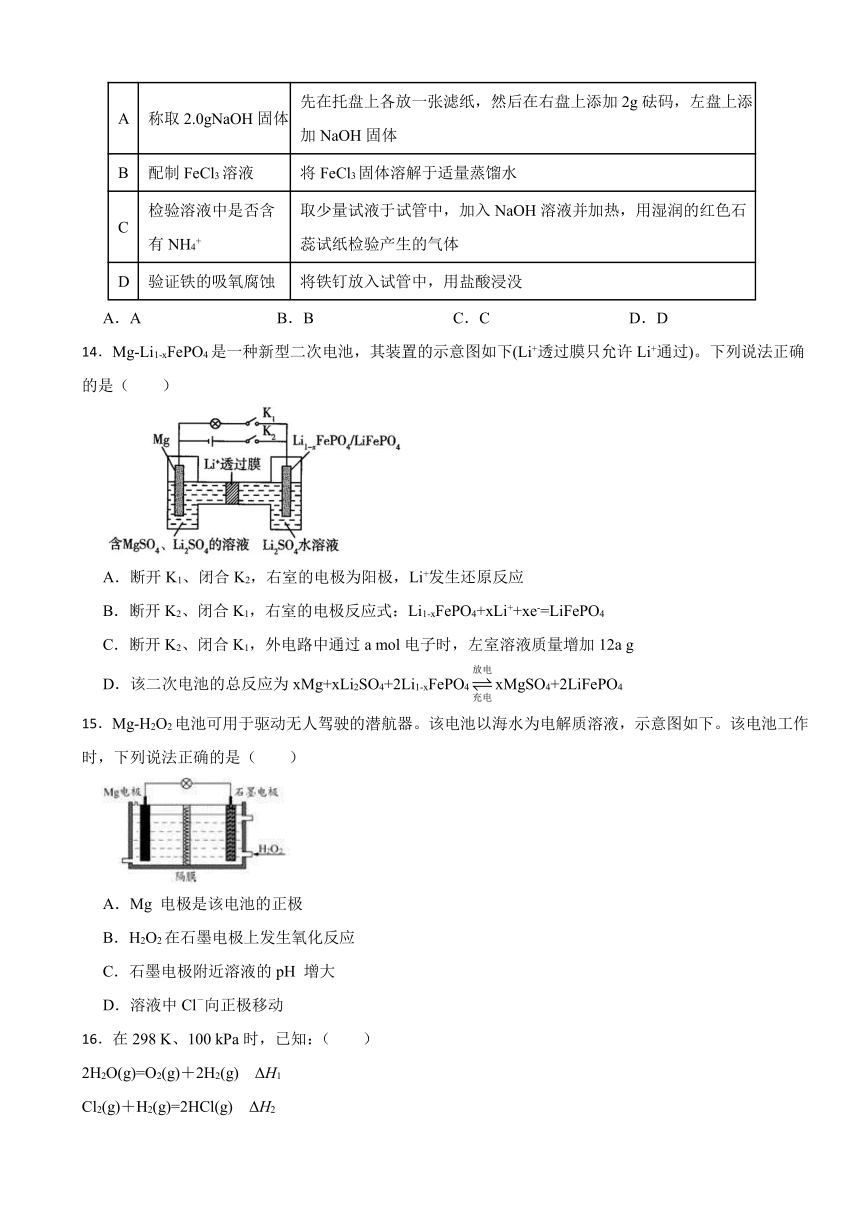
12.科学家发明了一种Mg—PbO2电池,电解质为Na2SO4、H2SO4、NaOH,通过M和N两种离子交换膜将电解质溶液隔开,形成A、B、C三个电解质溶液区域(已知:a>b),装置如图,下列说法错误的是
A.Na+通过M膜移向B区,离子交换膜N为阴离子交换膜
B.B区域的电解质浓度逐渐减小
C.放电时,Mg电极反应为Mg+ 2OH—-2e—=Mg(OH)2
D.消耗2.4 g Mg时,C区域电解质溶液减少16.0 g
13.下列实验操作符合题意且能达到相应实验目的的是( )
实验目的 实验操作
A 称取2.0gNaOH固体 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B 配制FeCl3溶液 将FeCl3固体溶解于适量蒸馏水
C 检验溶液中是否含有NH4+ 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D 验证铁的吸氧腐蚀 将铁钉放入试管中,用盐酸浸没
A.A B.B C.C D.D
14.Mg-Li1-xFePO4是一种新型二次电池,其装置的示意图如下(Li+透过膜只允许Li+通过)。下列说法正确的是( )
A.断开K1、闭合K2,右室的电极为阳极,Li+发生还原反应
B.断开K2、闭合K1,右室的电极反应式:Li1-xFePO4+xLi++xe-=LiFePO4
C.断开K2、闭合K1,外电路中通过a mol电子时,左室溶液质量增加12a g
D.该二次电池的总反应为xMg+xLi2SO4+2Li1-xFePO4xMgSO4+2LiFePO4
15.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
A.Mg 电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH 增大
D.溶液中Cl-向正极移动
16.在298 K、100 kPa时,已知:( )
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
二、综合题
17.已知下列反应:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)△H=﹣266kJ/mol
试回答:
(1)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为: .
(2)沼气是一种能源,它主要成分是CH4.0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,则其燃烧的热化学方程式为: .
(3)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l),已知室温下3.2gSiH4自燃放出热量79.2kJ,其热化学方程式为: .
18.
(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) = CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) = CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) = CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g) = H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) = CO2(g) + H2(g)的反应热 kJ·mol-1。
(2)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式 。
19.
(1)I.将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置(以下均假设反应过程中溶液体积不变)。
铜片上的电极反应式为 ,电流由 (填“铁片”或“铜片”)流向 。
(2)若2min后测得铁片和铜片之间的质量差为2.4g,计算导线中流过的电子的物质的量为 mol。
(3)II.金属的电化学腐蚀的本质是形成了原电池。如图2所示,烧杯中都盛有稀硫酸。
图2的B中的Sn为 极,Sn极附近溶液的酸性 (填增强、减弱或不变)。
(4)图2的C中被腐蚀的金属是 。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是 。
(5)III.人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图3是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
写出该氢氧燃料电池的正极电极反应式 。
(6)电池工作一段时间后硫酸溶液的浓度 (填“增大”、“减小”或“不变”)。
20.纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a 用炭粉在高温条件下还原CuO
方法b 用葡萄糖还原新制的Cu(OH)2制备Cu2O
方法c 电解法,反应为
方法d 用肼(N2H4)还原新制的Cu(OH)2
(1)已知:①2Cu(s)+ O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+ O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+ O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是: 。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为 离子交换膜(填“阴”或“阳”),该电池的阳极反应式为 ,钛极附近的pH值 (填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
21.甲醇(CH3OH)是应用广泛的化工原料和前景乐观的燃料。
(1)I.一定条件下,在5L密闭容器中充入1 mol CO2和3 mol H2,发生反应:xCO2(g)+3H2(g) CH3OH(g)+H2O(g)。测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。
x= ;0~3min内H2的平均反应速率v(H2)= mol/(L·min)。
(2)下列措施能提高正反应速率的是 (填正确答案的字母)。
A 降低温度 B 增加CO2的量 C 使用催化剂 D 及时分离出甲醇
(3)II.甲醇燃料电池可使甲醇作燃料时的能量转化更高效,某种甲醇然料电池的工作原理如图所示,其电极反应如下:2CH3OH+2H2O-12e-
=12H+ 2CO2 3O2+12H++12e-=6H2O
该装置的负极是电极 (填“A”或“B”);c处通入的物质是 (填“CH3OH”或“O2”)。
(4)甲醇燃料电池供电时的总反应方程式为
(5)当该装置消耗0.2
mol甲醇时,转移电子的数目为 ;若这部分电子全部用于电解水,理论上可产生氢气 L(标准状况)
答案解析部分
1.【答案】D
【解析】【解答】解:常见的电源:蓄电池、干电池、燃料电池、锂电池等,化学电池又可以分为一次电池和二次电池,可以将化学能转化为电能;而太阳能电池是太阳能转化为电能的装置,故太阳能电池不属于化学电池.
故选D.
【分析】根据化学电源是将化学能转化为电能的装置来回答.
2.【答案】C
【解析】【解答】22 g CO2通入750 mL 1 mol·L-1的NaOH溶液中充分反应,测得反应放出x kJ的热量,热化学方程式为:①2CO2(g)+3NaOH(aq)=NaHCO3(aq)+ Na2CO3(aq)+H2O(l) ΔH=-4xkJ·mol-1,1 mol CO2通入1 L 2 mol·L-1的NaOH 溶液中充分反应,放出y kJ的热量,热化学方程式为:②CO2(g)+2NaOH(aq)=Na2CO3(aq) ΔH=-ykJ·mol-1,根据盖斯定律①-②可得CO2(g)+NaOH(aq)=NaHCO3(aq),ΔH=-4x-(-y)kJ·mol-1=-(4x-y)kJ·mol-1;
故答案为:C。
【分析】首先写出 22 g CO2通入750 mL 1 mol·L-1的NaOH溶液中充分反应 的热化学反应方程,再写出 1 mol CO2通入1 L 2 mol·L-1的NaOH 溶液中充分反应热化学反应方程,最后利用方程式加减运算得到目标方程的热化学反应方程式。
3.【答案】D
【解析】【解答】A.氢氧化钡晶体与氯化铵晶体的反应为吸热反应,A不符合题意;
B.如图反应物的总能量低于生成物的总能量,因此该反应为吸热反应,B不符合题意;
C.化学键断裂吸收的能量高于形成化学键释放的能量,则反应为吸热反应,C不符合题意;
D.燃烧反应和中和反应都属于放热反应,D符合题意;
故答案为:D
【分析】A.氢氧化钡晶体与氯化铵晶体的反应为吸热反应;
B.结合物质能量与反应热效应的关系分析;
C.结合断键、成键过程分析反应的热效应;
D.燃烧反应和中和反应都属于放热反应;
4.【答案】D
【解析】【解答】粗铜中含有少量的Zn、Fe、Ag、Au等,采用电解法提纯时,粗铜与电源的正极连接作阳极,精铜与电源的负极连接作阴极,以含有Cu2+的溶液硫酸铜溶液作电解质溶液。电解时,阳极发生反应主要为:Cu-2e-=Cu2+,活动性比Cu强的Zn、Fe也会发生氧化反应,Zn-2e-=Zn2+,Fe-2e-=Fe2+,变为金属阳离子进入溶液,而活动性比Cu弱的金属Au、Ag则沉淀在阳极底部,形成阳极泥;阳极上发生反应为Cu2++2e-=Cu,在同一闭合回路中电子转移数目相等,可见在精炼过程中,阳极减少的金属质量与阴极增加的质量不一定相等,
故答案为:D。
【分析】粗铜的精炼中,粗铜作为阳极,精铜作为阴极,电解质溶液为铜盐,通电后,粗铜中比铜活泼的金属单质先放电形成离子溶于电解质溶液中,比铜不活泼的金属单质形成阳极泥掉落在电解质溶液形成沉淀,溶液中的铜离子移向阴极形成铜,完成精炼过程;
A、硫酸铜时铜盐;
B、阳极连接正极;
C、银和金比铜不活泼;
D、由于阳极中除了铜还有其他杂质,而阴极的生成只有铜,因此质量不相等。
5.【答案】C
【解析】【解答】解:A、化学反应在发生物质变化的同时还一定伴随着能量的变化,故A正确;
B、物质燃烧一定是放热反应,故B正确;
C、有的放热的化学反应需要加热才能发生,如铝热反应,故C错误;
D、植物的光合作用是光能转化为化学能,燃烧有光能产生,化学能除转化为热能外还转化为光能,故D正确.
故选C.
【分析】A、化学反应在发生物质变化的同时还伴随着能量的变化;
B、物质燃烧一定是放热反应;
C、有的放热的化学反应需要加热才能发生;
D、植物的光合作用是光能转化为化学能.
6.【答案】D
【解析】【解答】将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,B是电源的负极,A是电源的正极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极。
A.根据上述分析可知B电极是电源的负极,A不符合题意;
B.甲装置中,阳极C电极反应式为:4OH--4e-=O2↑+2H2O,阴极D电极反应式为:Cu2++2e-=Cu;乙装置是阳极E的电极反应为:2Cl--2e-=Cl2↑,阴极F电极的电极反应式为:2H++2e-=H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2,B不符合题意;
C.电镀装置中,镀层金属必须作阳极,镀件作阴极,所以H应该是镀件,G是镀层金属,电解质溶液必须是含镀层金属离子的盐溶液,用(丙)装置给铜镀银,G应该是Ag,电镀液选用AgNO3溶液,C不符合题意;
D.装置(丁)中Y极附近红褐色变深,证明氢氧化铁胶体微粒移向Y极,依据上述判断,X为阳极,Y为阴极,氢氧化铁胶体向Y电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,D符合题意;
故答案为:D。
【分析】本题考查了电解池的工作原理。根据通电后,向(乙)中滴入酚酞溶液,在F极附近显红色,判断电源B电极为负极是本题解答的关键。在电解池中,与电源负极连接的电极为阴极,与电源正极连接的电极为阳极。阳极发生氧化反应,阴极上发生还原反应,溶液中的阴离子向阳极区移动,溶液中的阳离子向阴极区移动,串联电路中电子转移数目相等。
7.【答案】B
【解析】【解答】A.气态水的能量高于液态水,故1mol H2O(l)变成1mol H2O(g),吸收能量,故A错误;
B.2mol H2(g)完全燃烧生成2mol气态水放出的热量为483.6kJ,则1mol H2O(g)分解成H2(g)和O2(g),吸收241.8 kJ能量,故B正确;
C.氢气燃烧为放热反应,2mol H2(g)和1mol O2(g)的总能量大于2mol H2O(l)的能量,故C错误;
D.2mol H2O(g)分解生成H2(g)和O2(g),吸收483.6 kJ能量,由于反应热等于反应物总键能减生成物总键能,故断裂2mol H2O(g)中所有的O﹣H键,吸收能量大于483.6kJ,故D错误,
故选B.
【分析】A.根据能量守恒定律分析解答;
B.根据2mol H2(g)完全燃烧生成2mol气态水放出的热量为483.6kJ判断;
C.氢气燃烧为放热反应,反应物总能量大于生成总能量;
D.根据反应热等于反应物总键能减生成物总键能分析解答.
8.【答案】B
【解析】【解答】解:A、以惰性材料为电极,KOH溶液为电解质构成的氢氧燃料电池,在负极上是氢气失电子的反应H2﹣2e﹣+2OH﹣=2H2O,故A错误;
B、铜、锌在稀硫酸溶液中构成原电池,正极上是氢离子得电子的还原反应2H++2e﹣=H2↑,故B正确;
C、将2Fe3++Cu=2Fe2++Cu2+设计成原电池,则金属铜是负极,负极反应式为Cu﹣2e﹣=Cu2+,故C错误;
D、以铝、铁为电极,在氢氧化钠溶液中构成原电池,自发的氧化还原反应发生在金属铝和氢氧化钠之间,负极反应式为4OH﹣+Al﹣3e﹣=[Al(OH)4]﹣,故D错误.
故选B.
【分析】A、以惰性材料为电极,KOH溶液为电解质构成的氢氧燃料电池,在负极上是氢气失电子的反应;
B、铜、锌在稀硫酸溶液中构成原电池,正极上是氢离子得电子的还原反应;
C、将2Fe3++Cu=2Fe2++Cu2+设计成原电池,则金属铜是负极,据此回答;
D、以铝、铁为电极,在氢氧化钠溶液中构成原电池,自发的氧化还原反应发生在金属铝和氢氧化钠之间.
9.【答案】C
【解析】【解答】根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐:
A.铜作正极,铁作负极,电解质为可溶性的氯化铁,则符合题意,故A不选;
B.铁作负极,碳作正极,电解质为Fe(NO3)3溶液,能发生氧化还原反应,则符合题意,故B不选;
C.Zn的金属活泼性比Fe强,则Zn作负极,Fe作正极,电解质为可溶性的硫酸铁,所以不能构成该条件下的原电池,则不符合题意,故C选;
D.Fe作负极,银作正极,电解质为Fe2(SO4)3溶液,发生反应为2Fe3++Fe═3Fe2+,符合题意,故D不选;
故答案为:C。
【分析】 原电池的总反应的离子方程式为2Fe3++Fe=3Fe2+,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,电解质溶液为可溶性的铁盐,据此解答。
10.【答案】A
【解析】【解答】解:A.碳与水蒸气制水煤气的反应是吸热反应,故A正确;
B.生石灰和水的反应是化合反应是放热反应,故B错误;
C.盐酸与氢氧化钠溶液的反应是中和反应是放热反应,故C错误;
D.木炭在氧气中燃烧是放热反应,故D错误.
故选A.
【分析】常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
11.【答案】C
【解析】【解答】放电时,Li+从M极移向N极,则M极为负极,N极为正极,充电时,M极为阴极,N极为阳极。
A:充电时,电子由阳极流入阴极,即N极流向M极,发生还原反应,说法正确,故A不符合题意;
B:锂电池的能量比较高,优点是质量小,电容量大,可重复使用,说法正确,故B不符合题意;
C:根据电子守恒可知,2Li~2e-~ Cu ,当电池中迁移1molLi+时,理论上可获得32g纯铜,说法错误,故C符合题意;
D:充电时,N极为阳极,发生氧化反应,电极反应式为 ,说法正确,故D不符合题意;
故答案为:D
【分析】原电池工作时,负极发生氧化反应,正极发生还原反应,电子在外电路沿导线自负极流向正极,内部阴、阳离子分别流向负极、正极。
电极反应式的书写:1.确定阳极、阴极上的反应物与生成物。2.标出化合价,确认得失电子数。3.依据电荷守恒原则,一般利用H+或OH-平衡电荷。4.物质守恒配平。
电子转移数目要找出所有化合价升高或降低的元素,并标出其化合价,化合价变化总数=化合价变化数乘以原子个数,最后根据题目要求求出电子转移数目。
12.【答案】B
【解析】【解答】A.由分析可知,原电池工作时,A区钠离子通过阳离子交换膜M进入B区,C区溶液中硫酸根离子通过阴离子交换膜B区,故A不符合题意;
B.由分析可知,原电池工作时,A区钠离子通过阳离子交换膜M进入B区,C区溶液中硫酸根离子通过阴离子交换膜B区,则B区中硫酸钠溶液的浓度增大,故B符合题意;
C.由分析可知,放电时,镁电极为原电池的负极,碱性条件下镁失去电子生成氢氧化镁,电极反应电极反应式为Mg+ 2OH--2e-=Mg(OH)2,故C不符合题意;
D.由分析可知,原电池工作时,消耗2.4 g镁时,放电转移电子×2=0.2mol,C区放电消耗0.4mol氢离子、0.1mol硫酸根离子,同时有0.1mol硫酸根离子移向B区,相当于溶液中减少0.2mol硫酸,同时生成0.2mol水,则C区实际减少质量为0.2mol×98g·mol-1-0.2mol×18g·mol-1=16.0g,故D不符合题意;
故答案为:B。
【分析】新型电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒。
13.【答案】C
【解析】【解答】A.氢氧化钠易潮解且具有腐蚀性,不能用滤纸称量,A不符合题意;
B.氯化铁易水解而使溶液变浑浊,应将氯化铁溶于少量盐酸中,再稀释,B不符合题意;
C.加热时铵离子与氢氧根反应产生氨气,湿润的红色石蕊试纸遇氨气变蓝,能达到相应实验目的,C符合题意;
D.在盐酸作用下,铁发生析氢腐蚀,D不符合题意;
故答案为:C。
【分析】A氢氧化钠易潮解不能用滤纸,应该用玻璃器皿
B:Fe3+易水解而使容易浑浊
C:加热时铵离子与氢氧根会反应产生氨气
D:酸性条件下,发生析氢腐蚀
14.【答案】B
【解析】【解答】A.断开K1、闭合K2,该装置为电解池,右室的电极与外接电源的正极相连作阳极,LiFePO4中的铁元素发生氧化反应,A项不符合题意;
B.断开K2、闭合K1,该装置为原电池,右室的电极为正极,得电子发生还原反应,电极反应式为Li1-xFePO4+xLi++xe-=LiFePO4,B项符合题意;
C.断开K2、闭合K1,外电路中通过a mol电子时,左室有0.5a mol Mg溶解,同时有a mol Li+移向右室,因此左室溶液质量增加
,C项不符合题意;
D.该二次电池的总反应为xMg+xLi2SO4+2Li1-xFePO4xMgSO4+2LiFePO4,D项不符合题意;
故答案为:B。
【分析】断开K1,闭合K2时,是电解池,左侧是阴极,镁离子得到电子变为镁单质,右侧是阳极,LiFePO4失去电子发生氧化反应,断开K2,闭合K1时,是原电池,左侧是负极,镁失去电子变为镁离子,右侧是正极是Li1-xFePO4得到电子发生还原反应,结合选项即可判断
15.【答案】C
【解析】【解答】A.组成原电池的负极被氧化,在Mg-H2O2电池中,镁为负极,而非正极,A项不符合题意;
B. H2O2在石墨电极上得电子发生还原反应,B项不符合题意;
C.工作时,正极反应式为H2O2+2H++2e-═2H2O,不断消耗H+离子,正极周围海水的pH增大,C项符合题意;
D.原电池中,阳离子向正极移动,阴离子向负极移动,形成闭合回路,所以溶液中的Cl-向负极移动,D项不符合题意。
故答案为:C。
【分析】本题考查原电池的工作原理等知识。符合题意书写电极反应式为解答该题的关键,镁-H2O2酸性燃料电池中,镁为活泼金属,应为原电池的负极,被氧化,电极反应式为Mg-2e-═Mg2+,H2O2具有氧化性,应为原电池的正极,被还原,电极反应式为H2O2+2H++2e-═2H2O,根据电极反应式判断原电池总反应式,根据电极反应判断溶液pH的变化。
16.【答案】A
【解析】【解答】令2H2O(g)=O2(g)+2H2(g) ΔH1①
Cl2(g)+H2(g)=2HCl(g) ΔH2②
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3③
根据盖斯定律,将反应①+反应②×2即可求得反应③,因此有ΔH3=ΔH1+2ΔH2 , 故A项正确。
故答案为:A
【分析】本题考查用盖斯定律进行反应热的计算。
17.【答案】(1)CO(g)+Na2O2(s)=Na2CO3(s)△H=﹣549 kJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJ moL﹣1
(3)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol
【解析】【解答】解:(1)已知①2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)△H=﹣266kJ/mol,
由盖斯定律: ×①+②得CO(g)+Na2O2(s)=Na2CO3(s)△H= ×(﹣566)+(﹣266)=﹣549 kJ/mol,
故答案为:CO(g)+Na2O2(s)=Na2CO3(s)△H=﹣549 kJ/mol;
(2)0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,所以1mol甲烷完全燃烧生成液态水时能放出890kJ的热量,故甲烷燃烧生成液态水时的热化学反应方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJ moL﹣1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJ moL﹣1;
(3)n(SiH4)= =0.1mol,则1molSiH4燃烧放出的热量为:792kJ,
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol.
【分析】根据燃烧热的定义、焓变的计算以及盖斯定律进行书写热化学方程式即可.
18.【答案】(1)41
(2)CH3OH(l)+3/2O2(g)=CO2 (g)+2H2O(l) △H=-726.4kJ/mol
【解析】【解答】解:(1)已知25℃时:①C(石墨) +O2 (g) = CO2(g) △H1 =-394 kJ·mol-1,②C(石墨) +1/2O2 (g) = CO (g) △H2 =-111 kJ·mol-1,③H2(g) +1/2O2 (g) = H2O(g) △H3=-242kJ·mol-1,依据盖斯定律①-②-③得到:CO(g)+ H2O(g) = CO2(g) + H2(g) △H=-41kJ/mol。
故答案为:41。
(2)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,32g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出726.4kJ热量,则燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2 (g)+2H2O(l) △H=-726.4kJ/mol。
故答案为:CH3OH(l)+3/2O2(g)=CO2 (g)+2H2O(l) △H=-726.4kJ/mol。
【分析】本题考查了用盖斯定律进行有关的化学反应热的计算。(1)要能熟练灵活应用盖斯定律。(2)掌握燃烧热化学方程式的书写规范。
19.【答案】(1)Cu2++2e-=Cu;铜片;铁片
(2)0.04
(3)正;减弱
(4)Zn;B>A>C
(5)O2+4e-+4H+=2H2O
(6)减小
【解析】【解答】I.(1)该原电池中,铁片作负极,其电极反应式为Fe-2e-=Fe2+,铜片作正极,其电极反应式为Cu2++2e-=Cu;原电池中电流由正极流向负极,即有铜片流向铁片;
(2)电池总反应为Cu2++Fe=Fe2++Cu,所以消耗的铁与生成的铜物质的量相等,若2min后测得铁片和铜片之间的质量差为2.4g,则有n(Fe)= =0.02mol,转移的电子为0.04mol
Ⅱ.(3)B为原电池装置,其中Fe比Sn活泼,则Fe极作负极,Sn极作正极,H+在Sn极得到电子产生H2,导致Sn极附近H+的浓度降低,酸性减弱;
(4)C为原电池装置,其中Zn比Fe活泼,则Zn作负极,被腐蚀的金属为Zn,Fe被保护;同理,在B中,Fe被腐蚀;A不是原电池装置,Fe的腐蚀速度要慢一些;故三个装置中,纯铁被腐蚀的速率,由快到慢的顺序是B>A>C;
Ⅲ.(5)燃料电池中通入空气(氧气)的一极为正极,电解质溶液显酸性,O2得电子后H+反应生成水:O2+4H++4e-=2H2O;
(6)该电池的总反应为2H2+O2=2H2O,电池工作一段时间后,水的量增多,硫酸的量没有改变,则硫酸溶液的浓度减小。
【分析】(1)铁做负极,铁失去电子变为亚铁离子,铜做正极,氢离子得到电子变为氢气,电流是正极流向负极
(2)根据正负极的电极式即可计算
(3)根据原电池的原理即可判断出Sn为正极,氢离子得到电子变为氢气,酸性减弱
(4)锌比铁活泼,铁做正极,锌做负极,锌失去电子变为锌离子,B中铁做负极,C中铁被保护即可判断速率
(5)根据题意氧气在正极得到电子结合氢离子即可写出电极式
(6) 根据电池总的反应方程式即可判断
20.【答案】(1)2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=+34.5kJ/mol
(2)阴;2Cu-2e-+2OH-= Cu2O+H2O;增大
(3)4Cu(OH)2+N2H4 2Cu2O+6H2O+N2↑
【解析】【解答】(1)已知:①2Cu(s) + O2(g)=Cu2O(s);△H= -169kJ/mol,②C(s)+ O2(g)=CO(g);△H= -110.5kJ/mol,③Cu(s)+ O2(g)═CuO(s);△H= -157kJ/mol,
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为2CuO(s)+C(s)=Cu2O(s)+CO(g),该反应可以由②-③×2+①得到,则反应的焓变为-110.5 kJ/mol –(-157 kJ/mol×2)-169 kJ/mol=34.5 kJ/mol;(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子的浓度;在电解池中,铜电极连接电源的正极,则铜电极作阳极,且根据总反应式 知,铜作阳极失去电子生成Cu2O,则在碱性环境下,阳极的电极反应式为2Cu-2e- +2OH- = Cu2O+H2O,钛极是阴极,发生还原反应,氢离子得电子,电极反应式为2H2O+2e- = H2↑+2OH-,所以氢氧根离子浓度增大,则pH值增大;(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,依据得失电子守恒、元素守恒,写出化学方程式为:4Cu(OH)2+N2H4 2Cu2O+6H2O+N2↑。
【分析】(1)根据盖斯定律并结合热化学方程式的书写方法来书写;(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子的浓度,在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值的变化;(3)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式。
21.【答案】(1)1;0.1
(2)BC
(3)B;CH3OH
(4)2CH3OH + 3O2 =2CO2 +4H2O
(5)1.2NA或 ;13.44
【解析】【解答】I(1)根据图像分析可知,相同时间内,甲醇与二氧化碳的变化量之比为:1:1,则甲醇与二氧化碳的系数比为1:1,故x=1;氢气与二氧化碳的系数比为3:1,则等时间内氢气与二氧化碳的变化量之比为3:1,故在0~3min内氢气的变化量为1.5mol,则0~3min内H2的平均反应速率 mol/(L·min);
(2)降低温度会减小反应速率,A不正确;增加CO2的量可以加快反应速率,使平衡正向移动,B正确;使用催化剂可以加快反应速率,C正确;及时分离出甲醇可使反应正向进行,但会减小反应速率,故D不正确;故答案为:BC;
II(3)由原电池的工作原理图可知,电子由电极B流向电极A,则电极A作正极,电极B为负极;c处通入CH3OH,发生氧化反应;
故答案为:B;CH3OH;
(4)甲醇燃料电池是甲醇和氧气发生氧化还原反应,故总反应方程式为:2CH3OH + 3O2 =2CO2 +4H2O;
(5)甲醇的电极反应式为:2CH3OH+2H2O-12e- =12H+ 2CO2,当该装置消耗0.2 mol甲醇时,转移电子1.2mol,转移电子的数目为1.2NA或 ;电解水时,1molH2对应2mol电子,则产生氢气0.6mol,氢气的体积为: 。
【分析】I(1)0~10min,甲醇与二氧化碳的变化量都为0.75mol,则
xCO2(g)+3H2(g) CH3OH(g)+H2O(g)
xmol 1mol
0.75mol 0.75mol 则x=1
设0~3min内氢气的变化量为ymol,
xCO2(g)+3H2(g) CH3OH(g)+H2O(g)
1mol 3mol
0.5mol ymol 则y=1.5mol 再根据公式v(H2)=可以求出。
(2)A.升高温度可以加快反应速率,降低温度会减小反应速率;
B.增加反应物的浓度可以加快反应速率,使平衡正向移动;
C.催化剂可以加快反应速率;
D.分离出甲醇,造成反应物的浓度降低,进而但会减小反应速率;
II(3)原电池中,电子由负极流向正极;
甲醇燃料电池中,甲醇发生氧化反应;
(4)根据质量守恒可以写出方程式;
(5)根据得失电子守恒可以得出结论。
一、单选题
1.下列电池不属于化学电池的是( )
A.一次电池 B.二次电池 C.燃料电池 D.太阳能电池
2.在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1的NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1的NaOH 溶液中充分反应,放出y kJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.2CO2(g)+2NaOH(l)=2NaHCO3(l) ΔH=-(8x-2y)kJ·mol-1
3.下列反应属于放热反应的是( )
A.氢氧化钡晶体和氯化铵晶体的反应
B.能量变化如上图所示的反应
C.化学键断裂吸收的热量比化学键生成放出的热量多的反应
D.燃烧反应和酸碱中和反应
4.粗铜中含有少量的Zn、Fe、Ag、Au等,采用电解法提纯,下列说法错误的是( )
A.可用硫酸铜溶液作电解质溶液
B.粗铜与电源的正极相连
C.在精炼过程中,Ag、Au沉积于阳极底部
D.在精炼过程中,阳极、阴极的质量变化量相等
5.下列说法错误的是( )
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.物质的燃烧一定是放热反应
C.放热的化学反应不需要加热就能发生
D.化学能与光能之间可以相互转化
6.如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )
A.电源B极是正极
B.(甲)(乙)装置的C,D,E,F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
7.已知2mol H2(g)燃烧生成液态水放出的热量为571.6lkJ,而2molH2 (g)完全燃烧生成气态水放的热量为483.6kJ.下列说法正确的是( )
A.1molH2O (I)变成1molH2O (g),向外界释放能量
B.1molH2O (g)分解成H2(g)和O2(g),吸收241. 8kJ能量
C.2mol H2(g)和1mol O2(g)的总能量小于2molH2O(1)的能量
D.断裂2molH2O (g)中所有的O﹣H键,吸收483.6 kJ能量
8.下列电极反应式正确的是( )
A.以惰性材料为电极,KOH溶液为电解质构成原电池,负极反应式为H2﹣2e﹣=2H+
B.铜、锌在稀硫酸溶液中构成原电池,正极反应式为2H++2e﹣=H2↑
C.以铜为电极将2Fe3++Cu=2Fe2++Cu2+设计成原电池,正极反应式为Cu﹣2e﹣=Cu2+
D.以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应式为Al﹣3e﹣=Al3+
9.某原电池的总反应的离子方程式为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
选项 正极 负极 电解质溶液
A Cu Fe FeCl3溶液
B C Fe Fe(NO3)3溶液
C Fe Zn Fe2(SO4)3溶液
D Ag Fe Fe2(SO4)3溶液
A.A B.B C.C D.D
10.下列反应属于吸热反应的是( )
A.碳与水蒸气制水煤气的反应 B.生石灰和水的反应
C.盐酸与氢氧化钠溶液的反应 D.木炭在氧气中燃烧
11.新能源汽车在我国蓬勃发展,新能源汽车所用电池多采用三元锂电池,某三元锂电池放电时工作原理如图所示。下列说法错误的是( )
A.充电时,M极有电子流入,发生还原反应
B.锂电池的优点是质量小,电容量大,可重复使用
C.用该电池电解精炼铜,当电池中迁移时,理论上可获得纯铜
D.充电时,N极的电极反应式为
12.科学家发明了一种Mg—PbO2电池,电解质为Na2SO4、H2SO4、NaOH,通过M和N两种离子交换膜将电解质溶液隔开,形成A、B、C三个电解质溶液区域(已知:a>b),装置如图,下列说法错误的是
A.Na+通过M膜移向B区,离子交换膜N为阴离子交换膜
B.B区域的电解质浓度逐渐减小
C.放电时,Mg电极反应为Mg+ 2OH—-2e—=Mg(OH)2
D.消耗2.4 g Mg时,C区域电解质溶液减少16.0 g
13.下列实验操作符合题意且能达到相应实验目的的是( )
实验目的 实验操作
A 称取2.0gNaOH固体 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B 配制FeCl3溶液 将FeCl3固体溶解于适量蒸馏水
C 检验溶液中是否含有NH4+ 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D 验证铁的吸氧腐蚀 将铁钉放入试管中,用盐酸浸没
A.A B.B C.C D.D
14.Mg-Li1-xFePO4是一种新型二次电池,其装置的示意图如下(Li+透过膜只允许Li+通过)。下列说法正确的是( )
A.断开K1、闭合K2,右室的电极为阳极,Li+发生还原反应
B.断开K2、闭合K1,右室的电极反应式:Li1-xFePO4+xLi++xe-=LiFePO4
C.断开K2、闭合K1,外电路中通过a mol电子时,左室溶液质量增加12a g
D.该二次电池的总反应为xMg+xLi2SO4+2Li1-xFePO4xMgSO4+2LiFePO4
15.Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )
A.Mg 电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH 增大
D.溶液中Cl-向正极移动
16.在298 K、100 kPa时,已知:( )
2H2O(g)=O2(g)+2H2(g) ΔH1
Cl2(g)+H2(g)=2HCl(g) ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2 B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2 D.ΔH3=ΔH1-ΔH2
二、综合题
17.已知下列反应:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)△H=﹣266kJ/mol
试回答:
(1)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为: .
(2)沼气是一种能源,它主要成分是CH4.0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,则其燃烧的热化学方程式为: .
(3)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l),已知室温下3.2gSiH4自燃放出热量79.2kJ,其热化学方程式为: .
18.
(1)工业制氢气的一个重要反应是:CO(g)+ H2O(g) = CO2(g) + H2(g)
已知25℃时:C(石墨) +O2 (g) = CO2(g) △H1 =-394 kJ·mol-1
C(石墨) +1/2O2 (g) = CO (g) △H2 =-111 kJ·mol-1
H2(g) +1/2O2 (g) = H2O(g) △H3=-242kJ·mol-1
试计算25℃时CO(g)+ H2O(g) = CO2(g) + H2(g)的反应热 kJ·mol-1。
(2)实验测得,5g甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式 。
19.
(1)I.将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置(以下均假设反应过程中溶液体积不变)。
铜片上的电极反应式为 ,电流由 (填“铁片”或“铜片”)流向 。
(2)若2min后测得铁片和铜片之间的质量差为2.4g,计算导线中流过的电子的物质的量为 mol。
(3)II.金属的电化学腐蚀的本质是形成了原电池。如图2所示,烧杯中都盛有稀硫酸。
图2的B中的Sn为 极,Sn极附近溶液的酸性 (填增强、减弱或不变)。
(4)图2的C中被腐蚀的金属是 。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是 。
(5)III.人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图3是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
写出该氢氧燃料电池的正极电极反应式 。
(6)电池工作一段时间后硫酸溶液的浓度 (填“增大”、“减小”或“不变”)。
20.纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a 用炭粉在高温条件下还原CuO
方法b 用葡萄糖还原新制的Cu(OH)2制备Cu2O
方法c 电解法,反应为
方法d 用肼(N2H4)还原新制的Cu(OH)2
(1)已知:①2Cu(s)+ O2(g)=Cu2O(s);△H = -169kJ·mol-1
②C(s)+ O2(g)=CO(g);△H = -110.5kJ·mol-1
③Cu(s)+ O2(g)=CuO(s);△H = -157kJ·mol-1
则方法a发生反应的热化学方程式是: 。
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:
该离子交换膜为 离子交换膜(填“阴”或“阳”),该电池的阳极反应式为 ,钛极附近的pH值 (填“增大”“减小”或“不变”)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为 。
21.甲醇(CH3OH)是应用广泛的化工原料和前景乐观的燃料。
(1)I.一定条件下,在5L密闭容器中充入1 mol CO2和3 mol H2,发生反应:xCO2(g)+3H2(g) CH3OH(g)+H2O(g)。测得CO2(g)和CH3OH(g)的物质的量随时间变化如图所示。
x= ;0~3min内H2的平均反应速率v(H2)= mol/(L·min)。
(2)下列措施能提高正反应速率的是 (填正确答案的字母)。
A 降低温度 B 增加CO2的量 C 使用催化剂 D 及时分离出甲醇
(3)II.甲醇燃料电池可使甲醇作燃料时的能量转化更高效,某种甲醇然料电池的工作原理如图所示,其电极反应如下:2CH3OH+2H2O-12e-
=12H+ 2CO2 3O2+12H++12e-=6H2O
该装置的负极是电极 (填“A”或“B”);c处通入的物质是 (填“CH3OH”或“O2”)。
(4)甲醇燃料电池供电时的总反应方程式为
(5)当该装置消耗0.2
mol甲醇时,转移电子的数目为 ;若这部分电子全部用于电解水,理论上可产生氢气 L(标准状况)
答案解析部分
1.【答案】D
【解析】【解答】解:常见的电源:蓄电池、干电池、燃料电池、锂电池等,化学电池又可以分为一次电池和二次电池,可以将化学能转化为电能;而太阳能电池是太阳能转化为电能的装置,故太阳能电池不属于化学电池.
故选D.
【分析】根据化学电源是将化学能转化为电能的装置来回答.
2.【答案】C
【解析】【解答】22 g CO2通入750 mL 1 mol·L-1的NaOH溶液中充分反应,测得反应放出x kJ的热量,热化学方程式为:①2CO2(g)+3NaOH(aq)=NaHCO3(aq)+ Na2CO3(aq)+H2O(l) ΔH=-4xkJ·mol-1,1 mol CO2通入1 L 2 mol·L-1的NaOH 溶液中充分反应,放出y kJ的热量,热化学方程式为:②CO2(g)+2NaOH(aq)=Na2CO3(aq) ΔH=-ykJ·mol-1,根据盖斯定律①-②可得CO2(g)+NaOH(aq)=NaHCO3(aq),ΔH=-4x-(-y)kJ·mol-1=-(4x-y)kJ·mol-1;
故答案为:C。
【分析】首先写出 22 g CO2通入750 mL 1 mol·L-1的NaOH溶液中充分反应 的热化学反应方程,再写出 1 mol CO2通入1 L 2 mol·L-1的NaOH 溶液中充分反应热化学反应方程,最后利用方程式加减运算得到目标方程的热化学反应方程式。
3.【答案】D
【解析】【解答】A.氢氧化钡晶体与氯化铵晶体的反应为吸热反应,A不符合题意;
B.如图反应物的总能量低于生成物的总能量,因此该反应为吸热反应,B不符合题意;
C.化学键断裂吸收的能量高于形成化学键释放的能量,则反应为吸热反应,C不符合题意;
D.燃烧反应和中和反应都属于放热反应,D符合题意;
故答案为:D
【分析】A.氢氧化钡晶体与氯化铵晶体的反应为吸热反应;
B.结合物质能量与反应热效应的关系分析;
C.结合断键、成键过程分析反应的热效应;
D.燃烧反应和中和反应都属于放热反应;
4.【答案】D
【解析】【解答】粗铜中含有少量的Zn、Fe、Ag、Au等,采用电解法提纯时,粗铜与电源的正极连接作阳极,精铜与电源的负极连接作阴极,以含有Cu2+的溶液硫酸铜溶液作电解质溶液。电解时,阳极发生反应主要为:Cu-2e-=Cu2+,活动性比Cu强的Zn、Fe也会发生氧化反应,Zn-2e-=Zn2+,Fe-2e-=Fe2+,变为金属阳离子进入溶液,而活动性比Cu弱的金属Au、Ag则沉淀在阳极底部,形成阳极泥;阳极上发生反应为Cu2++2e-=Cu,在同一闭合回路中电子转移数目相等,可见在精炼过程中,阳极减少的金属质量与阴极增加的质量不一定相等,
故答案为:D。
【分析】粗铜的精炼中,粗铜作为阳极,精铜作为阴极,电解质溶液为铜盐,通电后,粗铜中比铜活泼的金属单质先放电形成离子溶于电解质溶液中,比铜不活泼的金属单质形成阳极泥掉落在电解质溶液形成沉淀,溶液中的铜离子移向阴极形成铜,完成精炼过程;
A、硫酸铜时铜盐;
B、阳极连接正极;
C、银和金比铜不活泼;
D、由于阳极中除了铜还有其他杂质,而阴极的生成只有铜,因此质量不相等。
5.【答案】C
【解析】【解答】解:A、化学反应在发生物质变化的同时还一定伴随着能量的变化,故A正确;
B、物质燃烧一定是放热反应,故B正确;
C、有的放热的化学反应需要加热才能发生,如铝热反应,故C错误;
D、植物的光合作用是光能转化为化学能,燃烧有光能产生,化学能除转化为热能外还转化为光能,故D正确.
故选C.
【分析】A、化学反应在发生物质变化的同时还伴随着能量的变化;
B、物质燃烧一定是放热反应;
C、有的放热的化学反应需要加热才能发生;
D、植物的光合作用是光能转化为化学能.
6.【答案】D
【解析】【解答】将直流电源接通后,F极附近呈红色,说明F极显碱性,是氢离子在该电极放电,所以F即是阴极,B是电源的负极,A是电源的正极,可得出D、F、H、Y均为阴极,C、E、G、X均为阳极。
A.根据上述分析可知B电极是电源的负极,A不符合题意;
B.甲装置中,阳极C电极反应式为:4OH--4e-=O2↑+2H2O,阴极D电极反应式为:Cu2++2e-=Cu;乙装置是阳极E的电极反应为:2Cl--2e-=Cl2↑,阴极F电极的电极反应式为:2H++2e-=H2↑,当各电极转移电子均为1mol时,生成单质的量分别为:0.25mol、0.5mol、0.5mol、0.5mol,所以单质的物质的量之比为1:2:2:2,B不符合题意;
C.电镀装置中,镀层金属必须作阳极,镀件作阴极,所以H应该是镀件,G是镀层金属,电解质溶液必须是含镀层金属离子的盐溶液,用(丙)装置给铜镀银,G应该是Ag,电镀液选用AgNO3溶液,C不符合题意;
D.装置(丁)中Y极附近红褐色变深,证明氢氧化铁胶体微粒移向Y极,依据上述判断,X为阳极,Y为阴极,氢氧化铁胶体向Y电极移动,异性电荷相互吸引,所以氢氧化铁胶体粒子带正电荷,D符合题意;
故答案为:D。
【分析】本题考查了电解池的工作原理。根据通电后,向(乙)中滴入酚酞溶液,在F极附近显红色,判断电源B电极为负极是本题解答的关键。在电解池中,与电源负极连接的电极为阴极,与电源正极连接的电极为阳极。阳极发生氧化反应,阴极上发生还原反应,溶液中的阴离子向阳极区移动,溶液中的阳离子向阴极区移动,串联电路中电子转移数目相等。
7.【答案】B
【解析】【解答】A.气态水的能量高于液态水,故1mol H2O(l)变成1mol H2O(g),吸收能量,故A错误;
B.2mol H2(g)完全燃烧生成2mol气态水放出的热量为483.6kJ,则1mol H2O(g)分解成H2(g)和O2(g),吸收241.8 kJ能量,故B正确;
C.氢气燃烧为放热反应,2mol H2(g)和1mol O2(g)的总能量大于2mol H2O(l)的能量,故C错误;
D.2mol H2O(g)分解生成H2(g)和O2(g),吸收483.6 kJ能量,由于反应热等于反应物总键能减生成物总键能,故断裂2mol H2O(g)中所有的O﹣H键,吸收能量大于483.6kJ,故D错误,
故选B.
【分析】A.根据能量守恒定律分析解答;
B.根据2mol H2(g)完全燃烧生成2mol气态水放出的热量为483.6kJ判断;
C.氢气燃烧为放热反应,反应物总能量大于生成总能量;
D.根据反应热等于反应物总键能减生成物总键能分析解答.
8.【答案】B
【解析】【解答】解:A、以惰性材料为电极,KOH溶液为电解质构成的氢氧燃料电池,在负极上是氢气失电子的反应H2﹣2e﹣+2OH﹣=2H2O,故A错误;
B、铜、锌在稀硫酸溶液中构成原电池,正极上是氢离子得电子的还原反应2H++2e﹣=H2↑,故B正确;
C、将2Fe3++Cu=2Fe2++Cu2+设计成原电池,则金属铜是负极,负极反应式为Cu﹣2e﹣=Cu2+,故C错误;
D、以铝、铁为电极,在氢氧化钠溶液中构成原电池,自发的氧化还原反应发生在金属铝和氢氧化钠之间,负极反应式为4OH﹣+Al﹣3e﹣=[Al(OH)4]﹣,故D错误.
故选B.
【分析】A、以惰性材料为电极,KOH溶液为电解质构成的氢氧燃料电池,在负极上是氢气失电子的反应;
B、铜、锌在稀硫酸溶液中构成原电池,正极上是氢离子得电子的还原反应;
C、将2Fe3++Cu=2Fe2++Cu2+设计成原电池,则金属铜是负极,据此回答;
D、以铝、铁为电极,在氢氧化钠溶液中构成原电池,自发的氧化还原反应发生在金属铝和氢氧化钠之间.
9.【答案】C
【解析】【解答】根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐:
A.铜作正极,铁作负极,电解质为可溶性的氯化铁,则符合题意,故A不选;
B.铁作负极,碳作正极,电解质为Fe(NO3)3溶液,能发生氧化还原反应,则符合题意,故B不选;
C.Zn的金属活泼性比Fe强,则Zn作负极,Fe作正极,电解质为可溶性的硫酸铁,所以不能构成该条件下的原电池,则不符合题意,故C选;
D.Fe作负极,银作正极,电解质为Fe2(SO4)3溶液,发生反应为2Fe3++Fe═3Fe2+,符合题意,故D不选;
故答案为:C。
【分析】 原电池的总反应的离子方程式为2Fe3++Fe=3Fe2+,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,电解质溶液为可溶性的铁盐,据此解答。
10.【答案】A
【解析】【解答】解:A.碳与水蒸气制水煤气的反应是吸热反应,故A正确;
B.生石灰和水的反应是化合反应是放热反应,故B错误;
C.盐酸与氢氧化钠溶液的反应是中和反应是放热反应,故C错误;
D.木炭在氧气中燃烧是放热反应,故D错误.
故选A.
【分析】常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
11.【答案】C
【解析】【解答】放电时,Li+从M极移向N极,则M极为负极,N极为正极,充电时,M极为阴极,N极为阳极。
A:充电时,电子由阳极流入阴极,即N极流向M极,发生还原反应,说法正确,故A不符合题意;
B:锂电池的能量比较高,优点是质量小,电容量大,可重复使用,说法正确,故B不符合题意;
C:根据电子守恒可知,2Li~2e-~ Cu ,当电池中迁移1molLi+时,理论上可获得32g纯铜,说法错误,故C符合题意;
D:充电时,N极为阳极,发生氧化反应,电极反应式为 ,说法正确,故D不符合题意;
故答案为:D
【分析】原电池工作时,负极发生氧化反应,正极发生还原反应,电子在外电路沿导线自负极流向正极,内部阴、阳离子分别流向负极、正极。
电极反应式的书写:1.确定阳极、阴极上的反应物与生成物。2.标出化合价,确认得失电子数。3.依据电荷守恒原则,一般利用H+或OH-平衡电荷。4.物质守恒配平。
电子转移数目要找出所有化合价升高或降低的元素,并标出其化合价,化合价变化总数=化合价变化数乘以原子个数,最后根据题目要求求出电子转移数目。
12.【答案】B
【解析】【解答】A.由分析可知,原电池工作时,A区钠离子通过阳离子交换膜M进入B区,C区溶液中硫酸根离子通过阴离子交换膜B区,故A不符合题意;
B.由分析可知,原电池工作时,A区钠离子通过阳离子交换膜M进入B区,C区溶液中硫酸根离子通过阴离子交换膜B区,则B区中硫酸钠溶液的浓度增大,故B符合题意;
C.由分析可知,放电时,镁电极为原电池的负极,碱性条件下镁失去电子生成氢氧化镁,电极反应电极反应式为Mg+ 2OH--2e-=Mg(OH)2,故C不符合题意;
D.由分析可知,原电池工作时,消耗2.4 g镁时,放电转移电子×2=0.2mol,C区放电消耗0.4mol氢离子、0.1mol硫酸根离子,同时有0.1mol硫酸根离子移向B区,相当于溶液中减少0.2mol硫酸,同时生成0.2mol水,则C区实际减少质量为0.2mol×98g·mol-1-0.2mol×18g·mol-1=16.0g,故D不符合题意;
故答案为:B。
【分析】新型电池的判断:
1、化合价升高的为负极,失去电子,化合价降低的为正极,得到电子;
2、电极反应式的书写要注意,负极反应为负极材料失去电子化合价升高,正极反应为正极材料得到电子化合价降低,且要根据电解质溶液的酸碱性判断,酸性溶液不能出现氢氧根,碱性溶液不能出现氢离子,且电极反应式要满足原子守恒。
13.【答案】C
【解析】【解答】A.氢氧化钠易潮解且具有腐蚀性,不能用滤纸称量,A不符合题意;
B.氯化铁易水解而使溶液变浑浊,应将氯化铁溶于少量盐酸中,再稀释,B不符合题意;
C.加热时铵离子与氢氧根反应产生氨气,湿润的红色石蕊试纸遇氨气变蓝,能达到相应实验目的,C符合题意;
D.在盐酸作用下,铁发生析氢腐蚀,D不符合题意;
故答案为:C。
【分析】A氢氧化钠易潮解不能用滤纸,应该用玻璃器皿
B:Fe3+易水解而使容易浑浊
C:加热时铵离子与氢氧根会反应产生氨气
D:酸性条件下,发生析氢腐蚀
14.【答案】B
【解析】【解答】A.断开K1、闭合K2,该装置为电解池,右室的电极与外接电源的正极相连作阳极,LiFePO4中的铁元素发生氧化反应,A项不符合题意;
B.断开K2、闭合K1,该装置为原电池,右室的电极为正极,得电子发生还原反应,电极反应式为Li1-xFePO4+xLi++xe-=LiFePO4,B项符合题意;
C.断开K2、闭合K1,外电路中通过a mol电子时,左室有0.5a mol Mg溶解,同时有a mol Li+移向右室,因此左室溶液质量增加
,C项不符合题意;
D.该二次电池的总反应为xMg+xLi2SO4+2Li1-xFePO4xMgSO4+2LiFePO4,D项不符合题意;
故答案为:B。
【分析】断开K1,闭合K2时,是电解池,左侧是阴极,镁离子得到电子变为镁单质,右侧是阳极,LiFePO4失去电子发生氧化反应,断开K2,闭合K1时,是原电池,左侧是负极,镁失去电子变为镁离子,右侧是正极是Li1-xFePO4得到电子发生还原反应,结合选项即可判断
15.【答案】C
【解析】【解答】A.组成原电池的负极被氧化,在Mg-H2O2电池中,镁为负极,而非正极,A项不符合题意;
B. H2O2在石墨电极上得电子发生还原反应,B项不符合题意;
C.工作时,正极反应式为H2O2+2H++2e-═2H2O,不断消耗H+离子,正极周围海水的pH增大,C项符合题意;
D.原电池中,阳离子向正极移动,阴离子向负极移动,形成闭合回路,所以溶液中的Cl-向负极移动,D项不符合题意。
故答案为:C。
【分析】本题考查原电池的工作原理等知识。符合题意书写电极反应式为解答该题的关键,镁-H2O2酸性燃料电池中,镁为活泼金属,应为原电池的负极,被氧化,电极反应式为Mg-2e-═Mg2+,H2O2具有氧化性,应为原电池的正极,被还原,电极反应式为H2O2+2H++2e-═2H2O,根据电极反应式判断原电池总反应式,根据电极反应判断溶液pH的变化。
16.【答案】A
【解析】【解答】令2H2O(g)=O2(g)+2H2(g) ΔH1①
Cl2(g)+H2(g)=2HCl(g) ΔH2②
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) ΔH3③
根据盖斯定律,将反应①+反应②×2即可求得反应③,因此有ΔH3=ΔH1+2ΔH2 , 故A项正确。
故答案为:A
【分析】本题考查用盖斯定律进行反应热的计算。
17.【答案】(1)CO(g)+Na2O2(s)=Na2CO3(s)△H=﹣549 kJ/mol
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJ moL﹣1
(3)SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol
【解析】【解答】解:(1)已知①2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
②Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g)△H=﹣266kJ/mol,
由盖斯定律: ×①+②得CO(g)+Na2O2(s)=Na2CO3(s)△H= ×(﹣566)+(﹣266)=﹣549 kJ/mol,
故答案为:CO(g)+Na2O2(s)=Na2CO3(s)△H=﹣549 kJ/mol;
(2)0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,所以1mol甲烷完全燃烧生成液态水时能放出890kJ的热量,故甲烷燃烧生成液态水时的热化学反应方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJ moL﹣1,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣890KJ moL﹣1;
(3)n(SiH4)= =0.1mol,则1molSiH4燃烧放出的热量为:792kJ,
反应的化学方程式为:SiH4+O2=SiO2+2H2O,则热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l);△H=﹣792kJ/mol.
【分析】根据燃烧热的定义、焓变的计算以及盖斯定律进行书写热化学方程式即可.
18.【答案】(1)41
(2)CH3OH(l)+3/2O2(g)=CO2 (g)+2H2O(l) △H=-726.4kJ/mol
【解析】【解答】解:(1)已知25℃时:①C(石墨) +O2 (g) = CO2(g) △H1 =-394 kJ·mol-1,②C(石墨) +1/2O2 (g) = CO (g) △H2 =-111 kJ·mol-1,③H2(g) +1/2O2 (g) = H2O(g) △H3=-242kJ·mol-1,依据盖斯定律①-②-③得到:CO(g)+ H2O(g) = CO2(g) + H2(g) △H=-41kJ/mol。
故答案为:41。
(2)5gCH3OH在氧气中燃烧生成CO2和液态水,放出113.5kJ热量,32g即1molCH3OH在氧气中燃烧生成CO2和液态水,放出726.4kJ热量,则燃烧热的热化学方程式为:CH3OH(l)+3/2O2(g)=CO2 (g)+2H2O(l) △H=-726.4kJ/mol。
故答案为:CH3OH(l)+3/2O2(g)=CO2 (g)+2H2O(l) △H=-726.4kJ/mol。
【分析】本题考查了用盖斯定律进行有关的化学反应热的计算。(1)要能熟练灵活应用盖斯定律。(2)掌握燃烧热化学方程式的书写规范。
19.【答案】(1)Cu2++2e-=Cu;铜片;铁片
(2)0.04
(3)正;减弱
(4)Zn;B>A>C
(5)O2+4e-+4H+=2H2O
(6)减小
【解析】【解答】I.(1)该原电池中,铁片作负极,其电极反应式为Fe-2e-=Fe2+,铜片作正极,其电极反应式为Cu2++2e-=Cu;原电池中电流由正极流向负极,即有铜片流向铁片;
(2)电池总反应为Cu2++Fe=Fe2++Cu,所以消耗的铁与生成的铜物质的量相等,若2min后测得铁片和铜片之间的质量差为2.4g,则有n(Fe)= =0.02mol,转移的电子为0.04mol
Ⅱ.(3)B为原电池装置,其中Fe比Sn活泼,则Fe极作负极,Sn极作正极,H+在Sn极得到电子产生H2,导致Sn极附近H+的浓度降低,酸性减弱;
(4)C为原电池装置,其中Zn比Fe活泼,则Zn作负极,被腐蚀的金属为Zn,Fe被保护;同理,在B中,Fe被腐蚀;A不是原电池装置,Fe的腐蚀速度要慢一些;故三个装置中,纯铁被腐蚀的速率,由快到慢的顺序是B>A>C;
Ⅲ.(5)燃料电池中通入空气(氧气)的一极为正极,电解质溶液显酸性,O2得电子后H+反应生成水:O2+4H++4e-=2H2O;
(6)该电池的总反应为2H2+O2=2H2O,电池工作一段时间后,水的量增多,硫酸的量没有改变,则硫酸溶液的浓度减小。
【分析】(1)铁做负极,铁失去电子变为亚铁离子,铜做正极,氢离子得到电子变为氢气,电流是正极流向负极
(2)根据正负极的电极式即可计算
(3)根据原电池的原理即可判断出Sn为正极,氢离子得到电子变为氢气,酸性减弱
(4)锌比铁活泼,铁做正极,锌做负极,锌失去电子变为锌离子,B中铁做负极,C中铁被保护即可判断速率
(5)根据题意氧气在正极得到电子结合氢离子即可写出电极式
(6) 根据电池总的反应方程式即可判断
20.【答案】(1)2CuO(s)+C(s)=Cu2O(s)+CO(g) ΔH=+34.5kJ/mol
(2)阴;2Cu-2e-+2OH-= Cu2O+H2O;增大
(3)4Cu(OH)2+N2H4 2Cu2O+6H2O+N2↑
【解析】【解答】(1)已知:①2Cu(s) + O2(g)=Cu2O(s);△H= -169kJ/mol,②C(s)+ O2(g)=CO(g);△H= -110.5kJ/mol,③Cu(s)+ O2(g)═CuO(s);△H= -157kJ/mol,
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为2CuO(s)+C(s)=Cu2O(s)+CO(g),该反应可以由②-③×2+①得到,则反应的焓变为-110.5 kJ/mol –(-157 kJ/mol×2)-169 kJ/mol=34.5 kJ/mol;(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子的浓度;在电解池中,铜电极连接电源的正极,则铜电极作阳极,且根据总反应式 知,铜作阳极失去电子生成Cu2O,则在碱性环境下,阳极的电极反应式为2Cu-2e- +2OH- = Cu2O+H2O,钛极是阴极,发生还原反应,氢离子得电子,电极反应式为2H2O+2e- = H2↑+2OH-,所以氢氧根离子浓度增大,则pH值增大;(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,依据得失电子守恒、元素守恒,写出化学方程式为:4Cu(OH)2+N2H4 2Cu2O+6H2O+N2↑。
【分析】(1)根据盖斯定律并结合热化学方程式的书写方法来书写;(2)方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子的浓度,在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值的变化;(3)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式。
21.【答案】(1)1;0.1
(2)BC
(3)B;CH3OH
(4)2CH3OH + 3O2 =2CO2 +4H2O
(5)1.2NA或 ;13.44
【解析】【解答】I(1)根据图像分析可知,相同时间内,甲醇与二氧化碳的变化量之比为:1:1,则甲醇与二氧化碳的系数比为1:1,故x=1;氢气与二氧化碳的系数比为3:1,则等时间内氢气与二氧化碳的变化量之比为3:1,故在0~3min内氢气的变化量为1.5mol,则0~3min内H2的平均反应速率 mol/(L·min);
(2)降低温度会减小反应速率,A不正确;增加CO2的量可以加快反应速率,使平衡正向移动,B正确;使用催化剂可以加快反应速率,C正确;及时分离出甲醇可使反应正向进行,但会减小反应速率,故D不正确;故答案为:BC;
II(3)由原电池的工作原理图可知,电子由电极B流向电极A,则电极A作正极,电极B为负极;c处通入CH3OH,发生氧化反应;
故答案为:B;CH3OH;
(4)甲醇燃料电池是甲醇和氧气发生氧化还原反应,故总反应方程式为:2CH3OH + 3O2 =2CO2 +4H2O;
(5)甲醇的电极反应式为:2CH3OH+2H2O-12e- =12H+ 2CO2,当该装置消耗0.2 mol甲醇时,转移电子1.2mol,转移电子的数目为1.2NA或 ;电解水时,1molH2对应2mol电子,则产生氢气0.6mol,氢气的体积为: 。
【分析】I(1)0~10min,甲醇与二氧化碳的变化量都为0.75mol,则
xCO2(g)+3H2(g) CH3OH(g)+H2O(g)
xmol 1mol
0.75mol 0.75mol 则x=1
设0~3min内氢气的变化量为ymol,
xCO2(g)+3H2(g) CH3OH(g)+H2O(g)
1mol 3mol
0.5mol ymol 则y=1.5mol 再根据公式v(H2)=可以求出。
(2)A.升高温度可以加快反应速率,降低温度会减小反应速率;
B.增加反应物的浓度可以加快反应速率,使平衡正向移动;
C.催化剂可以加快反应速率;
D.分离出甲醇,造成反应物的浓度降低,进而但会减小反应速率;
II(3)原电池中,电子由负极流向正极;
甲醇燃料电池中,甲醇发生氧化反应;
(4)根据质量守恒可以写出方程式;
(5)根据得失电子守恒可以得出结论。
